Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.28 n.2 Ciudad de la Habana abr.-jun. 2009
ARTÍCULOS DE INVESTIGACIÓN
Efecto de la privación de sueño sobre la presión arterial en ratas
Effect of sleep deprivation on the blood pressure of rats
Tahumara de la Portilla Teresa-CallejaI; José Anías CalderónII; Susana Chao GonzálezIII; Vicente Río VázquezIII
IEspecialista de I Grado en Fisiología Normal y Patológica. Instructora. Instituto de Ciencias Básicas Y Preclínicas "Victoria de Girón". La Habana, Cuba.
IIDoctor en Ciencias. Especialista de II Grado en Fisiología Normal y Patológica. Instituto de Ciencias Básicas Y Preclínicas "Victoria de Girón". La Habana, Cuba.
IIIEspecialista de I Grado en Fisiología Normal y Patológica. Asistente. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". La Habana, Cuba.
RESUMEN
Con el objetivo de evaluar el efecto de la privación crónica de sueño sobre la presión arterial sistólica, se estudiaron 3 grupos de 8 ratas Wistar, un grupo control: sin privación de sueño y dos grupos experimentales: privación del sueño total y privación de fase de sueño MOR, durante períodos de 96 h continuas semanales, sin interrupción a lo largo de 2 meses. A dichos grupos se les midió la presión arterial sistólica cada semana antes de iniciar el período de privación de sueño. Al concluir los 2 meses, se les realizó extracción de ambos riñones. Los resultados revelaron que hubo diferencia estadísticamente significativa a partir de la semana 6 entre el grupo control y el grupo con privación del sueño total. En cuanto al estudio histológico de los cortes de los riñones, no se encontró alteración alguna de nefroesclerosis. En el modelo de estudio, la privación de sueño total produce un aumento notable de la presión arterial sistólica, no siendo así en el grupo con privación de fase de sueño MOR. Las alteraciones morfológicas renales no parecen participar en la hipertensión obtenida mediante las técnicas aplicadas.
Palabras clave: Privación crónica de sueño, presión arterial sistólica, privación de sueño total, privación de sueño MOR, hipertensión arterial.
ABSTRACT
With the objective of evaluating the effects of chronic sleep deprivation on the systolic blood pressure, three groups of 8 Wistar rats were studied- a control group with no sleep deprivation and two experimental groups subjected to total sleep deprivation and MOR sleep phase deprivation, respectively- for continuous 96h periods weekly throughout 2 months. Systolic blood pressure was taken in all the three groups every week before starting the sleep deprivation period. After two months, their kidneys were extracted. The results yielded that there was a statistically significant difference between the control group and the group subjected to total sleep deprivation. As to the histological study of the kidney cuts, nephrosclerosis alterations were not found. In the study model the total sleep deprivation brings about a remarkable rise in systolic blood pressure, except for the group which underwent MOR sleep phase deprivation and that renal morphological alterations does not seem to be involved in hypertension resulting from the applied techniques.
Key words: Chronic sleep deprivation, systolic blood pressure, total sleep deprivation, MOR sleep phase deprivation, blood hypertension.
INTRODUCCIÓN
La hipertensión arterial (HTA) es una enfermedad cardiovascular de alta prevalencia a escala mundial, que además constituye factor de riesgo determinante en el desarrollo de múltiples enfermedades que disminuyen la expectativa de vida de los pacientes que la padecen.1,2
Recientemente han comenzado a prestar atención los investigadores a la relación entre los trastornos del sueño y la HTA. Estos estudios abordan aspectos vinculados a: la privación total de sueño,3,4 a la insuficiente cantidad de sueño,5-7 a la falta de calidad del sueño,5-10 a la privación exclusiva de sueño paradójico11-12 y a las alteraciones del ritmo cicardiano del sueño.13
Al revisar en la base de datos MedLine se encontraron sólo 27 trabajos donde se relaciona la privación del sueño con la presión arterial. La casi totalidad de estos trabajos se han realizado en humanos y sólo 4 abordan el estudio de esta relación en ratas.3-14
Considerando que estudios epidemiológicos efectuados en EE. UU.15 y en la población cubana,16 indican que un tercio de la población tiene trastornos del sueño, es indiscutible la necesidad de analizar los posibles mecanismos que subyacen en la referida relación. Conociendo que el estudio de dichos mecanismos tienen primordial soporte en los experimentos con animales y que el riñón es uno de los órganos más involucrados en la hipertensión arterial, es propósito de este trabajo evaluar el efecto de la privación crónica de sueño total (PST) y del sueño de movimientos oculares rápidos o sueño paradójico (PSM) sobre la presión arterial sistólica (PAS), así como su repercusión morfológica en el riñón.
MÉTODOS
Se estudió una muestra de 24 ratas albinas, de la cepa Wistar, machos jóvenes que comenzaron el experimento con 150 g de peso. Se incluyeron ratas con PAS menor o igual que 140 mm/Hg al inicio de la investigación. Se excluyeron del estudio ratas con enfermedades durante el periodo experimental o conductas anómalas, así como ratas hipertensas espontáneas (PAS mayor que 140 mmHg al inicio de la investigación). La muestra se dividió en 3 grupos al azar, cada uno de 8 animales, quedando 2 grupos experimentales: PST y PSM (o REM) y un grupo control: sin privación de sueño. La PST total se realizó por inmersión en tanque de agua hasta el cuello (técnica desarrollada en el laboratorio de Fisiología del Sistema Nervioso del ICBP: "Victoria de Girón" por Anías J, de la Osa J. "Técnica para privar totalmente de sueño a ratas" y presentada en el V Congreso Nacional de Ciencias Fisiológicas; 1998: Ciudad de la Habana, Cuba), y la PSM por la técnica de plataforma fija sobre el estanque de agua.17
La privación de sueño de los grupos experimentales fue durante 96 h (de lunes a las 12:00 m a viernes a las 12:00 m). Se dejaron dormir durante el resto del viernes hasta las 12.00 del lunes en su medio y estilo de vida habitual (esto se hizo para que el animal se recuperara de los efectos de las técnicas empleadas, tratando así de reproducir lo mejor posible la vida real). Se les midió la PAS a través del método de Riva-Rocci, adaptado por Hetch18 Los días lunes, antes de comenzar el nuevo ciclo de privación, incluyendo la última medición al finalizar el experimento. Este proceder se realizó durante 2 meses para cada grupo experimental.
Al grupo control se le tomó de forma concurrente la presión arterial el mismo día y en el mismo horario que los grupos experimentales y permanecieron durante todo el experimento en sus condiciones de vida habitual.
Al finalizar la investigación a los animales se les realizó la extracción de los riñones para posterior estudio histológico en busca de posible repercusión renal de las técnicas de privación de sueño.
Para el procesamiento y análisis de los resultados se estimaron los parámetros descriptivos básicos: media y desviación estándar por medios computarizados. El procedimiento estadístico utilizado fue un análisis de la varianza para observaciones repetidas. Se analizaron los siguientes aspectos: test de los efectos Within-Subjets, test de los efectos Between-Subjects y comparaciones múltiples con ajuste de Bonferroni. Se consideró toda diferencia estadísticamente significativa para p<0,05.
RESULTADOS
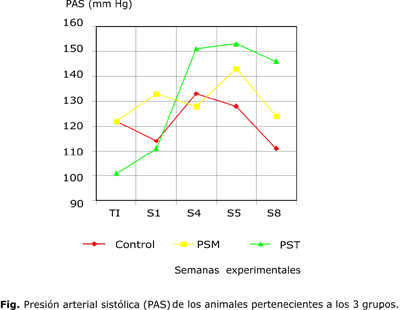
En la figura puede observarse que la medición de la PAS, antes de iniciar los experimentos (MI), estuvo en el rango normal para los tres grupos de animales estudiados.
En la semana 5 (S5) en los dos grupos experimentales se constataron cifras de HTA (PAS>140 mm Hg), que no fueron significativas con respecto al grupo control, aunque en la PST fue mayor la HTA que en la PSM (10 mm Hg mayor). A partir de la semana 5 ambos grupos experimentales presentaban cifras medias de PAS por encima del grupo control, a pesar de que el grupo de PSM no resultó estadísticamente significativo.
En la PST comienza a aparecer una diferencia significativa con respecto al grupo control a partir de la semana 6 (S6), (p = 0,011, p = 0,034 y p = 0,017 en semanas 6, 7 y 8, respectivamente).
De la semana 5 a la 8 (S8) hubo una disminución progresiva de los valores de PAS en los tres grupos, aunque se mantuvieron los valores de PAS en los grupos experimentales por encima del control. Entre los dos grupos experimentales no se observó diferencia significativa en ninguna semana.
En cuanto al estudio histológico de los cortes de riñones, al realizar la observación de las láminas al microscopio óptico se estudiaron las siguientes estructuras: corteza (glomérulos, arteriolas, túbulos contorneados proximales y túbulos contorneados distales) y médula (túbulos rectos, túbulos colectores y vasos sanguíneos), no se encontraron alteraciones.
DISCUSIÓN
El hecho que la medición efectuada antes de iniciar las privaciones del sueño (MI) estuvieran entre el rango normal para los tres grupos de animales, indican que la técnica de medición evaluó adecuadamente el valor de la PAS, ya que al estar los animales en sus condiciones de vida normales, les corresponden valores de presión normal.
Los incrementos de PAS, observados de manera estadísticamente significativa en el grupo de animales con PST, concuerda con los resultados obtenidos por otros autores tanto en animales3 como en humanos.4
El que no hubiera diferencia significativa en las mediciones de la PAS, en el grupo de las ratas PSM con respecto a los controles, encuentra apoyo en el trabajo efectuado por Neves y otros,12 donde estudian el efecto de PSM, durante 72 h, en tres grupos de ratas con base genética diferente en cuanto al comportamiento de su presión arterial (ratas hipertensas, ratas Wistar-Kyoto normales y ratas con predisposición a la hipertensión) y encuentran que la PSM sólo indujo hipertensión en estas últimas ratas. De forma contradictoria se ha informado en humanos11 que la PSM incrementa la presión arterial a causa del aumento de las endotelinas 1 y 2 provocado por la referida técnica de privación.
La disminución progresiva de los valores obtenidos de PAS de la S5 a la S8, en los tres grupos estudiados, pudiera deberse a la habituación de la medición de la PAS por la técnica usada para medirla en los tres grupos de animales.
El que no se observaran diferencias significativas entre los dos grupos experimentales en ninguna de las semanas estudiadas, inclina a pensar que la PSM, provocó hipertensión arterial, como ha sido planteado por otros autores.11
El que no se encontrara ningún daño histológico en las estructuras renales de los animales con hipertensión indica que los aumentos de PAS obtenidos no parecen involucrar al riñón. Por lo tanto, se necesita esclarecer el papel de otros mecanismos que participan en el control de la presión arterial, algunos ya estudiados por otros autores aunque no de manera conclusiva, como son: el control neural simpático sobre el sistema cardiovascular,4 el papel de factores hormonales,19 el de enzimas relacionadas con el óxido nítrico3 y el de las endotelinas 1 y 2.11
En resumen, el efecto de la privación crónica del sueño, sobre todo la privación de sueño total, tiende a incrementar la presión arterial en ratas. Las técnicas empleadas resultaron ser efectivas para la obtención de los objetivos propuestos.
REFERENCIAS BIBLIOGRÁFICAS
1. Mc Fate Emith W. Epidemiología de la Hipertensión Arterial. Clínicas Médicas Norteamérica. 1977:467-84.
2. Puldón Seguí G. Efectos del alcoholismo sobre la presión arterial y las características histológicas del riñón en ratas Wistar machos [tesis]. La Habana: Instituto de Ciencias Básicas Y Preclínicas "Victoria de Girón";2001.
3. Hung-Ming Ch, Un-In W, Tzer-Bin L, Chyn-Tair L, Wei-Ling H, Jeng-Yung S. Total sleep deprivation inhibits the neuronal nitric oxi and cytochrome reactivities in the nodose gangria rats. J Anat. 2006;209(2):239-50.
4. Masahiko K, Bradley G, Gardar S, Krzysztof N, Catherine AP, Virend KS. Effects of sleep deprivation on neural circulatory control. Hypertension. 2000;35:1173-5.
5. Lusardi P, Zoppi A, Preti P, Pesce RM, Piazza E, Fogari R. Effects of insufficient sleep on blood pressure in hypertensive patients: a 24-h study. Amer J Hypertens. 1999;12(1 Pt 1):63-8.
6. Francesco PC, Saverio S, Ngianga-Bakwin K, Michelle AM, Frances MT, Meena K, et al. Gender-specific associations of short sleep duration with prevalent and incident hypertension: the Whitehall II study. Hipertensión. 2007;50;693-700.
7. Francesco PC, Saverio S. Response to gender-specific associations of short sleep duration with prevalent hypertension. Hipertensión. 2008;51:17.
8. Javaheri S, Storfer-Isser A, Rosen CL, Redline S. Sleep quality and elevated blood pressure in adolescents. Circulation. 2008;118(10):1034-40. Publicación electrónica 18 Ago 2008.
9. Verdecchia P, Angeli F, Borgioni C, Gattobigio R, Reboldi G. Ambulatory blood pressure and cardiovascular outcome in relation to perceived sleep deprivation. Hypertension. 2007;49:777-83.
10. Tafil-Klawe M, Klawe JJ, Zlomanczuk P, Szczepanska B, Sikorski W, Smietanowski M. Daily changes in cardiac and vascular blood pressure components during breath holding episodes in obstructive sleep apnea patients after day-shift and night-shift work. J Physiol Pharmacol. 2007;58(Suppl 5):685-90.
11. Palma BD, Gabriel A, Bignotto M, Tufik S. Paradoxical sleep deprivation increases plasma endothelin levels. Brazilian J Med Biol Res. 2002;35:75-9.
12. Neves FA, Marson O, Baumgratz RP, Bossolan D, Ginosa M, Ribeiro AB, et al. Rapid eye movement sleep deprivation and hypertension. Genetic influence. Hypertensión. 1992;19(2 Suppl):II202-6.
13. Knutsson A, Beggild H. Shiftwork and cardiovascular disease: review of disease mechanisms. Rev Environ Health. 2000;15(4):359-72.
14. Mion D. Jr, Krieger EM. Blood pressure regulation after deprivation of rapad-eye-movement sleep in rats. J Hypertens Suppl. 1988;6(4):S74-6.
15. Bliwise DL. Historical change in the report of daytime fatigue. Sleep. 1996;19:462-4.
16. Damiani CS, García RX, Bacallao GJ. Trastornos del sueño en la tercera edad. Influencia del círculo de abuelos. Rev Cubana Med Gen Integr. 1992;8 (4):310-7.
17. Jouvet D, Vimont E, Delorme F, Jouvet M. Étude de la privation sélective de la phase paradoxale de sommeil chez le chat. C R Soc Biol. 1964;158:756-9.
18. Hecht K. Papel del hipocampo en la neurosis experimental. Disregulación neurótica de la presión sanguínea. En: Hecht K, editor. Algunos aspectos fisiológicos, teóricos y prácticos de la Psiquiatría. La Habana: Editorial Científico-Técnica;1979. p.46-50.
19. Gordon RD, Wolfe LK, Island DP, Liddle GW. A diurnal rhythm in plasma rennin activity in man. J Clin Invest. 1966;45:1587-92.
Recibido: enero de 2009.
Aprobado: febrero de 2009.
Tahumara de la Portilla Teresa-Calleja. Calle 114, No. 5127, e/51 y 59, apto.2 (altos). Marianao. La Habana, Cuba. E-mail: tahumara@giron.sld.cu