Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.28 n.2 Ciudad de la Habana abr.-jun. 2009
TÉCNICA
Optimización de un medio de cultivo para el crecimiento de Gardnerella vaginalis
Optimization of a cultural medium for growing Gardnerella vaginalis
Lilian Sánchez MirandaI; Ana María Moreno ZamoraII; Tania Pérez BuenoIII; Ivette Espinosa CastañoIV
IDoctora en Ciencias Veterinarias. Investigadora Auxiliar. Centro Nacional de Sanidad Agropecuaria. San José de las Lajas. La Habana, Cuba.
IIIngeniera Química. Centro Nacional de Sanidad Agropecuaria. San José de las Lajas. La Habana, Cuba.
IIIDoctora en Ciencias Técnicas. Investigadora Auxiliar. Centro Nacional de Sanidad Agropecuaria. San José de las Lajas. La Habana, Cuba.
IVDoctora en Ciencias Médicas. Investigadora Auxiliar. Centro Nacional de Sanidad Agropecuaria. San José de las Lajas. La Habana, Cuba.
RESUMEN
Se presenta una técnica para la optimización del medio de cultivo Caldo Triptona Soya suplementado con suero equino para el crecimiento de Gardnerella vaginalis. Se utilizó un diseño experimental 22 donde se evaluó la influencia de dos componentes del medio y un diseño compuesto central para mejorar los rendimientos celulares. Con la mejor variante de este estudio se realizaron corridas para caracterizar el crecimiento bacteriano empleando diferentes estimaciones. Se obtuvo que la dirección hacia los mayores crecimientos se localizó hacia mayores concentraciones de triptona soya y suero equino. La variación en la concentración de los componentes evaluados no influyó en la expresión de las proteínas antigénicas dado por los perfiles electroforéticos obtenidos.
Palabras clave: Gardnerella vaginalis, medio de cultivo, crecimiento, optimización, diseño experimental.
ABSTRACT
The optimization of the cultural medium Soy Triptone Broth supplemented with equine serum to grow Gardnerella vaginalis is presented in this paper. An experimental design 22 was used in which the influence of two components of this medium was evaluated; and a central design aimed at improving cell performances. With the best variant of this study, the runs allowed characterize the bacterial growth using different estimations. The greatest growths were observed in higher concentrations of soy triptone and equine serum. The variation of the evaluated component concentrations did not have an impact on the expression of antigenic proteins given by the obtained electrophoretic profiles.
Key words: Gardnerella vaginalis, cultural medium, growth, optimization, experimental design.
INTRODUCCIÓN
La vaginosis bacteriana (VB) es la infección más frecuente que causa vaginitis en la mujer de edad fértil, constituye un factor de riesgo para la ruptura prematura de membranas y parto pretérmino en mujeres gestantes.1 Su prevalencia varia según la población estudiada, de manera que en gestantes está entre el 10-30 %, mientras que en pacientes con infecciones de trasmisión sexual (ITS) resulta mayor con valores entre 24-40 %.2 La infección es de causa polibacteriana, con la proliferación de bacterias anaerobias (Mobiluncus spp, Mycoplasma hominis, Ureplasma urealyticum y Bacteriodes spp), donde Gardnerella vaginalis está presente en más del 90 % de los casos por lo que se considera el principal agente.3,4
A pesar de la importancia del diagnostico todavía existen pocas formulaciones de medios de cultivo para el aislamiento y el estudio del crecimiento de G. vaginalis.5,6 En este sentido, se informa su crecimiento en Agar Sangre Humana tween (HBT) a 35-37 oC en condiciones de microaérofilia con una atmósfera de CO2 al 5-7 %, se incuba de 48-72 h y se observan colonias blancas, puntiformes, beta hemolíticas de 0,3-0,5 mm de diámetro.7,8
Por otra parte, se han evaluado medios de cultivo líquidos como Caldo Triptona soya suplementado o no con suero equino (CTS-se) / (CTS) y caldo Casman (CC) en diferentes condiciones de incubación con el 10 % de CO2 y condiciones aerobias,9 donde no se encontraron diferencias significativas en los valores de densidad óptica para los medios CTS-se y CC. Sin embargo, para otros fines como la elaboración de diagnosticadores a mayor escala todavía las cantidades de biomasa celular resultante es limitada y el precio en el mercado de estos medios de cultivo es alto.
De ahí que una de las alternativas es optimizar algunas condiciones de crecimiento en especial el medio de cultivo para obtener mayores concentraciones celulares sin afectar la antigenicidad, por lo que se procedió a optimizar el Caldo Triptona soya (de la firma BIOCEN) suplementado con suero equino mediante el empleo de un diseño experimental.
MÉTODOS
Microorganismo
Se empleó la cepa de Gardnerella vaginalis 14018 procedente del American Type Collection Culture (ATCC).
Medios de cultivo
Medio Agar Columbia (oxoid). Para su preparación se le adicionó un volumen de agua destilada hasta alcanzar 1 000 mL de medio. Se puso en autoclave a 121ºC durante 15 min y posteriormente se le adicionó el suplemento selectivo SR119RE (Oxoid), 1mg / 500 mL de anfotericen B, 15 mg / 500 mL de ácido nalidíxico, 2 mg / 500 mL de sulfato de gentamicina y sangre humana.
Caldo Triptona soya (CTS-se). Compuesto por Triptona soya suplementado con suero equino pH 7,2±0,5. Primeramente, se esteriliza 121 oC durante 15 min y después se agrega el suero equino (previamente filtrado). La adición del suero se realiza bajo condiciones de esterilidad.
Medio Casman. Medio Casman líquido (CC) según lo descrito por Espinosa y otros.9
Preparación de inóculos para el cultivo de G. vaginalis
Se partió de un ámpula liofilizada que se resuspendió en 0,5 mL de solución salina, se sembraron en placas de Agar Columbia suplementado con sangre humana y antibióticos. Las placas se incubaron durante 48 h en jarras de anaerobiosis con bolsas de anaerobiosis, Anaerogen (Oxoid) para obtener una atmósfera de 10 % de CO2.
Las colonias crecidas sobre el agar se recogieron con el medio de cultivo Casman líquido y esta suspensión de células bacterianas se utilizó como preinóculo para sembrar erlenmeyers de 100 mL con 50 mL de los medios de cultivo Caldo Triptona soya.
Luego de inoculado cada erlenmeyer, con tapón de algodón bajo condiciones de aerobiosis, se incubó a 37 oC sin agitación durante 16-18 h. Posteriormente, se utilizó como inóculo para evaluar la multiplicación bacteriana en cada variante de medio diseñado. Para ello se emplearon erlenmeyers de 250 mL con 150 mL de medio de cultivo que se inocularon al 10 % del volumen final y se incubaron bajo las mismas condiciones durante 18 h.
Influencia de la Triptona soya (TS) y el suero equino (se) en el crecimiento de G. vaginalis
Para esto primeramente se realizó un diseño factorial a dos niveles (22) como experimento de tamizado para saber hacia que dirección se obtendrían los mejores resultados que se muestran en las tablas 1 y 2. Como variable de respuesta se seleccionó la concentración celular medida como densidad óptica (DO) a 540 nm a las 18 h de cultivo. Los resultados se compararon con los valores de DO obtenidos con el medio control (Caldo Triptona soya sin modificar) y con los del medio Caldo Casman para un nivel de significación de p< 0,05.
A continuación se realizó un diseño compuesto central (DCC) con cuatro estrellas y réplicas en el nivel central (tabla 3) sobre las cuales se estudiaron los factores y se ajustó el modelo. Las corridas del diseño factorial y DCC se realizaron tres veces.
Determinación del crecimiento celular
Turbidometría. La DO del cultivo se determinó mediante un espectrofotómetro LASSO BIOTECH LTDA realizando las lecturas a una longitud de onda de 540 nm.
Conteo de viables. Se realizó mediante la relación existente entre la concentración de células viables y la DO de los cultivos según lo descrito por Sánchez 10 con la siguiente ecuación:
Y = 189,46 X - 25,51 R² = 0,9754 Y =106 UFC / mL; X = D.O
Masa seca. Se determinó la masa seca después de la separación de microorganismo por centrifugación a 10Gx por 20 min a 4 ºC en centrifuga de alta velocidad Beckman modelo J2-21, lavado con agua destilada y secado en una balanza infrarroja Sartorius modelo MA45.
Determinación de proteínas. Se utilizó el método de Lowry y otros11 a todas las muestras de los medios evaluados
Análisis estadístico
Se realizó el análisis estadístico a los diseños evaluados utilizando medios computarizados. Los resultados experimentales se trataron de ajustar a una ecuación polinomial de segundo orden por regresión múltiple como sigue:
Donde: Y= DO
b0, bi, bii, bij: Coeficientes de la ecuación
Se evaluó la significación de cada uno de los parámetros del modelo teniendo en cuenta el término de segundo orden sólo en el estudio de Caldo Triptona soya + Suero equino donde se determinó la superficie de respuesta para el diseño compuesto central. Además, se realizó la prueba de bondad de ajuste del modelo. El valor de crecimiento celular obtenido y determinado por los diseños experimentales de los medios evaluados se comparó con los obtenidos experimentalmente con el medio control.
Cinética de crecimiento de G. vaginalis en los medios seleccionados
Para realizar la cinética de crecimiento de G. vaginalis se trabajó con la mejor combinación evaluada y se comparó con el medio de cultivo CC. Se emplearon erlenmeyers de 1L con 500 mL de medio y el inóculo empleado se cultivó en el mismo medio.
Los cultivos fueron incubados durante 24 h a 37 0C y se monitoreó mediante la toma de muestra cada 2 h para la determinación de las DO con una longitud de onda de 540 nm. Se le determinó pH en un pHmetro digital y proteínas al final de la fase logarítmica de crecimiento. La velocidad de crecimiento específica (µ) se calculó en la fase exponencial de crecimiento y los valores se compararon entre sí a través de la prueba de Wilcoxon, no paramétrica. Los crecimientos celulares fueron analizados según lo descrito anteriormente.
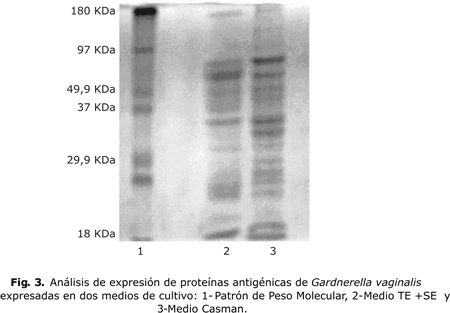
Las células obtenidas de estos medios se analizaron por una electroforesis en gel de acrilamida (PAGE-SDS) para el estudio de la influencia de la variación en la concentración del medio de cultivo sobre la expresión de las proteínas antigénicas de G. vaginalis.
Procesamiento de los cultivos para electroforesis en geles de Acrilamida PAGE-SDS
Para evaluar el patrón electroforético de G. vaginalis en los medios evaluados se tomaron 250 mL de cultivos de 16-18 h y se centrifugaron a 10 Gx, se llevó la concentración de proteínas a 3 mg / mL. Se tomaron 0,5 mL de cada cultivo evaluado a esa concentración y se adicionó igual volumen de solución amortiguadora diluyente de la muestra y se trataron por calor a 100 ºC durante 5 min. Los polipéptidos se separaron electroforéticamente, en un sistema de soluciones amortiguadoras discontinuo con gel concentrador al 5 % y gel separador al 12,5 %.11 Las corridas se realizaron en minigeles (Bio Rap Mini protean IIDual Slab Cell Bio-Rap 9) utilizando voltaje constante de 20 voltios/cm de gel. Se utilizó un marcador de peso molecular de amplio rango procedente de la casa comercial SIGMA (EE.UU.) y para revelar los geles se colorearon con azul de Comassie.
RESULTADOS
En la tabla 4 se muestran los resultados del experimento factorial a dos niveles para el Caldo Triptona soya suplementado con suero equino, en el que se obtuvo que sólo la variable triptona soya era significativa (p< 0,05), mientras que el suero equino y la interacción entre ellas no tuvieron una marcada influencia.
Del análisis de regresión múltiple se eliminaron los términos no significativos y resultó el siguiente modelo:
DO = 1,33187 + 0,141875 X1; R2=89,65 %; pmodelo=0,0
Como se puede apreciar, el modelo es significativo y la dirección hacia los mayores rendimientos que orienta este experimento es hacia mayores concentraciones de triptona soya. Con los resultados del DCC (tabla 5) y mediante un análisis de regresión múltiple se determinó el modelo que especifica la relación entre la concentración celular y las variables independientes. En este caso el modelo no resultó ser el propuesto debido a la no significación estadística de las variables cuadráticas y la interacción entre ellas en la región estudiada para p<0,05.
Tabla 5. Valores de DO en función de las mismas variables para el DCC
| Corrida | X1 | X2 | DO |
| 1 | 1 | -1 | 2,56 |
| 2 | 1 | -1 | 2,50 |
| 3 | 1 | -1 | 2,55 |
| 4 | 1 | -1 | 2,49 |
| 5 | 1 | -1 | 2,47 |
| 6 | 1 | -1 | 2,53 |
| 7 | -1 | 1 | 2,70 |
| 8 | -1 | 1 | 2,68 |
| 9 | -1 | 1 | 2,68 |
| 10 | -1 | 1 | 2,73 |
| 11 | -1 | 1 | 2,70 |
| 12 | -1 | 1 | 2,66 |
| 13 | 1 | 1 | 2,90 |
| 14 | 1 | 1 | 3,01 |
| 15 | 1 | 1 | 2,97 |
| 16 | 1 | 1 | 2,98 |
| 17 | 1 | 1 | 3,01 |
| 18 | 1 | 1 | 2,89 |
| 19 | -1 | -1 | 2,27 |
| 20 | -1 | -1 | 2,30 |
| 21 | -1 | -1 | 2,29 |
| 22 | -1 | -1 | 2,30 |
| 23 | -1 | -1 | 2,89 |
| 24 | -1 | -1 | 2,78 |
| 25 | 2 | 0 | 3,24 |
| 26 | 2 | 0 | 3,19 |
| 27 | 2 | 0 | 3,10 |
| 28 | 2 | 0 | 3,20 |
| 29 | 2 | 0 | 3,24 |
| 30 | 2 | 0 | 3,19 |
| 31 | -2 | 0 | 2,01 |
| 32 | -2 | 0 | 2,05 |
| 33 | -2 | 0 | 2,06 |
| 34 | -2 | 0 | 2,07 |
| 35 | -2 | 0 | 2,05 |
| 36 | -2 | 0 | 2,03 |
| 37 | 0 | 2 | 2,90 |
| 38 | 0 | 2 | 2,82 |
| 39 | 0 | 2 | 2,87 |
| 40 | 0 | 2 | 2,90 |
| 41 | 0 | 2 | 2,86 |
| 42 | 0 | 2 | 2,80 |
| 43 | 0 | -2 | 2,86 |
| 44 | 0 | -2 | 2,87 |
| 45 | 0 | -2 | 2,79 |
| 46 | 0 | -2 | 2,80 |
| 47 | 0 | -2 | 2,84 |
| 48 | 0 | -2 | 2,83 |
| 49 | 0 | 0 | 2,50 |
| 50 | 0 | 0 | 2,49 |
| 51 | 0 | 0 | 2,49 |
| 52 | 0 | 0 | 2,58 |
| 53 | 0 | 0 | 2,58 |
| 54 | 0 | 0 | 2,49 |
El modelo matemático obtenido una vez eliminado los términos no significativos es:
DO = 2,66115 + 0,232347 X1 + 0,0768194 X2; R2=70,95%; pmodelo =0,0
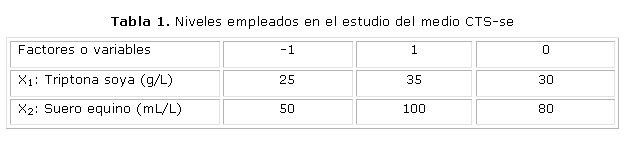
La prueba de bondad de ajuste demostró que el modelo lineal ajustado es válido y el coeficiente de correlación es aceptable. El óptimo se ubicó en las cantidades de 45g de triptona soya y 87,5 mL de suero equino para 1L de medio. A este medio de cultivo se le llama en lo adelante TS + SE modificado. La superficie respuesta que se obtuvo del modelo se muestra en la figura 1 donde se aprecia que los mayores rendimientos se localizaron hacia mayores concentraciones de triptona soya y suero equino.
Por otra parte, el valor de crecimiento celular obtenido mediante el análisis del modelo matemático en el punto de máxima concentración de Triptona soya y Suero equino (DO= 3,27), se comparó con los valores obtenidos experimentalmente con el medio ya optimizado, en este caso TS + SE modificado (3,12 ± 0,054 unidades de DO) donde se encontró una buena concordancia entre ambos valores. Al comparar los resultados con los valores de DO obtenidos con el medio control (Triptona soya y suero equino sin modificar) con valores de DO = 1,27 unidades y con los del medio CC DO = 0,81 se obtuvieron diferencias significativas para un nivel p<0,05.
Los rendimientos de G. vaginalis en las dos variantes de los medios de cultivo evaluados con diferencias significativas para p<0,05, en los valores de la masa seca, se destaca el medio TS + SE modificado con 60 ± 0,05 mg/L con respecto a lo encontrado en el medio de cultivo control CC de 20±0,07 mg/L
Características del crecimiento de de G vaginalis en el medio TS + SE modificado y su comparación con el medio Caldo Casman
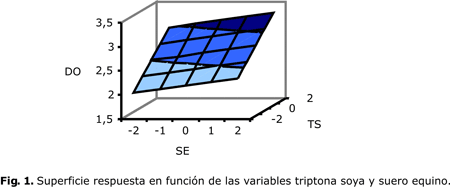
Los estudios del crecimiento a nivel de laboratorio de la cepa G. vaginalis en los medios TS+SE modificado y su comparación con Caldo Casman empleado como control se muestra en la figura 2.
En ninguna de las variantes se observa la fase de latencia o de adaptación para su crecimiento, debido fundamentalmente, a que el inóculo empleado se encontraba en fase de crecimiento exponencial y se trabajó con el mismo medio fresco en cada variante evaluada, por lo que la cepa no necesitó tiempo de adaptación en un nuevo medio con otros requerimientos nutricionales.
Posteriormente, continuó creciendo en cada uno de los medios evaluados durante 16 h donde se observó la fase exponencial de crecimiento a partir de la cual en el cultivo crecido en medio Casman se observó una desaceleración del crecimiento, y a las 18 h de incubación comenzó la fase estacionaria de crecimiento, por su parte, el cultivo con medio TS+SE modificado extendió su fase exponencial hasta las 22 h.
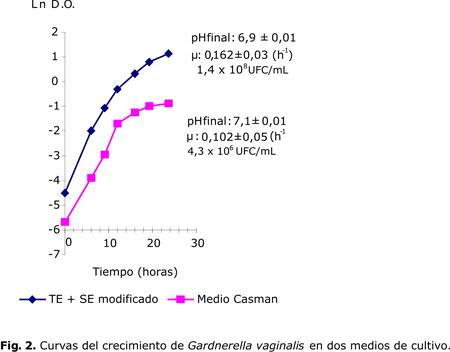
En las variantes evaluadas de medio de cultivo se determinaron los máximos valores de células viables y sus velocidades específicas de crecimiento. Existieron diferencias significativas entre las dos variantes evaluadas y en el medio TS+SE modificado se observaron los mayores valores. Mediante el empleo de PAGE-SDS (figura 3) se estudió la influencia de las variaciones en la concentración de los medios de cultivo sobre la expresión de las proteínas antigénicas.
Se aprecia el perfil de las proteínas de G. vaginalis, con un patrón similar en los dos medios evaluados, se identificaron 14 proteínas que comprenden los siguientes pesos moleculares relativos 14, 20, 33, 36, 42, 45, 48, 52, 55, 61, 78, 84, 90 y 175 kDa, las cuales se expresaron en ambos medios.
DISCUSIÓN
El método del diseño experimental se considera como una herramienta potencial para la optimización, ya que se pueden analizar los efectos de cada componente, así como, las interacciones entre ellos.13 Un problema de estos procedimientos es la dificultad en la selección inicial de los valores de las variables operativas, la mayoría de los autores utilizan un rango arbitrario determinado por su experiencia, pero si los valores iniciales son inadecuados, la dirección hacia el óptimo será falsa y necesitarán más experimentos para encontrar el óptimo, por lo que para evaluar las condiciones óptimas de este microorganismo en particular, se trabajó en el diseño de cultivo adecuado basado en los requerimientos nutricionales específicos que soportan su crecimiento (según lo informado por Espinosa y otros9 ) y la síntesis de sus componentes celulares, por lo que las cantidades evaluadas fueron establecidas por las experiencias acumuladas en el laboratorio.
En este sentido, se pudo constatar que mediante el diseño factorial y el DCC propuesto, la dirección de la optimización es hacia un incremento de las cantidades de triptona soya y suero equino que lograron favorecer el crecimiento de G. vaginalis a juzgar por los valores de DO encontrados en los diseños evaluados. Hay que destacar que el medio Caldo Triptona soya (Firma BIOCEN, componente del medio TS + SE modificado) presenta una formulación compuesta por hidrolizado enzimático de caseína, peptona de soya, dextrosa, fosfato dipotásico y cloruro de sodio que aporta grandes cantidades de nitrógeno amino y fuentes de carbono para el desarrollo de este microorganismo que carece de mecanismos biosintéticos poderosos, por lo que se considera una bacteria de difícil crecimiento, lo que hace complejo lograr reproducibilidad en el crecimiento celular obtenido; se plantea que en estos tipos de medios existe una variación en el aporte que dan al crecimiento los componentes naturales fundamentalmente el hidrolizado enzimático de caseína, peptona de soya y el suero equino.
Existen antecedentes que muestran las ventajas de emplear diseños experimentales en procesos bioquímicos y microbiológicos. Pérez y otros14 logran disminuir (hasta el 65 %) las concentraciones de tres componentes de medios de cultivos de precios elevados en el mercado internacional y obtienen rendimientos celulares de Mycoplasma spp mayores que lo informado en la literatura consultada mediante la optimización del medio de cultivo, con un diseño factorial primero, posteriormente un DCC, seguido de un diseño punto estrella para determinar un mejor modelo estadístico que describiera las variables en estudio. Aunque se comunica por varios autores que los diseños factoriales 2K empleados como tamizado de las variables y DCC para la optimización en los procesos farmacéuticos tienen la limitación de ser periféricos ya que los puntos experimentales están en los límites de la zona de muestreo, son muy útiles en el campo de la microbiología ya que da la dirección del óptimo sobre la región estudiada.15,16
Con respecto a los resultados obtenidos en el conteo de unidades formadoras de colonia (4,06 x108± 0,17 UFC/mL) y la concentración de proteínas (2,75 mg/mL) a las 18 h de crecimiento se destaca el medio evaluado TS+se modificado al comparase con el medio control, correspondiendo con un nivel de significación de p<0,05. En este sentido, los resultados coinciden con lo reportado sobre los diferentes métodos que existen para la estimación del crecimiento de bacterias como G. vaginalis, uno de ellos es la medición de la turbidez que tiene una alta reproducibilidad y correlación con el peso seco y el conteo de células viables; siendo este último el más sensible para la determinación de la biomasa bacteriana.
Los resultados encontrados en la cinética de crecimiento a mayor volumen así como en el estudio de los perfiles de proteínas encontradas en las células enteras están acorde con los publicados por Espinosa y otros al caracterizar cepas de G. vaginalis en especial ATCC y aislamientos clínicos.9 Estos hechos hablan a favor de la utilización del medio ya optimizado en el crecimiento de G. vaginalis y como una alternativa para la sustitución del medio Casman empleado actualmente.
Finalmente se puede concluir que el diseño experimental empleado en la optimización del medio de cultivo resulta apropiado. La combinación de 45 g/L de triptona soya y 87,5 mL de suero equino influencian positivamente en el crecimiento bacteriano de Gardnerella vaginalis . Las condiciones de crecimiento evaluadas no influyen en la expresión de proteínas antigénicas de Gardnerella vaginalis por lo que el medio Caldo Triptona Soya suplementado se puede utilizar para los fines propuestos.
REFERENCIAS BIBLIOGRAFICAS
1. Tohill BC, Heilig CM, Klein RS, Rompalo A, Cu-Uvin S, Brown W, et al. Vaginal flora morphotypic profiles and assessment of bacterial vaginosis in women at risk for HIV infection. Infect Dis Obstet Gynecol. 2004;12:21-6.
2. Dowd T, Bourne N. Inventing a new diagnostic test for vaginal infection. BMJ. 1994;309:40-2.
3. Faro S, Martens M, Maccato M, Haemmil M, Pearlman M.Vaginal flora and pelvic inflamatory disease. Am J Obstet-Gynecol. 1993;169:470-3.
4. Meis PJ, Golberg RL, Mercer B, Moawad A, Das A, Menellis D, et al. The pretern prediction study: significance of vaginal infections. Am J Obstet Gynecol. 1995;176(49):1231-5.
5. Hunt DE, Jones JV, Dowell VR. Selective medium for the isolation of bacteroides gingivalis. J Clin Microbial. 1986;23:441-5.
6. Greenwood JR, Picket M.J. Genus Gardnerella. Bergey´s Manual of Systematic bacteriology. Vol. 2. Murray RGE, Brenner DJ, Bryant MP, Holt JG, Krieg NR, Moulder JW, Fennig NP, Sneath PHA, Syaley JT, editors. Baltimore: Williams and Wilkins;1986.
7. Totten PA, Amsel R, Hale J. Seective differencial human blood bilayer media for isolation of Gardnerella (Haemophilus) vaginalis. J Clin Microbiol. 1982;15:141-7.
8. Karmali MA, Simor AE, Roscoe M, Fleming PC, Smith SS, Lane J. Evaluation of a blood-free, charcoal based selective medium for the isolation of Campylobacter organisms from feces. J Clin Microbial.1986;23:456-9.
9. Espinosa I, Lorenzo M, Riverón Y, Álvarez E, Villoch A. Evaluación de diferentes medios líquidos para el cultivo de Gardnerella vaginalis y caracterización del perfil de proteína por electroforesis PAGE-SDS. Rev Cubana Med Trop. 2003;55(2):69-75
10. Sánchez L. Escalado de Controles positivos para Newvagin. [Proyecto]. La Habana: CENSA;2005.
11. Lowry OH, Rosebrough NJ, Farr AL, Rabdau RJ. Protein measurenment with the folin phenol reagent. J Biol Chem. 1954;193:265-75.
12. Laemli UK. Cleavage of structural protein during the assembly of the head bacteriofago T4. Nature. 1970;227:680-5.
13. Sevilla E. Apuntes sobre modelación estadísticas y diseño de experimentos. La Habana:ISPJAE;1989.
14. Pérez T, Sánchez L Díaz T, Rosado I, Rodríguez R. Aplicación del diseño experimental al estudio de un medio de cultivo para el crecimiento de Mycoplasma gallisepticum. Rev Salud Anm. 2001;23(2):80-3.
15. Perez M, Sánchez L, Bocourt D, Piad R. Optimización de la hidrólisis enzimática de Sacharomyces cerevisiae para su empleo como probiótico en animales. Rev Salud Anm. 2001;23(3):145-52.
16. Fernández EG, Fernández MC, Pérez I, Morón Y. Diseño de experimentos en tecnología y control de los medicamentos. LabCiencia. 2008;1:1-20. [Con Noticias técnicas de Laboratorio].
Recibido: febrero de 2009.
Aprobado: marzo de 2009.
Lilian Sánchez Miranda. Centro Nacional de Sanidad Agropecuaria. San José de las Lajas. Apdo. Postal 10. La Habana, Cuba. Teléf.: 5347-863653 o 47863014 ext 12. E-mail: lilian@censa.edu.cu