Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.28 n.3 Ciudad de la Habana jul.-sep. 2009
ARTÍCULOS DE REVISIÓN
Sistemas de análisis digital de imágenes en el glaucoma
Systems of imaging digital systems in case of glaucoma
Dra. Liamet Fernández Argones;I Dr. Ibrain Piloto Díaz;II Dra. María Josefa Coba Peña;III Dra. Bertila Pérez Tamayo;III Dra. Marerneda Domínguez Randulfe;IV Dra. Katia Trujillo FonsecaI
I Especialista de I grado en Oftalmología. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Especialista de I grado en Oftalmología. Especialista de I grado en MGI. Instructor. Universidad de la Ciencias Médicas de La Habana. Cuba.
III Especialista de 1er grado en Oftalmología. Instructor. Universidad de la Ciencias Médicas de La Habana. Cuba.
IV Especialista de I grado en Oftalmología. Especialista de I grado en MGI. La Habana, Cuba.
RESUMEN
A la luz del desarrollo tecnológico actual incorporado a la Oftalmología, no se concibe el seguimiento riguroso del Glaucoma sin el uso de los sistemas de análisis digital de imágenes de la papila y de la capa de fibras neurorretinianas. Se realiza una revisión bibliográfica sobre los aportes de la Polarimetría Láser de Barrido (GDx VCC, Carl Zeiss Meditec, Dublin, CA), la Tomografia Confocal Láser (Heidelberg Retina Tomograph HRT, Heidelberg Engineering Inc.) y la Tomografía de Coherencia Óptica (Stratus OCT, Carl Zeiss Meditec, Alemania) en el diagnóstico y seguimiento del Glaucoma. Se considera que las mensuraciones objetivas brindadas deben ser incorporadas de forma eficiente e intuitiva para sacarles el máximo de provecho en beneficio de los pacientes.
Palabras clave: glaucoma, papila, retina, córnea
ABSTRACT
Now a day we can´t consider the strict follow up in Glaucoma without the use of the digital analysis of image system of the optic nerve head and the retinal nerve fiber layer. This is a review about some contributions of Scanning Laser Polarimetry (GDx VCC, Carl Zeiss Meditec, Dublin, CA), Confocal Scanning Laser (Heidelberg Retina Tomograph HRT, Heidelberg Engineering Inc.) and Optical Coherence Tomography (Stratus OCT, Carl Zeiss Meditec, Alemania) in the diagnosis and follow up of Glaucoma. It´s considered that objective measurement giving by them must be incorporate in the rigorous analysis of each glaucomatous patient.
El diagnóstico precoz de la neuropatía óptica glaucomatosa continúa siendo un reto. Numerosas investigaciones se dirigen a detectar la alteración funcional de las células ganglionares, antes de su pérdida. Sin embargo, hasta hoy, continúa siendo la alteración estructural de la papila óptica el primer signo visible de daño glaucomatoso.
El avance tecnológico ha permitido el desarrollo de tres herramientas clínicas que permiten un análisis cuantitativo y cualitativo de las estructuras involucradas: la Polarimetría de barrido láser (SLP), la Tomografía con focal láser o Retiniana de Heidelberg (HRT) y la Tomografía de coherencia óptica (OCT). Si bien es cierto que son instrumentos costosos, es indudable que al ofrecer un análisis cuantitativo altamente reproducible de los parámetros de la cabeza del nervio óptico (CNO) y de la capa de fibras neurorretinianas (CFNR), se convierten en examen obligado para la detección objetiva precoz del avance del daño glaucomatoso.
Existe un consenso entre los especialistas dedicados al glaucoma referente a la importancia de la Fotografía Estereoscópica de la papila y la CFNR. Se les confiere particular importancia en la evaluación de algunas características del anillo neurorretiniano (ANR) tales como la presencia de cambios en los capilares, palidez, hemorragias en astilla, atrofia parapapilar, entre otros, los cuales aún no pueden ser detectados por los sistemas de análisis digital. Se considera que en manos de expertos documenta, a través de un análisis cualitativo, la progresión de la hipertensión ocular a glaucoma ó bien la evolución en las etapas iniciales y moderadas. Su principal desventaja es la carencia de mensuraciones objetivas que permitan evaluar precozmente un cambio.1-3
La incorporación de alta tecnología en Cuba se ha desarrollado en varios centros oftalmológicos localizados en diferentes regiones del país. La mayoría disponen del HRT, algunos del OCT. Es necesario conocer los principios de funcionamiento de cada sistema, sus ventajas y desventajas, para complementar eficientemente la evaluación clínica en cada caso. Los dibujos, las descripciones y las medidas de los cocientes excavación/ papila son probablemente poco adecuados para un control riguroso del glaucoma.
Polarimetría de barrido láser (SLP)
Esta tecnología, introducida en el año 1993 en la practica clínica,4 utiliza un láser de 820 nm (1) de longitud de onda para realizar un barrido del fondo de ojo, en un tiempo de 0.7 segundos. Utiliza la capacidad birrefringente de la CFNR (dada por el ordenamiento paralelo de sus axones y microtúbulos), para medir su grosor peripapilar. El polarímetro identifica la luz reflejada y el retardo en el regreso entre la luz que incide perpendicularmente y la paralela. Ha sido determinado histológicamente que un grado (1º) de retraso equivale a 7,4 micras de espesor de la CFNR.4
El modelo original tenía un compensador corneal fijo (GDx Nerve Fiber Analyzer, Diagnostic Technologies, San Diego, CA). Fue seguido por el modelo con compensador corneal variable (GDx VCC, Carl Zeiss Meditec, Dublin, CA), el cual se introduce en la práctica clínica en el año 2002.4 En el año 2007 se reportan estudios con el modelo GDx ECC (enhanced corneal compensation Carl Zeiss Meditec, Dublin, CA) que muestra un desempeño significativamente superior en el diagnóstico del glaucoma.5
Inicialmente se asumía que la birrefringencia corneal era fija; hoy se sabe que entre el 30- 60 % de los individuos se desvían de lo considerado como normal tanto en magnitud como en eje, por lo que se desarrolló el segundo modelo. 6 En este último aún se considera que la birrefringencia es igual en todos los sectores de la CFNR. Algunos estudios sugieren que existen diferencias a lo largo de la retina peripapilar, lo cual puede influir en los resultados.7 La alteración macular afecta la compensación corneal; la cirugía corneal u otro cambio en su arquitectura, precisan de una reevaluación de la birrefringencia corneal.1,7
La polarimetría láser tiene la desventaja de no analizar la papila óptica; sólo estudia la CFNR. Muestra los resultados en un mapa de colores con un patrón normal en reloj de arena debido al mayor grosor de la CFNR en los sectores superior e inferior (colores rojo- anaranjado).
Las medidas son tomadas a lo largo del anillo demarcado por dos líneas grises (centrado en la CNO por el operador) y graficadas en la curva TSINT (representa las zonas temporal- superior- inferior- nasal- temporal) así como en el mapa de desviaciones. En ambos es posible apreciar a primera vista la presencia de anomalías al comparar con base normativa para edad y raza. Finalmente la tabla de parámetros informa el indicador de la capa de fibras nerviosas (NFI) el cual indica la probabilidad de tener daño glaucomatoso; siendo baja si es menor de 30, sospechosa entre 30 y 59 y alta si 60 o más.6 La SLP tiene una sensibilidad del 70% y una especificidad 90 % en la detección del daño glaucomatoso.7
Heidelberg Retina Tomograph (HRT)
La segunda tecnología en discusión es el oftalmoscopio de barrido láser (Heidelberg Retina Tomograph HRT, Heidelberg Engineering Inc.). Recibe este nombre por la imagen topográfica que brinda de la papila óptica semejante a una foto, aunque se trata de representaciones en colores de las medidas topográficas calculadas en cada punto.1
Utiliza un diodo láser de 670nm para realizar un escaneo bidimensional en múltiples planos focales, realizándose finalmente una reconstrucción tridimensional. La imagen es adquirida durante un segundo y precisa de una desviación estándar menor de 30 para considerar el examen de calidad provisto de mensuraciones útiles.7
El primer examen de HRT de cada sujeto precisa de la demarcación de la línea de contorno, por parte del operador, para el cálculo de los parámetros estereométricos de la copa, el ANR y la CFNR. En manos no experimentadas puede inducir falsos resultados. Por otra parte no se mide de forma directa el grosor de la CFNR. Se asume que 50 micras por debajo de la superficie de la retina a nivel del haz papilomacular se encuentra el plano de referencia, considerándose luego la altura de cada sector a nivel de la línea de contorno.6
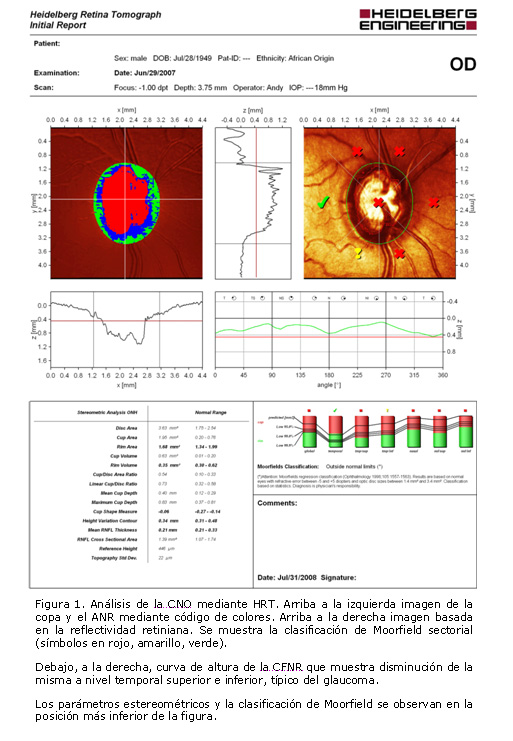
Su análisis brinda una imagen topográfica en colores donde el rojo indica la zona más excavada, el azul la inclinada y el verde la horizontal permitiendo apreciar las características de la excavación y el ANR. A su lado, la imagen de la reflexión retiniana se divide en 6 porciones mostrando un símbolo que corresponde a la clasificación de Moorfield8 para cada sector. Debajo, la curva de altura de la CFNR permite percibir rápidamente defectos focales típicos del glaucoma en los sectores superior e inferior (curva en doble joroba considerada como normal) (figura 1).
Se muestran resultados numéricos en la tabla de parámetros estereométricos así como la clasificación del disco óptico en normal, sospechoso o fuera de límites normales según el análisis de regresión de Moorfield (compara la relación entre el área del ANR y la excavación con base de dato normativa para el tamaño pupilar y edad del paciente) 6 y según el cálculo de la probabilidad de glaucoma conocido como GPS por sus siglas en inglés. El Glaucoma Probability Score (incluido en el software del HRT III), analiza un modelo tridimensional de la imagen topográfica. No necesita línea de demarcación; se basa en la profundidad, el espesor y la pendiente de las paredes de la capa.1,9
El HRT brinda además el Análisis de los Cambios Topográficos, el cual utiliza los dos primeros exámenes como línea base. Evolutivamente el color rojo indica progresión de la excavación, disminución del ANR o de la CFNR, mientras que el verde significa lo opuesto. Éste último se aprecia por lo general alrededor de los vasos sanguíneos por las variaciones en el flujo sanguíneo. Del mismo modo, la variación en el valor de PIO al momento del examen puede influenciar en falso deterioro o mejoría de las lesiones.
El HRT III incluye una base de datos específica según la etnia para todos los parámetros, lo que la hace útil para muchas poblaciones.1,9 Tiene una sensibilidad del 80 % y una especificidad del 90 % en la detección del daño glaucomatoso.7
Tomografía de coherencia óptica (OCT)
Se desarrolla en los inicios de los 90, a partir de los estudios de laboratorio que se realizaban investigando las aplicaciones del femtosecond láser para cirugía. El Dr. Huang reporta la primera aplicación clínica del OCT en el año 1991, mientras que en el año 1993 Swanson diseña el primer prototipo clínico oftálmico que fue construido por los laboratorios de ingeniería, introduciéndose al mercado en 1996.10
La Tomografía de Coherencia Óptica obtiene imágenes pseudohistológicas de la retina y de la CNO a partir de una luz láser diodo, cerca del infrarrojo (820-840nm), de baja coherencia, que se divide para viajar a la retina y a un espejo de referencia. Ambas luces regresan, creándose un patrón de interferencia que es analizado por el fotorreceptor. Inicialmente se obtiene un A scan individual midiendo la longitud axial ocular y se ajusta el brazo de referencia del interferómetro para cada paciente automáticamente.7
Se han desarrollado tres generaciones: OCT (1996), OCT2 (2000), Stratus OCT (2002); (Carl Zeiss Meditec, Alemania).10 Hasta el 2006 los modelos de OCT se basaban en On Time Domain (conocido como OTD) donde la información profunda es adquirida secuencialmente moviendo el espejo de referencia y observando el cambio en el tiempo del patrón de interferencia necesitándose 1.28 s en la adquisición de las imágenes. Fourier Domain (10) ó Spectral Domain (SDOCT) usa esencialmente el mismo sistema que el OTDOCT. Puede usar lo mismo un diodo láser superluminiscente o titanium- sapphire como fuente de luz. En contraste, el espejo de referencia permanece estacionario y la información profunda es obtenida analizando los patrones de interferencia en un espectro de luces reflejadas mezcladas. En vez de usar un foto-receptor utiliza un espectrómetro de alta velocidad permitiendo una detección mucho más eficiente de señales débiles, adquisición de datos con mayor rapidez y mejor resolución que alcanza un rango de 6-2 micras; abre las puertas a la creación de imágenes tridimensionales, videos y a la cuantificación del flujo sanguíneo de la retina y el nervio óptico (Doppler OCT) en el futuro.7,10,11 A finales del año 2006 Heidelberg recibe la aprobación de la FDA para combinar el SDOCT y el angiógrafo láser: el Spectralis.10
En cada pasada el Stratus OCT realiza entre 128 y 768 barridos. Cada scan A se compone de 1,024 puntos de datos adquiridos a una profundidad de 2 mm. De esta manera, el OCT integra entre 131,072 y 786,432 puntos de datos para construir una imagen de corte transversal o tomográfica de la anatomía retiniana. Realiza el análisis cuantitativo de las características de la copa y el ANR a partir de 6 líneas radiales de escaneo centradas en el NO. Muestra un corte transversal de la papila, definiendo automáticamente el margen del disco óptico como el lugar donde termina el epitelio pigmentario de la retina. En ocasiones debe ser redefinido manualmente; algunos autores consideran que en más del 50% de los casos.12 (figura 2).
El escaneo del grosor de la CFNR peripapilar se realiza centrado en el NO, a 3.4mm de diámetro visualizándose en un corte transversal de las estructuras. Se cuantifica en diferentes sectores y se clasifica como normal, limítrofe o fuera de los límites normales al comparar con base de datos normativa para la edad. (figura 3)
Las mediciones obtenidas son directas; sin embargo, se interpola información entre las líneas radiales para llenar defectos de información. Se hace difícil obtener un registro consistente en cada visita y de esta manera complica las comparaciones a largo tiempo.1
El programa de OCT permite escoger entre el escaneo rápido o lento para el análisis de la CNO y de la CFNR. Se considera de preferencia el escaneo rápido en el glaucoma,1,13 reportándose una sensibilidad del 80% y una especificidad del 90% en la detección del daño glaucomatoso.7,14
CONSIDERACIONES
El Ocular Hypertension Treatment Study (OHTS15 estableció factores de riesgo para la progresión de la hipertensión ocular a glaucoma y demostró que aun cuando el disco no era reconocido como glaucomatoso en la evaluación de estereofotografías por expertos, existían características en el mismo visibles a la oftalmoscopía confocal láser (en la línea base), que se asociaban al desarrollo del glaucoma primario de ángulo abierto. Constituyó la primera validación basada en la evidencia de la tecnología de imagen en el glaucoma.2 Otros estudios a través de la OCT y de la SLP han demostrado igualmente que el daño anatómico precede al funcional.16-21
Las tres herramientas de análisis digital de imágenes presentan ventajas y desventajas. A la luz de los conocimientos actuales se sugiere determinar cual utilizar, en base a las preferencias personales.1 Las compañías insisten en mostrar que un sólo instrumento es suficiente para el seguimiento del glaucoma, cuando en realidad brindan información que se complementa. 3,22-23 Se ha sugerido brindar más atención al GDx en el glaucoma temprano; al HRT en etapas intermedias y más tarde a la OCT. Se considera que en el GDx es más fácil detectar daño focal (ya que las fibras están más repartidas), mientras que en el HRT se requiere mayor daño a nivel de la CNO donde las fibras están superpuestas.6,24,25
La principal utilidad de estas tecnologías está en el seguimiento a largo plazo y en la detección del glaucoma en el período preperimétrico. Actualmente la detección de los cambios anatómicos en el nervio óptico precede a los funcionales y pueden demostrarse a través del mapa de desviaciones, el análisis de progresión, entre otros. El seguimiento debe ser realizado de preferencia en el mismo equipo, utilizando siempre el mismo sistema de imágenes.
La información obtenida debe usarse para complementar la evaluación clínica. Como medios diagnósticos no sustituyen la evaluación de un oftalmólogo experto. De éste se exige un mayor nivel científico que permita incorporarlos e interpretarlos abriendo nuevos campos en el manejo del glaucoma. La imagen estereoscópica obtenida en la lámpara de hendidura con lente convexo de alto poder es un método adecuado para detectar la neuropatía óptica glaucomatosa.26 Si se obtienen resultados contradictorios debe repetirse el examen. La calidad de la imagen determina la confiabilidad de los resultados y es dependiente de factores tales como: la habilidad del operador, el diámetro pupilar, la transparencia de los medios oculares, variables dependientes del instrumento, entre otros.12,23,27
Aún existen muchas dudas. ¿Mejoran las tecnologías de imágenes el manejo clínico del glaucoma? ¿Cómo integrar mejor las mensuraciones al diagnóstico y monitoreo del glaucoma? ¿Cuál de ellas elegir? Corresponde al oftalmólogo informarse de los avances tecnológicos y emplearlos eficiente e intuitivamente para sacarles el máximo de provecho en beneficio de los pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1- Hertz BT, Parrish RK. ¿Qué tecnología dominará el análisis estructural del glaucoma? Ophthalmology Times América Latina. 2007: 13-14.
2- Greenfield D, Weinreb N. Role of Optic Nerve Imaging in Glaucoma Clinical Practice and Clinical Trials. Available online 4 March 2008
3- Badalá F, Nouri-Mahdavi K, Raoof DA, Leeprechanon N, Law SK, Caprioli J. Optic disk and nerve fiber layer imaging to detect glaucoma. Am J Ophthalmol. 2007 Nov; 14 (5):724-32.
4- Lemij H, Reus N. New developments in scanning laser polarimetry for glaucoma Current Opinion in Ophthalmology. 2008; 19(2):136-140.
5- Medeiros F, Bowd C, Zangwill L, Patel Ch, Weinreb R. Detection of Glaucoma Using Scanning Laser Polarimetry with Enhanced Corneal Compensation. Invest Ophthalmol Vis Sci. 2007; 48:3146-3153.
6- Donado OD. Nuevas tecnologías en la detección del Glaucoma: GDx VCC y HRT II. Rewiew of Ophthalmol. 2004; 5: 12-16.
7- Yi K, deBoer JF, Chen TC. Optic Nerve Head and Retinal Nerve Fiber Layer Imaging in Glaucoma. Contemporary Glaucoma. 2007; 6(30):1-7.
8- Wollstein G, Garway-Heath DF, Hitchings RA. Identification of early glaucoma cases with the scanning laser ophthalmoscope. Ophthalmology 1998; 105: 1557- 1563.
9- Strouthidis N, Garway-Heath DF. New developments in Heidelberg retina tomograph for glaucoma. Current Opinion in Ophthalmology. 2008; 19(2):141-148
10- Lindstrom R. Ocular Surgery News celebrates 25 years of ophthalmic coverage. Ocular Surgery News US Edition. 2007 Dec.
11- Yi K, Chen TC, deBoer JF. Spectral Domain Optical Coherence Tomography. Techniques in Ophthalmology. 2006; 4(4). 170-174.
12- Chang, Robert; Budenz, Donald L. New developments in optical coherence tomography for glaucoma. Current Opinion in Ophthalmology. 2008; 19(2):127-135.
13- Naithani P, Sihota R, Sony P, Dada T, et al. Evaluation of Optical Coherence Tomography and Heidelberg Retinal Tomography Parameters in Detecting Early and Moderate Glaucoma. Invest Ophthalmol Vis Sci. 2007;48:3138-3145.
14- Manassakorn A, Nouri-Mahdavi K, Caprioli J. Comparison of retinal nerve fiber layer thickness and optic disk algorithms with optical coherence tomography to detect glaucoma. Am J Ophthalmol. 2006 Jan; 141(1):105-115.
15- Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol 2002; 120:714-720.
16- Huang ML, Chen HY. Development and comparison of automated classifiers for glaucoma diagnosis using Stratus optical coherence tomography. Invest Ophthalmol Vis Sci. 2005 Nov; 46(11):4121-9.
17- Sihota R, Sony P, Gupta V, Dada T, Singh R. Diagnostic capability of optical coherence tomography in evaluating the degree of glaucomatous retinal nerve fiber damage. Invest Ophthalmol Vis Sci. 2006 May; 47(5):2006-10.
18- Anton A, Moreno-Montañes J, Blázquez F, Alvarez A, Martín B, Molina B. Usefulness of optical coherence tomography parameters of the optic disc and the retinal nerve fiber layer to differentiate glaucomatous, ocular hypertensive, and normal eyes. J Glaucoma. 2007 Jan; 16(1):1-8.
19- Baraibar B, Sanchez-Cano A, Honrubia, F. Preperimetric Glaucoma Assessment With Scanning Laser Polarimetry (GDx VCC): Analysis of Retinal Nerve Fiber Layer by Sectors. Journal of Glaucoma. 2007 Dec; 16(8):659-664.
20- Ciara D F, Garway-Heath DP. Evaluating the effect of the new alignment algorithm for longitudinal series of Heidelberg retina tomography images. Acta Ophthalmologica. 2008 March; 86(2):207-214.
21- Sheng H, Rong T. Analysis of Retinal Nerve Fiber Layer and Macular Thickness Measurements in Healthy Taiwanese Individuals Using Optical Coherence Tomography (Stratus OCT). Journal of Glaucoma. 2008; 17(1):30-35.
22- Deleón-Ortega JE, Arthur SN, McGwin G Jr, Xie A, Monheit BE, Girkin CA. Discrimination between glaucomatous and nonglaucomatous eyes using quantitative imaging devices and subjective optic nerve head assessment. Invest Ophthalmol Vis Sci. 2006 Aug; 47(8):3374-80.
23- Mendoza CE, Santiesteban R, González A, González L y col. La tomografía de coherencia óptica en el diagnóstico de enfermedades de la retina y el nervio óptico. Rev Cubana Oftalmol. 2005 jul-dic; 18 (2), ISSN 0864-2176
24- Nouri-Mahdavi K, Hoffman D, Tannenbaum DP, Law SK, Caprioli J. Identifying early glaucoma with optical coherence tomography. Am J Ophthalmol. 2004 Feb; 137(2):228-35.
25- Ioannis H, Athina K, Ioannis E, Vlassis G; Athanasios K, et al. Comparison of Optical Coherence Tomography and Scanning Laser Polarimetry in Glaucoma, Ocular Hypertension, and Suspected Glaucoma. Ophthalmic Surg Lasers Imaging. 2008; 39 (2):125-132.
26- Remo S Jr; Vessani R. New findings in the evaluation of the optic disc in glaucoma diagnosis. Current Opinion in Ophthalmology. 2007; 18(2):122-128.
27- Kourkoutas D, Buys Y, Flanagan J, Hatch W, et al. Comparison of glaucoma progression evaluated with Heidelberg retina tomograph II versus optic nerve head stereophotographs. Can J Ophthalmol 2007; 42:82-88.
Aprobado: 14 de junio de 2009
Dra. Liamet Fernández Argones. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba. E mail: lianetfa@infomed.sld.cu