Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.29 n.1 Ciudad de la Habana ene.-mar. 2010
ARTÍCULOS ORIGINALES
Aproximación al cultivo de condrocitos en la Universidad Nacional de Colombia. Reporte técnico
Approach to chondrocytes culture in National University of Colombia. A technical report
Nancy Stella Landínez ParraI; Diego Alexander Garzón AlvaradoII; Carmen Alicia Cardozo de MartínezIII
IMáster en Ingeniería Biomédica. Profesor Asistente. Facultad de Medicina. Universidad Nacional de Colombia, Bogotá.
IIDoctor en Ciencias (PhD), Máster en Ciencias, Ingeniero Mecánico. Profesor Adjunto. Facultad de Ingeniería. Universidad Nacional de Colombia, Bogotá.
IIIProfesora Asociada. Grupo de Reactivos Biológicos. Laboratorio de Biomiméticos-IBUN. Universidad Nacional de Colombia, Bogotá.
RESUMEN
La pérdida de un tejido o de su función, debido a defectos congénitos, enfermedad o trauma, es uno de los problemas más difíciles, frecuentes y costosos que enfrenta la medicina humana. La degeneración del cartílago articular se conoce como osteoartrosis (OA), la cual se manifiesta mediante daño enzimático y mecánico de la matriz extracelular, que genera dolor y conduce a pérdida del movimiento e inestabilidad articular. El cartílago articular tiene una baja capacidad de reparación, por su avascularidad. El presente trabajo pretende realizar una aproximación a la ingeniería tisular del cartílago con el propósito de establecer la fundamentación teórica en el tema para comprender el comportamiento in vitro del tejido que permita a futuro construir un equivalente de cartílago mediante los procedimientos actuales de ingeniería tisular, que ofrezca respuesta a la problemática social y de salud pública. Las conclusiones del presente trabajo posibilitan futuras investigaciones en el campo de la regeneración de cartílago articular y su aplicación clínica e igualmente brindan las bases para plantear investigaciones in vivo o in vitro que profundicen en el tema.
Palabras clave: cartílago articular, ingeniería tisular, condrocitos, factores de crecimiento, bioreactores.
ABSTRACT
The loss of a tissue or its function due to congenital defects, disease or trauma, is one of the major, frequent and expensive problems challenging the human medicine. The articular cartilage degeneration is known as osteoarthritis (OA), which is characterized by enzyme and mechanical damage of extracellular matrix, generating pain and lead to the loss of movement and articular instability. The articular cartilage has low repair ability due to its avascularization. The aim of present paper is to make an approach to cartilage tissue engineering to establish the theoretical basis on this subject to understand the tissue in vitro behavior allowing in the future, to construct a cartilage equivalent by means of current procedures of tissue engineering, offering a response to social problems and of the public health. Conclusions from present paper make easy futures researches in the field of articular cartilage regeneration and its clinical application and also, providing the bases to planning in vivo and in vitro researches to deepen in this subject.
Key words: Articular cartilage, tissue engineering, chondrocytes, growth factors, bioreactors.
INTRODUCCIÓN
La pérdida de un tejido o de su función, debido a defectos congénitos, enfermedad o trauma, es uno de los problemas más difíciles, frecuentes y costosos que enfrenta la medicina humana.1 Las actuales modalidades de tratamiento incluyen los autoinjertos, los aloinjertos y las prótesis artificiales, sin embargo cada uno de estos métodos tienen sus propias limitaciones que incluyen la escasez de donantes de tejidos, la presencia de reacciones inmunes y la transferencia de agentes patógenos, lo que hace difícil el éxito de estos procedimientos. Por tal razón, el advenimiento de la ingeniería de tejidos constituye un desafío a producir sucedáneos de tejidos que puedan restaurar las características estructurales y las funciones fisiológicas de los tejidos naturales in vivo.2
Precisamente, uno de los tejidos mas investigados es el cartílago, en especial, el cartílago articular. Varios autores3,4 señalan que el cartílago articular tiene una baja capacidad de reparación, debido a su avascularidad y a la muerte de condrocitos. Por tanto, la viabilidad de los condrocitos puede ser uno de los factores críticos que limitan la respuesta de reparación.3,5 Varios estudios histológicos demuestran que la muerte de los condrocitos, se presenta en respuesta a las cargas mecánicas.6-8 La muerte celular por diversas causas lleva al deterioro de la matriz extracelular cuyo resultado final es la presencia de osteoartrosis (OA), que además del dolor, conduce a la pérdida del movimiento e inestabilidad articular.9
La OA, es causa de dolor y discapacidad, especialmente en personas mayores de 50 años. Se caracteriza por la pérdida de cartílago articular que se acompaña de cierto grado de síntesis de moléculas de la matriz extracelular.10,11 Con frecuencia la OA se manifiesta mediante daño enzimático y mecánico de la matriz extracelular, que lleva a degeneración del cartílago, exposición del hueso subcondral, formación de osteofitos marginales y a la inflamación de la membrana sinovial en la etapa clínica de la enfermedad,12-14 (Fig. 1).
A mediados de los años 80, los doctores Joseph Vacanti y Robert Langer, en Estados Unidos, comenzaron a buscar alternativas que permitieran suplir el déficit de órganos para donaciones. Estos investigadores tuvieron la idea de construir estructuras sintéticas y biodegradables que funcionaran como esqueletos, en donde las células crecieran para conformar un tejido; así constituyeron los fundamentos actuales de la ingeniería tisular.16 En los últimos años se aprecia un gran impulso a investigaciones en el campo de la ingeniería tisular del cartílago, es así como la Administración Nacional de Alimentos y Medicamentos (FDA) de los Estados Unidos, aprobó la utilización de tejido cartilaginoso, creado por ingeniería de tejidos, para ser implantados en rodillas osteoartrósicas.
Actualmente, países como España, Argentina, Chile y México se desarrollan en este campo, la Facultad de Ciencias Biológicas de la Universidad de Concepción en Chile, reporta diferenciación de condrocitos a partir de células de médula ósea,17 la división de bioingeniería de Laboratorios Craveri en, Argentina y la Unidad de Ingeniería Tisular del Centro Comunitario de Sangre y Tejidos de Asturias, realizan trasplantes autólogos de condrocitos.18,19 Por su parte el Instituto Nacional de Rehabilitación de México cuenta con una línea de investigación en cartílago.20 En Colombia no se están realizan aún trasplantes autólogos de condrocitos pero sí se cuenta con gran interés en este campo. Actualmente el Grupo de Bioingeniería de la Facultad de Ingeniería de la Universidad de Antioquia se realiza el proyecto desarrollo de un scaffold (andamio) para la reparación del cartílago articular mediante ingeniería de tejidos21 y las universidades colombianas de Los Andes, y la Nacional, se implementan líneas de investigación que posibiliten avances científicos en el tema.
El presente trabajo pretende realizar una aproximación a la ingeniería tisular del cartílago articular, con el propósito de establecer la fundamentación teórica que permita plantear una línea de investigación en el tema. Esta aproximación permite comprender el comportamiento in vitro del cartílago articular a fin de plantear las estrategias a seguir para lograr un equivalente de tejido mediante los procedimientos actuales de la ingeniería tisular, para, dar respuesta a posteriori, a la problemática social y de salud pública, que constituye la osteoartrosis como enfermedad degenerativa en Colombia.
La primera parte de este artículo se orientó a realizar una breve revisión acerca de la ingeniería tisular de manera general. Posteriormente se realizó un acercamiento a las técnicas de cultivo celular para condrocitos y finalmente se presentó el trabajo futuro en el área, mediante el planteamiento de una línea de investigación en el tema.
DESARROLLO
La ingeniería tisular
La ingeniería de tejidos es un campo interdisciplinario surgido en las últimas dos décadas y que reúne diversas áreas como el cultivo de células, la química de polímeros y los trasplantes. Esta área de conocimiento busca proporcionar una nueva solución a la pérdida del tejido, mediante el reemplazo o restauración de tejido o de la función de un órgano, con estructuras que contienen poblaciones específicas de células. La meta fundamental de la ingeniería de tejidos es desarrollar sustitutos biológicos que restauren, mantengan o mejoren la función del tejido perdido o lesionado por trauma o enfermedad.22 Estas nuevas tecnologías permiten la sustitución del tejido con daño, por un tejido diseñado y construido para satisfacer las funciones y las necesidades de cada paciente.
El éxito en la reconstrucción de los tejidos, se puede lograr sobre la base de la armonización de las funciones entre las células, los factores estimulantes (entre ellos las moléculas de señalización) y los andamios o constructos, los cuales constituyen la triada fundamental en los procesos de ingeniería tisular. Las interacciones de los factores de crecimiento celular y las funciones celulares, a menudo son dependientes del tiempo y del ciclo de crecimiento celular.23 La creación de matrices para guiar la regeneración de tejidos, depende de una correcta instrumentación del proceso a diferentes niveles, por ejemplo, el empleo de diversas células, la elección del polímero y el diseño de andamios, acorde con la fisiología del tejido a reconstruir. Estos métodos actualmente se utilizan para guiar la regeneración de diversos tejidos, como el hígado, el intestino, la piel, el cartílago, el hueso y algunas estructuras cardiovasculares.22
Los conceptos emergentes en el uso de los equivalentes (constructos-células), incluyen la necesidad de desarrollar modelos adecuados del entorno micromecánico de los diferentes tejidos.22 Los amplios descubrimientos de los elementos de regulación de la célula proporcionan nuevas estrategias para la intervención y la creación de tejidos con la recuperación de las funciones perdidas. Al mismo tiempo, los avances en las tecnologías de polímeros y tecnologías de liberación controlada, permiten a las células ser cultivadas en ambientes de cultivo con un adecuado andamio, que puede ser adaptado a las necesidades de cada tipo de célula.23 De esta forma se puede decir que la ingeniería de tejido in vitro se considera como una de las más promisorias técnicas para el tratamiento de pacientes con daño del cartílago por artrosis, trauma o anormalidades congénitas.24
Ingeniería tisular en el cartílago articular
El cartílago articular cubre los extremos de las superficies articulares y actúa como una superficie que transmite las fuerzas al hueso subyacente. El daño de este tejido por diferentes causas es de particular preocupación por su limitada capacidad de auto-reparación.25
Tal como se mencionó, el cartílago tiene un potencial muy pobre para recuperarse de manera espontánea luego de una lesión,1,3,4 pues carece de vasos sanguíneos y linfáticos y en él, raramente funcionan los mecanismos habituales de cicatrización, a través de la infiltración o de la migración celular, pues los condrocitos son pocos y se encuentran rodeados por abundante matriz extracelular (MEC).23
Actualmente, las estrategias para tratar los defectos condrales inflamatorios o traumáticos, con sustitutos biológicos, incluyen: el autoinjerto de tejido condral u osteocondral libre, el uso de trasplante alogénico de cartílago y la aplicación de los condrocitos o células progenitoras de condrocitos en suspensión, o como constructos (andamios) de células-polímero.22 Por ello, es necesario incentivar el desarrollo de investigaciones que redunden en la producción de células, biomateriales y factores de señalización, con esto fines terapéuticos.26
La ingeniería tisular del cartílago emerge como una técnica para la regeneración del tejido dañado, debido a una enfermedad o un trauma. Esta tiene un enorme potencial de aplicación mediante cirugía ortopédica, como una alternativa a los actuales métodos quirúrgicos de reemplazos aloplásticos de la articulación.25 Comúnmente, las estrategias de la ingeniería tisular son la combinación de: andamios (scaffolds) que proporcionen un adecuado entorno tridimensional, células apropiadas capaces de diferenciarse y mantener el fenotipo celular específico y la adición de correctas sustancia bioactivas tales como factores de crecimiento, citoquinas u hormonas, como un estímulo conveniente para la diferenciación del linaje específico de cada célula.27-28
La ingeniería tisular del cartílago basada en las células, es un prometedor, innovador, y multidisciplinario enfoque que utiliza los principios de la ingeniería y de las ciencias biológicas para la fabricación de sustitutos funcionales para la reparación o la sustitución del cartílago dañado.29 Los principios básicos de la ingeniería de tejidos utilizan una pequeña porción inicial de tejido del donante como una fuente de células (los condrocitos, los fibroblastos y las células madre), las cuales se aíslan y se expanden a un número clínicamente significativo, que posteriormente se siembran en andamios para obtener una forma conveniente o un nuevo tejido, mientras se apoya su crecimiento y diferenciación mediante la adición de apropiados factores bioactivos.25
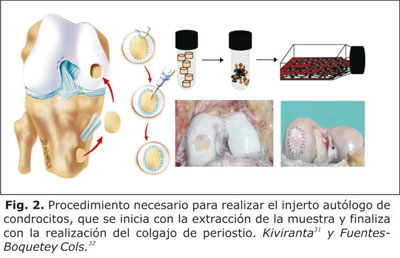
El concepto de terapias basadas en células para la regeneración del cartílago y la reparación no es nuevo. Los tratamientos más populares para la reparación del cartílago articular incluyen: las microfracturas, la mosaicoplastia, el trasplante de aloinjerto osteocondral y el transplante autólogo de condrocitos (ACT). Esta última variante se usa desde 1987 e implica la recolección de biopsias pequeñas de cartílago del paciente, de manera mínimamente invasiva, el aislamiento de los condrocitos del tejido del donante, y la expansión de las células in vitro. Estas células son luego entregadas en el sitio del defecto del cartílago con la ayuda de un colgajo de periostio para que, a partir de ellas, se produzca nuevo tejido cartilaginoso (Fig. 2).26,30
Aunque estas técnicas logran aliviar el dolor y mejorar la función articular, cada una cuenta con desventajas que pueden contraindicar su aplicación clínica.30 Algunas de las dificultades con la utilización de éstas técnicas son: la morbilidad de la zona donante, las complicaciones en los procedimientos quirúrgicos, el riesgo de infección, el rechazo del injerto,26 y el desprendimiento del parche de periostio.33
Otra de las grandes dificultades que se pueden presentar es que el tejido resultante o reparado carece de la estructura del cartílago nativo y es bioquímica y biomecánicamente inferior al cartílago hialino.26 Por este motivo, las últimas técnicas se centran en la implantación de células progenitoras en andamios biológicos, para optimizar el entorno y que se mantenga el fenotipo de los condrocitos.34 Es por esto que a continuación se revisan los aspectos más relevantes a considerar en la triada de la ingeniería tisular del cartílago.
Células fuente
El primer componente de la triada en ingeniería tisular del cartílago articular, lo constituye la determinación de la fuente óptima de células para la ingeniería de cartílago, sin embargo ésta aun no está determinada. Los condrocitos, los fibroblastos y las células madre se exploran como células fuente, viables para la reparación del cartílago.26
Los condrocitos se presentan como el mejor candidato para la reparación de los defectos del cartílago. Estos se pueden obtener a partir del cartílago articular o nasal.35 Sin embargo, éste es un procedimiento invasivo que proporciona un número limitado de las células. Además, cuando los condrocitos se cultivan en monocapa, tienden a desdiferenciarse y adquieren un fenotipo fibroblástico y dejan de expresar sus principales marcadores (agrecanos y colágeno tipo II).36
Por su parte, la piel presenta una abundante fuente de fibroblastos que pueden ser obtenidos con fines de ingeniería de tejidos. Estos se obtienen fácilmente en grandes cantidades con procedimientos mínimamente invasivos y pueden ser dirigidos hacia un fenotipo condrogénico cuando se cultivan en las condiciones adecuadas.37 Los fibroblastos dérmicos humanos pretratados con factor de crecimiento derivado de la Insulina IGF-1 y cultivados sobre agrecanos, forman una densa agregación que expresa GAG y colágeno tipo II.38
En este mismo contexto, recientes trabajos se centran en las células madre, las cuales son células pluripotenciales que pueden diferenciarse en múltiples linajes de células mediante la utilización de señales específicas y que pueden ser aisladas a partir de un gran número de tejidos. Estas células progenitoras pueden ser ampliadas a través de varios pasajes (ampliación del cultivo cuando se tiene confluencia celular) sin pérdida de su potencial de diferenciación.26, 39-41
Las células madre mesenquimales (MSC), presentan una serie de características prometedoras, como la autorrenovación, la capacidad de dividirse, y la multipotencialidad (capacidad de generar células, del tipo celular del tejido al que pertenecen),42-43 las cuales son derivadas de células pluripotenciales de tejido adulto. Bajo condiciones adecuadas, las MSC son capaces de diferenciarse en varios tipos de células de linajes diferentes como: células óseas, cartilaginosas, adiposas, musculares, tendinosas y estromales.44
Las MSC se consideran una fuente prometedora de células para la regeneración de los tejidos esqueléticos, debido a la facilidad de aislamiento y expansión, y a la multipotencialidad45. Un ejemplo de esto son las células madre derivadas de la médula ósea (BMSCs), las cuales sufren condrogénesis en una variedad de condiciones de cultivo, que normalmente consisten en la inducción condrogénica mediante la aplicación al cultivo del factor de crecimiento transformante beta (TGF-b) y un entorno de cultivo tridimensional (3D) que previene la pérdida del fenotipo. Para el cultivo in vitro, la adición de TGF-b en general estimula una mayor condrogénesis, independientemente del método de cultivo; sin embargo, el grado de condrogénesis es dependiente de andamio.46
Las células madre pueden derivarse del tejido adiposo y ser cultivadas in vitro durante un largo periodo, con una expansión estable y bajos niveles de la senescencia.47-48 Estas células de origen mesenquimal, son capaces de diferenciarse en condrocitos en la presencia del TGF-b, ácido ascórbico, y dexametasona en combinación con un entorno de cultivo 3D.47-49 Por su parte, las células madre embrionarias (CME) se obtienen de la masa interna de la célula de embriones en la fase de blastocitosis. Estas células son capaces de realizar duplicaciones y muchas tienen la capacidad de diferenciarse en todos los tipos de células somáticas. A pesar que las CMEs son atractivas como fuente de células, por su gran capacidad de proliferación, las dificultades en la selección y pureza de las CMEs, así como la antigenicidad y los conflictos bioéticos, pueden obstaculizan su uso clínico.26
De manera general, puede decirse que existen factores que pueden influenciar el crecimiento celular y la diferenciación in vitro: factores relacionados con los andamios, como los arreglos espaciales celulares (cultivos en 2D o 3D), la morfología de adherencia celular (planas o esféricas) y la densidad y distribución celular (alta o baja, uniforme o no uniforme); y los factores relacionados con el biorreactor, como la transferencia de masa y las señales fisicoquímicas (mecánicas ó bioquímicas). Estos factores específicos dependen del tipo de tejido que se cultive in vitro.50
Por ejemplo, los cultivos estáticos en monocapa bi y tridimensionales (2D y 3D) constituyen la base y la técnica más económica para la expansión de células madre mesenquimales (MSC). Los cultivos en monocapa deben ser realizados en frascos de vidrio para cultivo, rodillos de poliestireno o placas de Petri.51 Aunque los cultivos tridimensionales estáticos aún no están totalmente explorados,51 se reporta, por ejemplo, que la diferenciación condrogénica de las MSC requiere un entorno tridimensional que sirva para mejorar la interacción célula-célula favorable para la condrogénesis, ya que las células conservan su fenotipo. En este caso, los andamios apoyan la conservación del fenotipo de los condrocitos.25
Los andamios
Los andamios, como segundo componente de la triada, proporcionan un entorno 3D que es deseable para la producción del tejido cartilaginoso. Idealmente, el andamio debería: dirigir y controlar la degradación, promover la viabilidad celular, la diferenciación y la producción de MEC, permitir la difusión de nutrientes y productos de desecho, adherirse e integrarse con el cartílago nativo circundante, asumir el tamaño del defecto, y proporcionar integridad mecánica en función de su localización.26
Numerosos materiales de andamios se utilizan en la regeneración del cartílago. El enfoque principal está en materiales poliméricos, en forma de hidrogeles, esponjas, y mallas fibrosas, un ejemplo de ello puede verse en la figura 3.
Los hidrogeles pueden ser utilizados como andamios inyectables, fácilmente pueden llenar los defectos de cualquier tamaño y forma y se pueden implantar de una manera mínimamente invasiva.52 Los hidrogeles apoyan el transporte de nutrientes y residuos, y pueden suspender homogéneamente las células en un entorno 3D, donde las células encapsuladas suelen mantener una morfología redondeada que puede inducir un fenotipo condrocítico. Los hidrogeles son también capaces de realizar la transducción de cargas mecánicas, para ejercer control de las fuerzas que actúan sobre las células encapsuladas, de manera similar a las condiciones fisiológicas.52-54
Las esponjas también son utilizadas como andamios, las cuales se fabrican con diversos materiales. Algunos polímeros naturales explorados como andamiajes bioactivos para ingeniería de cartílago incluyen: el alginato, la agarosa, la fibrina, el ácido hialurónico (HAc), el colágeno, el quitosán, el sulfato de condroitina, y la celulosa entre otros.53,55-60 Estos materiales también se utilizan como hidrogeles o microesferas.
Por su parte, las mallas son redes de fibras tejidas y no tejidas, en donde las variaciones en el volumen, el diámetro de la fibra y la direccionalidad pueden determinar el comportamiento de las células.26 Las mallas sin tejer tienen alto volumen vacío y las superficies están bien adaptadas para la regeneración del tejido, mientras que las mallas tejidas presentan mayor resistencia y pueden ser hechas en un amplio rango de porosidades. En general, en estas formas prefabricadas se pueden cultivar células gracias a que los andamios son mecánicamente estables y luego pueden ser implantados in vivo para una reparación completa.26 Las mallas más comúnmente utilizadas son las hechas de poli (á-hidroxi-ésteres). Estas mallas se utilizan desde la década de 1990 para la regeneración del cartílago e incluyen el ácido poliláctico (PLA), el ácido poliglicólico (PGA), y sus copolímeros (PLGA).26,60-62
Los polímeros naturales a menudo pueden interactuar recíprocamente con las células a través de los receptores de la superficie celular y pueden regular o dirigir la función de las mismas. Sin embargo, debido a esta interacción, estos polímeros también pueden estimular una respuesta del sistema inmune, por lo tanto, la antigenicidad y la transferencia de la enfermedad son motivo de preocupación cuando se utilizan estos biomateriales.26
Finalmente, la tasa de degradación de los biomateriales constituye otro aspecto relevante, la cual se puede producir por hidrólisis o enzimáticamente. Mediante el control de la degradación temporal y espacial, los andamios se pueden mejorar y dirigir el crecimiento del nuevo tejido. El trabajo de Solchaga y Cols.63 mostró que la tasa de degradación de los andamios es fundamental para el proceso de reparación, una tasa de degradación lenta genera un cartílago de mayor espesor, pero que con frecuencia presenta grietas y fisuras en la superficie del cartílago. Por tanto, se debe buscar un equilibrio entre la degradación lenta, que puede obstaculizar la producción de la nueva MEC cartilaginosa, hasta la degradación rápida, que puede comprometer el apoyo estructural y la forma de retención.63
Factores estimulantes
La estructura y función de las células, de los tejidos y de los órganos en el cuerpo humano, son, en parte, determinadas por factores ambientales, que probablemente sean los mismos factores que afectan el desarrollo, el mantenimiento y la remodelación del tejido in vivo, que pueden ser extrapolados al comportamiento del cultivo in vitro.50 El tercer componente de la tríada de la ingeniería de tejidos lo constituyen los factores estimulantes, los cuales se emplean para inducir, acelerar, y mejorar la formación de cartílago. Dentro de estos factores se destacan: la introducción de factores de crecimiento, los cuales pueden añadirse a los medios de cultivo in vitro, en los andamios, y también, in vivo para controlar la diferenciación celular y la formación de tejido, la terapia génica, en donde las células pueden ser modificadas para que expresen moléculas bioactivas de manera diferencial y la introducción de señales mecánicas a través de regímenes tales como, la carga hidrostática o dinámica de compresión. A continuación se realiza una breve descripción de cada uno de estos factores estimulantes.
Factores de crecimiento
Es importante recordar que la reparación del hueso y del cartílago es una compleja cascada de eventos biológicos controlados por numerosas citocinas y factores de crecimiento que proporcionan señales que le permiten a las células inflamatorias migrar y desencadenar procesos de curación. Un enfoque en la ingeniería de tejidos incluye el suministro de factores de crecimiento para estimular la adhesión celular, la proliferación, la diferenciación y por lo tanto la promoción de la regeneración ósea y cartilaginosa. Esto permite, esencialmente impregnar los andamios de factores de crecimiento para ser liberados a un ritmo y una concentración deseables, y para permanecer en los sitios de la lesión durante un tiempo suficiente para contactar a los progenitores y estimular los procesos de cicatrización de los tejidos.29
Una variedad de factores de crecimiento (FG) como la proteína morfogenética ósea-2 (BMP-2), el factor de crecimiento derivado de la insulina (IGF-I), y el factor transformante de crecimiento b1 (TGF-b1) se utilizan para prevenir la desdiferenciación de los condrocitos o para promover la condrogénesis.27,64 La investigación de Elder y Cols.64 de 2009, demostró un aumento significativo en las propiedades biomecánicas de compresión y de tracción, como resultado del tratamiento con factores de crecimiento. De igual forma los reportes de Park y Cols.65 (2007), con utilización de TGF-b1, aseguran que la expresión génica del cartílago depende de la dosis de TGF-b1 originalmente cargada en el andamio, para inducir la diferenciación condrogénica.
Similares resultados se obtuvieron a partir del trabajo de Hong y Na66 de 2008 quienes utilizaron MSC de conejo que contenían factores de crecimiento para condrogénesis: factor transformante de crecimiento beta-3 (TGF b-3), o factor básico de crecimiento de fibroblastos (FGF)) sobre un andamio de hidrogel de poli (NiPAAm-co-AAC). El análisis con RT-PCR del tejido cartilaginoso resultante, reveló que un andamio de hidrogel con una TGF b-3 fue óptimo para la formación de cartílago, determinado a través de la producción de colágeno tipo II, agrecanos y la expresión génica de los homeogenes SOX9. El aumento dramático en el número de células en las muestras con TGF b-3 se acompañó del mantenimiento de los fenotipos celulares.
La terapia génica
La terapia génica es un método alternativo para encapsular las moléculas bioactivas en los andamios. Está terapia se convirtió en otro método de entrega local, donde las células pueden ser diseñadas para sobre-expresar moléculas bioactivas. Las células son transfectadas con agentes virales (retrovirus y adenovirus) y no virales (liposomas y polímeros).67
Los condrocitos con OA pueden ser transducidos con Sox 9, a través de adenovirus y vectores retrovirales para estimular el colágeno tipo II y la expresión y deposición en cultivos tanto monocapa como en esferas de alginato.68 El trabajo de Guo y Cols.67 reporta experimentos realizados con células madre de médula ósea de conejos, derivadas de las células mesenquimales (MSC), que fueron transfectadas con el Gen TGF-a1 en un cultivo en monocapa con Lipofectamine 2000. Después de la transfección, la expresión de la matriz extracelular del cartílago se incrementó, mientras que las metaloproteinasas de matriz 1 y 3 (MMP 1 y 3) y la actividad enzimática disminuyó. Los resultados mostraron un aumento significativo en la expresión de colágeno tipo II en el día 14 y expresión de agrecanos a partir de los 7 días en los grupos que contenían TGF-transfectado sobre los grupos de control, lo que indica que el TGF-b1-transfectado con micropartículas condrogénicas promueve la diferenciación de las MSC de conejo.
Señales mecánicas como factor de modificación
La utilización de tejido cartilaginoso formado in vitro es una alternativa de tratamiento, sin embargo, la regeneración del tejido con los métodos actuales de bioingeniería de cartílago no coincide con las propiedades físicas del cartílago nativo, lo cual puede afectar su capacidad de recubrir un defecto en las grandes articulaciones a largo plazo. En diferentes estudios se demostró que la estimulación mecánica mejora la formación de cartílago desde la ingeniería tisular.29 Se plantea que muchos tipos de cartílago dependen de las fuerzas mecánicas para mantener la función saludable.26 Algunos autores como De Cross y Cols.,29 Lima y Cols.,69 y Waldman y Cols.,70 desarrollaron métodos de aplicación de fuerzas compresivas, que mecánicamente estimulan los condrocitos y resultan en un incremento de acumulación de matriz y mejor formación del tejido.29
Un enfoque adicional es la introducción de señales mecánicas a través de regímenes tales como la carga hidrostática o dinámica de compresión o mediante el uso de biorreactores. Existe una amplia evidencia de la importancia de las fuerza mecánicas en la facilitación de la regeneración del cartílago articular. Estudios realizados en explantes o en condrocitos sembrados en monocapa, en andamios o en hidrogeles, demostran que una magnitud baja o moderada, aplicada a frecuencias del orden de 1 Hz mejoran substancialmente la expresión y la síntesis de proteínas de la matriz. Aunque diversos regímenes de carga reportan, se encontró que la mayoría de los trabajos se centran en la carga compresiva y en la presión hidrostática.71-74
Finalmente los biorreactores mejoran el transporte de nutrientes y proporcionan un ambiente hidrodinámico que impone un fluido-inducido por esfuerzo cortante para promover la síntesis de las proteínas específicas del cartílago, lo que acelera o mejora el crecimiento del tejido en los procedimientos de ingeniería de cartílago in vitro. 60,75-76 Recientemente, se desarrolla un nuevo biorreactor de pared ondulada (WWB) que genera aumento en la proliferación de los condrocitos y en el depósito de la MEC en cultivos sobre andamios de PGA cultivados en frascos spinner comunes.77
Otro nuevo concepto en biorreactores, para mejorar las propiedades del cartílago in vitro, sugiere la incorporación de la tensión de cizalla y el movimiento rotacional en un rango fisiológico de carga. El biorreactor aplica cargas dinámicas similares a las condiciones de carga aplicadas a la articulación de la rodilla in vivo. Por otra parte se pueden realizar pruebas de las propiedades mecánicas del cartílago dentro del biorreactor sin sacar el tejido de la estructura portadora.78
Primera aproximación al cultivo de condrocitos: procedimiento y resultados preliminares
Al realizar una revisión en la literatura, se encuentran múltiples protocolos para el cultivo de condrocitos, que ofrecen diversas posibilidades cuyos datos no son comparables.79-87 Realizar un análisis y descripción de todos los protocolos existentes es, en extremo, extenso, sin embargo, la revisión de la literatura permite evidenciar que la mayoría de los protocolos coinciden en varios aspectos relevantes tales como: las condiciones de cultivo a una temperatura de incubación de 37 oC, en un ambiente húmedo con un 95 % de O2 y un suplemento del 5 % de CO2; la disociación celular a partir de tripsina y/o colagenasa; el cambio del medio de cultivo cada 2 o 3 días y el uso de tripsina para disociar nuevamente las células en el proceso de pasajes celulares, si el cultivo está pre-confluente, para realizar una nueva siembra de las mismas, en dos nuevos frascos.79-87
A pesar de la diversidad de protocolos para la disociación y el cultivo de condrocitos en monocapa, se tomó el protocolo de la Unidad de Ingeniería Tisular del Centro Comunitario de Sangre y Tejidos de Asturias en España, gracias a la comunicación personal con el Dr. Alvaro Meana, investigador de dicha Unidad.88 A partir de este protocolo se realizaron varios procedimientos para lo disociación y siembra de condrocitos en monocapa, como sigue:
Preparación previa
En cabina de flujo laminar se realizó la preparación del medio de cultivo DMEN + F12 (Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12) con suplemento de antibióticos y antimicóticos. A continuación se procedió a preparar el medio condrocítico con suplemento de ácido ascórbico y suero autólogo.
Toma de muestra
Previo al procedimiento quirúrgico se llevó a la sala de cirugía un frasco shot de 50 mL. con medio DMEN + F12 con suplemento de antibióticos y antimicóticos. La muestra se obtuvo por un médico ortopedista, en sala de cirugía, a partir de la resección del cóndilo femoral de la rodilla de una paciente femenina quien presentó osteoartrosis, durante un procedimiento de artroplastia de la misma. La muestra se transportó hasta el laboratorio en DMEN + F12 con antibióticos y antimicóticos.
Disociación y siembra celular
El proceso de disociación celular se inició con un procedimiento de fragmentación de la muestra en pequeños trozos y la aplicación de tripsina para realizar la digestión enzimática del tejido, por espacio de 30 minutos. Posteriormente se retiró el sobrenadante y se aplicó a la muestra colagenasa al 2 %, por espacio de 6 a 8 horas en condiciones de incubación y de agitación constante.
Al cabo de las 8 horas, se realizó un procedimiento de centrifugación a 1,200 rpm y se obtuvo un pellet de células que se re-suspendió con medio condrocítico previamente preparado. Se realizó conteo celular y siembra de las células obtenidas en una caja de 6 pozos.
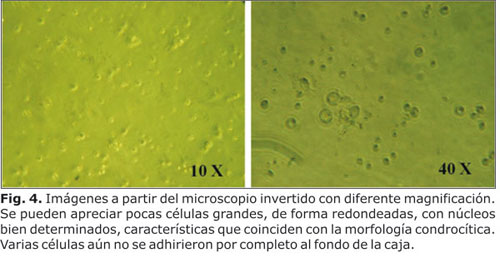
Con el microscopio invertido se consideró la morfología celular y se evidenció la disociación de los condrocitos. Las células sembradas en medio condrocítico, fueron llevadas a la incubadora, la cual contó con una temperatura de 37 ºC y una concentración de CO2 del 5 %, por espacio de 48 horas, luego de lo cual se realizó el cambio de medio. A la observación se evidenció que algunos condrocitos aún no se adhierieron al piso del pozo (Fig. 4).
Pasadas otras 48 horas se procedió a realizar el cambio de medio, pero se evidenció alteración del medio de cultivo (turbio), se procedió entonces a realizar análisis bacteriológico, donde se constató marcada contaminación bacteriana, por lo cual se decidió descartar el cultivo en su totalidad.
Propuesta de una línea de trabajo
Sobre la base de la revisión de la literatura y de los resultados obtenidos a partir de la primera aproximación al cultivo de condrocitos se planteó la necesidad de definir una línea de investigación en este campo.
La línea de investigación propuesta considera 5 fases: (1) caracterización del cultivo de condrocitos en mono capa, (2) determinación y evaluación de un gel de biopolímero como posible andamio o constructo, (3) caracterización de un cultivo de condrocitos en un constructo tridimensional, (4) elección y aplicación de algunos factores de crecimiento en un cultivo tridimensional de condrocitos y (5) aplicación de fuerzas externas hidrostáticas y/o de compresión sobre el constructo con la respectiva evaluación del efecto de las mismas sobre el comportamiento mecánico y la expresión génica del cultivo.
Los procedimientos planteados son ambiciosos por cuanto consideran, además del cultivo de condrocitos, el evaluar algunos biomateriales que puedan constituirse en los andamios, así como el rol de los factores de crecimiento y de las fuerzas ejercidas sobre las características bioquímicas y biomecánicas de los constructos.
DISCUSIÓN
La pérdida de un tejido o de su función, debido a defectos congénitos, enfermedad o trauma es uno de los problemas más difíciles, frecuentes y costosos que enfrenta la medicina humana.1 Los avances en ingeniería de tejidos deben responder a los desafíos impuestos en dichas alteraciones de tal manera que permitan diseñar y desarrollar equivalentes que reemplacen las características estructurales y funcionales del tejido lesionado.
De igual forma es necesario considerar la utilidad de la terapia génica en los procesos de ingeniería tisular del cartílago articular, así como el impacto que sobre los condrocitos tienen diferentes andamios a partir de biomateriales (micro-y nano-fabricados).
El éxito en la regeneración o sustitución del cartílago dañado o enfermo dependerá de los futuros avances en la comprensión de la biología in vivo del cartílago y del entendimiento de los cambios sufridos por el mismo cuando se cultiva in vitro, con el propósito de diseñar estrategias y procedimientos de ingeniería tisular que permitan desarrollar sustitutos del tejido o facilitar la reparación o la regeneración del mismo. De igual forma es recomendable tener siempre en mente los procesos inmunológicos y de biocompatibilidad desencadenados a partir de éstas prácticas.
Tal como lo plantean Lanza y Cols.,16 en ningún otro espacio como en el campo de la ingeniería tisular, es necesario el trabajo multidisciplinar que permita la interrelación de saberes desde distintas disciplinas como la biología, la química, las teorías de materiales, la ingeniería y la clínica, con énfasis en las áreas de investigación que puedan ser de utilidad clínica en el futuro.16
La selección de las células, el diseño de los andamios y la estimulación biológica constituyen los mayores desafíos en la ingeniería tisular. Por lo tanto es importante considerar los desarrollos tecnológicos relacionados con la diferenciación de células mesenquimales, los efectos de las fuerzas mecánicas y de los factores de crecimiento así como también la importancia de los ambientes facilitadores del fenotipo condrocítico que impidan su des-diferenciación, al considerar la utilidad de los cultivos en monocapa y las ventajas de los cultivos tridimensionales.
Los modelos matemáticos pueden ser de utilidad para predecir fenómenos importantes en el comportamiento de los diferentes dispositivos que se utilizan en la ingeniería de tejidos para el cartílago articular, por lo tanto es aconsejable considerar estas herramientas dentro de los protocolos diseñados para tal fin.
REFERENCIAS BIBLIOGRÁFICAS
1. Langer R, Vacanti JP. Tissue Engineering. Science. 1993;260:920-6.
2. Nerem RM, Cellular engineering. Annals of Biomedical Engineering. 1991;19:529-45.
3. Archer CW. Skeletal development and osteoarthritis. Annals of the Rheumatic Diseases. 1994;53:624-30.
4. Kuhn K, D'Lima DD, Hashimoto S, Lotz M. Cell death in cartilage. Osteoarthritis and Cartilage. 2004;12:1-16.
5. D'Lima DD, Hashimoto S, Chen PC, Colwell CW, Lotz MK. Human chondrocyte apoptosis in response to mechanical injury. Osteoarthritis and Cartilage. 2001;9:712-19.
6. Kurz B, Lemke AK, Fay J, Pufe T, Grodzinsky AJ, Schunke M. Pathomechanisms of cartilage destruction by mechanical injury. Annals of Anatomy. 2005;187:473-85.
7. Loening AM, James IE, Levenston ME, Badger AM, Frank EH, Kurz B, et al. Injurious mechanical compression of bovine articular cartilage induces chondrocyte apoptosis. Archives of Biochemistry and Biophysics. 2000;381,2:205-12.
8. Tew SR, Kwan AP, Hann A, Thomson BM, Archier CW. The reactions of articular cartilage to experimental wounding. Arthritis & Rheumatism. 2000;43,1:215-25.
9. Martel-Pelletier J, Boileau C, Pelletier JP, Roughley PJ. Cartilage in normal and osteoarthritis Conditions. Best Practice & Research Clinical Rheumatology. 2008;22,2:351-84.
10. Wong M, Carter DR. Articular cartilage functional histomorphology and mechanobiology: a research perspective. Bone. 2003;33:1-13.
11. Bay-Jensen AC, Andersen TL, Charni-Ben Tabassi N, Kristensen PW, Kjaersgaard-Andersen P, Sandell L, et al. Biochemical markers of type II collagen breakdown and synthesis are positioned at specific sites in human osteoarthritic knee cartilage. Osteoarthritis and Cartilage. 2008;16:615-23.
12. Silver FH, Bradica G, Tria A. Relationship among biomechanical, biochemical, and cellular changes associated with osteoarthritis. Biomedical Engineering. 2001;29(4):373-91.
13. Silver FH, Bradica G, Tria A. Do changes in the mechanical properties of articular cartilage promote catabolic destruction of cartilage and osteoarthritis? Matrix Biology. 2004;23:467-76.
14. Sniekers YH, Weinans H, Bierma-Zeinstra SM, van Leeuwen JPTM, van Osch GJVM. Animal models for osteoarthritis: the effect of ovariectomy and estrogen treatment a systematic approach. Osteoarthritis and Cartilage. 2008;16:533-41.
15. Almazán DA. Hospital Ángeles Metropolitano. México DF. [serie en Internet] 2009 [citado 22 septiembre 2009] [aprox. 2 p.]. Disponible en: http://www.mirodilla.com/images/condro_gr4.jpg
16. Lanza R, Langer R, Vacanti J. Principles of tissue engineering. New York: Elsevier, Inc. 2007.
17. Universidad de Concepción. Facultad de Ciencias biológicas. Sede Chillan. Chile. [serie en Internet] septiembre 2008 [citado 22 septiembre 2009] [aprox. 5 p.]. Disponible en: http://www.chillan.udec.cl/noticias/2008/200809/des_20080911c.html
18. Laboratorios Craveri. División de bioingeniería. Área de Ingeniería de Tejidos. Buenos Aires, Argentina. [serie en Internet] 2009 [citado 20 septiembre 2009] [aprox. 1 p.]. Disponible en: http://www.craveri.com.ar/home.php?pagina=contenidos.php&id_seccion=28
19. Centro Comunitario de Sangre y Tejidos de Asturias [serie en Internet] 2009 [citado 20 septiembre 2009] [aprox. 4 p.]. Disponible en: http://www.donasturias.com/scripts/presentacion_noticia1.asp
20. Haider MA, Schugart RC. A numerical method for the continuous spectrum biphasic poroviscoelastic model of articular cartilage. Journal of Biomechanics. 2006;39:177-83.
21. Garzón GA. Simulación de procesos de reacción-difusión: aplicación a la morfogénesis del tejido óseo. (Tesis Doctoral), Centro Politécnico Superior de la Universidad de Zaragoza. 2007.
22. JMarler JJ, Upton J, Langer R, Vacanti JP. Transplantation of cells in matrices for tissue regeneration. Advanced Drug Delivery Reviews. 1998;33:165-82.
23. Kino-Oka M, Maeda Y, Yamamoto T, Sugawara K, Taya M. A kinetic modeling of chondrocyte culture for manufacture of tissue-engineered cartilage. Journal of Bioscience and Bioengineering. 2005;99,3:197-207.
24. Freed LE, Martin I, Vunjak-Novakovic G. Frontiers in Tissue Engineering: in vitro modulation of Chondrogenesis. Clinical Orthopaedics and Related Research. 1999;367:46-58.
25. Janjanin S, Li WJ, Morgan MT, Shanti RM, Tuan RS. Mold-shaped, nanofiber scaffold-based cartilage engineering using human mesenchymal stem cells and bioreactor. Journal of Surgical Research. 2008;149:47-56.
26. Chung C, Burdick JA. Engineering cartilage tissue. Advanced Drug Delivery Reviews. 2008;60:243-62.
27. Lee SH, Shin H. Matrices and scaffolds for delivery of bioactive molecules in bone and cartilage tissue engineering. Advanced Drug Delivery Reviews. 2007;59:339-59.
28. Kuo CK, Li WJ, Mauck RL, Tuan RS. Cartilage tissue engineering: its potential and uses. Current opinion in rheumatology. 2006;18:64-73.
29. De Croos JNA, Dhaliwal SS, Pilliar RM, Kandel RA. Cyclic compressive mechanical stimulation induces sequential catabolic and anabolic gene changes in chondrocytes resulting in increased extracellular matrix accumulation. Matrix Biology. 2006;25:323-31.
30. Marlovits S, Zeller P, Singer P, Resinger C, Vecsei V. Cartilage repair: generations of autologous chondrocyte transplantation. European Journal of Radiology. 2006;57:24-31.
31. Kiviranta I. Tissue Engineering and repair of articular cartilage. Department of Anatomy. University of Kuopio, Finland. [Serie en Internet] 2009 [citado 23 Octubre 2009] [aprox. 4 p.]. Disponible en: http://www.luotain.uku.fi/terac/research_fields/figure_4.jpg
32. Fuentes-Boquete IM, Arufe MC, Díaz SM, Gómez TH, et al. Tratamiento de lesiones del cartílago articular con terapia celular. Rheumatology Clinics. 2007;3 Supl 3:S63-9.
33. Iwasa J, Ochi M, Uchio Y, Katsube K, Adachi N, Kawasaki K. Effects of cell density on proliferation and matrix synthesis of chondrocytes embedded in atelocollagen gel. Artificial Organs. 2003;27:249-55.
34. Segal NA, Buckwalter JA, Amendola A. Other surgical techniques for osteoarthritis. Best Practice & Research Clinical Rheumatology. 2006;20,1:155-76.
35. Vinatier C, Magne D, Moreau A, et al. Engineering cartilage with human nasal chondrocytes and a silanized hydroxypropyl methylcellulose hydrogel. Journal of Biomedical Materials Research. 2007;80:66-74.
36. Bonaventure J, Kadhom N, Cohen-Solal L, et al. Reexpression of cartilage-specific genes by dedifferentiated human articular chondrocytes cultured in alginate beads. Experimental Cell Research. 1994;212:97-104.
37. Nicoll SB, Wedrychowska A, Smith NR, Bhatnagar RS, Modulation of proteoglycan and collagen profiles in human dermal fibroblasts by high density micromass culture and treatment with lactic acid suggests change to a chondrogenic phenotype. Connective Tissue Research. 2001;42:59-69.
38. French MM, Rose S, Canseco J, Athanasiou KA. Chondrogenic differentiation of adult dermal fibroblasts. Annals of Biomedical Engineering. 2004;32:50-6.
39. Vinatier C, Mrugala D, Jorgensen C, Guicheux J. Cartilage engineering: a crucial combination of cells, biomaterials and biofactors. Trends in Biotechnology. 2009;27,5.
40. Hwang YS, Bishop AE, Polak JM, Mantalaris A. Enhanced in vitro chondrogenic differentiation of murine embryonic Stem cells. Biotechnology and Bioprocess Engineering. 2007;12:696-706.
41. Csaki C, Schneider PRA, Shakibaei M. Mesenchymal stem cells as a potential pool for cartilage tissue engineering. Annals of Anatomy. 2008;190:395-412.
42. Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The international society for cellular therapy position statement. Cytotherapy. 2006;8:315-7.
43. Weissman IL, Anderson DJ, Gage F. Stem and progenitor cells: origins, phenotypes, lineage commitments, and transdifferentiations. Annual Review of Cell and Developmental Biology. 2001;17:387-403.
44. Chen FH, Tuan RS. Mesenchymal stem cells in arthritic diseases. Arthritis Research & Therapy 2008;10:223-34.
45. Chen FH, Rousche KT, Tuan RS. Technology insight: adult stem cells in cartilage regeneration and tissue engineering. Nature Clinical Practice Rheumatology. 2006;2:373.
46. Coleman RM, Case ND, Guldberg RE. Hydrogel effects on bone marrow stromal cell response to chondrogenic growth factors. Biomaterials. 2007;28:2077-86.
47. Zuk ,M. Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 2001;7:211-28.
48. Merceron C, Vinatier C, Clouet J, Colliec-Jouault S, Weiss P, Guicheux J. Adipose-derived mesenchymal stem cells and biomaterials for cartilage tissue engineering. Joint Bone Spine. 2008;75:672-4.
49. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 2002;13:4279-95.
50. Freed LE, Vunjak-Novakovic G. Culture of organized cell communities. Advanced Drug Delivery Reviews. 1998;33:15-30.
51. Pountos I, Corscadden D, Emery P, Giannoudis PV. Mesenchymal stem cell tissue engineering: Techniques for isolation, expansion and application. J Care Injured. 2007;38:23-7.
52. Bryant SJ, Anseth KS. Hydrogel properties influence ECM production by chondrocytes photoencapsulated in poly(ethylene glycol) hydrogels. Journal of Biomedical Materials Research. 2002;59:63-72.
53. Erickson IE, Huang AH, SenguptaS, KestleS, Burdick JA, Mauck RL. Macromer density influences mesenchymal stem cell chondrogenesis and maturation in photo crosslinked hyaluronic acid hydrogels. Osteoarthritis Cartilage. 2009;10:1016.
54. Chung CM, Beecham RL, Mauck JA. The influence of degradation characteristic sof hyaluronic acid hydrogel son in vitro neocartilage formation by mesenchymal stem cells. Biomaterials. 2009;30,26:4287-96.
55. Wang X, Wenk E, Zhang X, Meinel LVunjak-Novakovic G, Kaplan DL. Growth factor gradients via microsphere delivery in biopolymer scaffolds for osteochondral tissue engineering. Journal of Controlled Release. 2009;134,2:81.
56. Seda-Tigli R, Ghosh S, Laha MM, Shevde KK, Daheron L, Gimble J, et al. Comparative chondrogenesis of human cell sources in 3D scaffolds. Journal of Tissue Engineering and Regenerative Medicine. 2009;10:1002.
57. Erickson IE, Huang AH, Chung C, Li RT, Burdick JA, Mauck RL. Differential maturation and structure-function relationships in mesenchymal stem cell-and chondrocyte-seeded hydrogels. Tissue Engineering. Part A. 2009;15,5:1041-52.
58. Chung C, Burdick JA. Influence of three-dimensional hyaluronic acid microenvironment son mesenchymal stem cell chondrogenesis. Tissue Enginerering. 2009;15,2:243-54.
59. Dickhut A, Gottwald E, Steck E, Heisel C, Richter W. Chondrogenesis of mesenchymal stem cells in gel-like biomaterials in vitro and in vivo. Frontiers in Bioscience. 2008;13:4517-28.
60. Ohyabu Y, Tanaka J, Ikada Y, Uemura T. Cartilage tissue regeneration from bone marrow cells by RWV bioreactor using collagen sponge scaffold. Materials Science and Engineering. 2009;29:1150-55.
61. Cui L, Wu Y, Cen L, Zhou H, Yin S, Liu G, et al. Repair of articular cartilage defect in non-weight bearing areas using adipose derived stem cells loaded polyglycolic acid mesh. Biomaterials. 2009;30:2683-93.
62. Sato T, Chen G, Ushida T, Ishii T, Ochiai N, Tateishi T. Tissue-engineered cartilage by in vivo culturing of chondrocytes in PLGA_collagen hybrid sponge. Materials Science and Engineering. 2001;17:83-9.
63. Solchaga LA, Temenoff JS, Gao JZ, Mikos AG, Caplan AI, Goldberg VM. Repair of osteochondral defects with hyaluronan and polyester-based scaffolds. Osteoarthritis and Cartilage. 2005;13:297-309.
64. Elder BD, Athanasiou KA. Systematic assessment of growth factor treatment on biochemical and biomechanical properties of engineered articular cartilage constructs. Osteoarthritis and Cartilage. 2009;17:114-23.
65. Park H, Temenoff JS, Tabata Y, Caplan AI, Mikos AG. Injectable biodegradable hydrogel composites for rabbit marrow mesenchymal stem cell and growth factor delivery for cartilage tissue engineering. Biomaterials. 2007;28:3217-27.
66. Hong K, Na K. Effect of Growth Factors on Chondrogenic Differentiation of Rabbit Mesenchymal Cells Embedded in Injectable Hydrogels. Journal of Bioscience and Bioengineering. 2008;106,1:74-9.
67. Guo CA, Liu XG, Huo JZ, Jiang C, Wen XJ, Chen ZR. Novel Gene-Modified-Tissue Engineering of Cartilage Using Stable Transforming Growth Factor-â1-Transfected Mesenchymal Stem Cells Grown on Chitosan Scaffolds. Journal of Bioscience and Bioengineering. 2007;103,6:547-56.
68. Li Y, Tew SR, Russell AM, Gonzalez KR, Hardingham TE, Hawkins RE. Transduction of passaged human articular chondrocytes with adenoviral, retroviral, and lentiviral vectors and the effects of enhanced expression of SOX9. Tissue Engineering. 2004;10:575-84.
69. Lima EG, Mauck RL, Han SH, Park S, Ng KW, Ateshian GA, et al. Functional tissue engineering of chondral and osteochondral constructs. Biorheology. 2004;41:577-90.
70. Waldman SD, Couto DC, Grynpas MD, Pilliar RM, Kandel RA. A single application of cyclic loading can accelerate matrix deposition and enhance the properties of tissue-engineered cartilage. Osteoarthritis and Cartilage. 2006;14:323-30.
71. Shieh AC, Athanasious KA. Principles of Cell Mechanics for Cartilage Tissue Engineering. Annals of Biomedical Engineering. 2003;31:1-11.
72. Carter DR, Beaupré GS, Wong M, Smith RL, Andriacchi TP, Schurman DJ. The mechanobiology of articular cartilage development and degeneration. Clinical Orthopaedics and Related Research. 2004;427:69-77.
73. Wong M, Siegrist M, Cao X. Cyclic compression of articular cartilage explants is associated with progressive consolidation and altered expression pattern of extracellular matrix proteins. Matrix Biology. 1999;18:391-9.
74. Wong M, Carter DR. Articular cartilage functional histomorphology and mechanobiology: a research perspective. Bone. 2003;33:1-13.
75. Concaro S, Gustavson F, Gatenholm P. Bioreactors for Tissue Engineering of Cartilage. Advances in Biochemical Engineering Biotechnology. 2009;112:125-43.
76. Lagan K, Moretti M, Raimondi MT, Dubini G. Tissue engineered cartilage development in a perfused high pressure bioreactor. Journal of Biomechanics. 2006;39:577.
77. Bueno EM, Bilgen B, Barabino GA. Wavy-walled bioreactor supports increased cell proliferation and matrix deposition in engineered cartilage constructs, Tissue Engineering. 2005;11:1699-1709.
78. Ilinich E, Bier R, Eisenbarth E, Goepfert C, Pirtner R, Morlock M, et al. Biomechanical and biochemical properties of native and in vitro porcine cartilage, a new bioreactor for the cultivation of cartilage with realistic joint loading. Journal of Biomechanics. 2006;39:557.
79. Goldring MB. Human Chondrocyte culture as models of cartilage-specific gene regulation. In: Human Cell culture Protocols. Methods in molecular medicine. New Jersey: Human Press. 1996. p. 217-32.
80. Wang Y, Blasioli DJ, Kim HJ, Kim HS, Kaplan DL. Cartilage tissue engineering with silk scaffolds and human articular chondrocytes. Biomaterials. 2006;27:4434-42.
81. Wu W, Chen F, Feng X, Liu Y, Mao T. Engineering cartilage tissues with the shape of human nasal alar by using chondrocyte macroaggregate-experiment study in rabbit model. Journal of Biotechnology. 2007;130:75-84.
82. Lin Z, Pavlos NJ, Cake MA, Wood DJ, Xu J, Zheng MH. Evidence that human cartilage and chondrocytes do not express calcitonin receptor. OsteoArthritis and Cartilage. 2008;16:450-7.
83. Patti AM, Gabriele A, de la Rocca C. Human chondrocyte cell lines from articular cartilage of metatarsal phalangeal joints. Tissue & Cell. 1999;31,6:550-4.
84. Wang LMS, Lazebnik M, Detamore MS. Hyaline cartilage cells outperform mandibular condylar cartilage cells in a TMJ fibrocartilage tissue engineering application. Osteoarthritis and Cartilage. 2009;17:346-53.
85. Wanga Y, Kimc UJ, Blasiolia DJ, Kimb HJ, Kaplan DL. In vitro cartilage tissue engineering with 3D porous aqueous-derived silk scaffolds and mesenchymal stem cells. Biomaterials. 2005;26:7082-94.
86. Appel B, Baumer J, Eyrich D, Sarhan H, Toso S, Englert C, et al, Synergistic effects of growth and differentiation factor-5 (GDF-5) and insulin on expanded chondrocytes in a 3-D environment. Osteoarthritis and Cartilage. 2009;17:1503-12.
87. Protocolo para Cultivo de condrocitos. Protocolos de la Unidad de Ingeniería Tisular del Centro Comunitario de Sangre y Tejidos de Asturias. España, 2008.
88. Meana Alvaro. Unidad de Ingeniería Tisular del Centro Comunitario de Sangre y Tejidos de Asturias-España. Comunicación Personal. Octubre 2008.
Recibido: 10 de septiembre de 2009.
Aprobado: 20 de noviembre de 2009.
Nancy Stella Landínez Parra. Universidad Nacional de Colombia. Grupo de Modelado y Métodos Numéricos en Ingeniería. E mail: nslandinezp@unal.edu.co