Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.29 n.4 Ciudad de la Habana oct.-dic. 2010
TRABAJOS ORIGINALES
Marcadores de estrés oxidativo en embarazadas diabéticas
Markers of oxidative stress in diabetic pregnants
Tammy Fernández RomeroI; Sonia Clapés HernándezII; Gipsis Suárez RománIII; Karina Casanueva CaleroIV; Daisy I. Armas CastilloV; Mari Carmen TormoVI; Guillermo T. SáezVII; Esteban Egaña MoralesVIII; Delia Rojo DomínguezIX
IEspecialista de II Grado en Bioquímica Clínica. Instructora. ICBP "Victoria de Girón". La Habana, Cuba.
IIDoctora en Ciencias. Profesora Titular. ICBP "Victoria de Girón". La Habana, Cuba.
IIIEspecialista de I Grado en Bioquímica Clínica. Instructora. ICBP "Victoria de Girón". La Habana, Cuba.
IVEspecialista de I Grado en Bioquímica Clínica. Laboratorio de Genética Molecular. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
VMáster en Ciencias. Especialista de I Grado en Bioquímica Clínica. Profesora Auxiliar. Facultad de Ciencias Médicas "Enrique Cabrera". La Habana, Cuba.
VIDoctora en Ciencias. Especialista en Bioquímica Clínica. Departamento de Bioquímica y Biología Molecular. Universidad de Valencia, España.
VIITécnico de Laboratorio. Departamento de Bioquímica y Biología Molecular. Universidad de Valencia, España.
VIIIMáster en Ciencias. Profesor Auxiliar. ICBP "Victoria de Girón". La Habana, Cuba.
IXEspecialista de II Grado en Bioquímica Clínica. Profesora Auxiliar. Departamento de Bioquímica. ICBP "Victoria de Girón". La Habana, Cuba.
RESUMEN
Introducción: El manejo del estrés oxidativo en la embarazada diabética podría ser beneficioso en la prevención de complicaciones como las malformaciones congénitas. Sin embargo, no existe un consenso en cuanto a la pertinencia de aplicar terapias antioxidantes previamente o durante la gestación. La ambigüedad de algunos resultados en cuanto al daño real sobre las biomoléculas pudiera ser la causa de tal desacuerdo. El estudio tuvo como objetivos evaluar el estado de marcadores de daño oxidativo a biomoléculas y de defensa antioxidante en embarazadas diabéticas, así como analizar la influencia del tipo diabetes en el estado REDOX durante la gestación.
Métodos: Se estudiaron 32 embarazadas diabéticas (15 con diabetes pregestacional y 17 gestacional) y 27 sanas, con un tiempo de gestación promedio superior a 20 semanas. Los marcadores se evaluaron por técnicas espectrofotométricas y cromatografía líquida de alta presión.
Resultados: se pudo asegurar daño oxidativo al material genético y a proteínas, unido a una disminución también significativa de las defensas antioxidantes mediadas por el glutatión reducido en las embarazadas con diabetes pregestacional. Los niveles de nitratos y nitritos no mostraron diferencias entre los grupos.
Conclusiones: los resultados permiten asegurar una vez más que las mujeres con diabetes pregestacional presentan un estado de estrés oxidativo que deteriora las defensas antioxidantes y no logra contrarrestar el daño oxidativo a biomoléculas.
Palabras clave: Diabetes pregestacional, diabetes gestacional, malformaciones congénitas, estrés oxidativo.
ABSTRACT
Introduction: The management of oxidative stress in diabetic pregnants could be beneficial to prevent complications like the congenital malformations. However, there is not a consensus as regards the relevance of applying antioxidant therapies before or during pregnancy. The ambiguity of some results as regard the real damage on biomolecules could be the cause of such disagreement. The aims of present study were to assess the state of the markers of oxidative damage to biomolecules and the antioxidant defence in diabetic pregnants, as well as to analyze the influence of the type of diabetes on the REDOX state during pregnancy.
Methods: Thirty two diabetic pregnants (15 with pregestational diabetes and 17 with gestational diabetes) and 27 healthy pregnants with an average pregnant time higher than 20 weeks. Markers were assessed using spectrophotometry and high-performance liquid chromatography techniques.
Results: There was oxidative damage to genetic material and proteins together with a decrease also significant in antioxidant defenses mediated by the reduced glutathione in pregestational diabetic pregnants. The nitrates and nitrites levels were not different among groups.
Conclusions: Results allowed us to make sure that women with pregestional diabetes had a oxidative stress state deteriorating the antioxidant defenses and not counteract the oxidative damage to biomolecules.
Key words: Pregestational diabetes, gestational diabetes, congenital malformations, oxidative stress.
INTRODUCCIÓN
El adecuado control metabólico y los cuidados preconcepcionales de la embarazada diabética han reducido la mayoría de las complicaciones que estas presentan. Sin embargo, la aparición de malformaciones congénitas (MC) en la descendencia continúa siendo elevada, con una prevalencia del 8-12 %, 3-5 veces mayor que en las embarazadas sanas.1
Se ha sugerido que las principales complicaciones de la diabetes mellitus (DM), en las que se incluyen las MC, pueden tener mecanismos etiológicos comunes entre los que se ha implicado el estrés oxidativo (EOx).2,3 El ambiente hiperglucémico e hiperlipémico que rodea al embrión genera sustancias oxidantes con alta capacidad para dañar la estructura de las biomoléculas y alterar las funciones en que ellas participan. Dichas sustancias pudieran provocar cambios en eventos de señalización cruciales durante determinados períodos del desarrollo, afectar la expresión de genes relacionados con la morfogénesis y producir daño estructural del material genético, mecanismos que han sido implicados en la embriopatía diabética.4
Por lo anterior, mantener un balance adecuado del estatus REDOX tanto antes como durante el embarazo puede ser crucial para lograr una adecuada salud de la madre diabética y su hijo. Aunque teóricamente estos pueden ser aspectos muy bien comprendidos, no existe un consenso en cuanto a los eventos fisiopatológicos que vinculan los eventos adversos de la gestación diabética y el estado REDOX.
El presente estudio tuvo como objetivos evaluar el estado de marcadores de daño oxidativo a biomoléculas y de defensa antioxidante en embarazadas diabéticas, así como analizar la influencia del tipo diabetes en el estado REDOX durante la gestación.
MÉTODOS
Diseño general del estudio
Es un estudio transversal descriptivo, donde participaron 32 embarazadas diabéticas (grupo D) y 27 gestantes sanas que formaron el grupo control (grupo C). Todas las participantes cumplieron los criterios de inclusión y exclusión. Entre las del grupo D se encontraron 15 pacientes que padecían DM previo a la gestación (DPG) y 17 con diabetes gestacional (DG). Las edades (entre 25 y 29,7 años el promedio por grupos) y tiempo de gestación promedio (entre 25 y 33,3 semanas) fueron muy similares en todos los grupos, con un predominio del segundo a inicios del tercer trimestre de la gestación.
Los casos fueron tomados del laboratorio clínico y salas de los hospitales maternos "Ramón González Coro" y "Eusebio Hernández" de Ciudad de La Habana durante el año 2007. Se tomó una muestra de sangre en el momento de la incorporación al estudio, que se hizo coincidir con la extraída para los análisis de control y evaluación del embarazo. Se tomó 1 mL para extracción de ADN y determinación de bases oxidadas y el resto se centrifugó para extraer el plasma, el cual fue conservado en alícuotas a -20 ºC hasta su estudio.
Criterios de inclusión: embarazadas con diagnóstico de DM antes o durante el embarazo y embarazadas sin antecedentes de enfermedades crónicas o de ser portadora de alguna MC que fueron consideradas sanas. La edad máxima fue de 40 años, no hubo límites en la edad gestacional y en todos los casos se recogió el consentimiento por escrito de participar en el estudio.
Criterios de exclusión: antecedentes de alguna enfermedad crónica no asociada a la DM o de MC, presentar hábitos tóxicos o haber ingerido algún medicamento no relacionado con el tratamiento de la DM en los tres meses previos al inicio de la gestación.
Determinaciones realizadas
En linfocitos de sangre periférica: daño oxidativo al ADN estimado por los niveles de 8-hidroxi-2´-desoxiguanosina (8-OxodG) por cromatografía líquida de alta presión.5-7
En plasma (por técnicas espectrofotométricas):
Daño oxidativo a lípidos y proteínas por concentración de malonildialdehído (MDA)8 y productos avanzados de oxidación de proteínas (PAOP).9
Capacidad de defensa antioxidante por concentración de glutatión reducido (GSH)10, actividad de las enzima superóxido dismutasa (SOD)11 y catalasa (CAT).12
Disponibilidad de óxido nítrico (NO.) medida por concentración de nitratos convertidos en nitritos (NO3-+NO2- ) por la acción de la enzima nitrato reductasa.13
Procesamiento estadístico
Los resultados se reportan como valores de la media de los grupos y la desviación estándar. Se utilizaron para las comparaciones las pruebas no paramétricas Kruskal-Wallis y U de Mann-Whitney para muestras que no siguen una distribución normal. Se consideró significativa la diferencia si p<0,05.
Consideraciones éticas
Se siguieron las orientaciones de la Declaración de Helsinki, en virtud de lo cual se recogió el consentimiento informado por escrito mediante una planilla entregada con tiempo para su análisis y en la que constaba la explicación de los objetivos de la investigación. En ningún caso se manejó el nombre de las pacientes. En todos los casos las extracciones se realizaron según lo establecido, por el personal capacitado y autorizado de cada entidad.
RESULTADOS
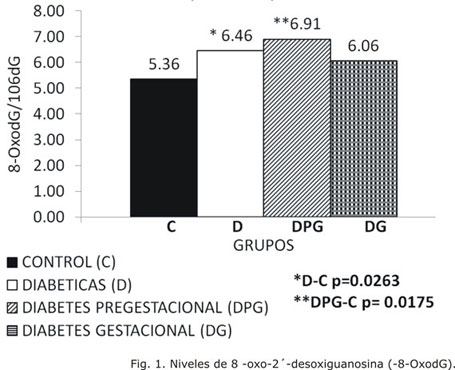
El indicador de daño oxidativo al ADN, 8-OxodG, mostró un incremento significativo en las embarazadas diabéticas en general, a expensas del grupo DPG (Fig. 1).
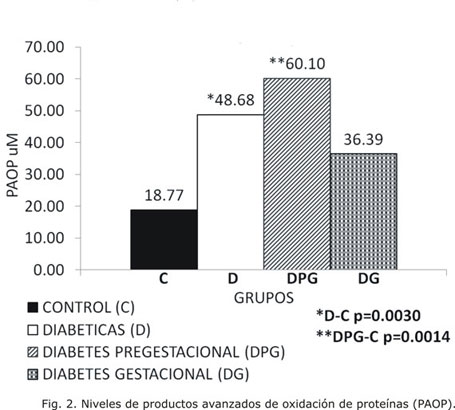
Un resultado similar se observó en cuanto a los niveles de proteínas oxidadas medidos por las concentraciones de PAOP (Fig. 2).
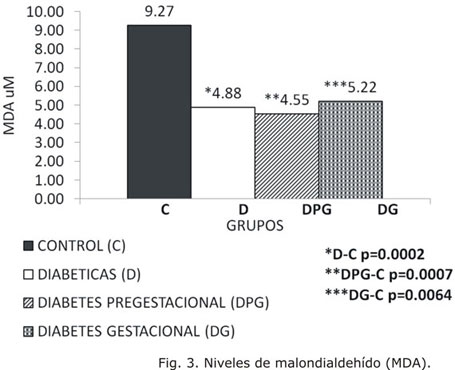
Sin embargo, las concentraciones de MDA, marcador de daño oxidativo a lípidos, resultaron significativamente inferiores en todos los grupos de embarazadas diabéticas con respecto a los controles (Fig. 3).
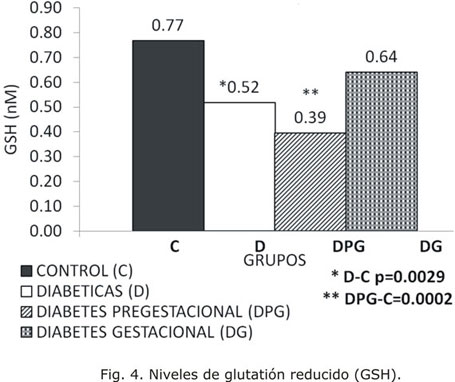
El análisis de los indicadores de defensa antioxidante evidenció que las concentraciones de GSH fueron inferiores en el grupo D, especialmente en el grupo DPG, con diferencias significativas con relación al grupo C (Fig. 4).
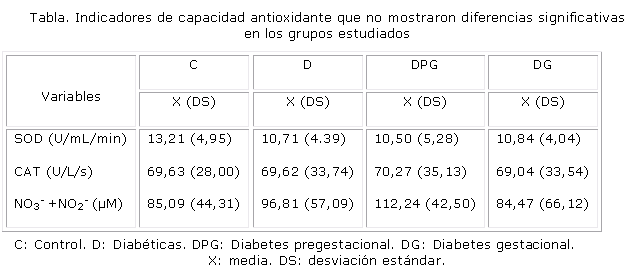
En el caso de las enzimas antioxidantes SOD y CAT, las actividades fueron muy similares en todos los grupos. Los resultados de las concentraciones de NO3-+NO2- mostraron un ligero incremento en los grupos D y DPG pero sin diferencias estadísticamente significativas con relación al grupo C (tabla).
DISCUSIÓN
El daño celular producido por las especies reactivas del oxígeno ocurre sobre diferentes biomoléculas. Entre las alteraciones que se pueden producir por oxidación del ADN se encuentran: la modificación o pérdida de bases nitrogenadas, el daño a la desoxirribosa y la rotura de bandas. Sus consecuencias incluyen: la aparición de mutaciones, la activación de oncogenes, la inactivación de genes supresores tumorales y la formación de uniones cruzadas ADN-ADN o ADN-proteínas.14
Entre las bases nitrogenadas más frecuentemente afectadas por oxidación se encuentra la guanina, lo cual puede evaluarse por la identificación del producto 8-OxodG.15 En el presente estudio, los niveles de este indicador se encontraron incrementados en las embarazadas diabéticas, a expensas de las que padecen diabetes pregestacional. Estos resultados concuerdan con lo reportado de que moléculas como el ADN deben experimentar mayor daño en el paciente diabético, el cual se correlaciona con el tiempo de evolución de la enfermedad.16
Como consecuencia de la oxidación de las proteínas se incrementa su catabolismo, se daña su estructura primaria y se producen entrecruzamientos y fragmentaciones, todo lo cual interfiere con sus funciones biológicas.15 En esta investigación se han encontrado evidencias de daño oxidativo a estas biomoléculas en las embarazadas diabéticas en general, a expensas del grupo DPG, con un incremento significativo desde el punto de vista estadístico con relación a las sanas. Estos resultados están en concordancia con los encontrados por otros autores.17
El daño oxidativo a los lípidos se produce fundamentalmente sobre los ácidos grasos poliinsaturados de las membranas, a través de un proceso que se conoce como peroxidación lipídica. Como consecuencia se generan peróxidos orgánicos y otros productos con efectos citotóxicos, entre los que se encuentra el MDA.15
La peroxidación lipídica se ha acuñado como uno de los principales eventos relacionados con reacciones oxidativas en situaciones de altas concentraciones de glucosa. Debería esperarse que en el estado diabético los niveles de esta sustancia se encontraran incrementados, lo cual ha sido reportado previamente.3,18,19 Sin embargo, en algunas investigaciones se han encontrado variaciones en los resultados de este marcador, de manera que existen algunas contradicciones en cuanto a si representa un buen indicador de EOx.17
En el presente estudio las concentraciones de MDA fueron significativamente menores en las embarazadas diabéticas que en las sanas, resultado similar al reportado ya por otros autores.20 Quizás el argumento de que las embarazadas diabéticas, a diferencia de las sanas, son sometidas a un estricto control metabólico, sobre todo en el tercer trimestre de la gestación en el cual se encuentran la mayoría de los casos estudiados, pudiera explicar en parte estos resultados. El embarazo es una situación de adaptación metabólica donde la reserva de lípidos se incrementa hasta cantidades que pudieran resultar patológicas con relación a mujeres no gestantes de la misma edad.21
El GSH constituye el principal antioxidante endógeno no enzimático. En este estudio se encontró una disminución significativa de sus concentraciones en el grupo D con respecto al C, a expensas del DPG. Los resultados concuerdan con lo reportado previamente de que las embarazadas diabéticas presentan defensas antioxidantes disminuidas17 y que estas deben encontrarse más agotadas en aquellas que padecen diabetes pregestacional, cuyas biomoléculas han sido expuestas a eventos oxidativos durante mayor tiempo.18
La SOD constituye la primera en importancia entre las enzimas antioxidantes ya que es la encargada de la eliminación del anión superóxido (O2.-), que es el primer metabolito reactivo que se forma cuando se reduce el oxígeno de forma incompleta. Por su parte, la CAT, como parte del sistema antioxidante, está involucrada en la destrucción del peróxido de hidrógeno (H2O2) generado durante el metabolismo celular.15
El estudio del comportamiento de la actividad de la SOD y la CAT no mostró diferencias significativas entre los grupos. Al evaluar la actividad de SOD, se ha reportado por varios investigadores una disminución en los diabéticos con relación a los controles18,22, pero en otras investigaciones se ha observado una actividad normal en este tipo de pacientes20 e incluso incrementada.23
Varios investigadores han sugerido la posibilidad de cambios transitorios y bifásicos en la actividad de las enzimas antioxidantes, así como de su expresión.24 Lo cierto parece ser que bajo condiciones diabéticas se produce una expresión y activación inadecuada en respuesta al incremento de ERO.
El óxido nítrico a concentraciones fisiológicas cumple importantes funciones: tiene actividad vasodilatadora, estimulante de la síntesis de músculo liso vascular y antiagregante plaquetario, Sin embargo, su producción incrementada se acompaña de la generación de peroxinitrito (ONOO-), un potente agente oxidante que rápidamente se descompone en radical hidroxilo (.OH), nitratos (NO3-) y nitritos (NO2-) 25; estos últimos son empleados para la cuantificación indirecta de NO. en plasma u orina.
Los resultados del análisis de las concentraciones de NO3- y NO2- en este estudio no mostraron diferencias estadísticamente significativas entre los grupos. Sin embargo, se puede observar un incremento en el grupo D y en especial en el DPG con relación al C. Resultados similares se han reportado previamente en pacientes diabéticos, en los que se ha postulado que la alteración del sistema de producción del NO. es una de las vías a través de la cual podría iniciarse la enfermedad vascular.26
Estos resultados muestran que las embarazadas que padecen diabetes pregestacional son las responsables de las diferencias encontradas en los niveles de marcadores de EOx entre las gestantes diabéticas y las sanas. Lo anterior sugiere la posibilidad de un efecto acumulativo de sustancias prooxidantes que actúen desde antes del embarazo agotando las defensas antioxidantes y disminuyendo su capacidad para enfrentar una gestación saludable, todo lo cual propicia la aparición de complicaciones, como las MC en la descendencia. La relevancia del daño al ADN en la aparición de las MC que una vez más se ha demostrado queda aún por demostrar en estudios posteriores. En un estudio de uno de los autores de este trabajo27 en el que se demostró incremento de la fragilidad cromosómica de las gestantes con diabetes pregestacional, no se encontró correlación con la aparición de defectos congénitos.
Se concluye que las embarazadas diabéticas presentan un incremento del daño oxidativo a biomoléculas, como ADN y proteínas, lo cual no fue observado en el caso de los lípidos. Además, a pesar de no presentar modificación en las actividades de las enzimas antioxidantes SOD y CAT, muestran una disminución de la capacidad de defensa antioxidante mediada por el GSH. Por otra parte, aunque no se encontraron diferencias significativas en los niveles de nitratos y nitritos, se observó un incremento de sus concentraciones en las gestantes con diabetes. Todas las diferencias se agudizaron en las embarazadas que padecían diabetes mellitus antes de la gestación.
REFERENCIAS BIBLIOGRÁFICAS
1. Nazer Herrera J, García Huidobro M, Cifuentes Ovalle L. Congenital malformations among offspring of diabetic women. Rev Med Chil. 2005;133(5):547-54.
2. Stirban A, Rosen P, Tschoepe D. Complications of Type 1 Diabetes: New Molecular Findings. Mount Sinai Journal of Medicine. 2008;75:328-51.
3. Morgan SC, Relaix F, Sandell LL, Loeken MR. Oxidative Stress during Diabetic Pregnancy Disrupts Cardiac Neural Crest Migration and Causes Outflow Tract Defects. Birth Defects Research (Part A). 2008;82;453-63.
4. Loeken MR. Advances in Understanding the Molecular Causes of Diabetes-Induced Birth Defects. J Soc Gynecol Investig. 2006;13(1):1-10.
5. Bunce M. PCR-SSP typing. En: Bidewell Jl, Navarrete C. Histocompatibility testing. England: Imperial College Press; 2000. p. 149-86.
6. Saez GT, Tormos C, Giner V, Chaves J, Lozano JV, Iradi A, et al. Factors related to the impact of antihypertensive treatment in antioxidant activities and oxidative stress by-products in human hypertension. Am J Hypertens. 2004;17:809-16.
7. Muñiz P, Valls V, Perez-Broseta C, Iradi A, Climent JV, Oliva MR, et al. The role of 8-hydroxy-2'-deoxyguanosine in rifamycin-induced DNA damage. Free Radic Biol Med. 1995;18:747-55.
8. Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: malondialdehyde and 4-hydroxynonenal. Meth Enzymol. 1990;186:407-21.
9. Kalousavá M, Skrha J, Zima T. Advanced glycation end-products and advanced oxidation protein products in patients with Diabetes Mellitus. Physiol Res. 2002;51:597-604.
10. Beutler E. Improved assay of the enzymes of glutathion syntesis. Clin Chem. Acta 61 1986;158:115-23.
11. Marklund S, Marklund G. Involvement of the superoxide anion radical in autoxidation of pyrogallol as a convenient assay for superoxide dismutasa. Eur J Biochem. 1974;47:469-74.
12. Beer RF, Sizer IW. Spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase. J Biol Chem. 1952:195;137-40.
13. Hisakazu M. Determination of nitrate in biological fluids using nitrate reductase in a flow system. J Health Sci. 2001;47:65-7.
14. Zorrilla García AE, Eirez Izquierdo M, Izquierdo Expósito M. Papel de los radicales libres sobre el ADN: carcinogénesis y terapia antioxidante. Rev Cubana Invest Bioméd. 2004;23(1):
15. Ibarra ML, Batista CM, Gómez BC, Zamora AL. Diabetes, estrés oxidativo y antioxidantes. Investigación en Salud. 2006;8(1):7-15.
16. Collins AR, Raslova K, Somorovsha M, Pretovsha M, Ondrusova A, Collins BH, et al. DNA damage in diabetes: correlation with a clinical marker. Free Radical Biology and Medicine. 2001;25(3):373-77.
17. Coughlan MT, Vervaart PP, Georgiou HM, Rice E. Altered placental oxidative stress status in gestational diabetes mellitus. Placenta. 2004;25:78-84. 18. Clapés S, Torres O, Companioni M. Indicadores de estrés oxidativo en pacientes diabéticos. Educ Méd Continua Ecuador. 2000;66:2-6.
19. Dale-Donne I, Rossi R, Colombo R, Giustarini D, Milzani A. Biomarkers of oxidative damage in human diseases. Clin Chem. 2006;52:4:601-23.
20. Llurba E, Grataco EE, Martin PG, Cabero L, Domínguez C. Comprehensive study of oxidative stress and anti oxidant status in preeclampsia and normal pregnancy. Free Radic Biol Med. 2004;37(4):557-70.
21. Rodríguez Y, Pita G, Cabrera A, Quintero ME, Díaz M, Martín I. Algunos indicadores del metabolismo lipídico en embarazadas y recién nacidos. Rev Cubana Salud Pública. 2004;30 (4).
22. Peuchant E, Brun JL, Rigalleau V, Dubourg L, Thomas MJ, Daniel JY, Leng JJ, Gin H. Oxidative and antioxidative status in pregnant women with either gestational or type 1 diabetes. Clin Biochem. 2004;37(4) 293-98.
23. Sobki H, Sdulrahman M, Al-Senaidy Tamader A, Al-Shammari I. Impact of gestational diabetes on lipid profiling and indices of oxidative stress in maternal and cord plasma. Saudi Med J. 2004;25(7): 876-80.
24. Damasceno DC, Tadue G, de Matos I, Cunha MV. Oxidative stress and diabetes in pregnant rats. Animal Reproduction Science. 2002;72:235-44.
25. Li Ch, Wogan GN. Nitric oxide as a modulator of apoptosis. Cancer Letters. 2005;226:1-15.
26. Bhatiaa S, Shuklaa R, Venkata Madhub S, Kaur Gambhira J, Madhava Prabhua K. Antioxidant status, lipid peroxidation and nitric oxide end products in patients of type 2 diabetes mellitus with nephropathy. Clinical Biochemistry. 2003:36:557-62.
27. Clapés S. Estrés oxidativo y fragilidad cromosómica en la gestación diabética. Trabajo para optar por el título de Doctor en Ciencias de la Salud. Ciudad de La Habana. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"; 2007.
Recibido: 10 de marzo de 2010.
Aprobado: 5 de junio de 2010.
Dra. Tammy Fernández Romero. Instituto de Ciencias Básicas y Preclínicas (ICBP) "Victoria de Girón". Calle 146 No 3102 esquina Ave. 31. Cubanacán, Playa, Ciudad de La Habana. Teléfono: 208 4877.