Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.30 n.2 Ciudad de la Habana abr.-jun. 2011
TRABAJO ORIGINAL
Un método experimental para lesionar un nervio periférico y evaluar conductualmente la recuperación y el efecto de tratamientos restaurativos
An experimental method to injure a peripheral nerve and to evaluate recovery and the effect of restorative treatments using behavioral techniques
Olivia Teresa González GayI, William Almaguer MeliánII, Lázaro Gómez FernándezIII, Margarita Minou Báez MartínIII, Jorge Alberto Bergado RosadoII
ILicenciada en Biología. Empresa de Producción de Biológicos "Carlos J. Finlay". La Habana, Cuba.
IIDoctor en Ciencias Biológicas. Profesor e Investigador Auxiliar. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
IIIDoctor en Medicina. Profesor e Investigador Auxiliar. Centro Internacional de Restauración Neurológica. La Habana, Cuba.
RESUMEN
Se presenta un método simple de lesión del nervio periférico por pinzamiento del nervio ciático, y de evaluación conductual de la lesión y su recuperación empleando la marcha sobre una rejilla metálica. La lesión del ciático dificulta el desplazamiento de los animales sobre este sustrato como lo demuestran el aumento significativo de la latencia de escape hacia la caja de habitación y el incremento de fallos en el apoyo de la pata lesionada. Empleando este método se evaluó el efecto de la administración poslesional del complejo vitamínico Compvit B® y del ácido orótico (un precursor de nucleótidos de pirimidina) sobre la recuperación del nervio dañado. Ambos tratamientos y su combinación, mejoraron significativamente la recuperación del nervio lesionado al ser comparados con controles tratados con solución salina.
Palabras clave: Nervio ciático, regeneración, vitaminas, Compvit B, ácido orótico.
ABSTRACT
The paper describes a simple method to injure the peripheral sciatic nerve by clamping, along with a behavioral test to asses the lesion and its recovery using the gait on a metallic grid. Sciatic nerve lesion impairs the displacement of the animals on this surface as demonstrated by the significant increase in the escape latency towards the room cage and the increased number of stance failures with the injured leg. Using this method we assessed the effect of post-injury administration of Compvit B® (vitamin compound) and orotic acid (a pyrimidine-nucleotide precursor) on the recovery of injured nerve. Both treatments and its combination, improved significantly the recovery of injured nerve compared to controls treated with saline solution.
Key words: Sciatic nerve, regeneration, vitamins, Compvit B, orotic acid.
INTRODUCCIÓN
La lesión de nervios periféricos es una consecuencia frecuente de accidentes y neuropatías de distinto origen.1,2 Aunque muchas de estas lesiones pueden regenerar espontáneamente, resulta importante contar con medicamentos que puedan promover y acelerar la recuperación.3-5 Las vitaminas del complejo B han sido muy utilizadas en el tratamiento de neuropatías6 y esto ha dado origen a preparados multivitamínicos con dosis altas de vitaminas B1, B6 y B12. Estos compuestos han sido ampliamente utilizados para el tratamiento restaurador en lesiones traumáticas y neuropáticas1 aunque faltan ensayos clínicos amplios que confirmen su efectividad.6
Compvit B® es un compuesto vitamínico de producción nacional que emplea altas dosis de vitaminas B1, B6 y B12, semejante a otros producidos en otros países y ha gozado de gran aceptación y uso desde su salida al mercado farmacéutico nacional. Sin embargo, su efectividad promoviendo la regeneración de nervios periféricos no ha sido probada experimentalmente.
Además de las vitaminas del complejo B, existen otros candidatos potenciales cuya eficacia debe ser también comprobada para justificar o no, su posible producción con fines terapéuticos. Entre ellos se encuentra el ácido orótico, también conocido como vitamina B13, que se encuentra en la leche en bajas concentraciones y es un excelente precursor de nucleótidos de pirimidina con efectos positivos sobre la memoria y la neuroplasticidad7 y del cual se sabe además, que se incorpora a nervios periféricos.8
Con este propósito nos dimos a la tarea de introducir y adaptar un modelo de lesión de nervio periférico y un método conductual para evaluar el grado de compromiso motor y su recuperación con diferentes tratamientos.
En la primera parte describiremos el desarrollo del modelo experimental, que se basa en la lesión del nervio ciático, por ser un nervio de fácil acceso y muy usado en estudios de este tipo.9,10 En la segunda parte presentaremos los resultados de la regeneración de nervios periféricos bajo tratamiento con Compvit B, ácido orótico o la combinación de ambos, basados en pruebas conductuales.
MÉTODOS
Animales
Se emplearon ratas machos de 250 g de peso (al inicio del experimento) obtenidas del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, Bejucal, Cuba). Los animales fueron mantenidos en cajas plásticas translúcidas (5 animales por caja) con libre acceso al agua y alimento bajo condiciones controladas de temperatura, humedad e iluminación (12:12 h luz: oscuridad). En todo momento se hicieron esfuerzos por reducir al mínimo el dolor y malestar ocasionado a los animales de acuerdo con las Regulaciones para el Uso de Animales de Laboratorio emitidas por el CENPALAB en 1997.
Lesión del nervio ciático
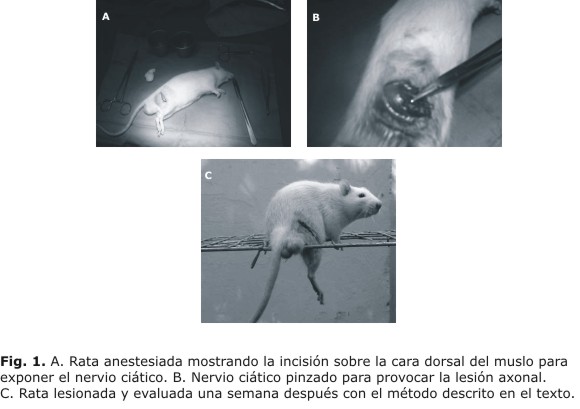
Los animales fueron anestesiados con hidrato de cloral (400 mg/kg) y con una tijera pequeña se cortó el pelo de la región dorsal del muslo derecho. A continuación fueron colocados sobre un paño quirúrgico estéril exponiendo la región rasurada que fue cuidadosamente limpiada con una torunda embebida en solución de tiomersal. Se realizó incisión longitudinal (con respecto al eje mayor) en la piel del muslo de unos 4 cm de longitud (figura 1A). Con una pinza de punta roma se decolaron las fascias subcutáneas y musculares hasta exponer el nervio ciático que aparece como una cinta de aproximadamante 1 mm de grosor de color blanco brillante.
Aproximadamente 2 cm proximal al punto de bifurcación del ciático se colocó una pinza de suturas de Mayo que fue cerrada hasta el 3er. paso durante 30 s (figura 1B). La pinza fue retirada, y la piel suturada y tratada con crema antibiótica de nitrofurazona.
Evaluación conductual
Antes de la lesión y una semana después de ella los animales fueron evaluados conductualmente colocándolos sobre una rejilla metálica de 44 x 44 cm con aberturas rectangulares de 3,5 x 5 cm situada a 1 metro sobre el piso. En el extremo opuesto de la rejilla se encontraba una caja idéntica a la utilizada para la estancia de los animales y que estos podían alcanzar desplazándose sobre la rejilla. Se midió el tiempo (latencia) que tardaban los animales en alcanzar la caja de un máximo permitido de 3 min (180 s). Se contó además el número de veces que la pata derecha de cada animal fallaba en el intento de apoyarse sobre la rejilla (figura 1C). Obsérvese como la pata lesionada incurre en errores de apoyo al caminar sobre la rejilla (figura 1).
En la sesión realizada antes de la lesión se realizaron 3 ensayos con intervalo de aproximadamente 30 min con el doble propósito de evaluar a los animales estando sanos y de familiarizarlos con el sitio de entrenamiento y la posibilidad de retorno seguro a su caja cruzando la rejilla (motivación). Para las comparaciones con animales lesionados se emplearon solamente los resultados del 3er. ensayo.
Una semana después de la lesión los animales fueron evaluados de nuevo mediante un ensayo idéntico al descrito arriba. Se midió también el tiempo de retorno a la caja y el número de fallos con la pata derecha, ahora con el nervio ciático lesionado (figura 1C).
Un ensayo idéntico fue realizado también al finalizar las dos semanas de tratamiento.
Exploración electrofisiológica
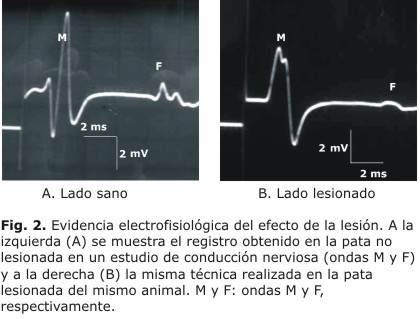
En algunos animales lesionados no sometidos a tratamiento se realizó un estudio electrofisiológico para corroborar la efectividad de la lesión. Bajo narcosis se colocó un electrodo de estimulación sobre la rama tibial posterior por detrás del maleolo medial y un electrodo de registro entre el primer y segundo artejos y otro de referencia entre el tercer y cuarto artejos. Sobre la cola del animal se colocó un electrodo conectado a tierra. La estimulación con intensidades crecientes (estimulador eléctrico SEN-300 Nihon Kohden, Japón) produjo una respuesta característica (osciloscopio digital con memoria VC-11 Nihon Kohden, Japón) con dos ondas: la onda M que representa la activación del músculo por los potenciales de acción ortodrómicos provocados por el estímulo y la onda F que representa la activación del músculo por los potenciales de acción antidrómicos y que tiene, por tanto una latencia mayor (figura 2). Nótese la reducción de la amplitud de ambas ondas y el corrimiento de latencia de la onda F.
Tratamiento
Según el tratamiento aplicado se constituyeron aleatoriamente los siguientes grupos.
Salina (n=10): tratados con solución salina fisiológica por vía intraperitoneal (i.p).
Compvit (n=13): tratados con Compvit® en una dosis de 1mL/kg de peso corporal del fármaco Compvit® (QUIMEFA, La Habana, Cuba) por vía intraperitoneal disuelta en solución salina fisiológica, equivalente a la que se usa comúnmente en humanos.
Orótico (n=14): tratados con ácido orótico suspendido en solución salina en una dosis de 100 mg/kg (i.p. ).
ComvitOro (n=7): tratados con una combinación de orótico y Compvit en las dosis arriba declaradas (i.p.).
Todos los tratamientos se aplicaron en días alternos durante 2 sem.
Estadística
Las comparaciones estadísticas fueron realizadas empleando análisis de varianza (ANOVA) con mediciones repetidas, seguidos del test de Tukey (post hoc) para confirmar diferencias entre grupos de tratamiento. En todos los casos fueron consideradas significativas diferencias en las que p < 0,05.
RESULTADOS
El método de lesión empleado en este trabajo produjo un defecto evidente en la motilidad de la pata posterior derecha de los animales lesionados, que se puede constatar con la simple observación de sus desplazamientos por la caja durante la semana de recuperación. Para cuantificar ese defecto empleamos un método conductual sencillo, pero eficaz.
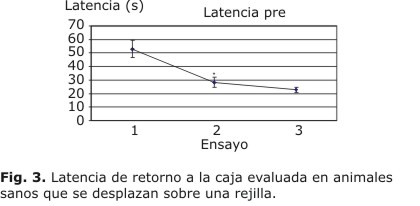
Todos los animales incluidos en el experimento fueron entrenados en esta sencilla prueba conductual antes de la lesión. Se realizaron 3 ensayos por animal con intervalo de unos 30 min y se midieron dos variables, la latencia de llegada a la caja de estancia y la cantidad de fallos al intentar apoyar la pierna derecha sobre la rejilla. Los resultados de la latencia se muestran en la figura 3.
El análisis estadístico (ANOVA, mediciones repetidas) demostró un efecto significativo de la repetición de ensayos, la cual reduce la latencia de retorno a la caja (F2,110= 13.5040). El análisis post hoc, empleando el test de Tukey demostró diferencias estadísticamente significativas entre el primer y segundo ensayos, pero no entre el segundo y el tercero, lo que demuestra que los animales aprenden rápidamente a localizar la caja y regresar a ella. Se muestra la media y el error estándar de la media.
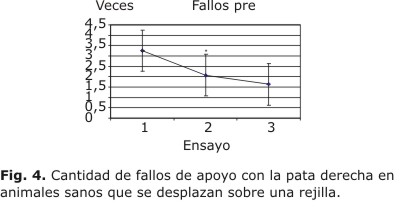
Algo similar ocurre con el número de fallos, como muestra la figura 4. El ANOVA (mediciones repetidas) demostró también un efecto significativo de la repetición de ensayos sobre el número de fallos de apoyo cometidos por los animales (F2,110= 27.2006). También en este caso, la reducción significativa se produjo del primer ensayo al segundo, pero no del segundo al tercero (test de Tukey), indicativo de una rápida adaptación a las nuevas condiciones del sustrato para la marcha. Se muestra la media y el error estándar de la media.
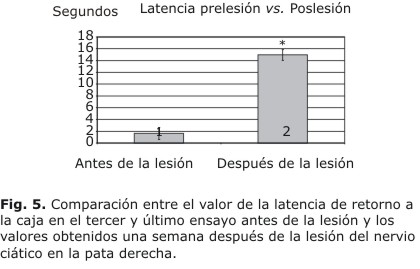
La lesión del nervio ciático modifica dramáticamente estos resultados cuando esos mismos animales fueron evaluados una semana después de la lesión. Como se aprecia en la figura 5, la latencia de escape se incrementa notablemente después de la lesión si se compara con la medida en el tercer ensayo pre-lesión (ANOVA, mediciones repetidas: F1,45=142.0186). El significativo aumento de latencia evidencia las dificultades en la marcha después de la lesión. Se muestra la media y el error estándar de la media.
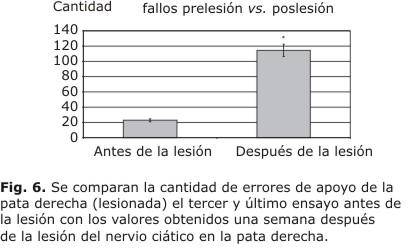
Algo similar ocurre con el número de fallos de apoyo (ANOVA, mediciones repetidas: F1,45=239.2303; fig. 6). Se comparan la cantidad de errores de apoyo de la pata derecha (lesionada) el tercer y último ensayo antes de la lesión, con los valores obtenidos una semana después de la lesión del nervio ciático en la pata derecha. El significativo aumento de los fallos es otra evidencia de las dificultades en la marcha después de la lesión. Se muestran la media y el error estándar de la media. .
Estos resultados conductuales se deben a la lesión del nervio como confirma la reducción de la amplitud y la prolongación de latencia de las ondas M y F en la pata lesionada, comparada con la pata sana contralateral (fig. 2) en la pequeña muestra estudiada con esta técnica.
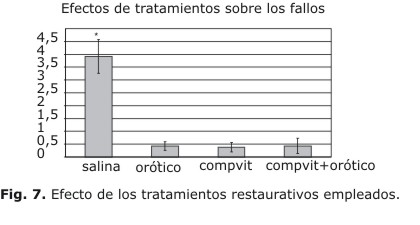
El tratamiento con Compvit B, ácido orótico o la combinación de ambos produce una reducción significativa del número de fallos cuando los animales fueron reevaluados al concluir las 2 sem de tratamiento. Al ser comparados con los controles tratados con solución salina (ANOVA simple: F3,42=21.44627) se comprueban diferencias estadísticamente significativas debidas al tratamiento (Fig. 7).
Debe señalarse también que también los animales tratados con salina cometieron menos fallos cuando fueron evaluados después del tratamiento (es decir, 3 sem después de la lesión) en comparación con los resultados obtenidos 1 sem después. El promedio de fallos a la semana fue de 11,571 ± 1,288 (media±error estándar de la media) mientras que a las 3 sem se redujo a 3,714 ± 0,892 (diferencia significativa, t de Student para muestras pareadas). El test de Tukey mostró además que todos los grupos tratados con vitaminas cometen menos fallos de apoyo en relación con los controles con salina, pero no se encontraron diferencias entre el tratamiento con Compvit B, el ácido orótico o la combinación de ambos.
DISCUSIÓN
La lesión de nervios periféricos es un método clásico de la neurología experimental que permite estudiar los procesos involucrados en la degeneración de los axones dañados, su eventual regeneración, así como métodos para acelerar la recuperación morfológica y funcional.11-14
El nervio ciático de la rata es el modelo más común de lesión de nervio periférico debido a su fácil acceso. En este trabajo hemos empleado el método de lesión por aplastamiento propuesto por varios autores9,10 por ser una lesión simple, reproducible y reversible.
La mayor dificultad estriba en las formas de evaluar el defecto funcional consecutivo a la lesión. Si bien el déficit en la marcha es evidente para cualquier observador, se hace necesario contar con métodos que permitan cuantificar el defecto y detectar ligeras diferencias en su evolución, que no son observables a simple vista. Los métodos en boga requieren de complejas mediciones realizadas a partir de impresiones de las huellas de la rata al desplazarse, por ejemplo mojando las patas en tinta negra o utilizando grabaciones en cinta de video15,16 pero se trata de procedimientos muy engorrosos y dependientes de tecnologías lejos del alcance de laboratorios en países en desarrollo.
El método introducido por nosotros; desplazarse sobre una rejilla y contar los fallos de apoyo en la pata lesionada ha mostrado, según nuestros resultados, ser un método simple y eficaz para detectar y cuantificar las consecuencias de la lesión del nervio ciático. Si comparamos los resultados de los animales sanos con los de esos mismos animales después de la lesión es evidente cómo se afecta la calidad del desplazamiento de los animales sobre este soporte. Este defecto no es solo motor, sino que incluye también componentes sensoriales (propiocepción, tacto) que también se verán afectados por ser el ciático un nervio mixto.
El entrenamiento de los animales antes de ser lesionados es importante porque aporta datos que permiten la comparación antes vs. después como constatación de que, efectivamente, se ha producido un daño morfológico con expresión funcional. También es importante porque ese entrenamiento permite a los animales familiarizarse con el conjunto experimental y, sobre todo, aprender que es posible escapar de la rejilla y retornar a su jaula. Los resultados que mostramos de esa sesión de entrenamiento sugieren que, en efecto, ese aprendizaje ocurre al comparar los resultados del primer ensayo con el segundo y que es rápido por cuanto ya no se presentan diferencias entre el segundo y el tercer ensayos. De la misma forma se hace evidente que los animales también adquieren habilidad para desplazarse sobre la rejilla como muestran los resultados de la comparación del número de fallos.
La aplicación de vitaminas del complejo B (Compvit B y ácido orótico) demuestra que ambas son efectivas acelerando la recuperación funcional de la pata dañada, lo cual puede atribuirse a una regeneración más efectiva del nervio lesionado. Esta recuperación es posible en el nervio periférico y existen numerosos estudios que lo demuestran15-17 y nuestros resultados lo confirman. La reducción del número de fallos en el grupo de animales tratados con salina es una evidencia de que en el período de 2 sem que median entre ambas evaluaciones tal proceso ha ocurrido. Los tratamientos aplicados no actúan como iniciadores del proceso, sino como elementos de apoyo que lo aceleran, lo hacen más efectivo o ambas.
El proceso de regeneración nerviosa es complejo e implica no solo el crecimiento de los cabos axónicos dañados, sino también la activación de elementos de la glía en procesos tan diversos como la eliminación del detritus poslesional, la guía del crecimiento axonal mediante pistas extracelulares y la mielinización de los nuevos cabos axonales distales.17-19 Todos esos procesos celulares demandan un eficiente metabolismo y el aporte de cofactores y precursores y pueden beneficiarse de un suplemento adicional de los mismos. Las vitaminas incluidas en Compvit B® cumplen importantes roles como cofactores en múltiples tejidos. El ácido orótico es, por otra parte, un precursor de nucleótidos de pirimidina que resultan esenciales para la síntesis de ARN, proteínas y glicoproteínas.20
Las técnicas en estudio con vistas a acelerar y mejorar la regeneración nerviosa periférica son variadas y van desde la aplicación de campos eléctricos, hasta el implante de biomateriales y células en el trayecto de los nervios afectados.21-26 El uso de terapias de apoyo mediante vitaminas puede constituir un aporte sustancial a esos propósitos.
Agradecimientos
Los autores agradecen la excelente ayuda técnica brindada por Magalys Ramírez Figueredo, Argimira Fernández, Irenia Horruitineir Gutiérrez y el Ing. Jesús Hernández Torres.
REFERENCIAS BIBLIOGRÁFICAS
1. Bischoff A, Lutschg J, Meier C. Polyneuropathy in vitamin B 12 and folic acid deficiency. Clinical and histopathological study with electron-microscopy analysis of the sural nerve. MMW Munch Med Wochenschr. 1975;117:1593-8.
2. Iyer GV, Taori GM, Kapadia CR, Mathan VI, Baker SJ. Neurologic manifestations in tropical sprue. A clinical and electrodiagnostic study. Neurology. 1973;23:959-66.
3. Apfel SC, Kessler JA. Neurotrophic factors in the treatment of peripheral neuropathy. Ciba Found Symp. 1996;196:98-108.
4. Navarro X, Vivó M, Valero-Cabré A. Neural plasticity after peripheral nerve injury and regeneration. Prog Neurobiol. 2007;82:163-201.
5. Terenghi G. Peripheral nerve regeneration and neurotrophic factors. J Anat. 1999;194:1-14.
6. Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, et al. Vitamin B for treating peripheral neuropathy. Cochrane Database Syst Rev. 2008:CD004573.
7. Bergado JA, Krug M, Ruthrich H, Matthies H. Orotate improves memory and enhances synaptic long-term potentiation in active avoidance behaviour in rats with perforant path stimulation as the conditioned stimulus. Eur J Pharmacol. 1988;157:155-63.
8. Benech CR, Saa EA, Franchi CM. In vivo local uptake of C-14 orotic acid by peripheral nerve. Exp Neurol. 1968;22:436-43.
9. van Meetern NLU, Brakkee JH, Hamers FPT, Helders PJM, Gispen WH. Exercise training improves functional recovery and motor nerve conduction velocity after sciatic nerve crush lesion in the rat. Arch Phys Med Rehabil. 1997;78:70-7.
10. Varejao ASP, Cabrita AM, Meek MF, Bulas-Cruz J, Melo-Pinto P, Raimondo S, et al. Functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J Neurotrauma. 2004;21:1652-70.
11. Itoh S, Suzuki M, Yamaguchi I, Takakuda K, Kobayashi H, Shinomiya K, et al. Development of a Nerve Scaffold Using a Tendon Chitosan Tube. Artif Organs. 2003;27:1079-88.
12. Jung-Testas I, Schumacher M, Bugnard H, Baulieu E-E. Stimulation of rat Schwann cell proliferation by estradiol: Synergism between the estrogen and cAMP. Dev Brain Res. 1993;72:282-90.
13. Knoops B, Hubert I, Hauw JJ, van den Bosch de Aguilar P. Axonal growth and glial migration from co-cultured hippocampal and septal slices into fibrin-fibronectin-containing matrix of peripheral regeneration chambers: a light and electron microscope study. Brain Res. 1991;540:183-94.
14. Zhelyaznik N, Schrage K, McCaffery P, Mey J. Activation of retinoic acid signalling after sciatic nerve injury: up-regulation of cellular retinoid binding proteins. Eur J Neurosci. 2003;18:1033-40.
15. Costa LM, Simoes MJ, Mauricio AC, Varejao AS. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. Int Rev Neurobiol. 2009;87:127-39.
16. Sarikcioglu L, Demirel BM, Utuk A. Walking track analysis: an assessment method for functional recovery after sciatic nerve injury in the rat. Folia Morphol (Warsz ). 2009;68:1-7.
17. Stoll G, Muller HW. Nerve injury, axonal degeneration and neural regeneration: basic insights. Brain Pathol. 1999;9:313-25.
18.Huber AB, Kolodkin AL, Ginty DD, Cloutier J-F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth. Annu Rev Neurosci. 2003;26:509-63.
19. Rossi F, Gianola S, Corvetti L. Regulation of intrinsic neuronal properties for axon growth and regeneration. Prog Neurobiol. 2007;81:1-28.
20. Ott T, Matthies H. Some effects of RNA precursors on development and maintenance of long-term memory: hippocampal and cortical pre- and post-training application of RNA precursors. Psychopharmacologia. 1973;28:195-204.
21. Federici T, Boulis NM. Invited review: festschrift edition of neurosurgery peripheral nervous system as a conduit for delivering therapies for diabetic neuropathy, amyotrophic lateral sclerosis, and nerve regeneration. Neurosurgery. 2009;65:87-92.
22. Gordon T, Chan KM, Sulaiman OA, Udina E, Amirjani N, Brushart TM. Accelerating axon growth to overcome limitations in functional recovery after peripheral nerve injury. Neurosurgery. 2009;65:132-44.
23. Yamada Y, Nishiura Y, Saijilafu, Hara Y, Ichimura H, Yoshii Y, et al. Repair of peripheral nerve defect by direct gradual lengthening of the distal nerve stump in rats: effect on nerve regeneration. Scand J Plast Reconstr Surg Hand Surg. 2009;43:305-11.
24. Kokai LE, Ghaznavi AM, Marra KG. Incorporation of double-walled microspheres into polymer nerve guides for the sustained delivery of glial cell line-derived neurotrophic factor. Biomaterials; 2009.
25. Radtke C, Vogt PM. Peripheral nerve regeneration: a current perspective. Eplasty. 2009;9:e47.
26. Lu MC, Tsai CC, Chen SC, Tsai FJ, Yao CH, Chen YS. Use of electrical stimulation at different current levels to promote recovery after peripheral nerve injury in rats. J Trauma. 2009;67:1066-72.
Recibido: 10 de enero de 2011.
Aprobado: 27 de enero de 2011.
Lic. Olivia Teresa González Gay. Empresa de Producción de Biológicos "Carlos J. Finlay". Infanta No. 1162 esquina a Manglar, Centro Habana. La Habana, Cuba. Correo electrónico: tereggay@infomed.sld.cu