Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.31 no.1 Ciudad de la Habana ene.-mar. 2012
ARTÍCULO ORIGINAL
Identificación y sensibilidad antimicrobiana de bacterias gramnegativas causantes de neumonía en pacientes VIH/sida
Identification and antimicrobial sensitivity of gramnegative bacteria causing pneumonia in HIV/AIDS patients
Dra. Tersilia García Castellanos,I Dra. Isabel Martínez Mota,II Lic. Daniel Salazar Rodríguez,I Dra. Miriam Pérez Monrás,I Dr. Jorge Pérez ÁvilaI
I Instituto "Pedro Kourí".
II Instituto "Finlay".
RESUMEN
Las bacterias gramnegativas se consideran como causa frecuente de neumonía en pacientes VIH/sida. La emergente y elevada proporción de microorganismos resistentes obliga a utilizar el antibiograma como un método que definirá la terapéutica de estos pacientes.
Objetivos: identificar las bacterias gramnegativas que causan neumonía en pacientes VIH/sida y determinar la sensibilidad antimicrobiana de los microorganismos aislados.
Métodos: se realizó un estudio descriptivo prospectivo en el Instituto "Pedro Kourí" de 85 pacientes con VIH/sida y diagnóstico presuntivo de neumonía bacteriana por criterios clínicos y radiológicos. Se recogieron muestras de esputo y sangre para cultivo. Las bacterias aisladas y la sensibilidad antimicrobiana se determinaron por el sistema semiautomatizado miniApi (bioMérieux).
Resultados: se aislaron 74 bacterias potencialmente patógenas de las que 32 (43,2 %) se clasificaron como gramnegativas. Predominaron Klebsiella pneumoniae (11 cepas: 34,3 %), Pseudomonas spp. (8 cepas: 25 %) y Escherichia coli (4 cepas: 12,5 %). Escherichia coli mostró el mayor porcentaje de resistencia y el 75 % de las cepas fue sensible frente a la amikacina. No se encontró resistencia al meropenem y más del 50 % de las enterobacterias identificadas con excepción de E.coli fueron sensibles a las cefalosporinas de tercera generación, ciprofloxacina, amikacina y cotrimoxazol. Pseudomonas spp. presentó resistencia al cotrimoxazol (87 %) y ticarcilina (75 %).
Conclusiones: las bacterias gramnegativas causan en un porcentaje no despreciable neumonía en pacientes con VIH/sida. Aunque persisten cepas resistentes frente a diversos antimicrobianos, las cefalosporinas, quinolonas y los carbapenémicos muestran una adecuada actividad frente a estas bacterias.
Palabras clave: bacterias gramnegativas, identificación, sensibilidad, neumonía, pacientes VIH/sida.
ABSTRACT
Gramnegative bacteria are considered to be a common cause of pneumonia in HIV/AIDS patients. The emergence of a large number of resistant microorganisms has made it necessary to use antibiograms to decide what treatment will be applied to these patients.
Objectives: identify gramnegative bacteria causing pneumonia in HIV/AIDS patients and determine the antimicrobial sensitivity of the microorganisms isolated.
Methods: a prospective descriptive study of 85 patients with HIV/AIDS and presumed diagnosis of bacterial pneumonia was carried out at "Pedro Kouri" Institute applying clinical and radiological criteria. Sputum and blood samples were collected to be cultured. The bacteria isolated and their antimicrobial sensitivity were determined using the mini-Api (bioMérieux) semiautomated system.
Results: seventy-four potentially pathogenic bacteria were isolated, of which 32 (43.2 %) were classified as gramnegative. The prevailing ones were Klebsiella pneumoniae (11 strains: 34.3 %), Pseudomonas spp. (8 strains: 25 %) and Escherichia coli (4 strains: 12,5 %). Escherichia coli exhibited the highest resistance percentage. 75 % of the strains were sensitive to amikacin. No resistance was found to meropenem, and more than 50% of the enterobacteria identified, with the exception of E. coli, were sensitive to third-generation cephalosporins, ciprofloxacin, amikacin and cotrimoxazol. Pseudomonas spp. showed resistance to cotrimoxazol (87 %) and ticarcillin (75 %).
Conclusions: gramnegative bacteria cause pneumonia in HIV/AIDS patients to a considerable extent. There continue to be strains which are resistant to various antimicrobial drugs. However, cephalosporins, quinolones and carbapenemics exhibit adequate activity against these bacteria.
Key words: gramnegative bacteria, identification, sensitivity, pneumonia, HIV/AIDS patients.
INTRODUCCIÓN
Las infecciones respiratorias, particularmente las neumonías, se encuentran entre las causas más frecuentes de morbilidad y mortalidad entre los pacientes con infección por VIH.1 El Centro para el Control y
MÉTODOS
Se realizó en el Laboratorio de Microbiología Clínica del Instituto de Medicina Tropical "Pedro Kourí", un estudio descriptivo prospectivo para identificar las bacterias gramnegativas que ocasionaron neumonía en pacientes VIH/sida, durante el período comprendido entre noviembre del año 2007 hasta abril del 2008. Se estudiaron 85 pacientes que brindaron su consentimiento informado por escrito para participar en esta investigación, con el diagnóstico presuntivo de neumonía bacteriana por criterios clínicos (tos, expectoración, fiebre, disnea, dolor en punta de costado, leucocitosis, velocidad de sedimentación globular acelerada) o radiológicos (infiltrados pulmonares focales o difusos, alveolares o intersticiales, cavitación o derrame pleural).
Criterios de exclusión: se excluyeron los pacientes que estuvieron bajo tratamiento con antimicrobianos 7 días previos al ingreso y aquellos que no dieron su consentimiento informado por escrito para la participación en la investigación.
Se definieron los siguientes criterios diagnósticos según las técnicas microbiológicas empleadas:
- Neumonía confirmada: individuos en los que se obtuvo un cultivo bacteriológico positivo a partir de las muestras de sangre o de un especimen adecuado de esputo (e ≥ 25 células del polimorfonucleares y d ≤ 10 células epiteliales por campo menor: 10x, en tinción de Gram, según criterios de Murray y Washintong, 1975).9
- Neumonía probable: casos donde se observó al microscopio un predominio de un patógeno potencial (por tinción de Gram) en el frotis de un espécimen adecuado de esputo, o en los que se detectó antigenuria (S. pneumoniae) por Látex.
- Neumonía sin confirmar: casos en los que no hubo confirmación por diagnóstico microbiológico de
Se definió como neumonía nosocomial aquella que apareció durante la hospitalización del paciente y que no estaba presente clínicamente ni en período de incubación en el momento del ingreso. También se consideró cuando esta afección se adquirió en el hospital y se manifestó después del alta hospitalaria.
Recolección y procesamiento de las muestras biológicas: la recepción de las muestras se realizó antes del ingreso de los pacientes en la sala y aún en los casos hospitalizados, se evitó el tratamiento con antimicrobianos antes de su recolección:
- Sangre (para hemocultivo). Se recolectó en todos los pacientes estudiados, al ingreso o en las primeras 24 h.
- Esputo (para tinción de Gram y cultivo). Se recolectó en todos los pacientes estudiados al ingreso o en las primeras 24 h, con previo enjuague de la cavidad bucal. La técnica de tinción de Gram se utilizó para medir la calidad del esputo y en aquellos casos donde se consideró que esta fue inadecuada (d ≤ 25 células polimorfonucleares y e ≥ 10 células epiteliales por campo menor 10x, según criterios de Murray y Washintong, 1975); se repitió la recolección y procesamiento de esta muestra biológica.
Identificación de los agentes bacterianos y determinación de la sensibilidad antimicrobiana: se realizó de acuerdo con las características del crecimiento de las bacterias aisladas en los medios de cultivo, con la posterior lectura, análisis e interpretación mediante el sistema semiautomatizado miniApi, siguiendo las recomendaciones del fabricante (bioMérieux, Francia).
Se utilizaron las siguientes cepas de referencia como control: K. pneumoniae 700603, E. coli ATCC 25922; P. aeruginosa ATCC 27853.
RESULTADOS
De todas las muestras procesadas provenientes de los pacientes estudiados se aislaron 74 bacterias potencialmente patógenas, de las que se identificaron 32 cepas de bacterias gramnegativas provenientes del esputo (43,2 %). No se aisló ningún microorganismo a partir del hemocultivo. Como se observa en la tabla, se aislaron 11 cepas (34,3 %) de K. pneumoniae. Los microorganismos que le siguieron en orden de frecuencia fueron: Pseudomonas aeruginosa (8 cepas: 25 %), E. coli (4 cepas: 12,5 %). Solamente se clasificaron como neumonía nosocomial 3 casos, causadas por K. pneumoniae (2 pacientes) y Raoultella spp (1 paciente).
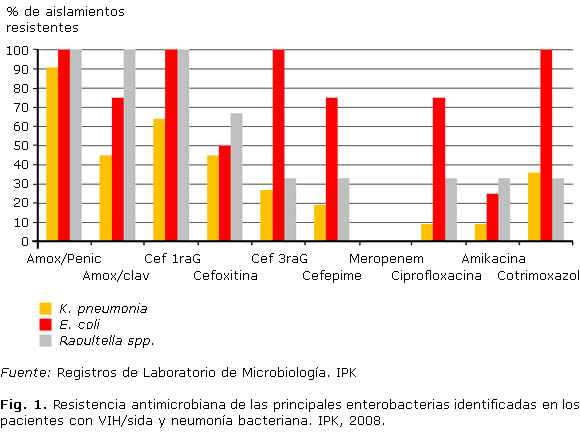
Como se observa en la figura 1, un elevado porcentaje de las principales enterobacterias identificadas mostraron resistencia a las penicilinas, amoxicilina y cefalosporinas de primera generación. Frente al resto de los antimicrobianos ensayados (cefoxitina, cefalosporinas de tercera generación, cefepime, ciprofloxacina, cotrimoxazol y amikacina), más de la mitad de los aislamientos fueron sensibles. No se identificaron cepas resistentes al meropenem. En relación con el resto de las enterobacterias identificadas, la totalidad de los aislamientos fueron resistentes a la amoxicilina, amoxicilina/clavulánico (excepto P. rettgeri) y cefalosporinas de primera generación (excepto K. oxytoca) y frente al resto de los antimicrobianos todas las cepas identificadas fueron sensibles.
La tercera parte de los aislamientos de Pseudomonas aeruginosa mostró resistencia a la ticarcilina y el 87 % al cotrimoxazol. Sin embargo, todos los aislamientos fueron sensibles al meropenem, ciprofloxacina, gentamicina y amikacina. Los porcentajes de resistencia frente al resto de los antimicrobianos fueron bajos: piperacilina/tazobactam (25 %), ceftazidima (25 %) y cefepime (13 %) (Fig. 2). El resto de los bacilos no fermentadores identificados (B. cepacia y A. junni) fueron resistentes a las cefalosporinas de segunda generación. A. junni mostró resistencia a la ticarcilina. Ambas bacterias fueron sensibles a las cefalosporinas de cuarta generación y al meropenem.
DISCUSIÓN
En este estudio se destaca como causa de neumonía bacteriana en pacientes con VIH/sida Klebsiella pneumoniae. Diferentes investigaciones destacan a K. pneumoniae junto con otras enterobacterias, como uno de los agentes etiológicos frecuentes de la neumonía, sobre todo de las neumonías intrahospitalarias, comportamiento que coincide con el de esta investigación. También se observa el predominio de este tipo de esta bacteria en los individuos de avanzada edad e inmunodeprimidos10,11 y en los pacientes con VIH/sida que presentan un bajo conteo de linfocitos CD4 (<50 cél/mm3).12-14
Diversos estudios refieren que la detección de bacteriemia ocurre en un porcentaje bajo de pacientes (
Se señala que P. aeruginosa en raras ocasiones causa procesos infecciosos en los individuos inmunocompetentes, comportándose como un agente oportunista en aquellos que presentan diversos factores predisponentes: quemados, inmudeprimidos (neutropénicos, sida), enfermos con fibrosis quística y los sometidos a ventilación mecánica.19 En las infecciones respiratorias agudas bajas de pacientes con VIH/sida se identifica P. aeruginosa como la bacteria más frecuente.20 A pesar de que en este estudio en ninguno de los casos estudiados este agente bacteriano provocó una neumonía intrahospitalaria, se reconoce a P. aeruginosa como el patógeno más frecuente aislado en neumonías nosocomiales,16 aunque en esta investigación el porcentaje de neumonía nosocomial fue bajo. Este bacilo no fermentador provoca una alta morbilidad y mortalidad en los pacientes con VIH/sida, fundamentalmente en aquellos con infecciones pulmonares.21 La neutropenia, el tratamiento previo con cefalosporinas y el conteo bajo de linfocitos CD4, son factores de riesgo para el desarrollo de bacteriemia por P. aeruginosa en individuos con sida.10
Las enterobacterias de interés clínico, con la única excepción de Salmonella y muy probablemente de Proteus mirabilis, son portadoras de una β-lactamasa cromosómica, natural y propia de cada especie, con diferentes patrones esperados de resistencia natural a los β-lactámicos, en función de la enzima implicada, que incluyen la resistencia natural a las penicilinas,22 lo que justifica la resistencia que se observó en este estudio de las enterobacterias frente a amoxicilina. Diversos autores23 identifican cepas de E. coli y K. pneumoniae resistentes a gran parte de los β-lactámicos y se informa resistencia de K. pneumoniae a las cefalosporinas de tercera generación (ceftazidima)24 y a las quinolonas.25 Con excepción de E. coli, más de la mitad de las enterobacterias identificadas en el presente estudio, se mostraron sensibles a la ceftriaxona y al cefepime, así como a la amikacina y ciprofloxacina, resultados similares a otros estudios.26,27 A pesar del incremento del uso de antimicrobianos de amplio espectro, algunos autores describen escasos aislamientos de cepas productoras de β-lactamasas de espectro extendido (BLEEs).28 No obstante, otros estudios detectan altos porcentajes de enterobacterias productoras de BLEEs, resistentes a las cefalosporinas de tercera generación, incluyendo además cepas de Klebsiella resistente a los carbapenémicos, en pacientes sometidos a ventilación mecánica.29 Se requerirán estudios posteriores a esta investigación para determinar la presencia de enzimas BLEEs en las cepas identificadas, que justificarían la resistencia frente a los β-lactámicos. Los carbapenemes constituyen el grupo de β-lactámicos más estables a la hidrólisis por β-lactamasas y son resistentes a la acción de la mayoría de estas enzimas, incluyendo AmpC y BLEEs de tipo TEM, SHV y OXA. La resistencia a estos antimicrobianos es todavía poco frecuente, con excepción de P. aeruginosa y otros bacilos gramnegativos no fermentadores. Zhanel y otros, al igual que los resultados obtenidos en este trabajo, tampoco identifican cepas de K. pneumoniae resistentes al meropenem o imipenem.30
La resistencia de P. aeruginosa a los β-lactámicos se señala por diferentes autores.31 P. aeruginosa produce una β-lactamasa cromosómica inducible tipo AmpC similar a la encontrada en algunas enterobacterias, mecanismo que le confiere resistencia a los β-lactámicos.32 Este microorganismo posee una resistencia intrínseca a múltiples antibióticos, lo que conlleva a una clara reducción de las posibilidades terapéuticas y por otra parte, posee una extraordinaria capacidad para adquirir nuevos mecanismos de resistencia, por lo general mediante mutaciones. Aunque si bien es cierto que la escasa permeabilidad de la membrana externa de P. aeruginosa interviene en el mecanismo de la resistencia intrínseca, probablemente el factor más importante sea la presencia de bombas de expulsión, sobre todo MexAB-OprM, con capacidad para expulsar a los β-lactámicos, tetraciclina, cloranfenicol, macrólidos, fluoroquinolonas, sulfonamidas y trimetoprim.33 Sin embargo, en este estudio, con excepción de ticarcilina y cotrimoxazol, la resistencia de Pseudomonas spp. frente a este grupo de antimicrobianos fue escasa.
Los siguientes fármacos: meropenem, cefepime, piperacilina/tazobactam y amikacina, se citan como los antimicrobianos más efectivos contra cepas de P. aeruginosa.28 En un estudio realizado en Tailandia entre pacientes con VIH/sida y neumonía, se plantea que del 67 al 84 % de las cepas de P. aeruginosa son sensibles a la amikacina, meropenem y piperacilina/tazobactam.34 Salazar y otros, al investigar cepas de P. aeruginosa provenientes de individuos con VIH/sida, en el Instituto de Medicina Tropical "Pedro Kourí", Cuba, observaron el 100 % de sensibilidad frente a la gentamicina y bajos porcentajes de resistencia a la ceftazidima y ciprofloxacina,35 comportamiento similar al observado en este trabajo. La resistencia de P. aeruginosa frente al imipenem ha sido identificada por algunos autores,24 patrón que no se observó en esta investigación.
Se requerirán estudios posteriores más amplios, que abarquen un período de tiempo mayor y una muestra más significativa para predecir los probables patrones de resistencia de las enterobacterias causantes de neumonía en los pacientes con VIH/sida. Sin embargo, en esta investigación, se demostró que las bacterias gramnegativas causan neumonía en un porcentaje no despreciable para este tipo de pacientes, y se comprobó además que, a pesar de que persisten cepas resistentes frente a diversos antimicrobianos, las cefalosporinas, quinolonas y los carbapenémicos muestran, de forma general, una adecuada actividad frente a este grupo de bacterias.
REFERENCIAS BIBLIOGRÁFICAS
1. Madeddu G, Porqueddu E, Cambosu F, Saba F, Fois A. Bacterial community acquired pneumonia in HIV-infected inpatients in the highly active antiretroviral therapy era. Infection. 2008 May;10:167-9.
2. CDC. Revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. Morbidity and Mortality Weekly Report. 1993;41:1-17.
3. Caiaffa WT, Graham NM, Vlahov D. Bacterial pneumonia in adult populations with human immunodeficiency virus (HIV) infection. Am J Epidemiol. 1993;138:909-22.
4. Biedenbach D, Moet G, Jones J. Occurrence and antimicrobial resistance pattern comparisons among bloodstream infection isolates from SENTRY Antimicrobial Surveillance Program. Diagn Microbiol Infect Dis. 2004;50:59-69.
5. Cabrera L, Palma S, Garcés M. Aislamientos bacterianos más frecuentes de muestras biológicas de pacientes infectados con el virus de la inmunodeficiencia humana (VIH). Rev Cubana Med Trop. 2003;55(2):112-4.
6. Dropulic LK, Leslie JM, Eldred LJ. Clinical manifestations and risk factors of Pseudomonas aeruginosa infection in patients with AIDS. J Infect Dis.1995;171:930-7.
7. Organización Mundial de
8. Byarugaba DK. A view on antimicrobial resistance in developing countries and responsible risk factors. Int J Antimicrob Agents. 2004 Aug;24(2):105-10.
9.
10. Afessa B, Green B. Bacterial pneumonia in hospitalized patients with HIV infection: the pulmonary complications, ICU support, and prognostic factors of hospitalized patients with HIV (PIP) study. Chest. 2000;117:1017-22.
11. Franzetti F, Grassini A, Piazza M, Degl'innocenti M, Bandera A. Nosocomial bacterial pneumonia in HIV-infected patients: risk factors for adverse outcome and implications for rational empiric antibiotic therapy. Infection. 2006 Feb;34(1):9-16.
13. Salami AK, Olatunji PO, Oluboyo PO, Akanbi AA, Fawibe EA. Bacterial pneumonia in the AIDS patients. West Afr J Med. 2006 Jan-Mar;25(1):1-5.
14. Sued O, Ben G, Pérez H. Cuidados intensivos en pacientes con infección por VIH. Patología de Urgencia. 2002;10:9-18.
15. Campbell S, Marrie T, Anstey R, Ackroyd-Stolarz S, Dickinson G. Utility of blood cultures in the management of adults with community acquired pneumonia discharged from the emergency department. Emerg Med J. 2003;20:521-3.
16. Fernández M, Zagolin M, Ruiz M, Martínez M, Díaz J. Neumonía adquirida en la comunidad que se hospitaliza: estudio etiológico. Rev Med
17. Corbo J, Friedman B, Bijur P, Gallager EJ. Limitada utilidad de hemocultivos iniciales en neumonía adquirida en la comunidad. Emerg Med J. 2004;21:446-8.
18. Luna CM. Blood cultures in community-acquired pneumonia: are we ready to quit? Chest. 2003;123(4):1142-50.
19. Sadikot R, Blackwell T, Christman T, Prince A. Pathogenhost interactions in Pseudomonas aeruginosa pneumonia. Am J Resp Crit Care Med. 2005;171:1209-23.
20. Pérez Monrás, Cabrera N, Batlle MC, Estévez R. Etiología bacteriana de las infecciones respiratorias agudas en pacientesVIH/sida. Rev Cubana Med Trop. 2002;54(2):147-51.
21. Manfredi R, Nanetti A, Ferri M, Chiodo F. Pseudomonas spp. complications in patients with HIV disease: an eight-year clinical and microbiological survey. Eur J Epidemiol. 2000 Feb; 16(2):111-8.
22.
23. Xiong Z, Zhu D, Zhang Y, Wang F. Extended-spectrum beta-lactamase in Klebsiella pneumoniae and Escherichia coli isolates. Zhonghua Yi Xue Za Zhi. 2002 Nov 10;82(21):1476-9.
24. Lee K, Lim CH, Cho JH, Lee WG, Uh Y, Kim HJ. High prevalence of ceftazidime-resistant Klebsiella pneumoniae and increase of imipenem-resistant Pseudomonas aeruginosa and Acinetobacter spp. in
25. Irfan S, Idrees F, Mehraj V, Habib F, Adil S. Emergence of Carbapenem resistant gramnegative and vancomycin resistant grampositive organisms in bacteremic isolates of febrile neutropenic patients: A descriptive study. BMC Infectious Dis. 2008;8:80.
26. Paladino JA, Sunderlin JL, Singer ME, Adelman MH, Schentag JJ. Influence of extended-spectrum beta-lactams on gram-negative bacterial resistance. Am J Health Syst Pharm. 2008 Jun;15;65(12):1154-9.
27. Rodríguez C, Martínez J. Vigilancia microbiológica en infecciones respiratorias bajas. Rev Cubana Hig Epidemiol. 2002 Sep-Dic;40(3).
28. Zhanel G, DeCorby M, Nichol KA, Wierzbowski A, Baudry PJ. Antimicrobial susceptibility of 3931 organisms isolated from intensive care units in
29. Hernández W, Ramos A, Nodarse R, Padrón A, De Armas E. Resistencia bacteriana en las bacterias productoras de betalactamasas extendidas (BLEE). Revista Cubana de Medicina Intensiva y Emergencias 2006 [citado 2008 Nov 12; 5(1) [aprox 2p.] Disponible en: http://bvs.sld.cu/revistas/mie/vol5_1_06/mie03106.htm
30. Zhanel G, DeCorby M, Laing N, Weshnoweski B, Vashisht R. Antimicrobial-resistant pathogens in intensive care units in
31. Gad GF, El-Domany RA, Ashour HM. Antimicrobial susceptibility profile of Pseudomonas aeruginosa isolates in
32. Vila J, Marco F. Lectura interpretada del antibiograma de bacilos gramnegativos no fermentadores. Enferm Infecc Microbiol Clin. 2002;20(6):304-12.
33. Poole K. Multidrug efflux pumps and antimicrobial resistance in Pseudomonas aeruginosa and related organisms. J Mol Microbiol Biotechnol. 2001;3:255-64.
34. Srifuengfung S, Tribuddharat C, Yungyuen T, Wensentia T. Respiratory tract infection caused by bacteria (non-Mycobacterium) and their antibiogram in HIV-positive patients. Southeast Asian J Trop Med Public Health. 2005 May;36(3):709-12.
35. Salazar D, González A, Palma S. Susceptibilidad antimicrobiana y serotipaje de Pseudomonas aeruginosa aisladas de pacientesVIH/sida. Rev Cubana Med Trop. 2002 [citado 2007 Dic 12]; 54(2): [aprox 2p.]. Disponible en: http://www.bvs.sld.cu/revistas/mtr/vol54_2_02/mtr10202.htm
Recibido: 24 de febrero del 2012.
Aprobado: 13 de abril del 2012.
Dra. Tersilia García Castellanos. Instituto de Medicina Tropical "Pedro Kourí". Apartado Postal 601, Marianao 13.