Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.31 no.3 Ciudad de la Habana jul.-sep. 2012
ARTÍCULO ORIGINAL
Morfogénesis de los túbulos dentinales: un modelo matemático
Morphogenesis of dentinal tubules: a mathematical model
Dr. Javier Laureano Niño BarreraI, Ing. Diego Alexander Garzón-AlvaradoII
IFacultad de Odontología. Universidad Nacional de Colombia.
IIDepartamento de Ingeniería Mecánica y Mecatrónica. Universidad Nacional de Colombia.
RESUMEN
La diferenciación mesenquimal a odontoblasto es un proceso complejo que determina la formación de los túbulos dentinales. Este proceso involucra una cuidadosa y regulada secuencia de cambios en el comportamiento de las células mesenquimales, coordinados por la expresión de diferentes factores moleculares, entre ellos, principalmente, el Noggin y BMP2. En este artículo se simula la formación de los túbulos dentinales a partir de un modelo matemático de reacción difusión que es solucionado por el método de los elementos finitos.
Palabras clave: túbulos dentinales, odontoblastos, BMP2, Noggin.
ABSTRACT
Mesenchymal differentiation into odontoblasts is a complex process determining the formation of dentinal tubules. The process involves a carefully regulated sequence of changes in the behavior of mesenchymal cells, coordinated by the expression of various molecular factors, particularly Noggin and BMP2. In this paper the formation of dentinal tubules is simulated using a reaction-diffusion mathematical model solved by the finite element method.
Key words: dentinal tubules, odontoblasts, BMP2, Noggin.
INTRODUCCIÓN
La morfogénesis dental es un proceso complejo que involucra factores genéticos,1-5 bioquímicos,6-11 mecánicos12 y celulares.3,13-15 Se considera que la formación de la estructura del diente puede ser guiada por la herencia genética que delimita su forma, tamaño y posición lo cual depende del tipo de especie y raza de un individuo particular.16 Adicionalmente, se ha encontrado que la señalización bioquímica hormonal del tipo local y sistémico puede afectar la formación del diente y alterar su estructura normal.17 En conjunto con los factores bioquímicos y genéticos, las cargas mecánicas pueden alterar el comportamiento celular modificando la morfología y función del diente.
Durante la morfogénesis se desarrollan diferentes tipos: esmalte, cemento y dentina.18,19 El esmalte es la capa externa, dura, que se puede encontrar en la corona del diente y se produce debido a la acción de los ameloblastos que se diferencian desde el epitelio dental interno.18 El cemento es la capa externa de la raíz del diente y se diferencia a partir del folículo dental.18,19. Por su parte, la dentina, es el principal tejido del diente que le confiere el soporte mecánico, protección de la pulpa y comunicación entre el exterior e interior a través de los túbulos dentinales que son formados desde el proceso odontoblástico.3,14-18
El proceso odontoblástico inicia con la diferenciación de los odontoblastos desde las células de la papila dental.3,13,14 Luego, el odontoblasto se desplaza hacia el interior de la papila y deja tras de sí una prolongación citoplasmática que está encargada de mineralizar su entorno, formando el túbulo.13-18 El proceso de formación del túbulo ha sido ampliamente estudiado y referenciado por diferentes autores.3,4,13,15,20,21 Por su parte, la diferenciación de los odontoblastos ha sido estudiada desde el aspecto funcional, bioquímico y genético.1,3,4,13,15 La diferenciación de los odontoblastos desde la papila es un proceso altamente organizado que desarrolla patrones bien establecidos de su ubicación y forma.1,3,4,13,15 La disposición geométrica de la diferenciación de estas células sugiere un patrón que establece unas distancias promedio entre los odontoblastos funcionales para, en el futuro, formar los túbulos.20,22
El odontoblasto se diferencia desde la papila dental, la cual se deriva del tejido ectomesenquimatoso, producto de las células de la cresta neural.4,18,19,23 Es así como el odontoblasto proviene de células mesenquimales.3,18,19 Se ha encontrado que la diferenciación a odontoblastos se debe a efectos bioquímicos y/o biológicos. Desde el punto de vista bioquímico la diferenciación se debe, entre otras, al efecto de la proteína morfogenética de hueso tipo 2 (BMP2) y la tipo 4 (BMP4) que son expresadas por las células de origen epitelial e interactúan con la membrana basal. Luego, una vez llegan estos factores, la membrana basal permite su transporte hasta células que serán diferenciadas a odontoblastos. La BMP2 y BMP4 son los principales factores que permiten la diferenciación,1,6,9,11,24,25 aunque existen muchos más, entre los que cabe mencionar la proteína morfogenética de hueso 7 (BMP7), el factor de crecimiento fibroblástico 10 (FGF10) y el factor de crecimiento fibroblástico 8 (FGF8).6-8,15
A pesar del amplio estudio sobre los factores bioquímicos que permiten la diferenciación de los odontoblastos, el patrón geométrico de los sitios donde se lleva a cabo este proceso no ha sido establecido totalmente. Por ejemplo, Ruch y otros3,15,26 han postulado que solo los preodontoblastos que han cumplido un determinado número de ciclos celulares, se convierten en posmitóticos y son competentes para diferenciarse en odontoblastos funcionales. Teniendo en cuenta lo anterior, la ubicación espacial de la distribución de los factores de crecimiento, específicamente BMP 2 sobre la membrana basal, determinaría los posibles sitios de diferenciación de los preodontoblastos competentes los cuales formaran los túbulos dentinales.
Por su parte, Mitsiadis y otros14 han planteado que la diferenciación de las células dentales es inducida por distintas señales químicas. Esta influencia puede inducir a las células a diferenciarse en una célula especializada en un sitio especifico o simplemente escogen su sitio de diferenciación estocásticamente y las señales químicas solo soportan su supervivencia y proliferación.14
Adicionalmente, Tziafas y otros27 han afirmado que el mecanismo de morfogénesis y diferenciación del odontoblasto es un tema de investigación constante. De hecho, el mecanismo exacto de señalización molecular y los eventos biológicos que preceden la diferenciación de la célula mesenquimal a odontoblasto es tema de constante debate.27 Por tanto, el objetivo de este artículo es proponer un modelo matemático, de carácter bioquímico, que simule el patrón de la formación de los túbulos dentinales a partir de la diferenciación de los odontoblastos. Para este fin, se utilizan ecuaciones de reacción-difusión cuyos parámetros se encuentran en el espacio de Turing y forman, patrones bien definidos y repetibles similar a lo que ocurre en la realidad biológica. La hipótesis se basa en el efecto de dos proteínas morfogenéticas que interactúan de forma secuencial con los tejidos epitelial y mesenquimal para crear patrones geométricos de diferenciación a odontoblastos. En primera instancia se supone que una de las principales proteínas que establecen la diferenciación es la BMP2, la cual forma un bucle regulatorio en conjunto con otras proteínas regulatorias de los tejidos embrionarios. Para probar esta hipótesis se han realizado simulaciones computacionales en dos dimensiones que permiten evidenciar las similitudes entre los patrones obtenidos y aquellos observados en la geometría de diferenciación de estas células. Con el advenimiento de la ingeniería tisular, la investigación en regeneración pulpar ha utilizado factores de crecimiento que pueden interactuar con matrices desarrolladas para remplazar el tejido pulpar. La forma como estos factores de crecimiento se distribuyan sobre la matriz determinará el futuro del tejido que se busca regenerar. Por tanto este artículo es de importancia para odontólogos, biólogos, clínicos e investigadores que deseen comprender desde una perspectiva matemática, el proceso de diferenciación de los odontoblastos y formación de los túbulos dentinales.
Sobre la diferenciación de los odontoblastos
Durante la etapa de campana las células de la papila dental que se encuentran directamente por debajo del nódulo secundario del esmalte, se diferencian en los odontoblastos.27
Varios miembros de la familia de las proteínas morfogenéticas óseas (BMP) y de la familia del factor de crecimiento fibroblástico (FGF) se han asociado con la diferenciación de los odontoblastos.6-9 Además, durante la dentinogénesis se han detectado proteínas específicas de dentina como son la sialoproteína dentinal y la fosfoproteína dentinal que se encuentran involucradas en el proceso de mineralización de la dentina.28-30
En conjunto con los factores de crecimiento, se ha encontrado que la membrana basal juega un papel importante en la diferenciación odontoblástica. Su importancia radica en que en que varias señales derivadas del epitelio quedan atrapadas en la membrana basal, y al activarse, interactúan con la capa donde se encuentran los preodontoblastos competentes.3,26 Estos preodontoblastos cambian su forma para volverse elongados y toman una disposición en forma de empalizada en conjunto con los demás odontoblastos ya diferenciados.18,19
Esta relación epitelio-mesénquima modulada por la membrana basal se presenta durante toda la diferenciación dental. En efecto, al inicio, la BMP2 y la BMP4, se expresan en el epitelio dental interno; cambiando su sitio de expresión en la etapa de brote, al mesénquima.6,10,23 Durante la etapa de casquete la expresión de BMP2 y BMP4 vuelve a situarse en la capa epitelial, específicamente en el nudo del esmalte6, 23 Posteriormente, en la etapa de campana, la BMP2 y la BMP4 se producen nuevamente en la papila dental, derivada del mesénquima.6,10. Al final del proceso, como consecuencia de la actividad de los distintos factores de crecimiento entre epitelio y mesénquima, se diferencian los odontoblastos.1,4,13,15
Durante los procesos embriológicos de diferenciación celular, las BMP son reguladas por moléculas antagonistas entre las que se encuentra el Noggin.31-33. Se ha reportado que el Noggin es un inhibidor específico de la actividad de las BMP en células mesenquimales. El Noggin regula la respuesta de células indiferenciadas a las BMP, a través de un mecanismo de retroalimentación negativo que sirve para mantener a las células en estado indiferenciado controlando así la tasa de crecimiento celular.31 El mecanismo de inhibición sugerido se basa en la unión del Noggin a las BMP, impidiendo que estas interactúen con los receptores de superficie celular.33. Debido al proceso de retroalimentación las BMP a su vez inducen a las células mesenquimales a expresar Noggin.31 Una vez el proceso de diferenciación y proliferación celular se activa, la expresión de Noggin se reduce.31
Alrededor del proceso odontoblástico y con la presencia de colágeno tipo I, proteínas no colágenas y proteínas específicas de dentina como fosfoforina dentinal y sialoproteína dentinal28-30,34 permiten la precipitación de los cristales de hidroxiapatita. Esta formación se lleva a cabo entre las fibras de colágeno, mineralizando y formando la dentina.18,28,30
MÉTODOS
Hipótesis sobre el proceso de diferenciación de los odontoblastos
La hipótesis de este trabajo se basa en la diferenciación de los odontoblastos a partir del tejido mesenquimal mediante la acción de la proteína BMP2. Esta proteína se encuentra regulada en el tejido ectomesenquimal y en la membrana basal. Para esto se supone la existencia de un sistema de reacción-difusión de dos moléculas primordiales, como son el BMP2 y la Noggin cuya distribución en el espacio puede conducir a un patrón estable en el tiempo e inestable en el espacio, similar a los patrones de diferenciación de los odontoblastos desde células mesenquimales.
La presencia de BMP2 liberado por la papila dental permite la diferenciación celular desde las células mesenquimales5,6. En conjunto con esta proteína existe otra, en este caso se supone el Noggin, que permite la regulación molecular que determina el sitio donde se diferencian las células para la correcta formación y distribución de los túbulos dentinales. Por tanto, la BMP2 y el Noggin compiten para restringir la diferenciación completa del tejido. Entre estas dos proteínas se desarrolla un proceso de competencia, del tipo activador-inhibidor o activador-sustrato. Esta regulación se supone como un bucle que está altamente acoplado y que se representa mediante ecuaciones de reacción-difusión cuyos parámetros se encuentran en el espacio de Turing.35,36 Este modelo matemático permitirá simular patrones de distribución espacial, que son repetibles ante diferentes tipos de condiciones iniciales y que llevarán a la misma distribución, similar a la alta repetitividad del proceso de diferenciación de odontoblastos.
Descripción del modelo
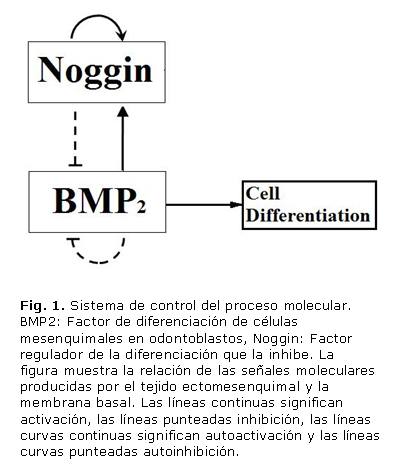
El proceso regulatorio que se propone en este artículo se esquematiza en la figura 1, y está basado en un sistema de reacción-difusión (de ecuaciones diferenciales parciales) del tipo activador-sustrato (también llamado modelo de agotamiento). El proceso indica que existe un lazo de control entre el Noggin (factor activador) y el BMP2 (sustrato), donde el Noggin se autorregula y compite con la producción de BMP2. De esta forma, se supone que el BMP2 se autoinhibe pero activa la producción de Noggin; y, por su parte, el Noggin inhibe la producción de BMP2.31-33,37 Esta hipótesis se basa en los resultados hallados por Zhu y otros31 Walsh y otros33 y Plikus y otros 32 en donde sus hallazgos relatan el bucle regulatorio entre BMP2 y Noggin. El BMP2 permite la diferenciación celular de las células mesenquimales a odontoblastos. De esta forma los odontoblastos diferencian y desarrollan patrones altamente repetibles, similares a los hallados en los patrones de Turing.
La definición de las relaciones indicadas en la figura 1 puede ser cuantificada por medio de ecuaciones que establecen cambios locales de los factores que están entre la membrana basal y el epitelio:
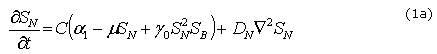
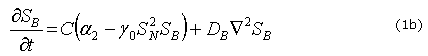
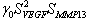
Donde C es la concentración de células del epitelio y el tejido mesenquimal que expresan los factores BMP y Noggin,![]() ,
, ![]() , representan las concentraciones de BMP y Noggin, respectivamente. Los restantes son parámetros del modelo:
, representan las concentraciones de BMP y Noggin, respectivamente. Los restantes son parámetros del modelo: ![]() y
y ![]() son términos que cuantifican la producción de cada factor molecular por los tejidos mesenquimal y epitelial, m es una constante que cuantifica la inhibición en la producción de Noggin por su exceso,
son términos que cuantifican la producción de cada factor molecular por los tejidos mesenquimal y epitelial, m es una constante que cuantifica la inhibición en la producción de Noggin por su exceso, ![]() regula la interacción no lineal entre la concentración de Noggin-BMP2 y cuantifica la activación o inhibición de cada factor molecular,
regula la interacción no lineal entre la concentración de Noggin-BMP2 y cuantifica la activación o inhibición de cada factor molecular, ![]() y
y ![]() son los coeficientes de difusión del BMP2 y Noggin, respectivamente. En la interpretación biológica de las anteriores ecuaciones el término
son los coeficientes de difusión del BMP2 y Noggin, respectivamente. En la interpretación biológica de las anteriores ecuaciones el término ![]() representa la activación no lineal de
representa la activación no lineal de ![]() (producción de Noggin por la presencia de BMP2) y el consumo no lineal de
(producción de Noggin por la presencia de BMP2) y el consumo no lineal de ![]() (por la presencia de Noggin). La ecuación (1c) representa el término de diferenciación de las células mesenquimales a odontoblásticas por la presencia de BMP2, la cual se regula a medida que transcurre el tiempo T. En esta ecuación h es una constante que regula la diferenciación celular,
(por la presencia de Noggin). La ecuación (1c) representa el término de diferenciación de las células mesenquimales a odontoblásticas por la presencia de BMP2, la cual se regula a medida que transcurre el tiempo T. En esta ecuación h es una constante que regula la diferenciación celular, ![]() representa el valor de la concentración de BMP2 con la cual comienza el proceso de diferenciación.
representa el valor de la concentración de BMP2 con la cual comienza el proceso de diferenciación. ![]() es el tiempo requerido para que se lleve a cabo la diferenciación y
es el tiempo requerido para que se lleve a cabo la diferenciación y ![]() representa el tiempo límite de acción de la BMP2.
representa el tiempo límite de acción de la BMP2.
Solución del sistema de ecuaciones de reacción-difusión por medio del método de los elementos finitos
Para la solución del conjunto de ecuaciones (1) se utilizó el método de los elementos finitos usando elementos triangulares. Debido a la no linealidad de los términos incluidos en el modelo, se utilizó el método de Newton-Raphson para solucionar el problema de evolución temporal de la concentración del Noggin y BMP2 (![]() y
y ![]() ). La integración del tiempo se realizó mediante la regla del trapecio.
). La integración del tiempo se realizó mediante la regla del trapecio.
Implementación numérica
La selección de las condiciones iníciales aleatorias alrededor del estado estable es similar al evento de la expresión molecular por parte de las células mesenquimales en la zona de diferenciación a odontoblastos. Las condiciones de flujo para cada factor molecular en la frontera se supone nulo, esto debido a que estas condiciones se suponen periódicas sobre el dominio.
RESULTADOS
Para verificar el potencial del modelo propuesto en la predicción del patrón de distribución de la diferenciación celular a odontoblastos, se realizaron ensayos numéricos en un cuadrilátero bidimensional con una longitud de 11 mm. Los parámetros del modelo de reacción-difusión fueron seleccionados de tal forma que se obtengan patrones de diferenciación con una periodicidad acorde con las presentes en la formación de los túbulos dentinales. En la malla de elementos finitos utilizada se emplearon 10 201 nodos y 2 500 elementos cuadriláteros. En todas las simulaciones se emplearon pasos incrementales de ![]() .
.
Como consecuencia de la interacción química entre los dos factores moleculares (reactantes) y mediante los resultados numéricos fueron determinados patrones espaciales estables en el tiempo. La concentración de los factores moleculares en el ectomesénquima y la acción del proceso difusivo permiten la formación de un patrón que se replica en todo el dominio. La arquitectura de diferenciación que se obtiene mediante el modelo R-D propuesto depende de los parámetros utilizados en la ecuación (1), por lo que se puede obtener estructuras con número de onda (4,4) como se muestra en la figura 2 .El número de ondas permite definir la periodicidad y distribución del número de sitios de diferenciación de las células mesenquimales a odontoblastos productores de dentina y, por lo tanto, con la capacidad de formar el túbulo dentinal.13 Los resultados de la figura 2 muestran la formación de cuatro medias ondas en cada una de las direcciones x e y. Las figuras 2b, 2c, 3b y 3c muestran los resultados para la organización del Noggins y BMP2 luego de la estabilización del proceso de reacción-difusión, nótese que en las zonas de mayor concentración de Noggins no se produce diferenciación celular y en aquellas zonas de mayor presencia de BMP2 se produce su diferenciación.
A partir del mecanismo de reacción-difusión puede determinarse el cambio de la concentración de Noggin y BMP2 para cada instante de tiempo. Las concentraciones de Noggin (SN) y BMP2 (SB) dentro del tejido mesenquimal, evolucionan de acuerdo a su difusividad, su interacción y a su expresión por parte de las células mesenquimales. Por lo que, tanto el Noggin como el BMP2 se concentran en altas cantidades en zonas específicas, permitiendo la diferenciación celular similar a lo ocurrido en el proceso biológico.
DISCUSIÓN
Mucho se ha aprendido en los últimos años acerca de los mecanismos celulares y moleculares que orientan los diferentes eventos que permiten la diferenciación del odontoblasto.1,3,6,15 No obstante, la explicación del patrón altamente estable y la elección de los sitios de diferenciación celular generan inquietudes aún no resueltas 32 Por ejemplo, Mitsiadis y otros14 plantean que los sitios de diferenciación celular son elegidos aleatoriamente, y las señales químicas permiten la supervivencia. De igual forma, Ruch y otros3,15,26 han postulado que solo algunas células mesenquimales pueden llegar a ser odontoblastos cuando cumplen un determinado número de ciclos celulares.
De esta forma, en este trabajo se presentó un modelo biorregulatorio basado en un conjunto de ecuaciones de reacción-difusión para predecir la formación de túbulos dentinales a partir de la diferenciación de los odontoblastos. De esta forma, la hipótesis consignada en este artículo establece que el sitio de diferenciación del odontoblasto está determinado por la distribución espacial de un conjunto de señales moleculares que compiten entre ellas para mantener sitios de mayor concentración que determinan el paso de célula mesenquimal a odontoblasto. Para este fin se utilizan parámetros que están en el espacio de Turing y que forman patrones con el mismo nombre. La aplicación del modelo de reacción-difusión con parámetros en el espacio de Turing es un área de constante trabajo y controversia en biología. Garzón y otros35,38 y Courtin y otros39 utilizaron en sus trabajos modelos de reacción-difusión para simular diferentes procesos biológicos, y encontraron en los resultados obtenidos, que el empleo de estos sistemas puede llegar a explicar diversos fenómenos biológicos de alta complejidad en donde exista formación de patrones.
REFERENCIAS BIBLIOGRÁFICAS
1. Lesot H, Lisi S, Peterkova R, Peterka M, Mitolo V, Ruch JV. Epigenetic signals during odontoblast differentiation. Adv Dent Res. 2001 Aug;15:8-13.
2. Mina M, Kollar EJ. The induction of odontogenesis in non-dental mesenchyme combined with early murine mandibular arch epithelium. Arch Oral Biol. 1987;32(2):123-7.
3. Ruch JV, Lesot H, Begue-Kirn C. Odontoblast differentiation. Int J Dev Biol. 1995 Feb;39(1):51-68.
4. Thesleff I. Tooth morphogenesis. Adv Dent Res. 1995 Nov;9(3 Suppl):12.
5. Thesleff I. Homeobox genes and growth factors in regulation of craniofacial and tooth morphogenesis. Acta Odontol Scand. 1995 Jun;53(3):129-34.
6. Aberg T, Wozney J, Thesleff I. Expression patterns of bone morphogenetic proteins (Bmps) in the developing mouse tooth suggest roles in morphogenesis and cell differentiation. Dev Dyn. 1997 Dec;210(4):383-96.
7. Kettunen P, Laurikkala J, Itaranta P, Vainio S, Itoh N, Thesleff I. Associations of FGF-3 and FGF-10 with signaling networks regulating tooth morphogenesis. Dev Dyn. 2000 Nov;219(3):322-32.
8. Kettunen P, Thesleff I. Expression and function of FGFs-4, -8, and -9 suggest functional redundancy and repetitive use as epithelial signals during tooth morphogenesis. Dev Dyn. 1998 Mar;211(3):256-68.
9. Thesleff I, Mikkola M. The role of growth factors in tooth development. Int Rev Cytol. 2002;217:93-135.
10. Thesleff I. Epithelial-mesenchymal signalling regulating tooth morphogenesis. J Cell Sci. 2003 May 1;116(Pt 9):1647-8.
11. Thesleff I, Vaahtokari A, Vainio S, Jowett A. Molecular mechanisms of cell and tissue interactions during early tooth development. Anat Rec. 1996 Jun;245(2):151-61.
12. Mammoto T, Mammoto A, Torisawa YS, Tat T, Gibbs A, Derda R, et al. Mechanochemical control of mesenchymal condensation and embryonic tooth organ formation. Dev Cell. Oct 18;21(4):758-69.
13. Arana-Chavez VE, Massa LF. Odontoblasts: the cells forming and maintaining dentine. Int J Biochem Cell Biol. 2004 Aug;36(8):1367-73.
14. Mitsiadis TA, Graf D. Cell fate determination during tooth development and regeneration. Birth Defects Res C Embryo Today. 2009 Sep;87(3):199-211.
15. Lisi S, Peterkova R, Peterka M, Vonesch JL, Ruch JV, Lesot H. Tooth morphogenesis and pattern of odontoblast differentiation. Connect Tissue Res. 2003;44 Suppl 1:167-70.
16. Ferrario VF, Sforza C, Colombo A, Carvajal R, Duncan V, Palomino H. Dental arch size in healthy human permanent dentitions: ethnic differences as assessed by discriminant analysis. Int J Adult Orthodon Orthognath Surg. 1999;14(2):153-62.
17. Kumasaka S, Shimozuma M, Kawamoto T, Mishima K, Tokuyama R, Kamiya Y, et al. Possible involvement of melatonin in tooth development: expression of melatonin 1a receptor in human and mouse tooth germs. Histochem Cell Biol. May;133(5):577-84.
18. Nanci A. Oral Histology. 7th ed.: Filadelfia, USA:Elsevier Inc.; 2008.
19. Bartold Mark, Narayanan S. Biology of the periodontal connective tissues. Exeter, UK:Quintessence Publishing; 1998.
20. Carda C, Peydro A. Ultrastructural patterns of human dentinal tubules, odontoblasts processes and nerve fibres. Tissue Cell. 2006 Apr;38(2):141-50.
21. Linde A. Dentin mineralization and the role of odontoblasts in calcium transport. Connect Tissue Res. 1995;33(1-3):163-70.
22. Wakabayashi H, Matsumoto K, Nakamura Y, Shirasuka T. Morphology of the root canal wall and arrangement of underlying dentinal tubules. Int Endod J. 1993 May;26(3):153-8.
23. Tompkins K. Molecular mechanisms of cytodifferentiation in mammalian tooth development. Connect Tissue Res. 2006;47(3):111-8.
24. Vainio S, Karavanova I, Jowett A, Thesleff I. Identification of BMP-4 as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development. Cell. 1993 Oct 8;75(1):45-58.
25. Yang W, Harris MA, Cui Y, Mishina Y, Harris SE, Gluhak-Heinrich J. Bmp2 is required for odontoblast differentiation and pulp vasculogenesis. J Dent Res. Jan;91(1):58-64.
26. Schmitt R, Ruch JV. In vitro synchronization of embryonic mouse incisor preodontoblasts and preameloblasts: repercussions on terminal differentiation. Eur J Oral Sci. 2000 Aug;108(4):311-9.
27. Tziafas D, Kodonas K. Differentiation potential of dental papilla, dental pulp, and apical papilla progenitor cells. J Endod. May;36(5):781-9.
28. Butler WT. Dentin matrix proteins. Eur J Oral Sci. 1998 Jan;106 Suppl 1:204-10.
29. Begue-Kirn C, Krebsbach PH, Bartlett JD, Butler WT. Dentin sialoprotein, dentin phosphoprotein, enamelysin and ameloblastin: tooth-specific molecules that are distinctively expressed during murine dental differentiation. Eur J Oral Sci. 1998 Oct;106(5):963-70.
30. Linde A. Dentin matrix proteins: composition and possible functions in calcification. Anat Rec. 1989 Jun;224(2):154-66.
31. Zhu W, Kim J, Cheng C, Rawlins BA, Boachie-Adjei O, Crystal RG, et al. Noggin regulation of bone morphogenetic protein (BMP) 2/7 heterodimer activity in vitro. Bone. 2006 Jul;39(1):61-71.
32. Plikus MV, Zeichner-David M, Mayer JA, Reyna J, Bringas P, Thewissen JG, et al. Morphoregulation of teeth: modulating the number, size, shape and differentiation by tuning Bmp activity. Evol Dev. 2005 Sep-Oct;7(5):440-57.
33. Walsh DW, Godson C, Brazil DP, Martin F. Extracellular BMP-antagonist regulation in development and disease: tied up in knots. Trends Cell Biol. May;20(5):244-56.
34. Begue-Kirn C, Smith AJ, Ruch JV, Wozney JM, Purchio A, Hartmann D, et al. Effects of dentin proteins, transforming growth factor beta 1 (TGF beta 1) and bone morphogenetic protein 2 (BMP2) on the differentiation of odontoblast in vitro. Int J Dev Biol. 1992 Dec;36(4):491-503.
35. Garzón-Alvarado DA, Ramírez Martínez AM. A biochemical hypothesis on the formation of fingerprints using a turing patterns approach. Theor Biol Med Model. 2011;8(1):24.
36. Murray JD. Parameter space for turing instability in reaction diffusion mechanisms: a comparison of models. J Theor Biol. 1982 Sep 7;98(1):143-63.
37. Balemans W, Van Hul W. Extracellular regulation of BMP signaling in vertebrates: a cocktail of modulators. Dev Biol. 2002 Oct 15;250(2):231-50.
38. Garzón-Alvarado DA, Martínez AM, Segrera DL. A model of cerebral cortex formation during fetal development using reaction-diffusion-convection equations with Turing space parameters. Comput Methods Programs Biomed. 2011. Dec;104(3):489-97.
39. Courtin B, Perault-Staub AM, Staub JF. Spatio-temporal self-organization of bone mineral metabolism and trabecular structure of primary bone. Acta Biotheor. 1995 Dec;43(4):373-86.
Recibido: 10 de septiembre de 2011.
Aprobado: 25 de septiembre de 2011.
Javier Laureano Niño Barrera. Facultad de Odontología. Universidad Nacional de Colombia. Correo electrónico: jlninob@unal.edu.co
.