Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.31 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Estandarización de un ensayo inmunoenzimático para la detección de anticuerpos anti-ADN doble cadena en el lupus eritematoso sistémico
Standardization of an immunoenzymatic assay to detect anti-double-stranded DNA antibodies in systemic lupus erythematosus
Dra. Aymé Debesa Padilla, Dr.Cs. Oscar Hernández Betancourt
Centro de Inmunología y Productos Biológicos. Universidad de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba.
RESUMEN
Introducción: los anticuerpos anti-ADN doble cadena son un marcador serológico diagnóstico de lupus eritematoso sistémico (LES). El ensayo inmunoenzimático en fase sólida es una técnica rápida y rentable para su detección.
Objetivo: estandarizar un ELISA que detecte anti ADN doble cadena para el diagnóstico del lupus.
Métodos: los pasos que se siguieron para la estandarización incluyeron la preparación de controles, la sensibilización de la fase sólida, la selección de los amortiguadores y conjugado del ensayo, la evaluación de las condiciones de reacción y la determinación del nivel de corte. Además se realizó el estudio de inespecificidades. Se probaron 5 tipos de placas de poliestireno y se compararon ADN plasmídico de E.coli, pUC19 y ADN genómico humano como antígenos de recubrimiento. Se evaluó el efecto de la poli-L-lisina y la irradiación de la placa con luz ultravioleta, en la fijación del antígeno. El valor de corte del ensayo se determinó por el método del valor límite.
Resultados: se observó disociación del antígeno cuando no se utilizó poli-L-lisina en el pretratamiento de la placa y la irradiación con luz UV no favoreció la unión del ADN a la fase sólida. No se encontraron diferencias significativas (p=0,710) entre ambos ADN, en el recubrimiento. El valor de corte (K=3) permitió clasificar como positivas 28 muestras (63,6 %) de pacientes con LES.
Conclusiones: el método estandarizado, con el empleo de ADN plasmídico, permitió la detección de anticuerpos anti-ADN doble cadena en pacientes con lupus.
Palabras clave: ADN, ensayos inmunoenzimáticos, ELISA, estandarización.
ABSTRACT
Introduction: anti-double-stranded DNA antibodies are a diagnostic serological marker for systemic lupus erythematosus (SLE). The solid-phase immunoenzymatic assay is a rapid, cost-effective technique for their detection. Objective: Standardize an ELISA detecting anti-double-stranded DNA for the diagnosis of lupus.
Methods: the standardization process included the following steps: preparation of controls, sensitization of the solid phase, selection of buffers and assay conjugate, evaluation of reaction conditions and determination of the cut-off level. A study of unspecificities was also conducted. Five types of polystyrene plates were tested, and a comparison was made of E. coli (pUC19) plasmid DNA and human genomic DNA as coating antigens. An evaluation was conducted of the effect of poly (L-lysine) and irradiation of the plate with ultraviolet light upon antigen fixation. The assay cut-off value was determined by the limit value method.
Results: antigen dissociation was observed when poly (L-lysine) was not used in the pretreatment of the plate and UV light irradiation did not foster DNA binding to the solid phase. No significant differences were found (p=0.710) between the two DNA coatings. The cut-off value (K=3) made it possible to classify 28 samples of patients with SLE as positive (63.6 %).
Conclusions: the method standardized with the use of plasmid DNA enabled detection of anti-double-stranded DNA antibodies in patients with lupus.
Key words: DNA, immunoenzymatic assays, ELISA, standardization.
INTRODUCCIÓN
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica caracterizada por la producción de autoanticuerpos y la formación y depósito de complejos inmunes. Estos autoanticuerpos, dirigidos la mayoría contra los componentes del núcleo celular, son el sello serológico distintivo del LES.1
Los anticuerpos antinucleares (AAN) son autoanticuerpos dirigidos contra antígenos del núcleo celular, como el ácido desoxirribonucleico de doble cadena y de simple cadena (ADNdc y ADNsc, respectivamente), histonas y antígenos nucleares extraíbles (ANE).2
Las alteraciones inmunológicas que conforman uno de los criterios diagnósticos del LES según la AAR, incluye la presencia de anticuerpos antifosfolípidos, anti-Sm y anti-ADNdc. Este último es el biomarcador más utilizado en el LES en la actualidad.3
En la detección de los anti-ADNdc se ha utilizado un repertorio amplio de métodos como la técnica de inmunofluorescencia indirecta con Crithidia luciliae (CLIFT), el ensayo Farr que es un radioinmunoensayo y a finales del pasado siglo comenzaron a utilizarse los ensayos inmunoenzimáticos en fase sólida (ELISA).3,4 Esta última es una técnica sencilla, rápida, con equipamiento barato que ofrece la posibilidad de procesar gran número de muestras a la vez.
Los antígenos de recubrimiento en el soporte sólido de los ELISA anti-ADNdc pueden ser de diferentes especies como ADN plasmídico, ADN bacteriano, ADN de timo de ternera y ADN genómico humano,5 obtenidos por diferentes métodos de purificación.
Optimizar el diagnóstico del LES mejoraría la atención médica que se les brinda a los pacientes y contribuiría a reducir la morbilidad y mortalidad.
Los kit diagnósticos comerciales para la determinación de anti-ADNdc son de difícil y costosa adquisición. La mayoría de los laboratorios de Inmunología del país carecen de un método para detectar estos anticuerpos. Por eso es importante la implementación de un método cualitativo, reproducible y barato como los ELISA que permita la detección de anti-ADNdc, sustituya importaciones de reactivos y permita el diagnóstico y seguimiento de los pacientes con LES.
Esta investigación demuestra la factibilidad de estandarizar un ELISA, que emplea ADN plasmídico como antígeno de recubrimiento, para la determinación de anticuerpos anti-ADN dc en el LES.
MÉTODOS
Se establecieron las condiciones óptimas de un ELISA heterogéneo indirecto cualitativo para la detección in vitro anticuerpos anti-ADNdc de clase IgG en pacientes con LES. Los pasos para la optimización del ensayo fueron los siguientes:
• Preparación de estándares y controles.
• Evaluación del recubrimiento o sensibilización de la fase sólida.
• Selección de amortiguadores.
• Selección de los reactivos de detección.
• Evaluación de las condiciones de reacción.
• Determinación del nivel de corte (cut off).
Preparación de estándares y controles
Ante la inexistencia de sueros de referencias o estándares, se trabajaron muestras mezcladas de 3 sueros positivos y 26 negativos de anti-ADNdc como controles, previamente diagnosticados mediante CLIFT con láminas comerciales (BYNDANZYME, United Kingdom), gentilmente donados por el Laboratorio de Inmunología del CIMEQ.
Se procesaron 44 muestras de sueros procedentes de pacientes con LES. Se incluyeron las muestras de sueros de pacientes que manifestaran 4 o más criterios de clasificación del LES de la Asociación Americana de Reumatología.6 Además, se analizaron 22 muestras de suero procedentes de personas sanas que donaron sangre en el Banco de Sangre Provincial.
Evaluación del recubrimiento o sensibilización de la fase sólida
En este paso se probaron como soporte sólido 5 tipos de placas de Poliestireno (PE), de 96 pozos: MaxiSorp® fondo plano y en U, FluoroNunc Polisorp® fondo plano y 2 placas de PE no tratado, fondo plano, una Linbro® y otra de captación media Costar®. Para el ensayo de los tipos de placas se siguió el protocolo general del ELISA heterogéneo indirecto, con la variación de esta variable.
Se compararon como antígenos de recubrimiento ADN plasmídico de E.coli, pUC19, y ADN humano purificado por el método del fenol cloroformo-alcohol isoamílico a partir de tejido prostático.7 La concentración de ADN plasmídico fue de 1,8 µg/mL y la del ADN humano de 0,4 µg/mL, con índices de pureza de 1,76 y 1,6 respectivamente, calculada mediante la razón A260/A280 por espectrofotometría a 260 nm. Para corroborar la pureza del ADN plasmídico se buscó la presencia de ADN simple cadena como contaminante, mediante un ELISA indirecto con el uso de una enzima nucleasa, Mung Bean que cataliza la hidrólisis de ácido nucleico de simple cadena a oligonucleótidos o mononucleótidos. Se experimentaron concentraciones de recubrimiento de 0,5 µg/mL, 1,0 µg/mL, 2,0 µg/mL, 4,0 µg/mL, 8,0 µg/mL y 16,0 µg/mL de ambos ADN y la concentración óptima se determinó según indica la literatura.8
Se probó el uso de Poli-L-lisina (PLL) (1 mg/mL) en el prerecubrimiento, para facilitar la inmovilización del ADN plasmídico a la fase sólida mediante la formación de enlaces covalentes. Se utilizó una concentración de 5 µg/mL diluida en amortiguador fosfato salino (PBS) 1X. El ensayo se evaluó usando diferentes concentraciones de ADN plasmídico en el recubrimiento.
El efecto de la luz ultravioleta en la fijación covalente del ADN al soporte fue valorado por medio de la comparación entre una placa irradiada y otra no irradiada con una lámpara germicida UV como recomienda la literatura.9
Se evaluaron diferentes soluciones amortiguadoras en el recubrimiento: amortiguador carbonato/bicarbonato (ACB 1X); amortiguador citrato (AC 1X); PBS 1X; y SSC 1X. Se realizaron varios ELISA indirectos para evaluar el recubrimiento óptimo teniendo en cuenta la linealidad mostrada por cada amortiguador y la concentración del antígeno, utilizando los controles positivos, negativos y el blanco.
Selección de amortiguadores
Se empleó PBS con la adición de Tween 20 al 0,05 % (PBST) como solución de lavado, en los pasos posteriores a la inmovilización del antígeno a la placa. Se experimentaron como soluciones bloqueadoras: albúmina sérica bovina (BSA), leche descremada y ovoalbúmina (OVA) a concentraciones de 0 %, 0,5 %, 1 % y 2 % en PBST. Posteriormente se estudió el efecto de los sueros de carnero (SC) y bovinos (SB) al 10 % solo y en combinación con BSA al 2 %.
Selección de los reactivos de detección
Se probaron los conjugados A100 y A1500, ambos IgG de carnero anti-cadena-g humana conjugada a peroxidasa de rábano picante (PRP), y se evaluaron las diluciones de trabajo 1/500, 1/1000 y 1/2000 en solución de bloqueo PBS1X, BSA 2 %, Tween 20 al 0,05 %. Las diluciones óptimas del conjugado se probaron por medio de un ELISA directo en el que se recubrió la placa con una mezcla de sueros positivos diluidos 1/400 y se incubó durante 16-20 horas a 4 °C. Se adicionó el sustrato orto-fenilendiamina (OPD) (0,4 mg/mL) en amortiguador citrato trisódico, 0,1 M, pH 4,5 y peróxido de hidrógeno al 0,04 % durante 15 min, protegiéndose de la luz. Luego se detuvo la reacción con ácido sulfúrico 2N y se realizó la lectura a 492 nm en un lector de ELISA (Multiskanplus, Finland).
Evaluación de las condiciones de reacción
La estandarización del sistema no incluyó fluctuaciones en el tiempo ni en las temperaturas de cada una de las etapas, se fijaron las descritas en la literatura.5,9
Para definir la dilución óptima de las muestras se probaron mezclas de los controles negativos, positivos y muestras de suero obtenidas del banco de sangre en un rango de 1/400 hasta 1/12800.
Determinación del nivel de corte (cut off)
Para determinar el valor de corte se emplearon paneles de muestras positivas y negativas. Su cálculo estuvo basado en el método del valor límite.8,10
Además, se evaluó la obtención de resultados no específicos por muestras de suero de enfermedades autoinmunes como la enfermedad mixta del tejido conectivo, la esclerosis sistémica y la artritis reumatoidea. También se analizaron muestras de sueros de pacientes con linfoma no Hodgkin, leucemias linfoide y mieloide crónicas, mieloma múltiple, cáncer de próstata e insuficiencia renal crónica, así como sueros lipémicos y hemolizados. Se calculó el porcentaje de interferencia para cada tipo de suero por medio de la división de las muestras positivas entre todas las analizadas y la multiplicación por 100.
Análisis estadístico
Se creó una base de datos en Microsoft Excel para el vaciamiento de los datos. Se realizó el procesamiento estadístico con el programa SYSTAT 7 versión 7.0 Copyright 1999, SPSS Inc. Se empleó estadística paramétrica (análisis factorial de varianza, ANOVA).
RESULTADOS
Los mayores valores de absorbancia se obtuvieron con las placas Maxisorp® independiente del tipo de fondo (plano o en U); no obstante se evidenció un alto valor de fondo en el blanco reactivo de las placas con el fondo en U. Las placas FluroNunc Polysorp® mostraron buenos valores de absorbancia y resolución entre los valores negativos y positivos, lo que unido a su amplia disponibilidad en el laboratorio, motivo su selección.
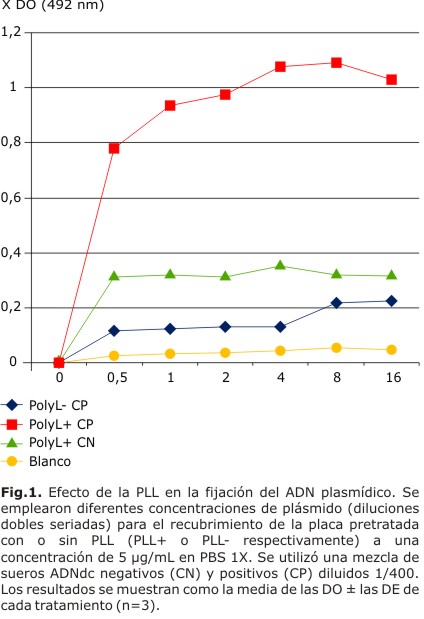
En la figura 1 se pueden observar los valores de absorbancia obtenidos en presencia o no de PLL.
La disociación del plásmido cuando no se utiliza PLL en el pretratamiento de la placa, se evidencia por los bajos valores de densidad óptica obtenidos independientemente de la concentración de la molécula de ADNdc empleada en el recubrimiento.
La evaluación del efecto de la luz UV no arrojó diferencias significativas (p=0,799) entre las medias de los controles negativos y positivos, en ambos tratamientos.
Se seleccionó como concentración óptima de recubrimiento 4 µg/mL de ADN plasmídico (Fig. 2).
La comparación de medias cuadradas, por medio de ANOVA simple (IC<0,05) no evidenció diferencias significativas (p= 0,710) entre ambos ADN.
El experimento con enzima nucleasa, Mung Bean, corroboró la homogeneidad y la ausencia de contaminación con ADNsc del ADN plasmídico empleado. No se encontró diferencia significativa (p= 0,165) entre los pozos tratados con 2 concentraciones de la enzima (0,8 y 3,2 u/µg de plásmido) y los no tratados.
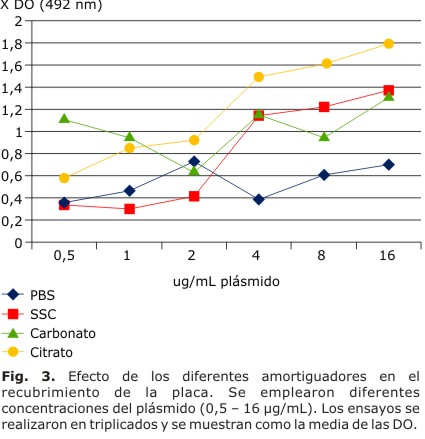
El ensayo de diferentes amortiguadores en la reacción de recubrimiento, como se observa en la figura 3, reveló que los amortiguadores ACB y PBS no presentaron un comportamiento uniforme, a medida que se incrementó la concentración de antígeno se observan valores irregulares de absorbancia. Los mejores resultados se obtuvieron con los amortiguadores SSC y AC, ambos con tendencia a la linealidad. El AC, que arrojó DO entre 1,5 y 1,8 en las concentraciones de plásmido superiores a 4 µg/mL, se eligió como amortiguador de recubrimiento.
Se evaluó la efectividad del agente bloqueador mediante el cálculo del factor normalizado (control positivo ADNdc+/control negativo ADNdc-). El análisis estadístico realizado (ANOVA) no arrojó diferencias entre la BSA y la OVO (p=0,38); en cambio, sí hubo discrepancia marcada cuando se empleó la leche (p=0,02), pues se observó menor discriminación entre el control positivo y el negativo. Al comparar la BSA con SC 10 % y SB 10 % y combinada con estos reactivos se obtuvo mejores resultados con BSA al 2 %, por lo que se seleccionó como reactivo para el bloqueo de sitios libres.
En la determinación de la dilución óptima de as muestras se seleccionó 1/4000 como dilución de trabajo, al lograrse con esta la mayor resolución posible entre los valores medios de las muestras y el control positivo.
De los 2 conjugados probados, el A1500 no mostró señales de absorbancia adecuadas para este ensayo, por lo que se decidió escoger el conjugado A100 en una dilución de trabajo de 1/1000.
El valor de corte fue calculado por el método del valor límite. El mayor valor de "K" obtenido se tomó como el valor de corte del ensayo, K máxima = 3,0 (Fig. 4). Posteriormente se determinó el valor "K" para cada muestra, tanto las muestras de pacientes con LES (n=44) como las muestras de banco de sangre (n=22), mediante el cociente absorbancia de la muestra (S) entre N. Los valores de las muestras se consideraron positivos cuando S/N ³ "K" máxima. De esta forma, toda muestra cuyo valor fue igual o superior a 3,0 se consideró positiva. Resultaron positivas 2 muestras de suero de donantes de sangre y 28 muestras (63,6 %) de pacientes con LES. La mayoría de los casos positivos (84,09 %) se encuentran por encima del valor de corte determinado en este ELISA.
La estimación de interferencias arrojó los porcentajes más altos en los sueros procedentes de pacientes con enfermedad mixta del tejido conectivo (66,6 %) y con insuficiencia renal crónica (71,4 %).
DISCUSIÓN
La detección de anti-ADNdc mediante ELISA está ampliamente difundida en los laboratorios clínicos por las ventajas que esta técnica posee: la relativa sencillez, la rapidez de ejecución, el bajo costo del equipamiento y la posibilidad de automatización. Además, emplea pequeñas cantidades de muestras y reactivos y presenta elevada precisión, sensibilidad, especificidad y detectabilidad.2,11
Un paso extremadamente importante en el proceso de estandarización de un ELISA lo constituye la sensibilización de la fase sólida, para la que debemos tener en cuenta la estructura molecular del antígeno que se fijará a la placa. Se conoce que en estos ensayos hay una relación directamente proporcional entre el número de moléculas inmovilizadas en la primera capa sobre la matriz sólida y las que reaccionan en la segunda capa, que continúa en capas ulteriores y es responsable de la sensibilidad del ensayo.8,12
En el presente trabajo se probaron distintos tipos de placas y los resultados no mostraron diferencias marcadas entre estas. Esto puede explicarse por el uso en todas ellas de PLL, lo cual elimina el efecto directo del soporte sólido sobre la molécula de antígeno. Las placas pueden ser de diferentes materiales como cloruro de polivinilo, polipropileno y PE, entre otros. Este último es el más usado por su dureza mecánica, excelente cualidad óptica y capacidad de proporcionar enlaces estables.8,12,13
La unión de antígenos o anticuerpos a un soporte sólido puede hacerse de forma covalente o por adsorción no covalente. La unión covalente elimina la posible disociación de las moléculas fijadas y facilita su orientación adecuada, es muy útil cuando se usa un material biológico de difícil adsorción, como los ácidos nucleicos.8,14
La dificultad de adsorción del ADNdc se debe a la repulsión electrostática entre el ADNdc cargado negativamente y la carga eléctrica negativa del PE, llamada potencial z.14 Entonces la adsorción puede lograrse mediante el empleo de moléculas puentes policatiónicas como la albúmina sérica bovina, la protamina y la poli-L-lisina.8,12-14 Esta última es la más empleada en los ELISA para detectar anti-ADNdc. 5,10,15
Existen autores que reportan concentraciones muy superiores de PLL que van desde 20 hasta 50 µg/mL.5,10,16 Estas concentraciones no fueron probadas en el presente trabajo por tratarse de un reactivo muy costoso, no obstante, la concentración ensayada brindó buenos resultados para fijar la molécula de ADN.
El tratamiento de la placa con luz UV puede abaratar el costo del ensayo, al ayudar a la fijación de la molécula de ADN a la placa tratada,9,16 lo que permite prescindir de la PLL. En este aspecto los resultados difieren de los obtenidos por Zouali y Stollar (1986),9 cuando al irradiar placas de poliestireno con luz UV lograron una sensibilidad similar a la alcanzada con el prerecubrimiento con PLL; en el caso aquí estudiado las placas tratadas fueron del tipo Fluoro Nunc, Polysorp®, lo que puede explicar el resultado negativo con respecto al efecto de la luz UV sobre la fijación de la molécula de ADN, si tenemos en cuenta las especificidades de uso de esta placa especialmente para ensayos fluorescentes.
La selección de la concentración de recubrimiento de 4 µg /mL de ADN plasmídico obedece al principio de elegir la concentración con la que se alcanza la meseta de mayor señal para los sueros positivos o estándares, y la menor para los controles negativos y el blanco reactivo. Este procedimiento permite alcanzar una mayor saturación, y verificar la ocupación de los espacios libres por las propias biomoléculas de cada ensayo.8,13,14
Los resultados con el uso de los 2 tipos de ADN fueron similares, lo cual indica que cualquiera de estos puede emplearse como recubrimiento en el método ELISA. Los anti ADNdc del LES reaccionan con el ADN animal, bacteriano, viral o de plantas, lo cual en parte se debe a que reconocen epítopes del eje pentosa-fosfato presentes en el ADNdc de cualquier especie.5,11 Se escogió el ADN plasmídico como antígeno de recubrimiento porque su purificación es fácil y tiene menos implicaciones bioéticas.
En cambio, un colectivo de autores cubanos reafirma que la línea que se ha trazado en Cuba como país en vías de desarrollo es la de producir, en la medida de las posibilidades, los productos biológicos que se requieren en las técnicas analíticas; con tal finalidad, comparan un ADN (xenógeno) de timo ovino con ADN humano (alógeno) con buenos resultados para este último.16
La elección de ADN genómico humano como antígeno en los ELISA para el diagnóstico de LES no es una elección muy adecuada en comparación con moléculas de ADN plasmídico. Primeramente es más económico y factible la obtención de grandes cantidades de ADN plasmídico con un alto grado de pureza, por otra parte es una molécula circular de doble cadena de mayor estabilidad al poseer un peso molecular menor, donde la contaminación con ADNsc es menos probable. Otras de sus ventajas es su más fácil manipulación que el ADN genómico, al ser una molécula pequeña con la cual pueden lograrse soluciones mas homogéneas que cuando se trabajan purificaciones de ADN genómico, molécula altamente viscosa en solución dado su alto peso molecular, que facilita su degradación.
Uno de los últimos métodos diseñados para detectar anti-ADNdc es el EliA, método fluorescente diseñado en pocillos recubiertos con ADN circular plasmídico de E. coli, que tiene sensibilidad y especificidad comparables al ensayo Farr o CLIFT.17
Las bases nitrogenadas del ADN son hidrofóbicas, relativamente insolubles en agua cerca del pH neutro y están orientadas hacia el interior de la hélice, en tanto el eje pentosa-fosfato se dispone hacia el exterior. Los grupos fosfatos portan cargas negativas y garantizan un valor de pK'=4,0 (constante de disociación ácido-básica), lo que hace de la molécula de ADN un ácido fuerte, este polímero posee características de un polianión que atrae fuertemente iones de carga contraria presentes en aminas policatiónicas como la espermina y la PLL, las cuales se acomodan en el surco mayor de la doble hélice brindando estabilidad y haciendo a la misma más flexible.18 El pH 4,5 del citrato al estar cercano al pK' de la molécula posee mayor efecto amortiguador y brinda por consiguiente una mayor estabilidad ante posibles cambios de pH, lo cual puede explicar su comportamiento en el ensayo.
Existen diferentes criterios para definir el valor de corte. En los ELISA suele calcularse este valor como 2 o 3 desviaciones estándares por encima de la media del control negativo o fijarlo como un valor arbitrario de la absorbancia, lo cual no brinda información estadística suficiente sobre el riesgo en la sobreestimación de títulos o títulos falsos negativos. El método del valor límite mediante el cálculo de K brinda una opción adecuada y aceptable por la comunidad científica, pues permite definir un valor normalizado independiente para cada ensayo realizado.
Por otra parte, los resultados fueron positivos en el 63,6 % de los pacientes con LES. La literatura reporta la positividad de anti-ADNdc en el 60- 80 % de los enfermos19,20 o en un porcentaje menor (56 %).11
La interferencia producida por el suero de pacientes con EMTC podría deberse a la frecuente presencia de los inmunocomplejos circulantes.21 Los pacientes con insuficiencia renal crónica que usualmente están politransfundidos o se les ha transplantado previamente, presentan altos títulos de aloanticuerpos,22 lo que podría explicar el porcentaje de interferencia elevado que arrojaron en el ensayo.
Se logró la estandarización de un ELISA indirecto con el empleo de una fuente alternativa de ADN, lo que permite la sustitución de reactivos y ofrece un método para detectar anti-ADNdc en pacientes con lupus.
REFERENCIAS BIBLIOGRÁFICAS
1. Isenberg DA, Manson JJ, Ehrenstein MR, Rahman A. Fifty years of anti-ds DNA antibodies: Are we approaching journey's end? Rheum. 2007;46(7):1052- 6.
2. Rouquette AM, Desgruelles C. Detection of antibodies to dsDNA: An overview of laboratory assays. Lupus. 2006;15(7):403-7.
3. Alba P, Bertolaccini ML, Khamashta MA. The use of laboratory methods in differential diagnosis and treatment of SLE and antiphospholipid síndrome. Expt Rev Clin Immunol. 2007;3(4):613-22.
4. Launay D, Schmidt J, Lepers S, Mirault T, Lamber M, Kyndt X, et al. Comparison of the Farr radioimmunoassay, 3 commercial enzyme immunoassays and Crithidia luciliae immunofluorescence test for diagnosis and activity assessment of systemic lupus erythematosus. Clin Chim Acta. 2010;411(13-14):959-64.
5. Janyapoon K, Jivakanont P, Surbrising R, Siriprapapan W, Tachawuttiwat T, Korbsrisate S. Detection of anti-dsDNA by ELISA using different sources of antigens. Pathology. 2005;37(1):63-8.
6. Hochberg MC. Updating the American College of Rheumatology criteria for the classification of systemic lupus eryhematosus. Arthritis Rheum. 1997;40:1725.
7. Hernández O, Debesa A, Quesada L. Purificación de ADN genómico humano para el diagnóstico del lupus eritematoso sistémico. Rev Archivo Med Camaguey. 2009;13(1).
8. Ochoa RF, Martínez JC, Ferriol X, Estrada E, García AM, Blanco R, et al. Guía para la estandarización de técnicas inmunoenzimáticas en ensayos de vacunas. VacciMonitor. 2000;9(3).
9. Zouali M, Stollar D. A rapid ELISA for measurement of antibodies to nucleic acid antigens using UV-treated polystyrene microplates. J Immunol Methods. 1986;90(1):105-10.
10. Ochoa Azze RF. A new format ELISA for the detection of HBsAg. Biotecnología Aplicada. 1998;15:250-3.
11. Ghirardello A, Villalta D, Morozzi G, Afeltra A, Galeazzi M, Gerli R, et al. Evaluation of current methods for the measurement of serum anti double-stranded DNA antibodies. Ann N Y Acad Sci. 2007;1109:401-6.
12. Tijssen P. The immobilization of immunoreactants on solid phases. En: Burdon RH, van Knippenberg PH, editors. Laboratory techniques in biochemistry and molecular biology. Practice and theory of enzyme immunoassays. London: Elsevier; 1993. p. 297-328.
13. Ochoa Azze RF. Sistemas ELISA en ensayos clínicos de vacunas y estudios seroepidemiológicos [Tesis doctoral]. Instituto Superior de Ciencias Médicas de La Habana: Instituto Finlay; 2001.
14. Tijssen P. The use of plastics as solid phases. En: Burdon RH, van Knippenberg PH, editors. Laboratory techniques in biochemistry and molecular biology. Practice and theory of enzyme immunoassays. London: Elsevier; 1993. p. 123-149.
15. Radice A, Sinico RA. A new oligonucleotide-based ELISA for the detection of anti-double-stranded DNA antibodies. Autoimmunity. 2006;39(2):113-9.
16. Suárez Román G, González Griego AM, Fernández Romero T, González Ramírez VE. Determinación de anticuerpos IgG contra el ADN de doble cadena mediante ELISA utilizando como recubrimiento ADN xenógeno y alógeno. Rev Cub Invest Bioméd. 2007;26(4):22-34.
17. López-Hoyos M, Cabeza R, Martínez Taboada VM, Crespo J, Sansegundo D, Blanco R, et al. Clinical disease activity and titers of anti ds-DNA antibodies measured by an automated immunofluorescene assay in patients with systemic lupus eryhematosus. Lupus. 2005;14:505-9.
18. Nelson DL, Cox MM. Lehninger Principles of Biochemistry. 4th ed. New York: Freeman; 2004.
19. Mindlin A. Clinical utility of serum diagnostic tests for rheumatic diseases. Rev Med Brux 2007;28(4):302-7.
20. El-Chennawi FA, Mosaad YM, Habib HM, El-Degheidi T. Comparative study of antinuclear antibody detection by indirect immunofluorescence and enzyme immunoassay in lupus patients. Immunol Invest. 2009;38(8):839-50.
21. Attar SM, Koshak EA. Medical conditions associated with a positive anti-double-stranded deoxyribonucleic acid. Saudi Med J. 2010;31(7):781-7.
22. Venstrom JM, Young JW. Immunological aspects of transplantation. En: Zabriskie JB, editor. Essential Clinical Immunology. New York: Cambridge University Press; 2008. p. 331-346.
Recibido: 15 de septiembre del 2012.
Aprobado: 12 de octubre del 2012.
Dr.Cs. Oscar Hernández Betancourt. Centro de Inmunología y Productos Biológicos. Universidad de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba. Correo electrónico: ohdez@infomed.sld.cu