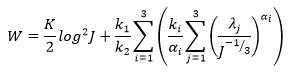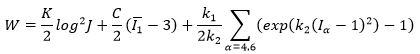Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.34 no.2 Ciudad de la Habana abr.-jun. 2015
Rev Cubana de Investigaciones Biomédicas. 2015;34(2)
ARTÍCULO ORIGINAL
El tejido blando arterial y la correlación de parámetros biomecánicos con aspectos clínicos
Arterial soft tissue and the correlation between biomechanical parameters and clinical aspects
MSc. Ernesto Camue Corona, DrC. Raide Alfonso González Carbonell, MSc. Yosbel Angel Cisneros Hidalgo, Ing. Yuri Eduardo Oropeza Rodríguez, Ing. Eduardo Osquel Pérez Rivero
Facultad de Electromecánica, Universidad de Camagüey “Ignacio Agramonte Loynaz”. Camagüey, Cuba.
RESUMEN
Introducción: las enfermedades cerebro-vasculares son frecuente en la actualidad, son las principales causas de muerte en Cuba, y en el mundo, debido a que conlleva al desarrollo de enfermedades isquémicas del corazón. Las alteraciones biomecánicas de la pared arterial constituyen manifestaciones precoces de la enfermedad aterosclerótica.
Objetivo: fundamentar la relación existente entre los parámetros biomecánicos del tejido blando arterial y los factores de riesgo de la aterosclerosis.
Métodos: se emplea la modelación biomecánica para estudiar el comportamiento de la pared vascular ante la acción de múltiples factores de riesgo.
Resultados: las tensiones tangenciales y circunferenciales en el tejido arterial se relacionan con las zonas de formación y ruptura de la placa de ateroma. La presencia de estenosis en la trayectoria de un fluido, provoca importantes cambios en la presión arterial y en las tensiones tangenciales, estimula poca resistencia a las tensiones circunferenciales.
Conclusiones: el comportamiento mecánico de la pared arterial y su nexo con los factores de riesgo muestran la complejidad de los procesos que en ella ocurren, tanto en condiciones fisiológicas como patológicas. Su caracterización provee una herramienta que posibilita la integración de estudios médicos e ingenieriles, sobre todo en las zonas de gran curvatura o bifurcaciones de las arterias.
Palabras clave: arterias, factores de riesgo, aterosclerosis, simulación biomecánica.
ABSTRACT
Introduction: cerebrovascular diseases are common conditions. They are the main cause of death both in Cuba and worldwide, since they lead to the development of ischemic heart diseases. Biomechanical alterations of the arterial wall are early manifestations of atherosclerotic heart disease.
Objective: substantiate the relationship between biomechanical parameters of arterial soft tissue and risk factors for atherosclerosis.
Methods: biomechanical modeling was used to study the behavior of the vascular wall under the action of multiple risk factors.
Results: tangential and circumferential tensions on arterial tissue are related to areas of atheroma plaque formation and rupture. The presence of stenosis along the route of a fluid leads to important changes in both arterial pressure and tangential tensions, and encourages little resistance to circumferential tensions.
Conclusions: mechanical behavior of the arterial wall and its relationship to risk factors reveal the complexity of the processes occurring therein in both physiological and pathological conditions. Its characterization constitutes a tool for the integration of medical and engineering studies, mainly about areas of great artery curvature or bifurcation.
Key words: arteries, risk factors, atherosclerosis, biomechanical simulation.
INTRODUCCIÓN
La aterosclerosis es una enfermedad cardiovascular crónica, generalizada y progresiva que afecta sobre todo a las arterias de gran y mediano calibre. Se desarrolla en la pared arterial, se produce la pérdida de elasticidad y la formación de una placa de ateroma (material lipídico, depósito de calcio y tejido conjuntivo); da lugar a la reducción del lumen arterial con el consiguiente desarrollo de eventos isquémicos en los órganos que irriga.1
En la actualidad, cada vez es más frecuente la enfermedad aterosclerótica, es una de las principales causa de muerte en Cuba, y en muchos países, debido a que conlleva al desarrollo de enfermedades isquémicas del corazón y a enfermedades cerebro-vasculares.
Según datos expuestos en el Anuario Estadístico de Salud de Cuba,2 en el año 2013 se reportan 92 270 defunciones, 2 898 más que en el 2012. El aumento de la mortalidad ocurre, en lo fundamental, en la población de 65 años y más. De las defunciones ocurridas en ese año, el 37,13 % se deben a las enfermedades cardiovasculares. Se plantea además, que la hipertensión arterial y la diabetes mellitus presentan tasas de prevalencia elevadas en la población adulta y adulta mayor; ambas patologías son factores de riesgo cardiovasculares.
La importancia social de estas enfermedades explica la necesidad, en el entorno médico y científico, por continuar con la perfección del diagnóstico clínico a partir de técnicas no invasivas, con el fin de mejorar el estado de salud de la población. En el presente trabajo se enfatiza en el comportamiento de la pared arterial ante la acción de múltiples factores de riesgo.
MÉTODOS
Se emplea la modelación biomecánica para estudiar el comportamiento de la pared vascular ante la acción de múltiples factores de riesgo. Los modelos biomecánicos están compuestos por los modelos geométricos, de carga y de material. 3 La definición del modelo biomecánico y en particular, la selección de los modelos de material influyen en la obtención de la informaciones para la predicción y diagnóstico de la aterosclerosis mediante la simulación biomecánica.
Características biomecánicas de la anatomía de la pared arterial
Desde el punto de vista microscópico, la pared arterial (o vascular) está constituida, por la elastina (fibras elásticas), el colágeno y el músculo liso (células musculares).
La elastina es una proteína muy flexible y capaz de recuperar su dimensión original después de sufrir deformaciones, incluso mayores del 50 %. El colágeno es un componente estructural para los tejidos blandos y duros, aportándole integridad y resistencia mecánica. El músculo liso presenta como principal función la de producir una tensión activa, independiente de la deformación aplicada, al contrario de la elastina y del colágeno que producen una tensión proporcional a la deformación;4 se encuentra ligado a la conducta viscosa de la pared arterial, evita que esta sea tan distensible como la elastina y tan rígida como el colágeno.
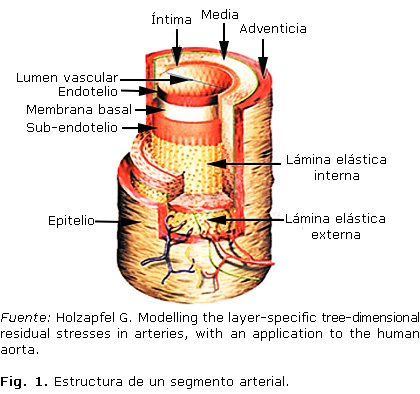
Desde el punto de vista macroscópico, la pared arterial está formada por tres capas (túnicas) diferenciables: una capa íntima, en relación con la sangre, una capa adventicia en contacto con tejidos vecinos, y ambas limitan una capa media (Fig. 1).
La túnica íntima es la capa interior de la pared arterial formada por el endotelio, membrana basal y el tejido conjuntivo subendotelial. Contiene fibras de colágeno y elásticas; se encuentra sometida a la tensión tangencial que ejerce el flujo sanguíneo, y tiene la función de filtro selectivo que deja pasar gases, fluidos y moléculas hacia y desde la sangre.5 En la túnica media se encuentran unidades laminares elásticas, proteoglicanos, músculo liso y fibras colágenas, es la principal responsable de las propiedades mecánicas de la pared arterial.6 Al finalizar, la túnica externa o adventicia es de tejido conjuntivo, con menor cantidad de fibras elásticas y más de colágeno que las observadas en las túnicas anteriores; sirve como anclaje del vaso a los tejidos que lo rodean.
En cuanto a las cargas que se encuentra sometido el tejido arterial, es la presión la más importante transmitida por el flujo sanguíneo, varía a lo largo del sistema cardiovascular, alcanza sus valores más elevados a la salida del ventrículo izquierdo del corazón. La presión en las arterias sigue el pulso del corazón, y en un hombre sano oscila entre 80 y 120 mmHg.
Modelos de material para describir el comportamiento biomecánico parietal
Existen diferentes ecuaciones que se utilizan para modelar la respuesta mecánica de un material, de acuerdo con su comportamiento. Los modelos se obtienen mediante mediciones experimentales que se ajustan a la respectiva relación de tensiones y deformaciones. Una ecuación constitutiva es aquella que establece una relación entre dos magnitudes físicas de un material, permite especificar su respuesta a fuerzas externas.6
La primera ecuación constitutiva fue desarrollada por Robert Hooke para describir el comportamiento de algunos materiales elásticos, es decir, materiales con capacidades para recuperar sus dimensiones originales después de retirar las cargas que produjeron en él las deformaciones. El resto de los materiales se definen por exclusión como inelásticos.
En los materiales elásticos, la ecuación constitutiva (Ley de Hooke) puede escribirse como una función lineal entre las tensiones y las deformaciones, ya que las tensiones dependen solo de la deformación en la configuración instantánea, y no de la historia de deformaciones sufrida por el cuerpo (ecuación 1).
Donde Cijkl es tensor de constantes elásticas. El modelo elástico lineal solo es válido para pequeñas deformaciones elásticas, que por lo general corresponde a valores de menos de 5 %, y pequeñas rotaciones. Es el modelo de material más difundido en la mayoría de los análisis biomecánicos.
Una división alternativa de los materiales es clasificarlos en isótropos y anisótropos. La isotropía se caracteriza por una igualdad en el comportamiento en cualquier dirección del espacio. En cambio, los sólidos anisótropos tienen al menos una dirección de comportamiento diferente. Si se supone que el material elástico es isótropo, el tensor Cijkl se puede simplificar y el sólido se define por la ecuación 2.
Aquí, E y son el módulo de Young y el coeficiente de Poisson, en orden. Estos valores también se pueden definir en términos de las constantes de Lamé λ y μ, el módulo de elasticidad tangencial (G) o el módulo de compresibilidad o volumétrico (K), como se muestra en la ecuación 3.
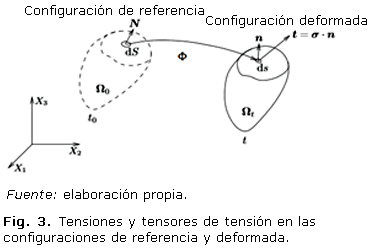
Para describir los materiales que presentan comportamiento elástico, bajo grandes deformaciones, se emplean modelos de hiperelasticidad.7 Estos constituyen la base de modelos de materiales complejos, que incluye fenómenos como la viscoelasticidad y el daño tisular. La ecuación constitutiva de estos materiales se reduce, entonces, a buscar su función de densidad de energía (W). De ahí que es necesario determinar las expresiones correspondientes a los tensores de deformación y de tensión (Fig. 2).
Si se denota con Φ la función que lleva los puntos materiales X en la posición de referencia a la posición actual x se tiene que fórmula 1 (véase figura 2).
El tensor gradiente de deformación F se define como: (ecuación 4)
Este tensor cuantifica el cambio en la forma de elementos infinitesimales en un cuerpo sólido; sus componentes, con respecto a bases ortonormales, se pueden escribir como: (ecuación 5)
El determinante del gradiente de deformación Jacobiano J relaciona los cambios de volúmenes debido a la deformación y está solo relacionado con la definición de un material incompresible:(ecuación 6)
Donde λ1, λ2 y λ3 son los alargamientos principales. Obvio, debe ser det F>0. Una deformación sin cambios en volumen –por ejemplo, en un material incompresible- implica que J=1.8
Con objeto de dar medidas de la deformación del material independientes del sistema de referencia, esto es, medidas objetivas de la deformación; se definen los tensores de Cauchy-Green por la derecha y por la izquierda.9
Tensor de Cauchy-Green por la derecha: (ecuación 7)
Tensor de Cauchy-Green por la izquierda: (ecuación 8)
Otras medidas de la deformación, son las dadas por el tensor de Green E y por el tensor de Almansi e: (ecuación 9)
Las tensiones indican las fuerzas por unidad de superficie en el material, escribiéndose fórmula 2 en la configuración deformada, donde f indica la fuerza aplicada sobre una superficie de tamaño s que tiene un vector tensión asociado t (Fig. 3).
El teorema de Cauchy asegura la existencia de un tensor único, llamado tensor de tensiones de Cauchy (denotado con σ) tal que fórmula 3, es n el vector normal a la superficie que tiene asociada la tensión t. Además, las ecuaciones de equilibrio de momentos arrojan que es simétrico.
El primer tensor de Piola-Kirchhoff, P es: (ecuación 10)
Este tensor verifica que: (ecuación 11)
Son N y S el vector normal y la superficie en la configuración inicial.
En el tensor de Kirchhoff, τ se define como fórmula 4 y el segundo tensor De Piola-Kirchhoff, S es: (ecuación 12)
El estudio de configuraciones con comportamiento no lineal exige, en lo general, una aproximación numérica al dificultarse el planteamiento analítico. Este proceso se facilita al reiterar sobre las ecuaciones linealizadas que describen el problema. En particular, en la configuración inicial se busca un cierto tensor C, denominado tensor de elasticidad respecto a la configuración inicial, tal que se obtenga la linealización (para incrementos pequeños) (ecuación 13).
Se ha utilizado la definición de E dada en ecuación 9, y ∆ representa un incremento infinitesimal y ∇, como es usual, el operador gradiente.
Un material se dice que es hiperelástico si su densidad de energía libre es función exclusiva de su estado de deformación, 10 por lo que su ecuación constitutiva se deriva de una función analítica de la densidad de energía de deformación (Ψ) con respecto al tensor gradiente de deformación (Fij).
En estas condiciones, dada la independencia de la energía a los procesos térmicos y la imposibilidad del aumento de la entropía; el aumento de la energía libre dΨ es equivalente al aumento de la energía interna dE, esta última es provocada por el trabajo realizado por las fuerzas internas dW que depende solo del estado de deformación del sólido.11 De aquí se tiene que el aumento de energía libre es igual al trabajo realizado por las fuerzas internas (ecuación 14).
La energía de deformación se puede definir en términos de los invariantes (I1, I2, I3) del tensor de deformación de Cauchy-Green Izquierdo (B), los invariantes alternativos fórmula 5 de B, o en términos de los alargamientos principales (λ1, λ2, λ3) (ecuación 15 y 16) como se muestra en la ecuación 4.
Además, W está relacionada con el tensor de esfuerzos de Cauchy (σij) para modelar el comportamiento de un material hiperelástico (ecuación 5 y 17).
Algunas expresiones de W consideran parámetros que se derivan del comportamiento del material, para el caso límite de pequeñas deformaciones, concreto en función del módulo de elasticidad E, del coeficiente de Poisson , las constantes de Lamé λ y μ y los módulos volumétrico K y tangencial G. En función de estos parámetros, algunos de los modelos hiperelásticos isótropos más utilizados en la literatura son las siguientes:
Neohookeano: (fórmula 6)
Mooney Rivlin: (fórmula 7)
Modelo Ogden:( fórmula 8)
Son ki y αi constantes del material.
Uno de los primeros modelos constitutivos para el comportamiento mecánico de materiales blandos fue propuesto por Fung, 12 que utilizó dos leyes hiperelásticas exponenciales para representar el comportamiento en carga y descarga. Humphrey13 presentó una formulación constitutiva que tenía en cuenta la microestructura del material, modelizado como un material compuesto por varias familias de fibras independientes embebidas en una matriz.
Holzapfel, 14 desarrollaron un modelo anisótropo, basándose en la composición y estructura de la pared vascular. En él, cada capa de la pared arterial (media y adventicia) se representa por un material compuesto, por una matriz y dos familias de fibras de colágeno diferentes. La expresión de la función de densidad de energía de dicho modelo es de la forma: (fórmula 9)
Donde c, k1y k2 son parámetros del material. En este caso, la función de densidad de energía crece exponencialmente con los pseudo-invariantes de anisotropía, ajustándose al proceso de rigidización que se ha comentado.
RESULTADOS
Los resultados biomecánicos fundamentales para describir el comportamiento de la pared arterial se basan en la determinación de los estados de tensión y deformación. Dentro de estos, las tensiones circunferenciales y tangenciales actuantes en la pared del vaso, son de suma importancia para aportar datos cuantitativos que permitan a la ciencia médica revisar las teorías existentes sobre las patologías vasculares.
Las tensiones tangenciales y circunferenciales se relacionan con las zonas de formación y ruptura de la placa de ateroma, alterando las propiedades de las células musculares presentes en la capa media que, en determinadas circunstancias, pueden atrapar lípidos y emigrar hacia el endotelio para constituirse en la placa ateromatosa. La presencia de estenosis en la trayectoria de un fluido provoca importantes cambios en la presión arterial y en las tensiones tangenciales, afecta la tromborresistencia de las células endoteliales, un núcleo lípido de una placa, cuando su tamaño es considerable, soporta muy poco las tensiones circunferenciales; por lo que se requiere de menores tensiones para provocar la ruptura, y niveles elevados de glucosa afectan las propiedades del fluido, predisponiendo a fenómenos trombóticos y vasoconstrictores.
La hipertensión arterial, la diabetes mellitus y la hipercolesterolemia modifican la geometría y microestructura de la pared vascular, así como el metabolismo de las células endoteliales. En consecuencia, alteran el comportamiento mecánico de sus túnicas y constituyentes.
DISCUSIÓN
Los factores de riesgo están constituidos por cualquier hábito o característica biológica que sirva para predecir la probabilidad de un individuo, de desarrollar una enfermedad cardiovascular. La existencia de un factor de riesgo no implica obligatorio una relación causa-efecto con la enfermedad. Su conocimiento y detección desempeña un importante papel para la valoración del riesgo cardiovascular.1
La presencia de factores de riesgo cardiovascular (hipercolesterolemia, hipertensión arterial, diabetes mellitus, etc.) representa un estímulo aterogénico sobre la pared arterial, que inicia diversos procesos relacionados con la disfunción endotelial y la respuesta inflamatoria, los cuales desencadenarán en el desarrollo de la arteriosclerosis.
La hipertensión arterial (HA) es una enfermedad crónica caracterizada por un incremento continuo de las cifras de la presión sanguínea en las arterias, constituye el antecedente más importante de la insuficiencia cardíaca, es el principal factor de riesgo de la aterosclerosis.11
Los valores de presión arterial, tanto sistólicos como diastólicos, se relacionan con la incidencia de accidentes cerebrovasculares y enfermedad coronaria. La hipertensión arterial, de manera silente, produce cambios en el flujo sanguíneo, a nivel macro y microvascular, causados a su vez por disfunción de la túnica íntima y el remodelado de la pared de las arteriolas de resistencia, que son las responsables de mantener el tono vascular periférico. Muchos de estos cambios anteceden en el tiempo a la elevación de la presión arterial y producen lesiones orgánicas específicas.
Por su parte, la diabetes mellitus se asocia con un elevado riesgo de cardiopatía isquémica y enfermedad arterial periférica, independiente de que la persona sea insulinodependiente o no. Este factor afecta tanto a las grandes arterias, y provoca aterosclerosis, como a los pequeños vasos sanguíneos, hemorragias en los ojos y extremidades, incluso en el cerebro.
Una condición primordial involucrada en la génesis de la enfermedad vascular del paciente diabético es la inestabilidad de los niveles de glucosa sanguínea. Este tipo de paciente presentan un aumento de factores de la coagulación (fibrinógeno, factor VII) y una fibrinólisis disminuida (aumento de los niveles del inhibidor del activador del plasminógeno tipo 1), asociada a un aumento de la adhesividad y agregación plaquetarias, todo lo cual predispone a la trombosis.15
La participación de la célula muscular lisa en presencia de la diabetes está dada, por una alteración en el equilibrio entre los mecanismos relajadores dados por el endotelio y la estimulación simpática con efecto vasoconstrictor.16
Otro factor importante en el desarrollo de la aterosclerosis, es la hipercolesterolemia. El riesgo atribuido a esta patología, es debido a lipoproteínas de baja densidad (LDL). Cuando las células son incapaces de absorber todo el colesterol que circula por la sangre, el sobrante se deposita en la pared de la arteria y contribuye a su progresivo estrechamiento, origina la arterosclerosis.
Las propiedades mecánicas del núcleo lipídico de la placa de ateroma pueden influenciar la distribución de las tensiones en el vaso enfermo cuando su tamaño es considerable. El núcleo lipídico soporta muy poco las tensiones circunferenciales, por lo que éste se concentra en la capa fibrosa.
El tejido arterial se considera como un biomaterial con un comportamiento biomecánico complejo, depende de la concentración, disposición y propiedades mecánicas de sus constituyentes. La morfología particular de su pared le permite resistir las altas presiones generadas dentro del sistema circulatorio, y conservar la presión necesaria para que la sangre llegue a todos los extremos de este sistema, regula las relaciones presión-flujo y tensión-deformación.17
La pared arterial es heterogénea, cada capa presenta una propiedad mecánica diferente. Si se trata de vasos enfermos, la heterogeneidad de la pared se confirma, puesto que aparecen zonas calcificadas con adherencias o de diferente densidad, cuyo comportamiento mecánico es desigual.
Las propiedades mecánicas de la pared vascular son dependientes de la dirección del estado de tensión aplicado. Por su similitud con un material reforzado con fibras, en lo habitual, se le considera como un material anisótropo, o sea, un material con propiedades variables según la dirección en que se mide.
Una de las hipótesis usual aceptada, es el comportamiento isocórico (deformación sin cambio de volumen) de la pared arterial. Esto puede explicarse por el hecho de que los tejidos que la componen contienen cantidades importantes de agua, entre el 70 % y 80% de su peso. Por ello, es frecuente considerar el material de dicha pared como incompresible.8
La respuesta mecánica de la pared arterial, también varía en función de la velocidad y duración de la carga aplicada (comportamiento reológico), y de si ésta es monótona o cíclica. Este comportamiento es responsable, fundamental, de los cambios rápidos de dimensiones, de la impedancia impuesta al flujo de sangre por las arterias y de la función de amortiguación de las ondas de presión que se propagan por ella.
Además, de la tensión elástica ejercida por la pared vascular y la tensión activa generada por el músculo liso, se debe considerar las tensiones tangenciales que genera el flujo axial, las que dependen de su pulsatilidad, velocidad y turbulencia, así como también de las condiciones de la pared y del fluido (estado del endotelio, densidad y viscosidad de la sangre, entre otras).
Asimismo, la interacción entre los tejidos que forman a la pared vascular da lugar al desarrollo de tensiones residuales circunferenciales que se suman al estado tensional producido por el alargamiento axial in vivo y la solicitación producida por el flujo sanguíneo.8
Otro aspecto importante, reflejo de la situación antes descrita, es que la geometría del árbol vascular y las condiciones reológicas del flujo sanguíneo provocan alteraciones de la dinámica de los fluidos que demandan adaptaciones constantes de la pared vascular. La observación de que las lesiones ateroscleróticas se desarrollan con mayor frecuencia en regiones de bifurcación de los vasos y las alteraciones del flujo que allí se producen, permitieron relacionar a las fuerzas biomecánicas, en especial la tensión tangencial, con el origen y la progresión de la aterosclerosis.18
De esta investigación se puede sintetizar algunos ejemplos que fundamentan la relación existente entre los parámetros biomecánicos analizados y los tres factores de riesgo de la aterosclerosis: las tensiones tangenciales y circunferenciales se relacionan con las zonas de formación y ruptura de la placa de ateroma, alterando las propiedades de las células musculares que, en determinadas circunstancias, pueden atrapar lípidos y emigrar hacia el endotelio para constituirse en la placa ateromatosa. La presencia de estenosis en la trayectoria de un fluido provoca importantes cambios en la presión arterial y en las tensiones tangenciales, afecta la tromborresistencia de las células endoteliales, un núcleo lípido de una placa, cuando su tamaño es considerable, soporta muy poco las tensiones circunferenciales; por lo que se requiere de menores tensiones para provocar la ruptura, y niveles elevados de glucosa afectan las propiedades del fluido, predisponiendo a fenómenos trombóticos y vasoconstrictores.
Dentro de este panorama, la interpretación apropiada de los estados de tensión y deformación en relación con algunos parámetros hemodinámicos como la presión, perfil de velocidad, densidad, y otros geométricos como el espesor y grado de estenosis de la pared será fundamental para evaluar, en etapas tempranas, las alteraciones en las funciones de conducto y de amortiguamiento de las arterias de gran calibre. Esta evaluación se reforzaría si se tiene en cuenta además, el comportamiento de eritrocitos, leucocitos y plaquetas y nivel de glucosa, obtenidos por análisis de sangre.
Se ha podido corroborar que el pilar fundamental sobre el que se fundamenta el origen de la aterosclerosis es la disfunción endotelial. Sin embargo, su aparición y progresión no está asociada a una sola causa. Por el contrario, son el resultado de una combinación compleja de factores biológicos, químicos y mecánicos, íntimos en relación con los de riesgo, y en determinados casos, con los genéticos y ambientales.
La hipertensión arterial, la diabetes mellitus y la hipercolesterolemia modifican la geometría y microestructura de la pared vascular, así como el metabolismo de las células endoteliales. En consecuencia, alteran el comportamiento mecánico de sus túnicas y constituyentes.
Los modelos constitutivos de materiales que han sido descritos resultan ser adecuados para la simulación biomecánica de las paredes de arterias de gran calibre, los que han sido implementados en diversos programas de elementos finitos (ANSYS, ABAQUS, etc.) empleados para la simulación biomecánica de la pared arterial. Es importante ajustar las expresiones constitutivas a las curvas de la arteria sana y la arteria dañada por medio de los parámetros libres en dichas expresiones.
A modo de conclusión se puede plantear que el comportamiento mecánico de la pared arterial y su nexo con los factores de riesgo, muestran la complejidad de los procesos que en ella ocurren tanto en condiciones fisiológicas como patológicas. Dicha caracterización provee una herramienta que posibilita la integración de estudios médicos e ingenieriles para, posterior, aplicarlos en un modelo matemático, con el cual se pueden realizar distintas simulaciones biomecánicas, sobre todo en las zonas de gran curvatura o bifurcaciones de las arterias. Las ecuaciones constitutivas elásticas e hiperelásticas han sido utilizadas para la simulación de las arterias de gran calibre.
REFERENCIAS BIBLIOGRÁFICAS
1. Lahoz Mostaza JMM. La aterosclerosis como enfermedad sistémica. Rev Esp Cardiol. 2007;60(2):184-95.
2. Anuario Estadístico de Salud 2013. MINISTERIO DE SALUD PÚBLICA; 2014. p. 189.
3. González Carbonell RA, Nápoles Padrón E, Calderín Pérez B, Cisneros Hidalgo Y, Landín Sorí M. Carácter interdisciplinario de la modelación computacional en la solución de problemas de salud. Humanidades Médicas. 2014 Jul;14(3):646-58.
4. Holzapfel GA, Ogden RW. Modelling the layer-specific three-dimensional residual stresses in arteries, with an application to the human aorta. J R Soc Interface. 2010 May;7(46):787-99.
5. Tsamis A, Krawiec JT, Vorp DA. Elastin and collagen fibre microstructure of the human aorta in ageing and disease: a review. J R Soc Interface. 2013 Jun;10(83):20121004.
6. Apolinar G, Andrés J. Análisis de inestabilidades en materiales reforzados bidireccionalmente con aplicación en la biomecánica: la formación de aneurismas [Tesis de Maestría]. Madrid: Escuela Técnica Superior de Ingenieros de Caminos, Canales y Puertos (UPM); 2012.
7. Bustamante R, Holzapfel GA. Methods to compute 3D residual stress distributions in hyperelastic tubes with application to arterial walls. Int J Eng Sci. 2010 Nov;48(11):1066-82.
8. Claes E. Estudio mecánico de las arterias coronarias humanas y sus sustitutos vasculares [Tesis de doctorado]. Madrid: Escuela Técnica Superior de Ingenieros de Caminos, Canales y Puertos (UPM); 2010.
9. Isaza López JA. Comportamiento mecánico de tejidos blandos tipo multicapa [Tesis de Maestría]. Medellín: Universidad Nacional de Colombia; 2013.
10. González R, Álvarez E. Modelos de materiales hiperelásticos para el análisis de los elastómeros usando el MEF. Ingeniería Mecánica. 2009 Sept;12(3):57-66.
11. Fischer E, Cabrera I. Biomecánica de la hipertensión arterial. Rev Argent Cardiol. 2004 Abr;72(2):150-6.
12. Fung Y, Fronek K, Patitucci P. Pseudoelasticity of arteries and the choice of its mathematical expression. Am J Physiol: Heart Circ Physiol. 1979;237(5):H620-H31.
13. Humphrey JD, Yin FC. A new constitutive formulation for characterizing the mechanical behavior of soft tissues. Biophys J. 1987;52(4):563-70.
14. Holzapfel GA, Gasser TC, Ogden RW. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of elasticity and the physical science of solids. 2000;61(1-3):1-48.
15. Vinik AI, Erbas T, Park TS, Nolan R, Pittenger GL. Platelet dysfunction in type 2 diabetes. Diabetes care. 2001 Ago;24(8):1476-85.
16. Rodrigo JA, Galleguillos OI. Diabetes y Enfermedad Vascular Periférica. Rev Med Clin Condes. 2009;20(5):687-97.
17. Calvo Plaza FJ. Simulación del flujo sanguíneo y su interacción con la pared arterial mediante modelos de elementos finitos [Tesis de doctorado]. Madrid: Escuela Técnica Superior de Ingenieros de Caminos, Canales y Puertos (UPM); 2006.
18. Bandieri JD. Influencia de los factores reológicos y biomecánicos en la aterosclerosis y la reestenosis. Parte I. Rev Argent Cardiol. 1997 May;65(3):287-95.
Recibido: 23 de febrero de 2015.
Aprobado: 20 de marzo de 2015.
Ernesto Camue Corona. Grupo de Biomecánica, Facultad de Electromecánica, Universidad de Camagüey “Ignacio Agramonte Loynaz”. Carretera Circunvalación Norte, entre Avenida Ignacio Agramonte y Camino Viejo de Nuevitas. Camagüey, Cuba.
Correo electrónico: ernesto.camue@reduc.edu.cu