Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.35 no.1 Ciudad de la Habana ene.-mar. 2016
Rev Cubana de Investigaciones Biomédicas. 2016;35(1)
ARTÍCULO DE REVISIÓN
Seguridad e inmunogenicidad en ensayos clínicos de vacunas para Dengue
Safety and immunogenicity in clinical trials of dengue vaccines
Janeth Catalina Reyes Castaño,I Jaiberth Antonio Cardona-Arias,II Juan Álvaro López,III Marlen Martinez-GutierrezI
I Grupo de Investigación en Ciencias Animales-GRICA. Facultad de Medicina Veterinaria y Zootecnia. Universidad Cooperativa de Colombia. Bucaramanga, Colombia.
II Grupo OLISTICA. Facultad de Medicina. Universidad Cooperativa de Colombia. Medellín, Colombia.
III Grupo de Inmunodeficiencias Primarias. Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: uno de los obstáculos para el licenciamiento de una vacuna para Dengue es la variabilidad de los estudios, lo que dificulta su análisis en conjunto para llegar a conclusiones confiables.
Objetivos: desarrollar una revisión sistemática de literatura para analizar la seguridad e inmunogenicidad de las diferentes vacunas para Dengue
Métodos: la búsqueda de información fue realizada en Cochrane Library, Scopus, Science Direct, PubMed, Nature, Lilacs y OvidSp por metodología de cosecha de perlas de acuerdo a los criterios de inclusión.
Resultados: se seleccionaron 42 artículos. Los principales síntomas reportados en los estudios incluyeron eritema, dolor y sensibilidad. Se encontró gran discrepancia en cuanto a la definición de seropositividad y gran variabilidad en relación a los Títulos de Media Geométrica reportados en cada estudio.
Conclusiones: se encontró una gran variabilidad en los estudios en relación a diseño y reporte de datos de seguridad e inmunogenicidad.
Palabras clave: DENV; vacuna; seguridad; inmunogenicidad; dengue.
ABSTRACT
Introduction: One of the obstacles for the licensing of a dengue vaccine is the variability of studies, which hampers their joint analysis to reach reliable conclusions.
Objectives: Perform a systematic literature review aimed at analyzing the safety and immunogenicity of the various dengue vaccines
Methods: Information was searched for in Cochrane Library, Scopus, Science Direct, PubMed, Nature, Lilacs and OvidSp, based on pearl harvest methodology in keeping with the inclusion criteria.
Results: Forty-two papers were selected. The main symptoms reported in the studies included erythema, pain and tenderness. Great discrepancy was found in the definition of seropositivity, as well as great variability in the geometric mean titers reported by each study.
Conclusions: Studies showed great variability concerning the design and report of safety and immunogenicity data.
Key words: DENV; vaccine; safety; immunogenicity; dengue.
INTRODUCCIÓN
El Dengue es producido por el Virus Dengue (DENV), virus que pertenece a la familia Flaviviridae, género Flavivirus y el cual es transmitido por mosquitos hematófagos del género Aedes, son los más frecuentes Aedes aegypti y Aedes albopictus. De forma estructural el DENV mide alrededor de 50 nm, posee una simetría icosahédrica y una envoltura lipídica. Su genoma es un Ácido Ribonucleico (RNA) de cadena sencilla y sentido positivo, el cual codifica para tres proteínas estructurales (entre ellas las proteína M y E, consideradas como sus mayores determinantes antigénicos) y siete no estructurales (NS1, NS2A, NS2b, NS3, NS4A, NS4b, NS5).1-3 Aunque en general se habla de la existencia de cuatro serotipos en el ciclo urbano de trasmisión viral (DENV-1 a DENV-4) los cuales son relacionados pero en su genética distintos.4 Recién se ha reportado la existencia de un quinto serotipo (DENV-5) que realiza un ciclo de trasmisión selvático.5 Aunque la prevalencia exacta de la enfermedad es desconocida, debido a las deficiencias en los sistemas de diagnóstico, vigilancia y reporte, se estima que a nivel mundial 100 países son endémicos y que ocurren entre 50 y 100 millones de infecciones cada año en el mundo, con un aproximado de 120 millones de viajeros expuestos a la infección cada año. Esto hace que más de 500.000 personas sean hospitalizadas en el mundo por padecer la enfermedad, lo que genera un gran impacto económico. Además, el 5 % de los casos llegan a ser mortales, por lo general, en menores de 15 años.6-8
La enfermedad causada por cualquiera de los primeros cuatro serotipos, ha sido clasificada por la Organización Mundial de la Salud (OMS) en dengue grave y no grave (con o sin signos de alarma).9 Esta clasificación facilita la toma de decisiones clínicas, la notificación al sistema de vigilancia epidemiológica y sirve como una medida final en los ensayos de medicamentos y vacunas para dengue.9,10 También se usa para categorizar de manera adecuada, la fisiopatología de la inmunopatogénesis en los ensayos de vacunas, con la dificultad de solo poder ser usada en la comparación de estudios de vacunas realizados antes del 2009, por las diferencias conceptuales entre la antigua y la actual clasificación.11
El Dengue puede controlarse de tres maneras:
- La primera involucra todas las estrategias disponibles para erradicar el mosquito vector. Aunque es una forma de control efectiva, la resistencia a los insecticidas ha disminuido su efectividad.12
- Lla segunda forma de control involucra el uso de fármacos para el tratamiento de la enfermedad. Aunque en los últimos años se ha aumentado el número de investigaciones que evalúan compuestos con actividad antiviral para este virus, hasta el momento ninguno de ellos se ha empezado a usar en humanos.13
- La tercera estrategia involucra la vacunación, sin embargo, a la fecha no hay ninguna vacuna licenciada.14
Aunque es necesario tener una vacuna licenciada para prevenir el dengue, la dificultad para su desarrollo se debe a varios factores; entre los que se encuentran:
- La cocirculación de los cuatro serotipos del DENV en regiones endémicas.
- El complejo entendimiento de la respuesta inmunoprotectora o inmunopatogénica post-vacunación (lo cual podría desencadenar el fenómeno conocido como Potenciación Dependiente de Anticuerpos, responsable en gran parte del desarrollo de dengue grave).
- El incompleto conocimiento de la biología del virus (pues podría generarse el mecanismo conocido como interferencia viral, llevar a la replicación más eficiente de alguno de los serotipos virales en individuos vacunados).11,15
A pesar de estas dificultades, posibles candidatos de vacunas se encuentran en fase de desarrollo preclínica o clínica. Estos candidatos pueden ser de dos tipos de formulaciones: monovalentes (biológico que solo contiene un serotipo del DENV) y tetravalentes (biológico que contiene los cuatro serotipos virales). Además del tipo de formulación, estos candidatos se pueden clasificar de forma general en cinco grupos:
1. Vacunas vivas atenuadas, por pasaje celular serial y mutagénesis directa; que incluye la deleción de 30 nucleótidos en la región 3’ UTR, o por la inserción de las regiones PrM y E en una cepa de la vacuna del Virus de Fiebre Amarilla o en una cepa atenuada de DENV.
2. Vacunas purificadas inactivadas.
3. Vacunas de subunidades recombinantes.
4. Vacunas basadas en vectores virales.
5. Vacunas de Ácido Desoxriribonucleico (DNA).11
Por otro lado, la mayoría de los estudios de desarrollo y evaluación de vacunas, presentan importantes diferencias en el diseño metodológico. Entre ellas se encuentran el tamaño de la población, las características demográficas de los participantes incluidos, el estatus inmune (infección previa o exposición previa a flavivirus) de los mismos, entre otros. Igual se observan diferencias en las metodologías empleadas para evaluar la respuesta a la vacunación; y diferencias en la manera de reportar los eventos adversos (seguridad) y los resultados de la respuesta inmune (inmunogenicidad), que dificulta una comparación entre los estudios.16
Describir las variaciones de los ensayos clínicos que se han publicado permitirá entender qué parámetros se han evaluado y cuáles podrían estar más asociados con la vacunación. Por esta razón se realiza una revisión sistemática que permite describir las características de los ensayos clínicos; entre los que se incluye el diseño del estudio, tipo de vacuna, características de la población, además de los parámetros que se han empleado para evaluar la seguridad y la inmunogenicidad de las diferentes vacunas para dengue. Los resultados obtenidos, a su vez podrían ser de gran utilidad a los investigadores que inicien el desarrollo de ensayos clínicos de dengue, pues podrían darles pautas sobre que parámetros a evaluar y que hayan sido empleados con anterioridad, cuál sería la forma más apropiada de diseñar sus ensayos clínicos, cómo deben ser reportados los resultados, entre otros aspectos, de modo que en un futuro estos estudios puedan ser comparados. Además, debido a que las revisiones sistemáticas permiten obtener conclusiones menos sesgadas, este trabajo permite describir las características y resultados de los estudios realizados, con lo que se pretende tener mayor evidencia de cómo se realizan los ensayos clínicos de vacunas para dengue, y derivado de esto, identificar cuál es posible la mejor vacuna.
MÉTODOS
TIPO DE ESTUDIO
Revisión sistemática. La elaboración del protocolo se realizó por la guía PRISMA17,18 y la guía de la OMS de vacunas para dengue.19
Búsqueda de literatura
La búsqueda se realizó entre junio y el 20 de diciembre de 2014, por dos investigadores de forma independiente para garantizar la reproducibilidad. Las discrepancias se resolvieron por consenso. Se incluyeron todos los artículos publicados hasta junio de 2014 en: Cochrane Library, Scopus, Science Direct, PubMed, Nature, Lilacs y OvisSp; sin restricción de idioma, ni de fecha de publicación. Sin embargo, solo se incluyeron estudios con texto completo, para garantizar la obtención de toda la información necesaria para el estudio. Además de la búsqueda sistematizada en estas bases de datos, una búsqueda manual también se llevó a cabo, para poder incluir diferentes estudios clínicos, que fueron citados en los artículos obtenidos por la revisión sistemática. Se realizaron tres estrategias de búsqueda las cuales incluyeron el término Dengue que fue considerado como término principal, unido mediante el conector booleano AND al término Seguridad en la primera estrategia, Inmunogenicidad en la segunda y Vacunación en la tercera. Tanto al término principal, como a los tres términos que se conjugaron con él, se les buscaron diferentes sinónimos o términos relacionados a través del método de cosecha de perlas y por la búsqueda en tesauros como MESH y DECS. Cada palabra sinónima o relacionada se unió mediante el conector booleano OR. Para el término Denguese emplearon 7 términos relacionados, para el término Seguridad también se usaron siete términos relacionados, para el término Inmunogenicidad, se emplearon 28 términos relacionados y para el término Vacunación se emplearon 22 términos relacionados.
Todos los artículos fueron organizados en el programa Mendeley y aquellos duplicados fueron identificados y eliminados. Para cada artículo la extracción de información se realizó en un archivo plano de Excel, que incluyó los datos generales del estudio, número de voluntarios y edad de la población, zona donde se realizó el ensayo clínico, tipo de vacuna, vacuna evaluada y casa farmacéutica que financia el estudio. El principal parámetro de inmunogenicidad que se tuvo en cuenta fueron los Títulos de Media Geométrica (GMT) y la tasa de seropositividad, sin ser considerado criterio de exclusión el no reportar cualquiera de los dos parámetros ya que esto permite describir las diferencias en el diseño de estudios. El reporte de seguridad se entiende como síntomas locales o sistémicos.
CRITERIOS DE INCLUSIÓN Y DE EXCLUSIÓN
Los estudios elegibles en su inicio deberían incluir tanto en su título como resumen alguno de los términos de la estrategia de búsqueda los cuales fueron seleccionados con base en PICO. Esta estrategia permitió identificar que eran ensayos clínicos y que eran de vacunación para dengue. En una segunda revisión se incluyó todo tipo de ensayo clínico (controlado, no controlado, aleatorizado o no aleatorizado), independiente de las características demográficas de los voluntarios (como edad y género) y de la región donde se realizaron los estudios (endémica/no endémica). En cuanto a la intervención o el tratamiento que recibieron los voluntarios, los estudios incluidos podían evaluar cualquier tipo de formulación (tetravalente/monovalente), usar cualquier tipo de vacuna (según la clasificación explicada antes), diferente calendario de vacunación (intervalos de los refuerzos), dosis, o cualquier vía de administración. En relación a los resultados, los estudios incluidos debían reportar parámetros de seguridad/reactogenicidad (se difernció entre efectos locales y sistémicos) y parámetros de inmunogenicidad (seropositividad, tasa de seropositividad, seroconversión) además de los GMT como indicador de eficacia de la vacunación. El año de publicación de los estudios no fue tomado en cuenta ya que la estrategia de búsqueda no tuvo restricciones en cuanto al tiempo ni el idioma con el fin de garantizar mayor exhaustividad de la misma.
Los criterios de exclusión que se tuvieron en cuenta para la eliminación de artículos fueron los siguientes:
- Ensayos clínicos de vacunación que solo evaluaron producción de citoquinas o respuesta de células T y no midieran GMT.
- Ensayos clínicos que evaluaron la respuesta a la inoculación de cepas virales para evaluar infección después de haber recibido un candidato de vacuna.
- Estudios derivados de un ensayo clínico en los cuales evaluaron la respuesta inmune celular con el fin de justificar la reactogenicidad de una vacuna.
- Ensayos clínicos en los cuales solo se aplicaron refuerzos vacunales, estudios de costos de vacunación y estudios de respuesta inmune no asociados a vacunación.
RECOLECCIÓN DE DATOS
Para la selección de los estudios, todos los artículos fueron organizados en el programa Mendeley y aquellos duplicados fueron identificados y eliminados. Después para garantizar la reproducibilidad en la selección de los artículos, dos autores revisaron los artículos seleccionados por título y resumen y eliminaron los que cumplían con algún criterio de exclusión. En caso tal de haber desacuerdo por algún estudio, un tercer autor fue convocado para solucionar esta discordancia.
Para cada artículo la extracción de información se realizó en un archivo plano de Excel, para confirmar la información extraída un segundo evaluador realizó la extracción de la información del 54,8 % de los artículos (k= 0,95).
Evaluación de la calidad metodológica
Para asegurar la calidad de los estudios incluidos, se diseñó un formulario, de acuerdo a las Herramientas de la Colaboración Cochrane (para evaluar el riesgo de sesgo en los ensayos aleatorios), de las listas de chequeo CASP (tema enfocado, el mismo tratamiento a los grupos, aleatorización, cegamiento, resultados completos, claros), es decir resultado en número y no solo en gráficos difíciles de interpretar, así como resultados dados según el grupo vacunado y no por voluntario, de las guías de la OMS (además de los anteriores se incluyen número de participantes, abandonos) y de las guías de vacunación para dengue (resultados de inmunogenicidad como GMT y seropositividad).
Por otro lado, para evaluar la calidad de los ensayos clínicos no controlados, solo se tuvo en cuenta los criterios de la guía de la OMS, para los cuales se evaluó si el tema en el estudio fue enfocado, descripción de características demográficas y número de participantes. En relación a los resultados obtenidos se evaluó si reportaban seropositividad, GMT, resultados de línea de base, también si hubo suspensión del ensayo o abandonos.
Tratamiento de los datos
Para la realización del análisis de seguridad, los datos extraídos se organizaron en variable dicotómica (reporta/no reporta), se realizó análisis de frecuencias y se reportaron como datos descriptivos. Para los datos de inmunogenicidad los estudios fueron agrupados según el tipo de formulación (monovalente para cada serotipo y tetravalente). Los GMT y los intervalos de confianza fueron recalculados para cada estudio o tomados directos, de cómo estaban reportados. Para la inmunogenicidad se revisó la definición empleada por cada estudio y después el dato fue extraído con la anotación de la definición.
RESULTADOS
DESCRIPCIÓN GENERAL
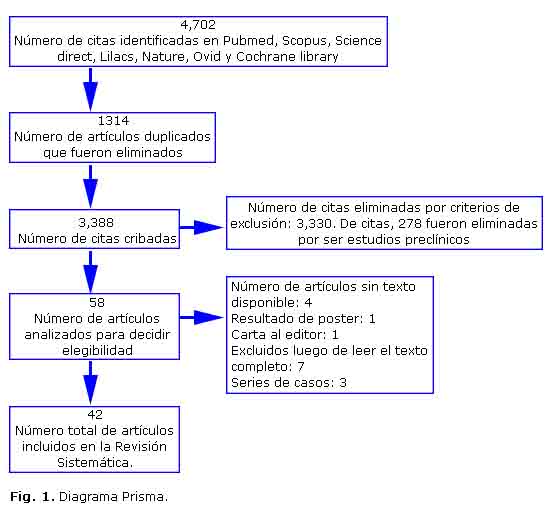
La búsqueda arrojó 4,702 artículos de los cuales 1,314 estaban duplicados. Después de aplicar a los 3,388 restantes los criterios de inclusión y exclusión y el análisis de las investigaciones elegibles, quedaron 42 artículos (Fig. 1) (tablas 1A, B y C).
En cuanto al tipo de formulación, 23 (54,8 %) estudios evaluaron formulaciones tetravalentes, 14 (33,3 %) evaluaron formulaciones monovalentes, 2 (4,8 %) evaluaron formulación monovalente de tres o cuatro serotipos en combinación con tetravalente y 3 (7,1 %) evaluaron varias formulaciones en monovalentes. De los 14 estudios que evaluaron formulaciones monovalentes, 4 (28,6 %) eran para DENV-1, 7 (50,0 %) para DENV-2 y 3 (21,4 %) para DENV-4. No se encontró ningún estudio que evaluara formulación monovalente solo para DENV-3. En cuanto a las fases de desarrollo 27 (64,3 %) eran de fase I, 12 (28,5 %) de fase II, 2 (4,8 %) de fase III y 1 (2,4 %) no reportaba la fase de desarrollo. Al relacionar el tipo de formulación con la fase de desarrollo, se encontró que el 23,8 % de todos los estudios tenían formulación tetravalente en fase I de desarrollo, 26,2 % tenían formulación tetravalente y se encuentran en fase II y los estudios con formulación tetravalente en fase III solo son 4,8 %. Para las formulaciones monovalentes o las que prueban varias monovalentes o monovalentes con tetravalentes, encontramos que de todos los estudios 40,4 % están en fase I de desarrollo, 2,4 % no reportan la fase y solo 2,4 % en fase II de desarrollo. Para estas formulaciones no hay estudios en fase III (tabla 2).
Por otro lado, los estudios también fueron clasificados según la edad de los voluntarios incluidos. De los 42 estudios, 30 (69,1 %) fueron realizados en población adulta, 2 (4,7 %) en población infantil, 2 (4,7 %) en población juvenil, 4 (9,5 %) en población infantil y juvenil y 4 (9,5 %) en población de todas las edades. Al relacionar las edades de los voluntarios incluidos con las fases de desarrollo, se encontró que de los 27 estudios en fase I, 23 (85,2 %) fueron realizados en adultos, 2 (7,4 %) fueron desarrollado en niños y 2 (7,4 %) en población de todas las edades (2 a 45 años). De los 12 estudios en fase II, 6 (50,0 %) fueron realizados en adultos, 3 (25,0 %) en adolescentes, 2 (16,7 %) en niños y adolescentes y 1 (8,3 %) en voluntarios de todas las edades. Por otro lado, los únicos dos estudios en fase III, fueron realizados en población infantil y el estudio que no reportó la fase de desarrollo, fue realizado en adultos (tabla 3).
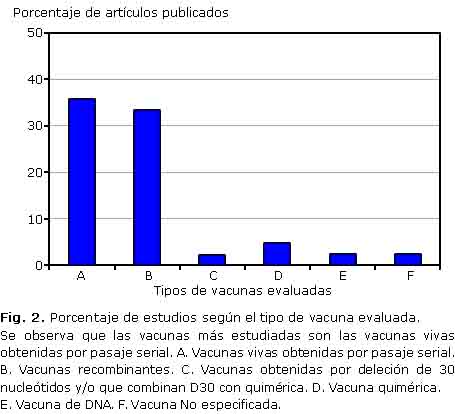
Los tipos de vacunas utilizados en los estudios fueron clasificados según criterios descritos previamente11 con algunas modificaciones. De acuerdo a ello se tuvieron en cuenta cinco grupos:
1. Vacunas vivas obtenidas por pasaje serial (35,7 %).
2. Vacunas recombinantes (33,3 %).
3. Vacunas obtenidas por deleción de 30 nucleótidos y/o que combinan deleción de 30 nucleótidos con quimérica (21,4 %).
4. Vacunas quiméricas (4,8 %).
5. Vacunas de DNA (2,4 %).
Solo el 2,4 % de los estudios no especifican método de atenuación. De estas vacunas; solo una (vacuna recombinante) se ha evaluado en un ensayo clínico controlado fase III (Fig. 2).
EVALUACIÓN DE LA CALIDAD METODOLÓGICA
Para los análisis de calidad metodológica los artículos se dividieron en ensayos clínicos controlados (40 artículos) y no controlados (2 artículos).
Para esta evaluación se tuvieron en cuenta los siguientes aspectos: Para evaluar el sesgo de selección (validez), se revisó si los artículos tenían el tema claramente enfocado, si fueron realizados de forma aleatoria y si los grupos tenían características similares; para el sesgo de realización se evaluó si había doble cegamiento y si los grupos recibieron el mismo tratamiento; para el riesgo de deserción se tuvieron en cuenta los abandonos y la suspensión del ensayo, para la precisión, se tuvo en cuenta el número de voluntarios incluidos. Con relación a los resultados reportados se verificó si se medía seropositividad, GMT, si se reportaban los resultados del grupo control y si se reportaban los resultados de medición inicial antes de comenzar la vacunación (línea de base). Estos datos fueron revisados por bloques con el fin de hacer una aproximación a la calidad metodológica general. La descripción de las características generales de los estudios incluidos y los resultados para cada uno de los parámetros que se tuvieron en cuenta para definir la calidad metodológica, se encuentran resumidos en las tablas 4A, B y C y tabla 5.
En los ensayos clínicos controlados, en relación al sesgo de selección, se encontró que 40 estudios (100 %) tenían el tema definido; 32 (80 %) fueron realizados de forma aleatoria y solo 19 estudios (47,5 %) reportaron similitud entre los grupos control. Con relación al sesgo de realización se encontró que en 34 estudios (85 %) el grupo control recibió el mismo tratamiento de quien recibió la vacuna (mismo calendario de vacunación o misma vía de aplicación) y solo 19 estudios (47,5 %) fueron doble ciego. En cuanto a la suspensión del ensayo solo el 2,5 % (1) de los 40 ensayos clínicos controlados fue suspendido. En relación a la precisión, se encontró que el número voluntarios incluidos en los ensayos clínicos fase I varía entre 10 y 148, en los ensayos clínicos fase II entre 35 - 4002 y en los ensayos clínicos fase III entre 250 -10,275. En relación a los resultados, se encontró que los 40 estudios (100 %) reportaron como principal medida de inmunogenicidad los GMT; 36 de ellos (90 %) reportaron la seropositividad, 15 (37,5 %) reportaron resultados del grupo control y 14 (35 %) resultados de medición inicial. De acuerdo a los resultados de estos parámetros y con el análisis por bloques, se consideró que los ensayos clínicos controlados tienen una calidad metodológica moderada (tablas 4A, B y C).
Por otro lado, para evaluar la calidad de los ensayos clínicos no controlados solo se tuvo en cuenta los criterios de la guía de la OMS: se evaluó si el tema fue claramente enfocado, descripción de características demográficas y resultados reportados. Con estos parámetros se considera que la calidad metodológica de los dos ensayos clínicos no controlados no es buena, ya que ninguno de los estudios describe las características de la población, el número de participantes fue bajo (entre 10 y 20) y solo un estudio reportó seropositividad y resultados de línea de base (tabla 5).
Seguridad
La seguridad puede ser reportada de acuerdo a la presencia de síntomas locales o sistémicos. Sin embargo, los estudios primarios no presentaron homogeneidad en los parámetros reportados, es por esta razón que los porcentajes que se mostraron corresponden a la frecuencia con que un síntoma es reportado (todos los estudios reportan más de un síntoma).
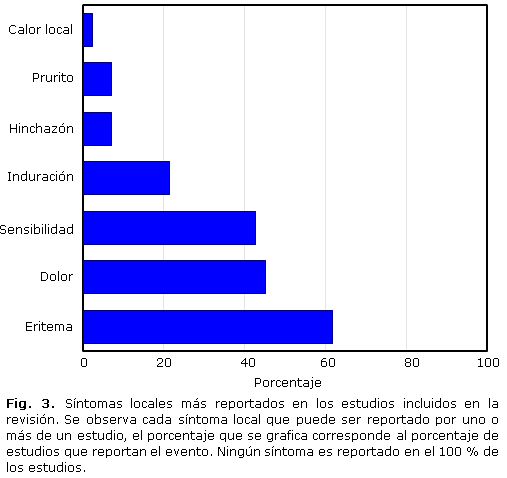
En los 42 estudios los síntomas locales más reportados son: eritema en 26 estudios (61,9 %), dolor en 19 estudios (45,2 %) y sensibilidad en 18 estudios (42,9 %). Otros sintomas locales son reportados con menor frecuencia, entre los que se encuentran: induración en 9 estudios (21,4 %), prurito en 3 estudios (7,1 %), hinchazón en 3 estudios (7,1 %) y calor local en uno de los estudios (2,4 %) (Fig. 3).
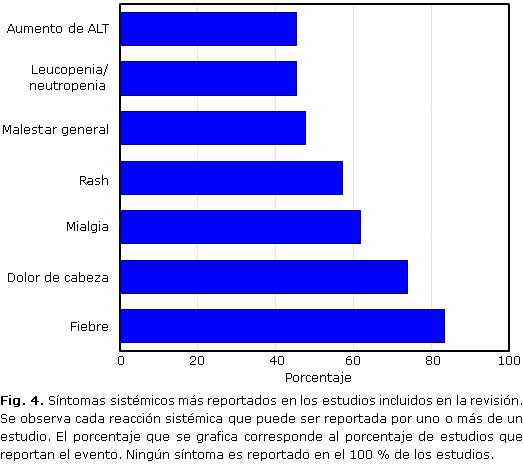
Por otro lado, los síntomas sistémicos con mayor frecuencia reportados son: fiebre en 35 estudios (83,3 %), dolor de cabeza en 31 estudios (73,8 %), mialgia en 26 estudios (61,9 %), rash en 24 estudios (57,1 %), malestar general en 20 estudios (47,65), leucopenia /neutropenia en 19 estudios (45,2 %) y aumento de alanina aminotransferasa en 19 estudios (45,2 %). Otros eventos como linfadenopatias, altralgia, malestar astenia, conjuntivitis, petequias, hemorragias, hepatomegalia, esplenomegalia, aumento de creatina fosfoquinasa, aumento de la creatinina, disminucion de la hemoglobina, dolor abdominal, diarrea, anorexia, faringitis y muerte son menos reportadas (Fig. 4).
Inmunogenicidad
Diferentes metodologías son empleadas para medir la respuesta inmune a las vacunas para dengue; (cada estudio puede utilizar una o varias de estas metodologías). En ese sentido la determinación de anticuerpos neutralizantes ya sea por ensayo de reducción de placa Plaque reduction neutralization test osus, siglas en inglés (PRNT) 50 o 60) o por micro neutralización es usada en 20 (52,4 %) de los 42 estudios; el método de Hemaglutinación es empleado en 4 estudios (9,5 %); el método de ELISA para Inmunoglobulina G (IgG) es utilizada en 5 estudios (11,9 %) y para Inmunoglobulina M (IgM) en siete estudios (16,7 %). Otras metodologías como la medición de citoquinas entre ellas el Interferón gamma, la respuesta de células B, la producción de anticuerpos heterólogos y la respuesta de células T son utilizadas por 5 estudios (11,9 %). Aparte de la metodología empleada, la inmunogenicidad es medida por medio de la presencia de anticuerpos neutralizantes reportada como GMT y seropositividad, seroprevalencia, tasa de seropositividad o seroconversión.
Con el fin de observar una tendencia o comportamiento en los GMT tras la vacunación, se graficaron los títulos de anticuerpos neutralizantes alcanzados por cada vacuna tetravalente según el serotipo vs la cantidad de voluntarios incluidos en el estudio20 (Fig. 5). La gráfica para DENV-1 mostró que los resultados de GMT son más homogéneos entre los estudios, los títulos alcanzados por las vacunas son menores a 400. DENV-1 es el serotipo que más bajos GMT tiende a producir. Para DENV-2 amplios intervalos de confianza fueron observados entre los estudios, se mostró que para este serotipo la respuesta entre los voluntarios es heterogénea, en el cual se alcanzan valores de hasta 800 GMT. Para DENV-3 la respuesta a vacunas por GMT fue muy diversa, algunos estudios presentan intervalos de confianza amplios, otros más estrechos independiente del número de voluntarios, la respuesta a este serotipo es muy variable aunque los títulos de GMT alcanzados no superaron el valor de 900. Para DENV-4 la respuesta también fue más homogénea, los títulos alcanzados en los estudios no superan los 850 GMT, además, los intervalos son más estrechos para estudios con más voluntarios (Fig. 5).
DISCUSIÓN
Los estudios de esta revisión, se hicieron con miras a identificar una vacuna con buenos perfiles de seguridad e inmunogenicidad y que pudiera ser licenciada a corto plazo. Sin embargo, las grandes variaciones entre los ensayos clínicos, los diferentes tipos de formulación y de vacuna, evidencian la necesidad de explorar y analizar con realidad rigurosa los estudios que se han realizado para identificar la razón por la que se presentan tantas diferencias. En este sentido esta revisión sistemática puede dar pautas para rediseñar los ensayos clínicos y las formas de reporte de resultados, lo que permitirá obtener resultados transparentes y comparables para obtener la mejor vacuna.
En esta revisión sistemática se garantizó la exhaustividad de la búsqueda, pues se incluyeron una gran variedad de términos de referencia, sin incluir restricción en la fecha de publicación o en el idioma. Se tuvieron en cuenta tanto ensayos clínicos controlados como no controlados, permite así obtener gran información que admitió a describir las diferencias en los diseños que son una fuente importante de heterogeneidad y que no hace posible la comparación entre estudios controlados y menos aún en no controlados, donde encontramos dos estudios. Además esta rigurosidad también permitió obtener la información de las diferencias en los resultados de los ensayos clínicos que han sido publicados hasta la fecha. A pesar de que recién se publicó que los primeros estudios para el desarrollo de una vacuna para dengue datan de 1920,21 los primeros ensayos clínicos reportados, son del año 1983.22 Esta discordancia puede deberse a las diferentes fuentes de información consultada debido a que solo se incluyeron artículos de revista indexadas.
De acuerdo al análisis realizado (tablas 4A, B y C), se concluyó que la calidad metodológica de los ensayos clínicos controlados es moderada, lo que dificulta la realización de análisis más detallados, pues la calidad de una revisión sistemática depende en gran parte de que los ensayos clínicos incluidos sean de calidad alta,23 lo que implica que el sesgo de validez sea evitado en el 100 % de los estudios24 y en este caso aunque el tema fue claramente enfocado en el 100 % la aleatorización fue solo del 80 %, característica que puede disminuirle credibilidad a un estudio.24 Otro aspecto importante para garantizar la calidad, es el sesgo de realización, en el cual el doble cegamiento debe ser mantenido hasta la fase de análisis de resultados,25 sin embargo, ninguno de los estudios que se encontraron aclaran este aspecto. Por otro lado, los ensayos clínicos no controlados fueron calificados como de baja calidad, lo que imposibilita analizarlos en detalle.
En relación al tipo de formulación, la OMS ha priorizado el desarrollo de vacunas tetravalentes para disminuir el riesgo de formación de anticuerpos heterólogos en los voluntarios vacunados, evita así el fenómeno de potenciación dependiente de anticuerpos.26 Sin embargo, es importante resaltar que un gran porcentaje de estudios (45,2 %) evaluó formulaciones monovalentes. Por otro lado, los estudios donde se realizaron ensayos clínicos con formulaciones monovalentes y tetravalentes derivadas de las monovalentes muestran un perfil de seguridad e inmunogenicidad diferente en cada formulación. Esto indica que las vacunas monovalentes evaluadas, sí van a ser empleadas en formulación tetravalente, como sugiere la OMS, deberán ser probadas de nuevo.27,28 En ese sentido cabe preguntarse ¿hasta qué fase de evaluación clínica debe ser probada una vacuna que no va a tener posibilidades reales de licenciarse? y ¿por qué exponer a diferentes personas con formulaciones monovalentes a un fenómeno de potenciación, si se conoce que la respuesta inmune no es extrapolable en estudios con formulaciones monovalentes y tetravalentes? Las respuestas a estas inquietudes deberían ser tenidas en cuenta para el diseño de futuros estudios vacunales.
Con respecto a la edad de los voluntarios, este criterio fue de gran importancia en el análisis, por tres razones:
- La primera porque se sabe que la población infantil y juvenil es una población objetivo para una futura vacunación, sin embargo, hay que considerar que ética e inmunológicamente son considerados población vulnerable. En el ámbito ético los niños no comprenden el total del concepto de los riesgos, beneficios y responsabilidades de la participación en los ensayos, razón por la cual sus padres deben aprobar el consentimiento. Se debe aclarar que estos estudios no aportan ningún beneficio al menor y la práctica solo conlleva a obtener resultados del conocimiento de un biológico como posible candidato a vacuna.
- La segunda, es que en relación a los aspectos de inmunogenicidad los niños y los infantes pueden tener un riesgo más alto de efectos secundarios que los adultos, debido a que sus órganos están en crecimiento y al desarrollo funcional del cuerpo en los primeros años de vida,29 además, por condiciones de peso y tamaño presentan mayores niveles de toxicidad.
- La tercera razón, es que la guía de vacunación para el dengue recomienda muy claro que los voluntarios de los ensayos iniciales sean adultos, para que posteriormente la vacuna pueda ser evaluada en jóvenes y en niños.26 No obstante, un porcentaje alto de los estudios (28,6 %) involucra niños en la evaluación.
En relación a las características de seguridad ninguna vacuna reporta la aparición de eventos serios, y todos los estudios siguen las recomendaciones de la OMS al discriminar la seguridad por síntomas locales y sistémicos.26 Los síntomas más comunes deberían tenerse en cuenta como primera línea de evaluación en las tarjetas de seguridad y podrían ser utilizados para el cálculo del “score”. El seguimiento de los eventos adversos por lo general informan que fue de 21 días, tiempo que se adapta a las recomendaciones de la OMS.26 Sin embargo, en los estudios fase II se debería prolongar este seguimiento de eventos adversos serios hasta por seis meses igual que lo hacen para inmunogenicidad. Esta recomendación también es dada por la OMS para evaluar seguridad a largo plazo.
Con relación a la inmunogenicidad de las vacunas, la medición de GMT es empleada como un marcador indirecto de protección, en los cuales la medición inmunológica se asocia con la posible protección brindada por la vacuna dependiendo de la robusta respuesta del sistema inmunitario frente al biológico.26,30 Sin embargo, esta medida siempre es un predictor de inmunidad protectora, ya que se ha reportado que en algunos casos a pesar de que se encontraron valores altos de GMT no hubo protección frente a DENV-2.31 Los valores de GMT son una correlación inicial de posible protección, razón por la cual son empleados en los ensayos clínicos. Es de resaltar que los ensayos de inmunidad celular pueden brindar información sobre memoria inmunológica y duración de la protección.
Por otro lado, los estudios utilizan una o varias metodologías para la detección de anticuerpos neutralizantes. De estas metodologías el ensayo de neutralización, es el único método aceptado por la OMS y reconocido como “Gold Standard”.32 En ese sentido, todos los ensayos clínicos que se incluyeron en este estudio emplean PRNT (ya sea PRNT50 o PRNT60). En cuanto a su reporte, los resultados de los GMT son publicados de forma narrativa, en tablas o en gráficos cuyas escalas en ocasiones son logarítmicas y difíciles de interpretar (tanto la media como su intervalo), además pueden informar la media geométrica para el grupo en general o reportar el resultado del ensayo de placa para cada individuo, el reporte de GMT por voluntario no permite tener un resultado general de inmunogenicidad de la vacuna por lo que no se puede comparar este parámetro con otros ensayos.
Hacia ensayos de vacunación para dengue el PRNT50 proporciona una sensibilidad y especificidad adecuada, es la medición más recomendada,32 mientras que mediciones de PRNT80 o PRNT90 son utilizados en estudios epidemiológicos y de diagnóstico, los cuales tienen como objetivo evaluar la reacción cruzada entre Flavivirus en regiones donde hay circulación de varios de ellos y en donde el dengue es endémico.33 De acuerdo a estos argumentos, en los estudios de vacunación la medición de efectividad para vacunas debería basarse solo en mediciones de PRNT50, lo que permitiría además poder hacer una comparación entre los estudios.
Los resultados de inmunogenicidad nos permitieron identificar que los GMT de las diferentes vacunas tetravalentes son muy heterogéneos entre los serotipos y entre las poblaciones, lo que se evidencia en amplios intervalos de confianza entre los voluntarios de cada estudio. Esta heterogeneidad en los resultados de GMT concuerda con los resultados del meta-análisis publicado reciente.34 En dicho estudio discuten que la heterogeneidad en los resultados se debe a las diferencias del estatus inmune de los voluntarios incluidos, sin embargo se plantea la posibilidad de la existencia de dos grupos de población: respondedores/no respondedores debido a que en estudios realizados en zonas endémicas o no endémicas presentan esta variación, de igual forma en los estudios en los cuales evalúan el estatus inmune previo al ensayo de vacunas.
Los resultados de inmunogenicidad y seguridad de las vacunas con formulación tetravalente, permitió identificar dos grandes grupos: el primero incluye los estudios realizados por la casa Sanofi Pasteur y el segundo por la casa farmacéutica GlaxoSmithKline. En cuanto a los 14 estudios realizados por la casa Sanofi Pasteur, se encontró que 5 de estos, a pesar de que probaron la vacuna recombinante ChimeriVax-Dengue vaccin, por sus siglas en inglés (CDY), presentan diferencias en el tratamiento del grupo control o en el calendario de vacunación lo que hace imposible su comparación.35-39 Solo 8 artículos reportados entre los años 2012 al 2014 presentan similitud en su metodología31,40-46 por lo que reciente se publicó un meta-análisis de 7 de esos estudios, se consideró que el octavo no fue incluido porque no estaba entre la fecha de búsqueda que ellos tenían establecida.34 Sin embargo, no era la intención de actualizar este meta-análisis sino establecer que se reporta en seguridad e inmunogenicidad, como se están diseñado los estudios clínicos de vacunas para dengue, para luego definir cuáles son las fuentes de heterogeneidad de los ensayos clínicos que dificulta el desarrollo del meta-análisis.34 En cuanto a los seis estudios realizados por la casa farmacéutica GlaxoSmithKline,47-52 cinco son similares en su diseño y se caracterizan porque utilizan la misma cepa y el calendario de vacunación, que consiste de dos dosis con un intervalo de 6 meses entre cada aplicación. Sin embargo aunque presenta similitudes que permitirían hacer meta-análisis de estos cinco, solo tres tenían como grupo control placebo u otra vacuna licenciada y dos de estos no publicaron los resultados del grupo control para la inmunogenicidad, ni los autores suministraron la información después de contactarlos. Esta razón imposibilita la realización de comparaciones entre estas vacunas. Finalmente, en relación a las vacunas con otras formulaciones, se demuestra que el perfil de seguridad e inmunogenicidad de una vacuna monovalente puede llegar a variar o a comportarse de forma similar que la formulación tetravalente.27,53-55 Es importante recalcar que la recomendación de la OMS es enfocar esfuerzos en la evaluación de vacunas tetravalentes.
Se concluye, que el presente análisis muestra las principales diferencias de los estudios vacunales para dengue en cuanto a diseños y reportes. A pesar de la existencia de una guía de vacunación se encontraron estudios publicados después del 2009, que no se acogen a las recomendaciones de la OMS. Por tanto, es importante seguir las recomendaciones y emplear parámetros de seguridad e inmunogenicidad con mayor frecuencia aquí identificados, con el fin de facilitar que futuros estudios realizados en vacunas sean comparables lo que permitirá identificar con argumentos claros cuál es el mejor candidato. Y aunque hasta el momento la vacuna por sus siglas en inglés, ChimeriVax tetravalent dengue vaccine (CYD-TDV) es la que se reporta como la de mayor avance, su eficacia es cuestionable, debido a que se encontró solo dos estudios de la vacuna DCY-TDV que evalúan eficacia. Uno de ellos muestra una eficacia vacunal del 30,2 % (95 % Intervalo de Confianza (IC) 13,4 a 56,6) aunque presenta altos GMT;31 y el otro muestra una eficacia solo del 56,5 %,37 por lo que se considera que esta vacuna requiere más estudios para comprobar que es la mejor. En ese sentido, unificar los datos de reporte y metodología permitirá realizar las comparaciones entre estudios.
AGRADECIMIENTOS
A Natalia Fuentes Ramos y a Carlos Mario Arroyave bibliotecólogos de la biblioteca central de la universidad de Antioquia, quienes apoyaron en el proceso de búsqueda y en la obtención de artículos no disponibles.
FINANCIMIENTO
Comité Nacional para el Desarrollo de la Investigación (CONADI) de la Universidad Cooperativa de Colombia. Proyecto 1475 de 2014.
REFERENCIAS BIBLIOGRÁFICAS
1. Lindenbach BD, Thiel HJ, Rice CM. Flaviviridae: The Viruses and Their Replication. Fields Virology. 5th Edition. Philadelphia: Lippincott-Raven Publishers; 2007.
2. Murphy BR, Whitehead SS. Immune response to dengue virus and prospects for a vaccine. Annual review of immunology. 2011;29:587-619.
3. Urcuqui-Inchima S, Patino C, Torres S, Haenni AL, Diaz FJ. Recent developments in understanding dengue virus replication. Advances in virus research. 2010;77:1-39.
4. Russell PK, Nisalak A. Dengue virus identification by the plaque reduction neutralization test. The Journal of Immunology. 1967;99(2):291-6.
5. Mustafa M, Rasotgi V, Jain S, Gupta V. Discovery of fifth serotype of dengue virus (DENV-5): A new public health dilemma in dengue control. Medical Journal Armed Forces India. 2015;71(1):67-70.
6. Rodriguez-Roche R, Gould EA. Understanding the dengue viruses and progress towards their control. BioMed research international. 2013;2013:690835.
7. Back AT, Lundkvist A. Dengue viruses - an overview. Infection ecology & epidemiology. 2013 [citado 14 Jul 2015];3. Disponible en: http://www.infectionecologyandepidemiology.net/index.php/iee/article/view/19839
8. WHO. Report of the Scientific Working Group meeting on Dengue. World Health Organization; 2006.
9. OMS, TDR. Dengue: guias para el diagnóstico, tratamiento, prevención y control. Bolivia: OMS; 2009.
10. INS, OPS, OMS. Guía para la atención clínica integral del paciente con dengue. Bogotá; 2010.
11. McArthur MA, Sztein MB, Edelman R. Dengue vaccines: recent developments, ongoing challenges and current candidates. Expert review of vaccines. 2013;12(8):933-53.
12. Santacoloma Varón L, Chaves Córdoba B, Brochero HL. Susceptibility of Aedes aegypti to DDT, deltamethrin, and lambda-cyhalothrin in Colombia. Revista Panamericana de Salud Pública. 2010;27(1):66-73.
13. Lim SP, Wang Q-Y, Noble CG, Chen Y-L, Dong H, Zou B, et al. Ten years of dengue drug discovery: progress and prospects. Antiviral research. 2013;100(2):500-19.
14. Thomas SJ, Endy TP. Critical issues in dengue vaccine development. Current opinion in infectious diseases. 2011;24(5):442-50.
15. Yauch LE, Shresta S. Dengue virus vaccine development. Advances in virus research. 2014;88:315-72.
16. McArthur MA, Sztein MB, Edelman R. Dengue vaccines: recent developments, ongoing challenges and current candidates. Expert Reviews of Vaccines. 2013;13:933-53.
17. Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, Petticrew M, et al. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P) 2015 statement. Systematic Reviews; 2015.
18. Urrútia G, Bonfill X. Declaración PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Medicina clínica. 2010;135:507-11.
19. Organization WH. Dengue: Guías para el diagnóstico, tratamiento, prevención y control. OPS/OMS La Paz; 2009.
20. Alonso MA. Estudios Pequeños: ¿ Cuál es la Importancia del Tamaño en los Estudios Clínicos? Medwave. 2011;6:1-3
21. Julian P, Higgins D, Peter CG, Peter J, Moher D, Oxman A, et al. Cochrane Bias Methods Group, Cochrane Statistical Methods Group. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ; 2011.
22. Scott EK, Bancroft WH, Summers PL, McCown JM, Anderson JH, Russell PK, et al. Dengue 2 vaccine: dose response in volunteers in relation to yellow fever immune status. J Infect Dis. 1983;148(6):1055-60.
23. The Cochrane Collaboration. Manual Cochrane de revisiones sistemáticas de intervenciones. Centro Cochrane Iberoamericano; 2011.
24. Cobos-Carbó A. Ensayos clínicos aleatorizados (CONSORT). Medicina clínica. 2005;125:21-7.
25. Fletcher R. Epidemiologia clínica: Lippincott Williams and Wilkins. Wolters Kluwer Health; 2008.
27. Sun W, Edelman R, Kanesa-Thasan N, Eckels KH, Putnak JR, King AD, et al. Vaccination of human volunteers with monovalent and tetravalent live-attenuated dengue vaccine candidates. Am J Trop Med Hyg. 2003;69(6 Suppl):24-31.
28. Kanesa-thasan N, Sun W, Kim-Ahn G, Van Albert S, Putnak JR, King A, et al. Safety and immunogenicity of attenuated dengue virus vaccines (Aventis Pasteur) in human volunteers. Vaccine. 2001;19(23-24):3179-88.
29. Organization WH. Correlates of vaccine-induced protection: methods and implications. World Health Organization; 2013.
30. Hombach J, Cardosa M, Sabchareon A, Vaughn DW, Barrett AD. Scientific consultation on immunological correlates of protection induced by dengue vaccines. Report from a meeting held at the World Health Organization 17-18 November 2005. Vaccine. 2007;25:4130-9.
31. Sabchareon A, Wallace D, Sirivichayakul C, Limkittikul K, Chanthavanich P, Suvannadabba S, et al. Protective efficacy of the recombinant, live-attenuated, CYD tetravalent dengue vaccine in Thai schoolchildren: a randomised, controlled phase 2b trial. Lancet. 2012;380(9853):1559-67.
32. Timiryasova TM, Bonaparte MI, Luo P, Zedar R, Hu BT, Hildreth SW, et al. Optimization and validation of a plaque reduction neutralization test for the detection of neutralizing antibodies to four serotypes of dengue virus used in support of dengue vaccine development. Am J Trop Med Hyg. 2013;88(5):962-70.
33. Roehrig JT, Hombach J, Barrett AD. Guidelines for Plaque-Reduction Neutralization Testing of Human Antibodies to Dengue Viruses. Viral immunology. 2008;21(2):123-32.
34. da Costa VG, Marques-Silva AC, Floriano VG, Moreli ML. Safety, immunogenicity and efficacy of a recombinant tetravalent dengue vaccine: a meta-analysis of randomized trials. Vaccine. 2014;32(39):4885-92.
35. Dayan GH, Thakur M, Boaz M, Johnson C. Safety and immunogenicity of three tetravalent dengue vaccine formulations in healthy adults in the USA. Vaccine. 2013;31(44):5047-54.
36. Poo J, Galan F, Forrat R, Zambrano B, Lang J, Dayan GH, et al. Live-attenuated Tetravalent Dengue Vaccine in Dengue-naive Children, Adolescents, and Adults in Mexico City: Randomized Controlled Phase 1 Trial of Safety and Immunogenicity. The Pediatric infectious disease journal. 2010.
37. Capeding RZ, Luna IA, Bomasang E, Lupisan S, Lang J, Forrat R, et al. Live-attenuated, tetravalent dengue vaccine in children, adolescents and adults in a dengue endemic country: randomized controlled phase I trial in the Philippines. Vaccine. 2011;29(22):3863-72.
38. Morrison D, Billings CW, Forrat R, Yoksan S, Lang J. A novel tetravalent dengue vaccine is well tolerated and immunogenic against all 4 serotypes in flavivirus-naive adults. J Infect Dis. 2010;201(3):370-7.
39. Qiao M, Shaw D, Forrat R, Wartel-Tram A, Lang J. Priming effect of dengue and yellow fever vaccination on the immunogenicity, infectivity, and safety of a tetravalent dengue vaccine in humans. Am J Trop Med Hyg. 2011;85(4):724-31.
40. Leo YS, Wilder-Smith A, Archuleta S, Shek LP, Chong CY, Leong HN, et al. Immunogenicity and safety of recombinant tetravalent dengue vaccine (CYD-TDV) in individuals aged 2-45 y: Phase II randomized controlled trial in Singapore. Human vaccines & immunotherapeutics. 2012;8(9):1259-71.
41. Ngoc Huu Tran CQL, Thi Que Huong Vu, Remi Forrat, Jean Lang, Quoc Dat Vu, Alain Bouckenooghe, et al. Safety and Immunogenicity of Recombinant, Live Attenuated Tetravalent Dengue Vaccine (CYD- TDV) in Healthy Vietnamese Adults and Children. Vaccines Vaccin. 2012;3:162.
42. Lanata CF, Andrade T, Gil AI, Terrones C, Valladolid O, Zambrano B, et al. Immunogenicity and safety of tetravalent dengue vaccine in 2-11 year-olds previously vaccinated against yellow fever: randomized, controlled, phase II study in Piura, Peru. Vaccine. 2012;30(41):5935-41.
43. Dayan GH, Garbes P, Noriega F, Izoton de Sadovsky AD, Rodrigues PM, Giuberti C, et al. Immunogenicity and safety of a recombinant tetravalent dengue vaccine in children and adolescents ages 9-16 years in Brazil. Am J Trop Med Hyg. 2013;89(6):1058-65.
44. Hss AS, Koh MT, Tan KK, Chan LG, Zhou L, Bouckenooghe A, et al. Safety and immunogenicity of a tetravalent dengue vaccine in healthy children aged 2-11 years in Malaysia: a randomized, placebo-controlled, Phase III study. Vaccine. 2013;31(49):5814-21.
45. Villar LA, Rivera-Medina DM, Arredondo-Garcia JL, Boaz M, Starr-Spires L, Thakur M, et al. Safety and immunogenicity of a recombinant tetravalent dengue vaccine in 9-16 year olds: a randomized, controlled, phase II trial in Latin America. The Pediatric infectious disease journal. 2013;32(10):1102-9.
46. Capeding MR, Tran NH, Hadinegoro SR, Ismail HI, Chotpitayasunondh T, Chua MN, et al. Clinical efficacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia: a phase 3, randomised, observer-masked, placebo-controlled trial. Lancet. 2014;384(9951):1358-65.
47. Sun W, Cunningham D, Wasserman SS, Perry J, Putnak JR, Eckels KH, et al. Phase 2 clinical trial of three formulations of tetravalent live-attenuated dengue vaccine in flavivirus-naive adults. Hum Vaccin. 2009;5(1):33-40.
48. Watanaveeradej V, Gibbons RV, Simasathien S, Nisalak A, Jarman RG, Kerdpanich A, et al. Safety and immunogenicity of a rederived, live-attenuated dengue virus vaccine in healthy adults living in Thailand: a randomized trial. Am J Trop Med Hyg. 2014;91(1):119-28.
49. Edelman R, Wasserman SS, Bodison SA, Putnak RJ, Eckels KH, Tang D, et al. Phase I trial of 16 formulations of a tetravalent live-attenuated dengue vaccine. Am J Trop Med Hyg. 2003;69(6 Suppl):48-60.
50. Thomas SJ, Eckels KH, Carletti I, De La Barrera R, Dessy F, Fernandez S, et al. A phase II, randomized, safety and immunogenicity study of a re-derived, live-attenuated dengue virus vaccine in healthy adults. The American journal of tropical medicine and hygiene. 2013;88(1):73-88.
children. The American journal of tropical medicine and hygiene. 2008;78(3):426-33.
52. Watanaveeradej V, Simasathien S, Nisalak A, Endy TP, Jarman RG, Innis BL, et al. Safety and immunogenicity of a tetravalent live-attenuated dengue vaccine in flavivirus-naive infants. The American journal of tropical medicine and hygiene. 2011;85(2):341-51.
53. Kanesa-Thasan N, Edelman R, Tacket CO, Wasserman SS, Vaughn DW, Coster TS, et al. Phase 1 studies of Walter Reed Army Institute of Research candidate attenuated dengue vaccines: selection of safe and immunogenic monovalent vaccines. Am J Trop Med Hyg. 2003;69(6 Suppl):17-23.
54. Lindow JC, Durbin AP, Whitehead SS, Pierce KK, Carmolli MP, Kirkpatrick BD. Vaccination of volunteers with low-dose, live-attenuated, dengue viruses leads to serotype-specific immunologic and virologic profiles. Vaccine. 2013;31(33):3347-52.
55. Durbin AP, Schmidt A, Elwood D, Wanionek KA, Lovchik J, Thumar B, et al. Heterotypic dengue infection with live attenuated monotypic dengue virus vaccines: implications for vaccination of populations in areas where dengue is endemic. Journal of Infectious Diseases. 2011;203(3):327-34.
56. Amar-Singh H, Koh M-T, Tan KK, Chan LG, Zhou L, Bouckenooghe A, et al. Safety and immunogenicity of a tetravalent dengue vaccine in healthy children aged 2-11 years in Malaysia: A randomized, placebo-controlled, Phase III study. Vaccine. 2013;31(49):5814-21.
57. Kitchener S, Nissen M, Nasveld P, Forrat R, Yoksan S, Lang J, et al. Immunogenicity and safety of two live-attenuated tetravalent dengue vaccine formulations in healthy Australian adults. Vaccine. 2006;24(9):1238-41.
58. Sabchareon A, Lang J, Chanthavanich P, Yoksan S, Forrat R, Attanath P, et al. Safety and immunogenicity of tetravalent live-attenuated dengue vaccines in Thai adult volunteers: role of serotype concentration, ratio, and multiple doses. The American journal of tropical medicine and hygiene. 2002;66(3):264-72.
59. Durbin AP, Kirkpatrick BD, Pierce KK, Elwood D, Larsson CJ, Lindow JC, et al. A single dose of any of four different live attenuated tetravalent dengue vaccines is safe and immunogenic in flavivirus-naive adults: a randomized, double-blind clinical trial. Journal of Infectious Diseases. 2013;207(6):957-65.
60. Osorio JE, Velez ID, Thomson C, Lopez L, Jimenez A, Haller AA, et al. Safety and immunogenicity of a recombinant live attenuated tetravalent dengue vaccine (DENVax) in flavivirus-naive healthy adults in Colombia: a randomised, placebo-controlled, phase 1 study. The Lancet Infectious Diseases. 2014;14(9):830-8.
61. Edelman R, Tacket CO, Wasserman SS, Vaughn DW, Eckels KH, Dubois DR, et al. A Live Attenuated Dengue-L Vaccine Candidate (45AZ5) Passaged In Primary Dog Kidney Cell Culture Is Attenuated And Immunogenic For Humans. Journal of Infectious Diseases. 1994;170(6):1448-55.
62. Beckett CG, Tjaden J, Burgess T, Danko JR, Tamminga C, Simmons M, et al. Evaluation of a prototype dengue-1 DNA vaccine in a Phase 1 clinical trial. Vaccine. 2011;29(5):960-8.
63. Durbin AP, McArthur J, Marron JA, Blaney J, Joseph E, Thumar B, et al. The live attenuated dengue serotype 1 vaccine rDEN1?30 is safe and highly immunogenic in healthy adult volunteers. Human vaccines. 2006;2(4):167-73.
64. Durbin AP, Whitehead SS, Shaffer D, Elwood D, Wanionek K, Thumar B, et al. A single dose of the DENV-1 candidate vaccine rDEN1Delta30 is strongly immunogenic and induces resistance to a second dose in a randomized trial. PLoS Negl Trop Dis. 2011;5(8):e1267.
65. Bancroft W, Scott RM, Eckels K, Hoke C, Simms T, Jesrani K, et al. Dengue virus type 2 vaccine: reactogenicity and immunogenicity in soldiers. Journal of Infectious Diseases. 1984;149(6):1005-10.
66. Vaughn DW, Hoke CH, Yoksan S, LaChance R, Innis BL, Rice RM, et al. Testing of a dengue 2 live-attenuated vaccine (strain 16681 PDK 53) in ten American volunteers. Vaccine. 1996;14(4):329-36.
67. Guirakhoo F, Kitchener S, Morrison D, Forrat R, McCarthy K, Nichols R, et al. Live Attenuated Chimeric Yellow Fever Dengue Type 2 (ChimeriVax™-DEN2) Vaccine: Phase I Clinical Trial for Safety and Immunogenicity: Effect of Yellow Fever Pre-immunity in Induction of Cross Neutralizing Antibody Responses to All 4 dengue serotypes. Human vaccines. 2006;2(2):60-7.
68. Bhamarapravati N, Yoksan S, Chayaniyayothin T, Angsubphakorn S, Bunyaratvej A. Immunization with a live attenuated dengue-2-virus candidate vaccine (16681-PDK 53): clinical, immunological and biological responses in adult volunteers. Bulletin of the World Health Organization. 1987;65(2):189.
69. Durbin AP, McArthur JH, Marron JA, Blaney JE, Thumar B, Wanionek K, et al. rDEN2/4?30 (ME), a live attenuated chimeric dengue serotype 2 vaccine, is safe and highly immunogenic in healthy dengue-naïve adults. Human vaccines. 2006;2(6):255-60.
70. Durbin AP, Karron RA, Sun W, Vaughn DW, Reynolds MJ, Perreault JR, et al. Attenuation and immunogenicity in humans of a live dengue virus type-4 vaccine candidate with a 30 nucleotide deletion in its 3'-untranslated region. The American journal of tropical medicine and hygiene. 2001;65(5):405-13.
71. Durbin AP, Whitehead SS, McArthur J, Perreault JR, Blaney JE, Thumar B, et al. rDEN4delta30, a live attenuated dengue virus type 4 vaccine candidate, is safe, immunogenic, and highly infectious in healthy adult volunteers. Journal of Infectious Diseases. 2005;191(5):710-8.
72. McArthur JH, Durbin AP, Marron JA, Wanionek KA, Thumar B, Pierro DJ, et al. Phase I clinical evaluation of rDEN4?30-200,201: a live attenuated dengue 4 vaccine candidate designed for decreased hepatotoxicity. The American journal of tropical medicine and hygiene. 2008;79(5):678-84.
73. Wright PF, Durbin AP, Whitehead SS, Ikizler MR, Henderson S, Blaney JE, et al. Phase 1 trial of the dengue virus type 4 vaccine candidate rDEN4?30-4995 in healthy adult volunteers. The American journal of tropical medicine and hygiene. 2009;81(5):834-41.
Recibido: 10 de octubre de 2015.
Aprobado: 10 de noviembre de 2015.
Marlen Martinez-Gutierrez. Grupo de Investigación en Ciencias Animales-GRICA. Facultad de Medicina Veterinaria y Zootecnia. Universidad Cooperativa de Colombia. Bucaramanga, Colombia.
Correo electrónico: marlen.martinezg@campusucc.edu.co