Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.35 no.4 Ciudad de la Habana oct.-dic. 2016
ARTÍCULO DE REVISIÓN
Nanopartículas para materiales antibacterianos y aplicaciones del dióxido de titanio
Nanoparticles for antibacterial materials and titanium dioxide applications
Claudia Patricia Betancur Henao, Vanessa Hernández Montes, Robison Buitrago Sierra
Grupo de Investigación Materiales Avanzados y Energía- MATyER. Instituto Tecnológico Metropolitano. Medellín, Colombia.
RESUMEN
La aparición constante de microorganismos multiresistentes (bacterias, virus, hongos), ha elevado el esfuerzo por la búsqueda de materiales antibacterianos, que sean efectivos para su aplicación en áreas tan diversas como la industria textil, alimentación animal, el tratamiento de aguas, industria médica, farmacéutica y cosmética. Es bien conocido que agentes antibacterianos inorgánicos tales como las nanopartículas de plata, de cobre, de óxido de zinc y de óxido de cobre, han atraído una atención especial a lo largo del tiempo, debido a su estabilidad y a que no presentan problemas de bioseguridad. Aun así, recién las nanopartículas de dióxido de titanio han venido ganando atención para aplicaciones biomédicas, dado que estas partículas se vuelven antibacteriales mediante un proceso de fotoactivación y presentan absorción de ciertas longitudes de onda que dependen de su fase inorgánica (anatasa, rutilo o brookita). No obstante, la actividad fotocatalítica del dióxido de titanio oscila en la región UV (ƛ>387nm), y ello ha representado el mayor esfuerzo en investigación, en búsqueda de conseguir que el dióxido de titanio tenga función de autodesinfección en la región de luz visible, aumentándose así sus aplicaciones en la industria biomédica. En este artículo se realizó una revisión crítica de la literatura disponible, sobre el uso de nanopartículas para materiales antibacterianos y aplicaciones del dióxido de titanio, haciéndose énfasis en el mecanismo de acción de estas partículas con sistemas biológicos y posibles modificaciones para mejorar su actividad fotocatalítica mediante la interacción con luz visible.
Palabras clave: materiales antibacterianos; nanopartículas; dióxido de titanio; actividad fotocatalítica.
ABSTRACT
The constant occurrence of multiresistant microorganisms (bacteria, viruses, fungi) has increased the search for antibacterial materials that may be effective to be applied in various areas such as textile industry, animal feeding, water treatment, medical, drug and cosmetic industry. It is well known that inorganic antibacterial agents as silver, copper, zinc oxide and copper oxide nanoparticles have attired special attention in the course of time due to their stability and the absence of biosafety problems. Despite this, just recently, have the titanium dioxide nanoparticles been gaining more attention for biomedical application, since these particles become antibacterial agents through a process of photo-activation and present absorption of certain wavelengths depending on their inorganic phase (anatase, rutile or brookite). Nevertheless, the photocatalytic activity of the titanium dioxide ranges in the UV zone ((?>387nm), and this has required greater efforts in terms of research, to make the titanium dioxide have the auto-disinfection function in the visible light zone, so as to increase the number of uses in the biomedical industry. This article was aimed at making a critical literature review on the use of nanoparticles for antibacterial materials, and the applications of titanium dioxide, thus making emphasis on the mechanism of action of these particles with the biological systems and the possible changes with a view to improving its photocatalytic activity by means of the interaction with the visible light.
Keywords: antibacterial materials; nanoparticles; titanium dioxide; photocatalytic activity.
INTRODUCCIÓN
El desarrollo de materiales antibacterianos se ha abordado desde diferentes áreas de las ciencias como posible solución a gran variedad de patologías (meningitis, encefalitis, bacteremia y gastroenteritis febril) asociadas con colonización bacteriana en superficies de dispositivos médicos, de prendas hospitalarias e incluso a nivel de infraestructura. Aunque la mortalidad humana por infecciones nosocomiales ha disminuido durante el último siglo, este es un problema de salud pública que requiere mayor atención, dado el alto impacto en la morbimortalidad, el aumento de la estancia hospitalaria y a su vez el incremento de los costos derivados de la prestación de los servicios de salud, se calcula que las infecciones intrahospitalarias en Inglaterra generan un costo de 1,000 millones de libras por año. En los Estados Unidos, la cifra es de entre 4,500 millones y 5,700 millones de US$. En México, el costo anual se aproxima a los 1,500 millones y en Colombia las instituciones gastan cada año cerca 727 mil millones de pesos. Es por ello que la prevención de la infección mediante materiales y métodos para limitar o inhibir el crecimiento de microorganismos se vuelve relevante.1-3
Los materiales antibacterianos orgánicos e inorgánicos deben generar en microorganismos patógenos, un efecto bactericida o bacteriostático, garantizándose la disminución o eliminación de los mismos. En este sentido, la nanotecnología presenta un amplio espectro de nuevas posibilidades, ofrece técnicas que permiten la síntesis de materiales con actividad antimicrobiana. Este ámbito es decisivo dado que el desempeño de las nanopartículas está solo relacionado con los métodos de síntesis, una vez que por medio de la modificación de los parámetros durante dicho proceso, es posible modificar las propiedades de los materiales obtenidos. Incluso en la literatura se ha detallado que la efectividad de las nanopartículas para aplicaciones como materiales antibacterianos, depende del tamaño de las partículas, la morfología, la estabilidad y en general las propiedades físico-químicas de estas.4-8
Dentro de los materiales antibacterianos inorgánicos, el dióxido de titanio ha ganado una atención especial, gracias a su amplia gama de propiedades, en especial por su propiedad fotocatalítica bastante usada para eliminar bacterias como la E. coli.9,10 En este artículo se realizó una revisión crítica de la literatura disponible sobre el uso de nanopartículas para materiales antibacterianos y aplicaciones del dióxido de titanio con énfasis en el mecanismo de acción de estas partículas con sistemas biológicos y posibles modificaciones para mejorar su actividad fotocatalítica mediante la interacción con luz visible. Esta revisión busca evidenciar la importancia de esta área en la industria biomédica y realizar una recopilación de la literatura disponible que permita buscar nuevas oportunidades de investigación del dióxido de titanio, así como la relación de su actividad antibacterial con los métodos de síntesis y la estructura del mismo.
MATERIALES ANTIBACTERIANOS
Los materiales antibacterianos son aquellos que tienen la capacidad de reducir o eliminar microorganismos patógenos y cuya acción puede estar medida por dos mecanismos; en el primero el material genera una lesión metabólica en los patógenos que es reversible tras la eliminación o la neutralización del mismo, este efecto es conocido como efecto bacteriostático; en tanto, el segundo mecanismo es irreversible ya que afecta estructuras celulares vitales o la función de la misma y se le conoce como efecto bactericida.11-14
Los materiales antibacterianos por lo común usados, en términos de composición química, pueden ser clasificados en dos grandes familias; materiales orgánicos y materiales inorgánicos
Los primeros pueden ser extraídos o en su defecto recolectados como producto de la secreción de numerosos organismos vivos (microorganismos, vegetales, insectos, peces y anfibios o mamíferos) los cuales son en su mayoría, producidos como mecanismo de defensa contra la invasión de microorganismos. Estos ejercen su actividad de permeabilización de las membranas celulares de bacterias a través de la formación de poros o defectos estructurales.
En comparación con los agentes convencionales, los antibacterianos orgánicos ofrecen la ventaja de actuar a concentraciones muy bajas, entre 1 y 4 mg/mL, además de tener una actividad antibacteriana de amplio espectro. Ejemplos de este tipo de materiales son la gramicidina y la cúrcumina, muy utilizados como agentes antibacterianos.15 Por otro lado, los materiales inorgánicos que incluyen los metales y los óxidos metálicos han sido los más reportados en la literatura por las ventajas que presentan ante las otras familias debido a su estabilidad y bioseguridad.16-23
Nanopartículas antibacterianas
Dentro de estos materiales promisorios, las nanopartículas antibacterianas inorgánicas tales como la plata, el óxido de zinc, el dióxido de titanio y las de cobre han atraído una atención especial debido a su alta estabilidad al estar en contacto con sistemas biológicos.24,25
Los agentes antibacterianos inorgánicos tales como los metales y los óxidos de metal poseen ventajas en comparación con compuestos orgánicos debido a su estabilidad y bioseguridad. Dentro de estos materiales promisorios, las nanopartículas de plata, óxido de zinc, dióxido de titanio y nanopartículas de cobre han atraído una atención especial.
La plata es el agente más estudiado y por ende del que se dispone mayor información en cuanto a su mecanismo de actividad antimicrobiana, es activo contra las bacterias Gram-negativas (Escherichia coli) y Gram-positivas (Staphylococcus, aureas) y aunque existe una gran controversia sobre su mecanismo de acción, estos podrían resumirse en tres principales; el primero se explicaría por la liberación gradual de iones de plata que inhiben la producción de adenosin trifosfato (ATP) y la replicación del ADN, factores fundamentales para la supervivencia celular; el segundo mecanismo podría atribuírsele a la capacidad de las nanopartículas para generar un daño directo a la membrana celular y el tercero por la generación de especies reactivas de oxígeno que generan estrés oxidativo y posterior, la muerte celular.25-29 De forma paralela, estudios recientes han tratado de entender el mecanismo de acción de las nanopartículas de plata y han buscado optimizar la síntesis de las mismas. En ese sentido N. Jayaprakash y colaboradores,30 propusieron la síntesis de nanopartículas de plata mediante la irradiación de microondas utilizándose serina como reductor y el polivinilpirrolidona (PVP) como agente de recubrimiento en medio acuoso, demostrándose que dicho método proporciona ventajas como mayor rentabilidad, formación de nanopartículas altamente estables, directas y escalables y menor tiempo de reacción.
En cuanto al óxido de Zinc (ZnO), este expone un amplio espectro de actividad biocida hacia diferentes bacterias, hongos y virus dado a la producción de especies reactivas de oxígeno y a la liberación de iones de Zinc (Zn2+); además está demostrado que la síntesis de este óxido metálico por rutas de química verde tiene una mayor bioactividad, lo que es posible se atribuye a mayor área superficial,31 mayor capacidad de absorción,32-34 cristalinidad y transmisión.
Por otro lado, para las nanopartículas metálicas de cobre, se describe que su formación y estabilización son procesos complejos, por lo que suelen ser usadas con más frecuencia el óxido de Cobre (Cu2O) que es económico y de fácil disponibilidad, adicionalmente, varios autores describen que su mecanismo de acción antimicrobiano es provocado por la liberación de Cu2+. 35-41 Estos iones de cobre pueden dañar la membrana celular bacteriana, entrar en las células y alterar su función enzimática lo que conduce a la muerte de las bacterias,35 otra propiedad de las nanopartículas de cobre, es que poseen una baja solubilidad en agua, lo que indica que pueden proporcionar una liberación sostenida de iones Cu2+ para uso a largo plazo.42
En 2015 M. Yadollahi y colaboradores,43 sintetizaron por formación in-situ una serie de hidrogeles de carboximetilcelulosa antibacteriana con contenido de nanopartículas de óxido de cobre, los resultados obtenidos muestran excelentes propiedades antibacterianas, así mismo en 2014 Cai y colaboradores,44 demostraron la capacidad biocida producida por este metal, fabricándose con éxito estructuras huecas de Cu a través del método de gelatina-asistida, obteniéndose buen efecto antibacteriano en E. coli y S. aureus. En este orden de ideas los esfuerzos también se han enfocado en los diversos métodos de síntesis de materiales compuestos con adición de este tipo de nanopartículas entre los métodos más utilizados están, la descomposición térmica y la reducción química.37,41
OXIDO DE TITANIO
El óxido de titanio es un mineral que se encuentra de forma natural en tres fases cristalinas: la anatasa y el rutilo (ambas tetragonales) y la brookita (romboédrica). La brookita y la anatasa son fases metaestables, mientras que el rutilo es un material termodinámicamente muy estable y es la forma más común de TiO2 que se encuentra en la naturaleza. A estas fases hay que añadir otras dos, el TiO2-II (ortorrómbico) y el TiO2-III (hexagonal), obtenidos de manera sintética en condiciones de muy alta presión, que presentan durezas muy elevadas. El TiO2 es anfotérico, muy estable químicamente, no tóxico (para el medio ambiente o los seres humanos), posee un fuerte poder oxidante y no es atacado por la mayoría de los agentes orgánicos e inorgánicos, además es un semiconductor sensible a la luz que absorbe radiación electromagnética cerca de la región Ultravioleta Visible (UV)45
Durante las últimas décadas el uso de los nanomateriales de TiO2 ha sido un área fuerte de investigación, mostrándose que dichas aplicaciones se pueden categorizar en cuatro tipos según las propiedades del material. Sus propiedades ópticas por ejemplo, permiten que sea un buen candidato para la protección UV, en tanto su propiedad fotocatalítica lo hace un material prometedor para la descomposición de contaminantes ambientales como el metanotiol (CH3SH) un gas incoloro similar al de la col podrida, emitido de aguas residuales y sólidos municipales. También por lo común es usado para matar las bacterias como la E. coli y las células tumorales en el cáncer. Por otro lado las propiedades eléctricas le confieren la características de superhidrofilicidad o superhidrofobicidad por lo que pueden ser destinados para materiales de autolimpieza o anti-empañamiento.10,46
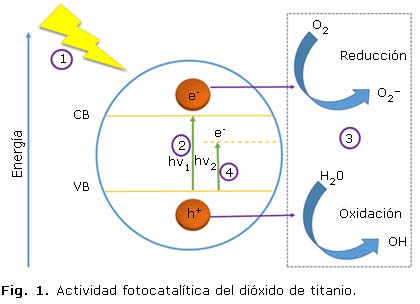
La sensibilidad a la luz UV o actividad fotocatalítica del TiO2 se describe como una reacción electroquímica y fotoelectroquímica que inicia cuando la radiación es capaz de excitar a un semiconductor, al grado de hacer que se comporte como un conductor. Cuando la radiación incide, los fotones de la banda de valencia del óxido de titanio se desplazan a la banda de conducción generándose reacciones de óxido-reducción. En la figura 1 se describe el proceso de fotocatálisis, este inicia con la excitación de una partícula semiconductora por rayos UV (paso 1), dadas estas condiciones, se crean pares electrón-hueco cuyo promedio de vida está en el rango de los picosegundos (paso 2). En este lapso deben migrar a la superficie y generar radicales libres muy reactivos que reaccionan con las especies alrededor mediante procesos de oxidación-reducción (paso 3), rompiéndose algunos enlaces moleculares y reduciéndolas u oxidándolas hasta convertirlas en especies menos complejas. Los pares electrón hueco que no alcanzan a separarse y a reaccionar con especies en la superficie se recombinan y la energía se disipa. Esta característica ha convertido al óxido de titanio como un candidato potencial para aplicaciones biomédicas.47,48
El conocimiento que existe sobre los efectos de las nanopartículas TiO2 en sistemas biológicos se basa en que las especies potenciales reactivas de oxígeno (ROS) que se generan en la superficie del TiO2 durante su actividad fotocatalítica, al estar próximas a las células bacterianas las destruye fácil, pues es capaz de causar peroxidación de los fosfolípidos de la membrana de las células, e interrumpe así su respiración celular.49
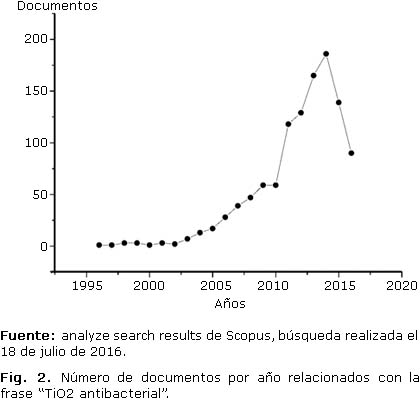
Una clara evidencia de la importancia que ha tomado el uso del dióxido de titanio como agente antibacterial, se puede evidenciar en el crecimiento de trabajos de investigación asociados a esta área. La figura 2 muestra el crecimiento exponencial durante la última década de reportes científicos extraídos de la base de datos Scopus relacionados con el uso del dióxido de titanio como agente antibacterial.
De los trabajos revisados es posible identificar que los métodos de síntesis de las nanopartículas y la modificación de las mismas, son de gran relevancia ya que tienen una relación directa con sus propiedades físico-químicas y en específico con su actividad antibacteriana, de acá la importancia del estudio de los métodos de síntesis y los procesos de modificación de este material.
Síntesis de óxidos de titanio
El óxido de titanio, gracias a su actividad fotocatalítica ha despertado gran interés a nivel industrial. Sin embargo, el método de síntesis es un aspecto crucial ya que de este dependen las propiedades físicas químicas que presenta el material.
En la literatura se encuentran diversos métodos para la obtención del dióxido de titanio.50 Uno de estos es la síntesis química en fase vapor, que consiste en la descomposición del precursor en uno o varios compuestos volátiles, en el interior de una cámara de vacío (reactor) bajo un flujo de argón, cerca de la superficie de un sólido para dar lugar a la formación de las nanopartículas del material. Sin embargo esta ruta de síntesis dificulta el control estequiométrico, porque los diferentes precursores tienen diferentes velocidades de evaporación lo cual es desfavorable.51-53 Otro método es la síntesis hidrotermal la cual se lleva a cabo de manera normal en recipientes cerrados (autoclave). Allí un precursor metálico (por lo general butóxido de titanio, alcóxido de titanio) es disuelto en un líquido (isopropanol, etanol-agua) y detrás son calentados por encima de su punto de ebullición, lo que genera una presión superior a la atmosférica (alcanzándose la presión de saturación de vapor). Aunque este método tiene ventajas interesantes como la preparación de materiales que se descomponen a elevadas temperaturas su mayor debilidad radica en el poco control que se tiene de la porosidad del material.10,54-57
La microemulsión y el método de precursor polimérico, hacen parte también de los métodos de síntesis más utilizados. El primero consiste en obtener gotas acuosas encapsuladas por moléculas de surfactante y rodeadas por una fase oleosa. La fase oleosa es usada como microreactor blando para la síntesis del material, pero su limitación radica en la formación de nanopartículas con un tamaño muy estrecho.58,59 El segundo, conocido también como Pechini, consiste en mezclar los reactivos de interés en una solución, remover el solvente para que quede una mezcla amorfa o nanocristalina de cationes y aniones (acetato, citrato, hidróxido, oxalato, alcóxido) y por último calentar el gel o polvo resultante para inducir la reacción al producto deseado. Entre las ventajas del método, se encuentra la eliminación de problemas de difusión y falta de homogeneidad del producto, la obtención de fases metaestables y la eliminación de fases intermedias impuras. Por otro lado, las desventajas del método consisten en la dificultad en ciertos casos, de controlar la estequiometria exacta, ya que algunas veces no es posible hallar reactivos compatibles.60,61
Por otra parte, la ruta sol gel es utilizada para sintetizar gran variedad de óxidos metálicos como óxidos de titanio, a manera de solución a las debilidades que presentan los métodos antes descritos. Este proceso permite la formación de materiales metaestables con homogeneidad de composición (uniformidad y distribución de tamaños de partículas) y de alta pureza. Además, el método no demanda una infraestructura tecnológica o costosa y es una técnica versátil para la preparación a temperaturas bajas de materiales a granel. También facilita el control de la porosidad, lo que favorece la interacción con las células, y permite la síntesis de materiales con formas variables como fibras, películas, catalizadores, adsorbentes, nanopartículas y nanocompuestos. De manera global, el proceso sol-gel implica la transición de un sistema en estado líquido o sol (suspensión coloidal de partículas sólidas con tamaño nanométrico que está en esta condición gracias al movimiento Browniano), a una fase sólida denominada gel (sólido constituido por al menos dos fases, con la fase líquida atrapada e inmovilizada por la fase sólida). Este cambio se da gracias a la hidrólisis y policondensación del sol. Cuando se obtiene el gel, este se calienta para eliminar el disolvente y descomponer aniones precursores, permitir el reordenamiento de la estructura del sólido y favorecer la cristalización.50,62
Óxido de titanio modificado
Dada la importancia que ha tomado el TiO2 como material antibacterial, se ha intentado sacar el mayor provecho de este, desde modificaciones estructurales en la síntesis y los diversos métodos, hasta la adición de agentes externos como dopantes. Dado que la actividad fotocatalítica del TiO2 oscila en la región UV (ƛ<387 nm), en la actualidad se busca que el TiO2 tenga función antibacteriana en la región de luz visible, lo cual ha representado un gran esfuerzo en investigación, ya que las ondas UV son solo el 5 % del espectro solar. Por tal fin, se deben crear deficiencias de oxígeno o defectos en su estructura procurando disminuir el ancho de la banda prohibida. La reducción de la brecha de banda de titanio, que es 3,2 eV para Anatasa, puede conducir a que sea activo en la luz visible. Por otra parte, como se observa en la figura 1 (paso 4), la formación de poros en la capa de óxido de titanio de fotoánodo puede conducir a una mayor absorción de la luz incidente
Sin embargo, este método a menudo se ve obstaculizado por la recombinación de los electrones y agujeros antes de que logren incrustarse los electrones de interés. Por ello una estrategia nueva, para ayudar a suprimir el proceso de recombinación y mejorar la eficiencia de TiO 2 en la actividad fotocatalítica es el doble-dopado del TiO2.
En la actualidad el dopaje del TiO2 con plata, cobre y óxido de zinc en conjunto con iones de nitrógeno, boro y tierras raras es un foco de investigación importante, que busca aumentar la capacidad fotocatalítica al rango de la luz visible y además aumentar las posibles interacciones del biomaterial con las bacterias.33,54,59,63-66
Resultados más destacados de óxido de titanio como agente antibacterial
Estudios recientes, reportan TiO2 codopado con plata-samario, mostrándose que el diámetro medio de partícula de Sm / Ag / TiO 2 fue de 14,62 nm y los iones de Ag y Sm estaban dispersos en la superficie de TiO2. Además estos estudios evidencian que las propiedades fotocatalíticas óptimas se daban en una proporción de Sm / Ag / TiO2 cercanos a 2: 2: 100 a 600 ºC. Los resultados anteriores muestran que el nanomaterial obtenido presenta un alto resistencia a la temperatura, buena actividad fotocatalítica y desempeño como antibacteriano ante la presencia de luz visible.67 El dopaje de dióxido de titanio también ha sido reportado con indio-cerio, plata-rodio, samario-cerio, plata- carbono activado, nitrógeno-oxido de indio y plata- nitrógeno. En todos los casos se observó como característica común una notable mejoría en la actividad fotocatalítica en la luz visible. Sin embargo la mayoría de estos estudios solo cuentan con una caracterización química y no con caracterización biológica lo cual deja bastantes inquietudes en cuanto a su interacción con bacterias.48,68-72
Así mismo el dopaje de TiO2 con zinc reporta resultados bastante interesantes, por ejemplo en 2014 Wang y colaboradores73 publicaron un artículo donde muestran el impacto de los aniones Cl-, Ac-, NO3- y SO42- en la capacidad antibacteriana del nanocompuesto; concluyendo que todos disminuyen la viabilidad celular, en especial el nanomaterial de TiO 2 dopado con Zn-SO4. El mismo autor74 también evaluó la actividad antimicrobiana de TiO2 dopada con zinc e itrio por el método de sol gel contra las bacterias Escherichi Coli y Sthapylococus Aureas. Los resultados mostraron que existió una disminución considerable en la viabilidad celular y que dicho efecto se conserva incluso cuando el material compuesto no está expuesto a la luz visible aunque en menor proporción. Estos mismos resultados son reportados por Wang y colaboradores75 donde sintetizan TiO 2 dopada con Zinc y Cesio por el método de sol gel.
Otros estudios reportan como materiales dopantes del TiO2 al estaño-manganeso y al boro-glicerol. Los resultados del primer estudio apuntan a tener un nanomaterial con alto potencial,76 mientras que el segundo analiza el efecto del boro como un ácido débil y su reacción con el compuesto polihidroxílico (tal como glicerol). En este último se generaron complejos estables, lográndo nanopartículas con una superficie rica en grupos hidroxilos que causan la ruptura de la membrana celular, potenciando la actividad antibacteriana de los materiales.77
En este sentido el dióxido de titanio dopado con nitrógeno y cobre, puede evidenciar excelentes propiedades fotocatalíticas. De ello existen pocos reportes en la literatura y en este trabajo se citan tres de ellos. En el primer estudio realizado por Wang y colaboradores78 se evalúan las propiedades electrónicas y ópticas del TiO2 por medio de análisis computacional y caracterización química, obteniéndose como resultado mejoras relevantes en la banda intermedia del TiO2 lo que conlleva a actividad fotocatalítica en el espectro de luz visible. El segundo artículo publicado también en 2014, Dashora y colaboradores79 analizaron la influencia de las nanopartículas TiO2 dopadas con Cu y N sobre la actividad catalítica solar, el diseño experimental planteado permitió concluir que a mayor concentración de dopante aumenta el número de defectos intrínsecos de TiO2 (más iones de Cu sustituyen iones Ti, mientras los átomos de N sustituyen los átomos de O). Estos dos dopantes extienden la absorción de TiO2 a la gama visible. En un trabajo posterior, Jaiswala y colaboradores80 analizaron las mismas nanopartículas y sus resultados fueron bastante positivos, ya que demostraron que la absorción de la luz visible fue más alta, una característica que atribuyen a la formación de una banda intermedia aislada (IB) que se produce debido a la fuerte hibridación entre los átomos de cobre y nitrógeno.
Por último, en la tabla se pueden apreciar varios estudios que demuestran que el co-dopaje de TiO2 con elementos metálicos e inorgánicos genera efectos sinérgicos, lo que se traduce en mejores propiedades de absorción en la región de luz visible. Generándose materiales con mayor actividad bactericida en condiciones favorables.
CONSIDERACIONES FINALES
De acuerdo con lo anterior, se puede concluir que, aunque las infecciones nosocomiales han disminuido, datos de la Organización Panamericana de la Salud (OPS,) muestran que más de 1,4 millones de personas en el mundo contraen infecciones en el hospital (OPS. Vigilancia de las Infecciones Asociadas a la Atención en Salud, módulo I) y es por ello que el desarrollo de materiales antibacterianos es un reto actual.
También es preciso mencionar que los trabajos revisados sugieren que la eficiencia de los agentes antibacterianos inorgánicos tales como los metales y los óxidos de metal tiene una relación directa con su tamaño y la relación de superficie volumen, pues estas características son determinantes en la interacción de los materiales con la membrana bacteriana.
Se evidencia que el estudio del TiO2 doble dopado con nanopartículas antibacterianas tradicionales como la plata, el cobre y el zinc es un área de estudio importante gracias a que aumenta el rendimiento de las nanopartículas de dióxido de titanio en la luz visible. Además el estudio de TiO2 codopado con elementos como N y Cu es bastante reciente y existe un vacío en conocimiento relacionado con la caracterización biológica de este tipo de nuevos materiales, dado que pocos estudios realizados solo cuentan con una caracterización química.
Por otro lado, hasta la fecha se discute el efecto del doble dopaje en las nanopartículas de TiO2, sin embargo, se sugiere que el efecto favorable se debe a la carga compensada de cationes y aniones que resultan de la pasivación de defectos, para evitar la recombinación.
Declaración de Conflicto de Intereses
Los autores declaran que no poseen ningún tipo de conflicto de intereses, ni financiero ni personal, que puedan influir en el desarrollo de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Song J, Jang J. Antimicrobial polymer nanostructures: synthetic route, mechanism of action and perspective. Adv Colloid Interface Sci. 2014 Jan;203:37-50.
2. Tamayo LA, Zapata PA, Vejar ND, Azócar MI, Gulppi MA, Zhou X, et al. Release of silver and copper nanoparticles from polyethylene nanocomposites and their penetration into Listeria monocytogenes. Mater Sci Eng C Mater Biol Appl. 2014 Jul 1;40:24-31.
3. Ávila Reyes C. Infecciones intrahospitalarias cuestan 727 mil millones anuales. UNperiódico. Feb 13 2011; (141):15.
4. Moritz M, Geszke-Moritz M. The newest achievements in synthesis, immobilization and practical applications of antibacterial nanoparticles. Chem Eng J. 2013;228:596-613.
5. Monteiro DR, Gorup LF, Takamiya AS, Ruvollo-Filho AC, de Camargo ER, Barbosa DB, et al. The growing importance of materials that prevent microbial adhesion: antimicrobial effect of medical devices containing silver. Int J Antimicrob Agents. 2009 Aug;34(2):103-10.
6. Hajipour MJ, Fromm KM, Akbar Ashkarran A, Jimenez de Aberasturi D, Larramendi IR De, Rojo T, et al. Antibacterial properties of nanoparticles. Trends Biotechnol. Elsevier Ltd. 2012;30(10):499-511.
7. Soenen SJ, Rivera-Gil P, Montenegro J-M, Parak WJ, De Smedt SC, Braeckmans K, et al. Cellular toxicity of inorganic nanoparticles: Common aspects and guidelines for improved nanotoxicity evaluation. Nano Today. 2011 Oct;6(5):446-65.
8. Verma A, Stellacci F. Effect of surface properties on nanoparticle-cell interactions. Small. 2010;6(1):12-21.
9. Scuderi V, Buccheri MA, Impellizzeri G, Di Mauro A, Rappazzo G, Bergum K, et al. Photocatalytic and antibacterial properties of titanium dioxide flat film. Mater Sci Semicond Process. 2016;42:32-5.
10. Chen X, Mao SS. Titanium dioxide nanomaterials: Synthesis, properties, modifications and applications. Chem Rev. 2007;107(7):2891-959.
11. Lavilla Lerma L, Benomar N, Casado Muñoz M del C, Gálvez A, Abriouel H. Correlation between antibiotic and biocide resistance in mesophilic and psychrotrophic Pseudomonas spp. isolated from slaughterhouse surfaces throughout meat chain production. Food Microbiol. 2015 Oct;51:33-44.
12. Michalak I, Chojnacka K. Encyclopedia of Toxicology. Encyclopedia of Toxicology. Elsevier; 2014. p. 461-3.
13. Bernatová S, Samek O, Pilát Z, Serý M, Ježek J, Jákl P, et al. Following the mechanisms of bacteriostatic versus bactericidal action using Raman spectroscopy. Molecules. Multidisciplinary Digital Publishing Institute. 2013 Jan 24;18(11):13188-99.
14. Ocampo PS, Lázár V, Papp B, Arnoldini M, Abel zur Wiesch P, Busa-Fekete R, et al. Antagonism between bacteriostatic and bactericidal antibiotics is prevalent. Antimicrob Agents Chemother. 2014 Aug;58(8):4573-82.
15. Lequeux I, Ducasse E, Jouenne T, Thebault P. Addition of antimicrobial properties to hyaluronic acid by grafting of antimicrobial peptide. Eur Polym J. 2014 Feb;51:182-90.
16. Dutta RK, Nenavathu BP, Gangishetty MK, Reddy AVR. Studies on antibacterial activity of ZnO nanoparticles by ROS induced lipid peroxidation. Colloids Surf B Biointerfaces. 2012 Jun;94:143-50.
17. Dong C, Cairney J, Sun Q, Maddan OL, He G, Deng Y, et al. Investigation of Mg(OH)2 nanoparticles as an antibacterial agent. J Nanoparticle Res. 2010;12(6):2101-9.
18. Jung WK, Koo HC, Kim KW, Shin S, Kim SH, Park YH, et al. Antibacterial activity and mechanism of action of the silver ion in Staphylococcus aureus and Escherichia coli. Appl Environ Microbiol. 2008;74(7):2171-8.
19. Fang M, Chen JH, Xu XL, Yang PH, Hildebrand HF. Antibacterial activities of inorganic agents on six bacteria associated with oral infections by two susceptibility tests. Int J Antimicrob Agents. 2006;27(6):513-7.
20. Zhang L, Jiang Y, Ding Y, Povey M, York D. Investigation into the antibacterial behaviour of suspensions of ZnO nanoparticles (ZnO nanofluids). J Nanoparticle Res. 2007;9(3):479-89.
21. Zhang B, lin y, Tang X, He S, Xie G. Synthesis, characterization, and antimicrobial properties of Cu-inorganic antibacterial material containing lanthanum. J Rare Earths. Elsevier. 2010 Dec;28:451-5.
22. MAO C, ZHANG B, TANG X, LI H, HE S. Optimized preparation of zinc-inorganic antibacterial material containing samarium using response surface methodology. J Rare Earths. 2014 Sep;32(9):900-6.
23. Ferraris S, Spriano S. Antibacterial titanium surfaces for medical implants. Mater Sci Eng C. 2015 Dec;61:965-78.
24. Dutta RK, Nenavathu BP, Gangishetty MK, Reddy AVR. Studies on antibacterial activity of ZnO nanoparticles by ROS induced lipid peroxidation. Colloids Surf B Biointerfaces. 2012 Jun 1;94:143-50.
25. Salem W, Leitner DR, Zingl FG, Schratter G, Prassl R, Goessler W, et al. Antibacterial activity of silver and zinc nanoparticles against Vibrio cholerae and enterotoxic Escherichia coli. Int J Med Microbiol. Elsevier GmbH. 2015;305(1):85-95.
26. de Azeredo HMC. Antimicrobial nanostructures in food packaging. Trends Food Sci Technol. 2013 Mar;30(1):56-69.
27. Novo M, Lahive E, Díez-Ortiz M, Matzke M, Morgan AJ, Spurgeon DJ, et al. Different routes, same pathways: Molecular mechanisms under silver ion and nanoparticle exposures in the soil sentinel Eisenia fetida. Environ Pollut]. Elsevier Ltd. 2015;205:385-93.
28. Liu Y, Liu Y, Liao N, Cui F, Park M, Kim H-Y, et al. Fabrication and durable antibacterial properties of electrospun chitosan nanofibers with silver nanoparticles. Int J Biol Macromol. Elsevier B.V. 2015;79:638-43.
29. Le Ouay B, Stellacci F. Antibacterial activity of silver nanoparticles: A surface science insight. Nano Today. 2015 Jun;10(3):339-54.
30. Jayaprakash N, Judith Vijaya J, John Kennedy L, Priadharsini K, Palani P. Antibacterial activity of silver nanoparticles synthesized from serine. Mater Sci Eng C. Elsevier B.V. 2015;49:316-22.
31. Ma G, Liang X, Li L, Qiao R, Jiang D, Ding Y, et al. Cu-doped zinc oxide and its polythiophene composites: Preparation and antibacterial properties. Chemosphere. 2014;100(2):146-51.
32. Gunalan S, Sivaraj R, Rajendran V. Green synthesized ZnO nanoparticles against bacterial and fungal pathogens. Prog Nat Sci Mater Int. Elsevier. 2013;22(6):693-700.
33. Qian Y, Yao J, Russel M, Chen K, Wang X. Characterization of green synthesized nano-formulation (ZnO-A. vera) and their antibacterial activity against pathogens. Environ Toxicol Pharmacol. Elsevier B.V. 2015;39(2):736-46.
34. Manoharan C, Pavithra G, Dhanapandian S, Dhamodharan P. Effect of In doping on the properties and antibacterial activity of ZnO films prepared by spray pyrolysis. Spectrochim Acta Part A Mol Biomol Spectrosc. Elsevier B.V. 2015;149:793-9.
35. Ren G, Hu D, Cheng EWC, Vargas-Reus MA, Reip P, Allaker RP, et al. Characterisation of copper oxide nanoparticles for antimicrobial applications. Int J Antimicrob Agents. 2009 Jun;33(6):587-90.
36. Rai A, Prabhune A, Perry CC. Antibiotic mediated synthesis of gold nanoparticles with potent antimicrobial activity and their application in antimicrobial coatings. J Mater Chem. 2010;20(32):6789.
37. De B, Gupta K, Mandal M, Karak N. Biocide immobilized OMMT-carbon dot reduced Cu2O nanohybrid/hyperbranched epoxy nanocomposites: Mechanical, thermal, antimicrobial and optical properties. Mater Sci Eng C. Elsevier B.V. 2015;56:74-83.
38. Lee Y-J, Kim S, Park S-H, Park H, Huh Y-D. Morphology-dependent antibacterial activities of Cu2O. Mater Lett. 2011 Mar;65(5):818-20.
39. Le Van N, Ma C, Shang J, Rui Y, Liu S, Xing B, et al. Effects of CuO nanoparticles on insecticidal activity and phytotoxicity in conventional and transgenic cotton. Chemosphere. 2015 Sep 22;144:661-70.
40. Hassan MS, Amna T, Kim HY, Khil M-S. Enhanced bactericidal effect of novel CuO/TiO2 composite nanorods and a mechanism thereof. Compos Part B Eng. 2013 Feb;45(1):904-10.
41. Sohrabnezhad SH, Mehdipour Moghaddam MJ, Salavatiyan T. Synthesis and characterization of CuO-montmorillonite nanocomposite by thermal decomposition method and antibacterial activity of nanocomposite. Spectrochim Acta - Part A Mol Biomol Spectrosc. Elsevier B.V. 2014;125:73-8.
42. Yoosefi Booshehri A, Wang R, Xu R. Simple method of deposition of CuO nanoparticles on a cellulose paper and its antibacterial activity. Chem Eng J. Elsevier B.V. 2015;262:999-1008.
43. Yadollahi M, Gholamali I, Namazi H, Aghazadeh M. Synthesis and characterization of antibacterial carboxymethyl cellulose/ZnO nanocomposite hydrogels. Int J Biol Macromol. Elsevier B.V. 2015;74:136-41.
44. Cai A, Sun Y, Chang Y, Guo A, Du L. Biopolymer-assisted in situ route toward Cu hollow spheres as antibacterial materials. Mater Lett. Elsevier. 2014;134:214-7.
45. Singh S, Mahalingam H, Singh PK. Polymer-supported titanium dioxide photocatalysts for environmental remediation: A review. Appl Catal A Gen. 2013 Jul;462-463:178-95.
46. Chen X, Mao SS. Synthesis of Titanium Dioxide (TiO2) Nanomaterials. J Nanosci Nanotechnol. 2006;6(4):906-25.
47. Pencheva D, Bryaskova R, Kantardjiev T. Polyvinyl alcohol/silver nanoparticles (PVA/AgNps) as a model for testing the biological activity of hybrid materials with included silver nanoparticles. Mater Sci Eng C. Elsevier B.V. 2012;32(7):2048-51.
48. Ashkarran AA, Hamidinezhad H, Haddadi H, Mahmoudi M. Double-doped TiO2 nanoparticles as an efficient visible-light-active photocatalyst and antibacterial agent under solar simulated light. Appl Surf Sci. 2014 May;301:338-45.
49. Menard A, Drobne D, Jemec A. Ecotoxicity of nanosized TiO2. Review of in vivo data. Environ Pollut. 2011 Mar;159(3):677-84.
50. Askeland DR, Phulé PP. Ciencia e Ingeniería de los Materiales. International Thomson Editores; 1998.
51. Avril L, Bourgeois S, Marco de Lucas MC, Domenichini B, Simon P, Addou F, et al. Thermal stability of Au-TiO2 nanocomposite films prepared by direct liquid injection CVD. Vacuum; 2015 Jun .
52. Piszczek P, Muchewicz Ż, Radtke A, Gryglas M, Dahm H, Różycki H, et al. CVD of TiO2 and TiO2/Ag antimicrobial layers: Deposition from the hexanuclear μ-oxo Ti(IV) complex as a precursor, and the characterization. Surf Coatings Technol. 2013 May;222:38-43.
53. Lee H, Song MY, Jurng J, Park Y-K. The synthesis and coating process of TiO2 nanoparticles using CVD process. Powder Technol. 2011 Nov;214(1):64-8.
54. Mahmoud MHH, Ismail AA, Sanad MMS. Developing a cost-effective synthesis of active iron oxide doped titania photocatalysts loaded with palladium, platinum or silver nanoparticles. Chem Eng J. 2012 Apr [cited 2015 Sep 15];187:96-103. Available from: http://www.sciencedirect.com/science/article/pii/S1385894712001477
55. Li C, Yoshimura M, Hotsuki N, Isobe T, Wang C, Matsushita S, et al. Processing of porous spherical Co-doped SiO2/Cu-grafted TiO2 hybrid particles for the decomposition of gaseous acetaldehyde in the dark and under visible light. Mater Lett. Elsevier. 2015;139:397-400.
56. Mori K, Maki K, Kawasaki S, Yuan S, Yamashita H. Hydrothermal synthesis of photocatalysts in the presence of and their application for degradation of organic compounds. Chem Eng Sci. 2008 Oct;63(20):5066-70.
57. Ahn J-H, Wang G, Kim Y-J, Lee H-M, Shin H-S. Synthesis and properties of Ti-O based nanowires. J Alloys Compd. 2010 Aug;504:S361-3.
58. Veréb G, Manczinger L, Oszkó A, Sienkiewicz A, Forró L, Mogyorósi K, et al. Highly efficient bacteria inactivation and phenol degradation by visible light irradiated iodine doped TiO2. Appl Catal B Environ. Elsevier B.V. 2013;129:194-201.
59. Zielińska A, Kowalska E, Sobczak JW, Łącka I, Gazda M, Ohtani B, et al. Silver-doped TiO2 prepared by microemulsion method: Surface properties, bio- and photoactivity. Sep Purif Technol. 2010 May 11;72(3):309-18.
60. Janković B, Marinović-Cincović M, Dramićanin M. Kinetic study of isothermal crystallization process of Gd2Ti2O7 precursor's powder prepared through the Pechini synthetic approach. J Phys Chem Solids. 2015 Oct;85:160-72.
61. Takamura H. Electrical conductivity of layered compounds in SrO-La2O3-TiO2 systems prepared by the Pechini process. Solid State Ionics. 2002 Dec 2;154-155:581-8.
62. Guglielmi M, Kickelbick G, Martucci A. Sol-Gel Nanocomposites. Springer; 2014.
63. Tobaldi DM, Pullar RC, Leoni M, Seabra MP, Labrincha JA. Nanosized titania modified with tungsten and silver: Microstructural characterisation of a multifunctional material. Appl Surf Sci. 2013 Dec;287:276-81.
64. Yadav HM, Otari S V, Koli VB, Mali SS, Hong CK, Pawar SH, et al. Preparation and characterization of copper-doped anatase TiO2 nanoparticles with visible light photocatalytic antibacterial activity. J Photochem Photobiol A Chem. Elsevier B.V. 2014;280:32-8.
65. Hebeish AA, Abdelhady MM, Youssef AM. TiO2 nanowire and TiO2 nanowire doped Ag-PVP nanocomposite for antimicrobial and self-cleaning cotton textile. Carbohydr Polym. 2013 Jan 16;91(2):549-59.
66. Yousef A, El-Halwany MM, Barakat NAM, Al-Maghrabi MN, Kim HY. Cu0- doped TiO2 nanofibers as potential photocatalyst and antimicrobial agent. J Ind Eng Chem. 2015 Jun;26:251-8.
67. Wu J, ZHANG G, Liu J, Gao H, Song C, DU H, et al. Synthesis, characteristics, and antibacterial activity of a rare-earth samarium/silver/titanium dioxide inorganic nanomaterials. J Rare Earths. The Chinese Society of Rare Earths. 2014 Aug;32(8):727-32.
68. Myilsamy M, Murugesan V, Mahalakshmi M. Indium and cerium co-doped mesoporous TiO2 nanocomposites with enhanced visible light photocatalytic activity. Appl Catal A Gen. Elsevier B.V. 2015 Feb;492:212-22.
69. Bokare A, Sanap A, Pai M, Sabharwal S, Athawale AA. Antibacterial activities of Nd doped and Ag coated TiO2 nanoparticles under solar light irradiation. Colloids Surf B Biointerfaces. 2013 Feb 1;102:273-80.
70. Eskandarloo H, Badiei A, Behnajady M, Ziarani GM. Ultrasonic-assisted sol-gel synthesis of samarium, cerium co-doped TiO2 nanoparticles with enhanced sonocatalytic efficiency. Ultrason Sonochem. Elsevier B.V. 2015;26:281-92.
71. Caro C, Gámez F, Sayagues MJ, Polvillo R, Royo JL. AgACTiO2 nanoparticles with microbiocide properties under visible light. Mater Res Express. IOP Publishing. 2015;2(5):055002.
72. Myilsamy M, Mahalakshmi M, Murugesan V, Subha N. Enhanced photocatalytic activity of nitrogen and indium co-doped mesoporous TiO2 nanocomposites for the degradation of 2,4-dinitrophenol under visible light. Appl Surf Sci. 2015 Jul;342:1-10.
73. Wang Y, Xue X, Yang H. Modification of the antibacterial activity of Zn/TiO2 nano-materials through different anions doped. Vacuum. 2014;101:193-9.
74. Wang Y, Yang H, Xue X. Synergistic antibacterial activity of TiO2 co-doped with zinc and yttrium. Vacuum. Elsevier Ltd. 2014;107:28-32.
75. Wang Y, Xue X, Yang H, Luan C. Preparation and characterization of Zn/Ce/SO42−-doped titania nano-materials with antibacterial activity. Appl Surf Sci. 2014 Feb;292:608-14.
76. Tripathi AK, Mathpal MC, Kumar P, Singh MK, Soler MAG, Agarwal A, et al. Structural, optical and photoconductivity of Sn and Mn doped TiO2 nanoparticles. J Alloys Compd. 2015 Feb;622:37-47.
77. Yang H, Wang Y, Xue X. Influences of glycerol as an efficient doping agent on crystal structure and antibacterial activity of B-TiO2 nano-materials. Colloids Surfaces B Biointerfaces. Elsevier B.V. 2014;122:701-8.
78. Wang S, Yang XJ, Jiang Q, Lian JS. Enhanced optical absorption and photocatalytic activity of Cu/N-codoped TiO2 nanocrystals. Mater Sci Semicond Process. Elsevier. 2014;24:247-53.
79. Dashora A, Patel N, Kothari DC, Ahuja BL, Miotello A. Formation of an intermediate band in the energy gap of TiO2 by Cu-N-codoping: First principles study and experimental evidence. Sol Energy Mater Sol Cells. Elsevier. 2014;125:120-6.
80. Jaiswal R, Bharambe J, Patel N, Dashora A, Kothari DC, Miotello A, et al. Copper and Nitrogen co-doped TiO2 photocatalyst with enhanced optical absorption and catalytic activity. Appl Catal B Environ. 2015 Jun;168-169:333-41.
81. Zhao YF, Li C, Lu S, Liu RX, Hu JY, Gong YY, et al. Electronic, optical and photocatalytic behavior of Mn, N doped and co-doped TiO2: Experiment and simulation. J Solid State Chem. 2016 Mar;235:160-8.
82. Eskandarloo H, Badiei A, Behnajady MA, Ziarani GM. Ultrasonic-assisted sol-gel synthesis of samarium, cerium co-doped TiO2 nanoparticles with enhanced sonocatalytic efficiency. Ultrason Sonochem. 2015 Sep;26:281-92.
83. Mattsson A, Lejon C, Bakardjieva S, Štengl V, Österlund L. Characterisation, phase stability and surface chemical properties of photocatalytic active Zr and Y co-doped anatase TiO2 nanoparticles. J Solid State Chem. 2013 Mar;199:212-23.
84. Kaur T, Sraw A, Wanchoo RK, Toor AP. Visible -Light Induced Photocatalytic Degradation of Fungicide with Fe and Si Doped TiO2 Nanoparticles. Mater Today Proc. 2016;3(2):354-61
Recibido: 25 de julio de 2016.
Aprobado: 26 de agosto de 2016.
Robison Buitrago Sierra. Grupo de Investigación Materiales Avanzados y Energía- MATyER. Instituto Tecnológico Metropolitano. Medellín, Colombia.