Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.37 no.3 Ciudad de la Habana jul.-set. 2018
Artículo de revisión
Estrés y cortisol: implicaciones en la ingesta de alimento
Stress and cortisol: implications on food intake
Celso Enrique Cortés Romero
Alejandra Escobar Noriega
Jorge Cebada Ruiz
Guadalupe Soto Rodríguez
Tania Bilbao Reboredo
Marcela Vélez Pliego
Benemérita Universidad Autónoma de Puebla, Facultad de Medicina. México.
RESUMEN
La búsqueda de alimento y su consumo son conductas dirigidas a satisfacer la obtención de los sustratos energéticos necesarios para sostener las diferentes funciones orgánicas que un individuo requiere para garantizar su supervivencia. La conducta alimentaria cuenta con dos sistemas reguladores, uno homeostático ubicado en hipotálamo y otro de tipo hedónico, representado por el sistema de recompensa cerebral. Dichos sistemas están modulados por señales estimuladoras (orexigénicas) e inhibidoras (anorexigénicas) del apetito. En condiciones de estrés crónico, la actividad del eje hipotálamo-hipófisis-adrenal, que regula la concentración de cortisol plasmático, dará lugar al establecimiento de diferentes mecanismos que promuevan la ingesta de alimento de elevada densidad energética, los cuales son considerados como poderosos disruptores de los procesos de regulación del apetito, condición potencialmente capaz de favorecer el desarrollo de una conducta compulsiva en la búsqueda de alimento, una disrupción en el balance energético y obesidad. El consumo repetido de alimentos apetitosos representa para los individuos vulnerados una oportunidad de automedicación dirigida al alivio del estrés, brindando una condición u oportunidad de confort. Los datos epidemiológicos sustentan la idea de un fuerte vínculo entre glucocorticoides y síndrome metabólico. La relación entre estrés crónico, cortisol e ingesta elevada de alimento tienen a la adiposidad visceral y a la resistencia a la insulina como factores predisponentes de una disrupción metabólica con consecuencias importantes al estado de salud de los seres humanos. El presente artículo tiene como objetivo valorar las implicaciones del estrés y cortisol sobre la ingesta de alimento.
Palabras clave: cortisol; estrés; ingesta de alimento; obesidad; sistema de recompensa.
ABSTRACT
Behaviors such as the search and consumption of food are aimed to obtain the energy substrates needed to sustain diverse organic functions required to guarantee the survival of an individual. The alimentary behavior has two regulatory systems: the homeostatic system, located in the hypothalamus and the hedonic system, represented by the cerebral reward system. These systems are modulated by both stimulatory (orexigenic) and inhibitory (anorexigenic) signals of appetite. Under chronic stress conditions, the activity of the hypothalamic-pituitary-adrenal axis, which regulates the plasma cortisol concentration, will lead to the establishment of different mechanisms that promote the ingestion of food with high energy density, which are considered as powerful disruptors of appetite regulation processes, a condition potentially capable of promoting the development of compulsive food search behavior, a disruption in the energy balance and obesity. Repeated consumption of appetizing foods represents an opportunity for self-medication aimed at stress relief, providing a condition or opportunity for comfort. Epidemiological data suggests a strong link between glucocorticoids and metabolic syndrome. The relationship between chronic stress, cortisol and high food intake has visceral adiposity and insulin resistance as predisposing factors of metabolic disruption with important consequences to the health status of humans. The purpose of this article is to evaluate the implications of stress and cortisol on food intake.
Key words: cortisol; stress; food intake; obesity; reward system.
INTRODUCCIÓN
La búsqueda de alimento y su consumo representan conductas dirigidas a satisfacer la obtención de los sustratos energéticos necesarios para el mantenimiento de las diferentes funciones orgánicas que un individuo requiere para garantizar su supervivencia. Asimismo, el inicio de una comida y su conclusión, la cantidad y selección del tipo de alimento ingerido, implican una comunicación neuroendocrina entre tejidos, órganos periféricos y sistema nervioso central.1 De lo anterior, es importante destacar que la aparición de la conducta para la ingesta de alimento está garantizada por un sistema homeostático ubicado en hipotálamo. Adicionalmente, esta misma conducta también se encuentra influida por un sistema hedónico, el cual comprende al sistema de recompensa o de reforzamiento cerebral.2 De igual forma, ambos sistemas encargados del control de la conducta alimentaria pueden estar sujetos, bajo determinadas circunstancias fisiológicas, a experimentar una modulación en su funcionamiento, tal como sucede bajo condiciones de estrés. El presente artículo tiene como objetivo valorar las implicaciones del estrés y cortisol sobre la ingesta de alimento.
CONTROL HOMEOSTÁTICO DE LA ALIMENTACIÓN
En la región inferior del diencéfalo se localiza el hipotálamo, el cual es un centro de integración de múltiples señales tanto centrales como periféricas, que al ser procesadas de manera adecuada promueven la elaboración de respuestas que, por medio del sistema nervioso autónomo y endocrino, tienen como objetivo la conservación del estado homeostático del organismo. El funcionamiento hipotalámico está basado en la interconexión que existe entre una importante variedad de núcleos, que a su vez emplean diversas señales químicas y receptores para su comunicación. Debemos decir entonces que el núcleo arqueado (ARC) del hipotálamo está conformado por dos grupos de neuronas, por un lado, aquellas que sintetizan neuropéptido Y (NPY) y el péptido relacionado con agouti (AgRP), y cuya estimulación promueve la ingesta de alimento. Mientras que el otro conjunto de neuronas del ARC sintetiza proopiomelanocortina (POMC) y al transcrito regulado por cocaína y anfetamina (CART), y su activación ocasiona la inhibición de la ingesta de alimento.3 Ambos grupos neuronales del ARC responden a señales periféricas provenientes del tejido adiposo y del páncreas (leptina e insulina, respectivamente), así como del tracto gastrointestinal (ghrelina). La presencia de ghrelina en el hipotálamo favorece la activación de las neuronas NPY/AgRP y la inhibición de las neuronas POMC/CART, por el contrario, la señalización por leptina e insulina es capaz de inhibir a las neuronas orexigénicas NPY/AgRP del ARC y de estimular a las neuronas anorexigénicas POMC/CART, lo que se traduce en una disminución de la ingesta de alimento y en un aumento del gasto energético. Otros núcleos hipotalámicos clave en el control de la ingesta de alimento, cuya función integral representaría el centro de la saciedad y por lo tanto tienen función anorexigénica, son el núcleo paraventricular (NPV), productor de señales anorexigénicas como CRH y oxitocina, el núcleo ventromedial (NVM) y el núcleo dorsomedial (NDM). Mientras que el área hipotalámica lateral (AHL) que contiene neuronas que sintetizan y liberan a la hormona concentradora de melanina (MCH) y a las orexinas A y B, representa al centro del hambre y consecuentemente se desempeña como una región con función orexigénica.2 Cabe hacer mención que existen señales de saciedad, que operan en el corto plazo, como la colecistocinina, la cual está involucrada con la regulación del tamaño de una comida al actuar en áreas específicas del tallo encefálico, especialmente a nivel del núcleo del tracto solitario.4,5
EJE HIPOTÁLAMO-HIPÓFISIS-ADRENAL
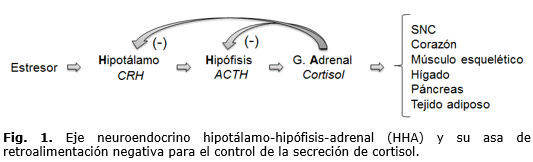
Los cambios o ajustes que ocurren en la función de tejidos, órganos y sistemas como consecuencia de la variabilidad de las condiciones ambientales, son consecuencia de procesos de adaptación frente a circunstancias de exigencia física y psicológica. Dentro de los mecanismos de adaptación se encuentra involucrado de manera por demás trascendente el eje hipotálamo-hipófisis-adrenal (HHA), cuyo funcionamiento tiene múltiples implicaciones en la salud y enfermedad de un individuo. Esto es, una situación detectada o reconocida como amenazante está representada por estresores físicos (ayuno, una quemadura, una infección, el ejercicio extenuante o la deshidratación), pero también por estresores psicológicos, cuya implicación fisiológica depende considerablemente de la manera en la que el individuo procesa la información así como de la experiencia previa ante este tipo de circunstancias.6 La aparición de un estresor físico o psicológico activará estructuras del tallo cerebral y/o del sistema límbico, respectivamente, dichas regiones establecerán comunicación con el NPV, el cual sintetiza la hormona liberadora de corticotropina (CRH), que es liberada por las terminaciones nerviosas en la eminencia media, para luego ingresar a la circulación sanguínea portal y ser transportada al lóbulo anterior de la hipófisis, donde estimulará la secreción de la hormona adrenocorticotrópica (ACTH) desde las células corticotropas. Por su parte, la ACTH será la encargada de promover la secreción de cortisol desde la corteza suprarrenal. El asa de retroalimentación se cerrará cuando el nivel de cortisol en plasma se haya elevado lo suficiente para inhibir en hipotálamo e hipófisis la liberación de CRH y ACTH, respectivamente (Fig. 1).6,7 Cabe hacer mención que la secreción de cortisol está también regida por un ritmo circadiano que determina un máximo en su secreción por la mañana y el nivel más bajo por la noche. Adicionalmente, es importante mencionar que la liberación de cortisol está fuertemente condicionada por los horarios de actividad física y de comida, o bien por los cambios de iluminación ambiental de tipo artificial a los que puede estar sometido el individuo.7
Una vez presente en torrente sanguíneo, el cortisol tiene una vida media de entre 60 y 90 minutos y puede encontrarse en tres estados: libre o no ligado en un 5-6 %; unido a la albúmina en un 4-5 %; o bien unido en un 90 % a la proteína transcortina, también conocida como globulina transportadora de corticoesteroides (CBG).8
En complemento a los procesos de liberación de cortisol, tenemos que el hipotálamo tendrá a cargo también la activación de diversas regiones cerebrales y núcleos del tallo encefálico dirigidos a la activación de la división simpática del sistema nervioso autónomo (SNA), permitiendo la liberación de adrenalina desde la médula suprarrenal, que junto con la presencia de cortisol en torrente sanguíneo, ocasionarán la aparición de respuestas vegetativas y conductuales dirigidas a hacer frente a las condiciones adversas que experimente el individuo.6 El cortisol es una hormona con acciones catabólicas, capaz de prevenir la hipoglucemia y de promover, en diferentes tejidos, efectos permisivos para la acción de hormonas como el glucagón y las catecolaminas, es decir, las acciones de estas últimas tendrían apenas un sutil efecto sin la presencia de cortisol (tabla).9
RECEPTORES PARA CORTISOL
Las acciones fisiológicas del cortisol se encuentran mediadas por el receptor mineralocorticoide (MR), denominado también tipo 1, y por el receptor a glucocorticoide (GR), también llamado tipo 2, los cuales forman parte de una superfamilia de receptores nucleares que funcionan como factores de transcripción activados por ligando, induciendo o reprimiendo la transcripción de genes, que a su vez representan del 10 al 20 % del genoma humano.10 El MR tiene una afinidad 10 veces mayor por cortisol respecto del GR.11 La distribución de MR en el organismo es discreta, pero su localización lo implica en funciones homeostáticas y cognitivas. Por su parte el GR presenta una baja afinidad por cortisol y tiene una amplia distribución en el organismo, además su activación depende de manera directa de la concentración de su ligando. De lo anterior, el MR media los efectos de cortisol a concentraciones bajas o en condiciones fisiológicas basales y cuando los niveles de la hormona aumentan, como ocurre durante el estrés o la secreción pulsátil bajo control circadiano, serán los GR los mediadores de los efectos biológicos del cortisol a nivel de tejido nervioso y órganos periféricos.12,13 Por otro lado, algunas acciones de los glucocorticoides son muy rápidas para considerar una proceso genómico de por medio, el cual regularmente involucra la síntesis de proteínas, por lo que determinados efectos del cortisol podrían ser mediados por receptores de membrana celular. Es sabido que la adecuada expresión y señalización del GR a nivel central, permitirá la adecuada inhibición de la secreción de ACTH y de CRH a nivel de hipófisis anterior y del NPV, respectivamente, por lo que dicho receptor representa una pieza clave en el mecanismo de retroalimentación negativa que el cortisol deberá ejercer durante la respuesta al estrés. Una alteración de la función del eje HHA debida a un fallo en la señalización del GR, se ha relacionado a diferentes trastornos como la depresión, desórdenes de tipo metabólico, alimenticio, cronobiológico y con la función del sistema inmunológico,14,15 por lo que el inadecuado funcionamiento o actividad del eje HHA podría representar una causa o bien una consecuencia de algún desorden orgánico (Fig. 2).4
ESTRÉS AGUDO Y CRÓNICO
El término estrés fue acuñado por Hans Selye en 1936 quien, con base a resultados obtenidos en sus trabajos de laboratorio, observó un "síndrome de adaptación general" en los animales de experimentación como respuesta ante una situación de amenaza. Los ajustes fisiológicos, psicológicos y de conducta de un individuo detonados ante condiciones de adversidad leve o excesiva representan la respuesta a lo que denominamos estrés, esto es, la condición determinada por las experiencias o factores que trastocan la estabilidad emocional y/o física del individuo.16,17 La respuesta que nuestro organismo experimenta ante una condición reconocida como estresante puede describirse en tres etapas:
- Fase de alarma o alerta, donde la activación del eje HHA y el aumento en la función de la división simpática.
Dan lugar a la movilización de energía desde los almacenes hepático y adiposo, al incremento del gasto cardiaco, de la frecuencia ventilatoria, al aumento de la presión arterial y de la glucosa en sangre, así como a una mayor irrigación sanguínea del músculo esquelético y del cerebro. Todo lo anterior sustenta la reacción de lucha-huida del organismo. Al mismo tiempo, deberán inhibirse aquellas funciones relacionadas con el consumo de alimento y la digestión, con el descanso o conciliación del sueño, y con la reproducción, entre otras. Lo anterior representa una respuesta típica ante una condición de amenaza inmediata, misma que es favorable puesto que nos permitiría superar situaciones adversas a través de la orquestación de diferentes procesos fisiológicos, por lo que si el individuo logra la adaptación al estrés agudo se restablecería el equilibrio en las funciones orgánicas.18 Podemos decir también que, sin esta capacidad de respuesta frente a estresores, nuestra sobrevivencia se vería francamente vulnerada. Por otro lado, si el estrés se prolonga, se cumpliría una segunda etapa:
- Fase de resistencia o de defensa, en la que el individuo soporta el estrés físico y/o mental, sin embargo, esto podría derivar en el agotamiento de las reservas orgánicas. De suceder lo anterior, el funcionamiento del sistema neuroendocrino será entonces insuficiente, situándonos en una tercera etapa:
- Fase de agotamiento, en la que la exposición al estresor se ha prolongado o incluso aumentado su intensidad, por lo que el estrés crónico favorecería la aparición de desajustes en las respuestas neurohumorales, en la homeostasis energética y en la conducta de alimentación, dando lugar al establecimiento de una condición fisiopatológica.17-19
Cabe mencionar que, para que los estresores sean capaces de producir una respuesta fisiológica, deberán ser detectados y procesados por el sistema nervioso para otorgarles una valoración cognitiva, por lo que la percepción psicológica del estresor, puede ser diferente en cada individuo y provocar respuestas de adaptación distintas.20
INGESTA DE ALIMENTO INDUCIDA POR ESTRÉS
Como se mencionó antes, el estrés es capaz de promover ajustes en la manera en la que interaccionamos con nuestro ambiente, de establecer cambios en la conducta y en la función orgánica. Dentro de estos cambios existe uno que hoy en día cobra especial importancia en la salud pública de nuestro país y del resto del mundo, nos referimos al problema de salud llamado sobrepeso y obesidad. Bajo este panorama, México comparte con los Estados Unidos de Norteamérica, el primer lugar de prevalencia mundial de obesidad en la población adulta. Y la población infantil, que también está afectada por dicha condición, coloca a México en el cuarto lugar de prevalencia a nivel internacional. El panorama no es nada alentador, por lo que las directrices en política de salud deberán, entre otros, dirigir su atención y esfuerzos a contrarrestar esta condición responsable del detrimento en la salud y calidad de vida de la población. Respecto a la estimación de la Organización para la Cooperación y el Desarrollo Económicos (OCDE) se calcula que dos terceras partes de la población mundial tendrán sobrepeso u obesidad en el año 2020.21
En este contexto, el desequilibrio energético (desbalance entre la cantidad de energía consumida y gastada) en el individuo representaría en esencia una importante causa del sobrepeso y obesidad. En otras palabras, la conducta alimentaria regida por un mecanismo homeostático dirigido en principio a cubrir la necesidad de energía a través de la ingesta de alimento, puede ser vulnerada por factores neurohumorales involucrados en la respuesta fisiológica al estrés o por las características hedónicas del alimento, condiciones que en combinación son capaces de detonar una paulatina y creciente ganancia de peso en los individuos que experimentan el crecimiento y perpetuación patológica del almacén graso corporal, a su vez relacionado con una multiplicidad de patologías de tipo metabólico.22
Como se mencionó antes, existe una relación entre la conducta alimentaria y determinadas señales neurohumorales derivadas de condiciones adversas, especialmente de tipo psicológicas, que, de acompañarse con un ambiente de elevada disponibilidad de comida, determinaría una ingesta de alimento inducida por estrés, la cual estaría dirigida, de manera engañosa, a la obtención de un estado de mejoría a través del consumo de alimento y bebida en respuesta a una condición estresante.22
Se debe mencionar que la sensación de hambre se entiende como la condición de necesidad de alimento dirigido al sostenimiento de las funciones del organismo. Mientras que el apetito se define como el deseo o anhelo de alimento con características particulares, comúnmente rico en azúcar y/o grasa.18 El consumo de alimento que es atractivo a los sentidos o bien denominado apetitoso, representa una actividad placentera que reduce la condición de estrés experimentada.23 Sin embargo y de manera peligrosa, la conducta dirigida a la ingesta repetida de alimento con una elevada densidad calórica es capaz de establecer un efecto reforzador, probablemente a través de mecanismos y circuitos neuronales similares a los del consumo de alcohol o de otras sustancias de abuso lícitas o ilícitas.24,25 Así, una combinación de estrés y consumo de alimentos con alta densidad energética parece representar una condición inductora clave para la ganancia de peso y desarrollo de obesidad. Dentro de las evidencias que respaldan este hecho, tenemos que la presencia de glucocorticoides a nivel del ARC en hipotálamo promueven la síntesis y liberación de NPY y del péptido relacionado con agouti (señales orexigénicas) e inhiben simultáneamente la liberación de CRH (señal anorexigénica).26 Adicionalmente, existe evidencia que demuestra que la ausencia de glucocorticoides endógenos, consecuencia de una adrenalectomía, ocasiona una pérdida de peso y reducción en la ingesta de alimento o hipofagia, siendo este último fenómeno asociado a una mayor síntesis y liberación de péptidos anorexigénicos como CRH y oxitocina a nivel del NPV, simultáneamente existe una menor producción de péptidos orexigénicos también a nivel central.27,28 La conducta hipofágica debida a la inexistencia endógena de glucocorticoides, pude revertirse con la administración en el hipotálamo de antagonistas de receptores a CRH y oxitocina.4,25
Caso contrario ocurre ante la evidencia clínica del síndrome de Cushing, donde se demuestra que la presencia crónica y el exceso de glucocorticoides favorece el apetito, una condición de hiperinsulinemia y la inevitable ganancia de peso.29 De igual manera, existe evidencia sobre el hecho de que la combinación de glucocorticoides e insulina impulsan el consumo de alimentos grasos, en cambio la presencia de una mayor concentración de glucocorticoides, pero no de insulina, aumentan la ingesta de alimento en general. Lo anterior genera la propuesta de que la combinación insulina y cortisol elevados puede ser un poderoso inductor al consumo de alimento rico en grasa.30
Durante un periodo de estrés crónico, junto con la elevación de cortisol existe también un aumento de los niveles circulantes de la hormona ghrelina, la cual es una señal periférica de "hambre", liberada por el estómago e intestino, especialmente cuando no existe alimento en el tracto gastrointestinal o bien debido al ayuno prolongado. El efecto orexigénico de ghrelina se basa en estimular a la población neuronal NPY/AgRP del ARC del hipotálamo, lo que resulta en una conducta de búsqueda e ingesta de alimento.29,31 El estrés agudo psicosocial es también una condición inductora de la elevación de ghrelina circulante.32
En este contexto, tenemos que los individuos catalogados como comedores emocionales son aquellos sujetos que cuando se sienten estresados consumen una mayor cantidad de alimento, en comparación con otros individuos que son llamados comedores no emocionales, que si bien pueden estar sometidos a estrés, su ingesta de alimento no cambia o incluso puede ser inhibida.33 Una distinción bioquímica principal entre ambos grupos es que los comedores emocionales tienen un nivel basal de grhelina más bajo y cuando ésta se eleva por una condición estresante, su concentración en plasma tiende a ser constante, induciendo a que al individuo tenga en alguna oportunidad una mayor ingesta de alimento. Los niveles basales de ghrelina más bajos han sido asociados al desorden alimentario conocido como atracón.29,34
Debemos mencionar que durante el estrés agudo lo común es experimentar la inhibición del apetito debido a la etapa de alerta que incluye la activación del sistema nervioso simpático. Bajo esta misma condición, la liberación, presencia y acción inhibidora de CRH y de urocortina 1 sobre las neuronas productoras de NPY y AgRP a nivel hipotalámico garantizarían la cancelación de la ingesta de alimento.35 Adicionalmente, durante el estrés agudo la presencia de cortisol plasmático promueve la liberación de insulina por el páncreas, cuyo traslado por torrente sanguíneo y posterior ingreso al sistema nervioso central entrega una señal periférica de saciedad.5
SISTEMA DE RECOMPENSA, GLUCOCORTICOIDES Y ALIMENTO APETITOSO
Los humanos contamos con un sistema cerebral capaz de generar un estado de satisfacción con base a la realización de determinadas conductas, y con ello se garantiza la repetición de ciertos comportamientos. Dicho sistema de recompensa o de reforzamiento lo integran estructuras del sistema mesolímbico, donde la producción y liberación de dopamina cobra especial importancia en la motivación para ejercer una determinada conducta. El área tegmental ventral (ATV) y el núcleo accumbens (NAc) son regiones estratégicas de este sistema mesolímbico,36,37 que a su vez guarda una estrecha intercomunicación con el NPV (regulador de gasto energético), el AHL (centro del hambre), la corteza prefrontal (centro de procesamiento cognitivo, planeación y toma de decisiones), la amígdala (sitio de procesamiento de la información relacionada con las emociones) y el hipocampo (centro de formación de la memoria influido por señales periféricas relacionadas con la ingesta de alimento), tal interconexión representa una compleja red nerviosa funcionalmente involucrada con el procesamiento de la información sensorial obtenida del consumo de alimentos considerados apetitosos. A la integración funcional de estas estructuras se suma el núcleo del tracto solitario (NTS), localizado en el tallo encefálico, involucrado en la recepción y procesamiento de señales provenientes de los sabores de los alimentos presentes en la cavidad oral, y con el envío de la información sensorial hacia NAc y AHL.2,38
La activación del NAc por la dopamina proveniente de las fibras nerviosas del ATV, o bien por señales estimuladoras desde NTS relacionadas con el consumo de alimento y la detección de su sabor, favorecen la comunicación del NAc con el AHL, el cual al ser estimulado producirá y liberará señales químicas, como las orexinas (A y B) y la molécula MCH, que inciden sobre el sistema homeostático de la ingesta de alimento pero también sobre el sistema hedónico al entregar una señal positiva sobre el ATV, cuya activación garantiza un incremento de la función del NAc, redundando en el hecho de que mantener activo al NAc da lugar no solo a experimentar placer sino a garantizar también la repetición de la conducta que brinda dicha condición, como por ejemplo el consumo de alimentos apetitosos o altamente agradables al paladar del individuo. Sin embargo, el consumo continuo de este tipo de alimento, más allá de la sensación placentera obtenida con su ingesta tendría consecuencias importantes para la salud del organismo, puesto que es sabido que los alimentos con elevada densidad energética son poderosos disruptores de los procesos de regulación del apetito, por lo que el consumo de este tipo de alimento daría lugar a una elevación del umbral de activación del sistema de recompensa, condición que potencialmente sería capaz de favorecer una mayor ingesta y una conducta compulsiva de búsqueda de alimento.38,39
Diversos estudios han descrito la influencia que tiene el consumo de alimento apetitoso sobre la conducta alimentaria de roedores, revelando que la ingesta repetida y prolongada inducirá la búsqueda y consumo aún ante la presencia simultánea de estímulos dolorosos o del establecimiento de condiciones displacenteras en sus nichos artificiales.40 Tales observaciones sugieren que la presencia de alimento apetitoso es una fuente de motivación para el consumo de alimento39 y consecuentemente promotor de un aumento del peso corporal a partir del desarrollo y crecimiento del tejido adiposo, situación estrechamente relacionada a la aparición de condiciones propias del síndrome metabólico. La ingesta de alimentos apetitosos o atractivos a los sentidos median un proceso de retroalimentación negativa sobre el eje HHA para inhibir su actividad por lo que son capaces de aliviar o disminuir la percepción de estrés.26
¿POR QUÉ LO ALIMENTOS APETITOSOS ALIVIAN EL ESTRÉS?
Una molécula clave, la dopamina, ha sido ampliamente involucrada con la adicción de sustancias de abuso, que de manera similar al consumo repetido de alimento rico en azúcar y grasa, permitiría una mayor liberación de dicha molécula a nivel del sistema de recompensa, específicamente sobre el NAc, generando un consumo compulsivo y descontrolado de alimento apetitoso.41,42 En relación a las situaciones de estrés, es sabido que las condiciones adversas crónicas inhiben la secreción de dopamina a nivel del NAc. Por lo tanto, la compensación de esa carencia o falta de dopamina en el sistema de recompensa deberá ser resuelta de algún modo, por lo que la conducta alimentaria dirigida a encontrar alivio a través del consumo de alimento tipo dieta de cafetería, representaría una alternativa, aunque potencialmente peligrosa a largo plazo.38
Las señales orexigénicas como las orexinas, ghrelina y NPY tiene la capacidad de modular la actividad eléctrica de las neuronas del ATV y promover la liberación de dopamina sobre el NAc.38
La evidencia obtenida a partir del estudio en animales expuestos a estrés crónico, ha revelado que existe una disminución de la actividad del eje HHA a través del consumo de alimentos apetitosos. Por ejemplo, en roedores, es posible la generación de una condición de estrés prolongado a partir de la separación materna temprana, situación que se acompaña de ansiedad y de una conducta depresiva, tales condiciones podrían ser revertidas por medio de la exposición y consumo de alimentos ricos en grasa.43
Condición que traspolada a situaciones humanas, podría sugerir que la conducta de consumo de alimentos apetitosos representa una oportunidad de automedicación dirigida al alivio del estrés por medio de alimentos que brindan una condición u oportunidad de confort. 44
EFECTO PERJUDICIAL DEL ESTRÉS CRÓNICO SOBRE LA SALUD
Los resultados obtenidos en estudios experimentales en animales confirman que el estrés físico o psicológico de tipo crónico se caracteriza por un nivel anormal de glucocorticoides y la presencia de características correspondientes al síndrome metabólico. De igual manera los datos epidemiológicos sustentan la idea de un fuerte vínculo entre síndrome metabólico y niveles elevados de glucocorticoides. Adicionalmente, la relación entre estrés crónico, glucocorticoides y síndrome metabólico tienen a la adiposidad visceral y a la resistencia a la insulina como factores predisponentes al establecimiento de trastornos metabólicos, por lo que la sobre actividad del eje HHA y el fallo en la señalización de la insulina a nivel central y periférico representan condiciones clave para la acumulación de grasa visceral.7
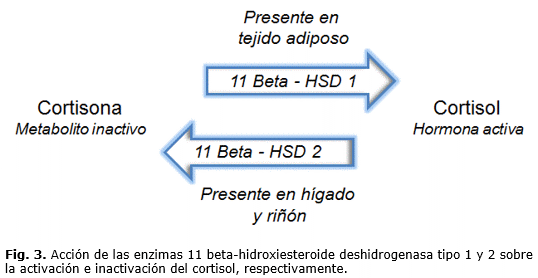
El efecto del estrés depende del tipo de estresor, de su duración y de la capacidad de respuesta o adaptación del individuo ante dicha condición. Cuando el estrés se torna crónico, es de esperarse un aumento del nivel de cortisol circulante en el organismo y en consecuencia de las acciones fisiológicas de dicho glucocorticoide.29 Es sabido que el cortisol tiene una acción francamente catabólica, puesto que promueve la lipólisis, la gluconeogénesis, así como la proteólisis muscular. 9 El cortisol también es capaz de estimular la acción de la enzima lipoproteína lipasa en el tejido adiposo visceral, donde dicha enzima tiene su mayor actividad bioquímica, por lo que la presencia crónica de glucocorticoides resultaría en la acumulación de tejido graso especialmente localizado en la región abdominal.29 Ha sido demostrado que el tejido adiposo abdominal o visceral cuenta con un mayor número de receptores para glucocorticoides respecto del tejido adiposo subcutáneo.45 Por otro lado, el crecimiento de una almacén graso abdominal daría lugar a un área de mayor dimensión para la expresión y funcionamiento de la enzima 11-ß-hidroxiesteroide deshidrogenasa tipo 1, la cual tiene la capacidad de trasformar la cortisona en cortisol activo, la acción inversa a la que realiza la enzima 11-ß-hidroxiesteroide deshidrogenasa tipo 2 (Fig. 3). 9 Por lo tanto, una mayor concentración de cortisol en sangre promovería la acumulación de un depósito graso abdominal, mismo que tendría la maquinaria enzimática para generar más cortisol, ocasionando el establecimiento de un círculo vicioso ante la condición de estrés crónico, dando lugar a la idea acerca de que la adiposidad abdominal podría representar una adaptación al estrés así como también una fuente de estrés dada la condición generadora de cortisol anteriormente comentada.46 El cortisol produce la liberación de insulina y leptina a nivel pancreático y adiposo, respectivamente, sin embargo el cortisol tiene la capacidad de disminuir la sensibilidad tisular para insulina y leptina, dando lugar entonces a una condición de resistencia orgánica a las acciones de ambas hormonas, que debemos recordar son señales reguladoras del hambre y también del balance energético.29 Aún más, en individuos con sobrepeso u obesidad la insulino/leptino resistencia invariablemente tiene un efecto directo sobre la correcta función de los mecanismos neuronales que regulan el hambre y la saciedad, y que consecuentemente están involucradas con el establecimiento de conductas de alimentación inadecuadas.47
En la actualidad la prevalencia de trastornos metabólicos, como la diabetes tipo 2, representan una causa importante de mortalidad y morbilidad a nivel mundial. La idea acerca de que un ambiente psicosocial adverso es un detonador de obesidad y diabetes tipo 2 es aceptada cada vez más. Adicionalmente, es sabido que una alta reactividad al estrés y la recuperación parcial o anormal de eventos adversos pasados son predictores importantes para el desarrollo de síndrome metabólico. La exposición a largo plazo de estrés psicológico o físico puede ocasionar un detrimento en la capacidad de respuesta del organismo y dar paso a alteraciones metabólicas.7
CONSIDERACIONES FINALES
El cortisol es una hormona indispensable para la adecuada función orgánica, su liberación ocurre por medio de la activación del eje neuroendocrino HHA, regulado por un proceso de retroalimentación negativa. La condición de estrés, especialmente de tipo crónico, es capaz de exigir a la función neuroendocrina y sobrepasar los mecanismos compensadores. El exceso de cortisol favorece la ingesta de alimento con elevada densidad energética, que junto con un estado de hiperinsulinemia contribuirían al establecimiento de obesidad, condición con un alto impacto en la salud pública mundial.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Cortés C, Baez B, Zamora I, Bilbao T, Cebada J, Galicia S, et al. Regulación de la ingesta de alimento: una aproximación al sistema endocannabinoide. Acad Biomédica Digit. 2015;(1):1-10.
2. Prospéro-García O, Díaz MM, Capuleño IA, Morales MP, Juárez JL, Contreras AER, et al. Inteligencia para la alimentación, alimentación para la inteligencia. Salud Ment. 2013;36(2):101-7.
3. Perry B, Wang Y. Appetite regulation and weight control: the role of gut hormones. Nutr Diabetes. 2012;2(1):e26.
4. Uchoa ET, Aguilera G, Herman JP, Fielder JL. Deak T, Cordeiro de Sousa MB, et al. Novel aspects of hypothalamic-pituititary-adrenal axis regulation and glucocorticoid actions. J Neuroendocr. 2014;26(9):557-72.
5. Havel PJ. Peripheral signals conveying metabolic information to the brain: short-term and long-term regulation of food intake and energy homeostasis. Exp Biol Med (Maywood). 2001;226(11):963-77.
6. Patricia J-B, De Gortari P. El estrés y sus efectos en el metabolismo y el aprendizaje. Biotecnologia; 2007. p. 65-76.
7. Paredes S, Ribeiro L. Cortisol: the villain in Metabolic Syndrome? Rev Assoc Med BRAs. 2014;60(1):84-92.
8. Wang M. The role of glucocorticoid action in the pathophysiology of the Metabolic Syndrome. Nutr Metab (Lond). 2005;2(1):3.
9. Boron W, Boulpaep E. Medical Physiology A Cellular and Molecular Approach. Updated se. United States: Saunders Elsevier; 2012.
10. Medina A, Seasholtz AF, Sharma V, Burke S, Bunney William J, Myers RM, et al. Glucocorticoid and mineralocorticoid receptor expression in the human hippocampus in major depressive disorder. J Psychiatr Res. 2013;47:307-14.
11. Reul JM, de Kloet ER. Two Receptor Systems for Corticosterone in Rat-Brain - Microdistribution and Differential Occupation. Endocrinology. 1985;117(6):2505-11.
12. De Kloet ER, Vreugdenhil E, Oitzl MS, Joëls M. Brain Corticosteroid Receptor Balance in Health and Disease. Endocr Rev. 1998;19(3):269-301.
13. Anacker C, Zunszain PA, Carvalho LA, Pariante CM. The glucocorticoid receptor: Pivot of depression and of antidepressant treatment? Psychoneuroendocrinology. 2011;36(3):415-25.
14. Laryea G, Schütz G, Muglia LJ. Disrupting Hypothalamic Glucocorticoid Receptors Causes HPA Axis Hyperactivity and Excess Adiposity. Mol Endocrinol. 2013;27(10):1655-65.
15. Blasiak A, Gundlach AL, Hess G, Lewandowski MH. Interactions of circadian rhythmicity, stress and orexigenic neuropeptide systems: Implications for food intake control. Front Neurosci. 2017;11(MAR):1-10.
16. Szabo S, Tache Y, Somogyi A. The legacy of Hans Selye and the origins of stress research: A retrospective 75 years after his landmark brief "Letter" to the Editor # of Nature. Stress [Internet]. 2012;15(5):472-8.
17. Fernández Alonso C. El estrés en las enfermedades cardiovasculares. Libro la salud Cardiovasc del Hosp Clínico. 2009;583-90.
18. Tahir U. Stress and Eating Behaviour. Adv Obesity, Weight Manag Control. 2016;4(4).
19. Duval F, González F, Rabia H. Neurobiología del estrés. Rev Chil Neuropsiquiatr. 2010;48(4):307-18.
20. Fauvel JP, Quelin P, Ducher M, Rakotomalala H, Laville M. Perceived job stress but not individual cardiovascular reactivity to stress is related to higher blood pressure at work. Hypertension. 2001;38:71-5.
21. Dávila J, González J, Barrera A. Panorama de la Obesidad en México. Rev Med Inst Mex Seguro Soc. 2015;53(2):2015.
22. Rosenkilde M, Reichkendler MH, Auerbach P, Torang S, Gram AS, Ploug T, et al. Appetite regulation in overweight, sedentary men after different amounts of endurance exercise: a randomized controlled trial. J Appl Physiol. 2013;115(11):1599-609.
23. Leigh Gibson E. Emotional influences on food choice: Sensory, physiological and psychological pathways. Physiol Behav. 2006;89(1):53-61.
24. Kiefer F, Grosshans M. Beitrag der Suchtforschung zum Verständnis der Adipositas. Nervenarzt. 2009;80(9):1040-9.
25. Bazhan N, Zelena D. Food-intake regulation during stress by the hypothalamo-pituitary-adrenal axis. Brain Res Bull. 2013;95:46-53.
26. Pecoraro N, Reyes F, Gomez F, Bhargava A, Dallman MF. Chronic stress promotes palatable feeding, which reduces signs of stress: Feedforward and feedback effects of chronic stress. Endocrinology. 2004;145(8):3754-62.
27. Uchoa ET, Silva LECM, de Castro M, Antunes-Rodrigues J, Elias LLK. Glucocorticoids are required for meal-induced changes in the expression of hypothalamic neuropeptides. Neuropeptides. 2012;46(3):119-24.
28. Gyengesi E, Liu ZW, D'Agostino G, Gan G, Horvath TL, Gao XB, et al. Corticosterone regulates synaptic input organization of POMC and NPY/AgRP neurons in adult mice. Endocrinology. 2010;151(11):5395-402.
29. Sominsky L, Spencer SJ. Eating behavior and stress: A pathway to obesity. Front Psychol. 2014;5:1-8.
30. Dallman MF, La Fleur SE, Pecoraro NC, Gomez F, Houshyar H, Akana SF, et al. Minireview: Glucocorticoids - Food intake, abdominal obesity, and wealthy nations in 2004. Endocrinology. 2004;145(6):2633-8.
31. Lutter M, Sakata I, Osborne-Lawrence S, Rovinsky SA, Anderson JG, Jung S, et al. The orexigenic hormone ghrelin defends against depressive symptoms of chronic stress. Nat Neurosci. 2008;11(7):752-3.
32. Rouach V, Bloch M, Rosenberg N, Gilad S, Limor R, Stern N, et al. The acute ghrelin response to a psychological stress challenge does not predict the post-stress urge to eat. Psychoneuroendocrinology. 2007;32(6):693-702.
33. Raspopow K, Abizaid A, Matheson K, Anisman H. Anticipation of a psychosocial stressor differentially influences ghrelin, cortisol and food intake among emotional and non-emotional eaters. Appetite. 2014;74:35-43.
34. Geliebter A, Gluck ME, Hashim SA. Plasma ghrelin concentrations are lower in binge-eating disorder. J Nutr. 2005;135(5):1326-30.
35. Tanaka C, Asakawa A, Ushikai M, Sakoguchi T, Amitani H, Terashi M, et al. Comparison of the anorexigenic activity of CRF family peptides. Biochem Biophys Res Commun. 2009;390(3):887-91.
36. Palmiter RD. Is dopamine a physiologically relevant mediator of feeding behavior? Trends Neurosci. 2007;30(8):375-81.
37. Menzies JRW, Skibicka KP, Dickson SL, Leng G. Neural substrates underlying interactions between appetite stress and reward. Obes Facts. 2012;5(2):208-20.
38. De Macedo IC, De Freitas JS, Da Silva Torres IL. The influence of palatable diets in reward system activation: A mini review. Adv Pharmacol Sci. 2016;2016:1-7.
39. Johnson PM, Kenny PJ. Dopamine D2 receptors in addiction-like reward dysfunction and compulsive eating in obese rats. Nat Neurosci. 2010;13(5):635-41.
40. Erlanson-Albertsson C. How Palatable Food Disrupts Appetite Regulation 54. Basic & Clin Pharmacol & Toxicol. 2005;97(2):61-73.
41. Quarta D, Smolders I. Rewarding, reinforcing and incentive salient events involve orexigenic hypothalamic neuropeptides regulating mesolimbic dopaminergic neurotransmission. Eur J Pharm Sci. 2014;57(1):2-10.
42. Baik JH. Dopamine signaling in food addiction: role of dopamine D2 receptors. BMB Rep. 2013;46(11):519-26.
43. Maniam J, Morris MJ. Palatable cafeteria diet ameliorates anxiety and depression-like symptoms following an adverse early environment. Psychoneuroendocrinology. 2010;35(5):717-28.
44. Ulrich-Lai YM, Fulton S, Wilson M, Petrovich G, Rinaman L. Stress exposure, food intake and emotional state. Stress. 2015;18(4):381-99.
45. Pedersen B, Morten J, Richelsen B. Characterization of Regional and Gender Differences in Glucocorticoid Receptors and Lipoprotein Lipase Activity in Human Adipose Tissue. J Clin Endocrinol Metab. 1994;78(6):1354-9.
46. Drapeau V, Therrien F. Is visceral obesity a physiological adaptation to stress? Panminerva Med. 2001;43:1-7.
47. Chao AM, Jastreboff AM, White MA, Grilo CM, Sinha R. Stress, cortisol, and other appetite-related hormones: Prospective prediction of 6-month changes in food cravings and weight. Obesity. 2017;25(4):713-20.
Recibido: 6 de julio 2018.
Aprobado: 8 agosto 2018.
Celso Enrique Cortés Romero. Benemérita Universidad Autónoma de Puebla, Facultad de Medicina. México.
Correo electrónico: ecortes49@gmail.com