Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.37 no.3 Ciudad de la Habana jul.-set. 2018
Artículo de revisión
Uso de biocidas y mecanismos de respuesta bacteriana
Use of biocides and bacterial response mechanisms
Diana Paola Patiño Bello
Laura Viviana Pérez Acevedo
María Inés Torres Caycedo
Daris Angelica Rosas Leal
Giselle Di Filippo Iriarte
Universidad de Boyacá. Tunja, Colombia.
RESUMEN
La constante aparición de microorganismos que incrementan su tolerancia a sustancias utilizadas para su control como los biocidas está generando atención en salud pública y debe ser estudiado, teniendo en cuenta los diversos riesgos que se pueden enfrentar principalmente en pacientes con alta susceptibilidad a las infecciones asociadas a la atención en salud, dado que estos biocidas son utilizados cotidianamente lo que ha generado mecanismos bacterianos como lo son la formación de biopelículas y aquellos que incrementan su tolerancia como la generación de bombas de flujo. Esta respuesta bacteriana a la presión de los biocidas se potencia por la aparición de microorganismos resistentes a los antimicrobianos de uso en el tratamiento y control de las infecciones lo que hace difícil el control de estos. Se realizó una revisión de literatura disponible en las bases de datos Proquest, ovid, Science direct, PubMed, donde se encontraron un total de 103 artículos y se seleccionaron 73, de acuerdo con el año de publicación en los idiomas español e inglés, que incluyeron estudios descriptivos y de revisión. El objetivo de este artículo fue realizar una revisión acerca de los principales mecanismos de acción de biocidas y la respuesta de tolerancia que presentan los microorganismos frente a estos; lo que conlleva a la reflexión sobre las implicaciones del uso de estas sustancias sobre la salud humana.
Palabras clave: biocidas; bacterias; resistencia, genes, bombas de flujo, mecanismo de acción.
ABSTRACT
The constant appearance of microorganisms that increase their tolerance to substances used for their control such as biocides is generating attention in public health and should be studied, taking into account the various risks that can be faced mainly in patients with high susceptibility to infections associated with health care, given that these biocides are used on a daily basis, which has generated bacterial mechanisms such as the formation of biofilms and those that increase their tolerance, such as the generation of flow pumps. This bacterial response to the pressure of the biocides is enhanced by the appearance of microorganism's resistant to the antimicrobials used in the treatment and control of infections, which makes their control difficult. A literature review was made available in the databases Proquest, ovid, Science direct, PubMed, where a total of 103 articles were found and 73 were selected, according to the year of publication in the Spanish and English languages, which included Descriptive and review studies. The objective of this article is to carry out a review about the main action mechanisms of biocides and the tolerance response presented by microorganisms against them; which leads to reflection on the implications of the use of these substances on human health.
Keywords: biocides; bacteria; resistance, genes, flow pumps, mechanism of action.
INTRODUCCIÓN
El hombre en su permanente lucha frente al control de patógenos ha recurrido a múltiples estrategias para la eliminación de los mismos, lo que ha llevado a procedimientos en los cuales son indispensables la aplicación de sustancias capaces de inhibir su acción.1-3 El término de resistencia a antisépticos y desinfectantes, se designa cuando se identifica que un microorganismo no es sensible a la concentración de biocida usada o que no es inactivado por concentraciones que inhiben la mayoría de cepas de éste, es decir, el microrganismo incrementa su tolerancia a la sustancia; respuesta bacteriana que puede ser identificada en diferentes ambientes asociados a acciones antropogénicas relacionadas con el uso de biocidas a nivel clínico, doméstico, comunitario, industrial,4 entre otros; los cuales actualmente están siendo objeto de estudio en comunidades microbianas de suelos, agua y otros recursos, expuestos a los biocidas.5 Además de la relación existente con la resistencia cruzada a antibióticos y los posibles riesgos generados por estos.6-9 Un biocida es un compuesto que mediante métodos químicos o biológicos pueden contrarrestar y ejercer un efecto de control sobre un microorganismo; varía ampliamente en su estructura química, cuando se usan en altas concentraciones mostrando un mecanismo de acción en el control microbiano con similitud considerable. Estos son ampliamente utilizados en: medicina, veterinaria, agronomía, industria y medio ambiente; pero dado a su uso indiscriminado, aparece la resistencia de los microorganismos a estas sustancias, afectando la salud pública a nivel mundial.10-13
Estos biocidas ejercen su mecanismo de acción sobre las moléculas de membrana en una célula viva, especialmente sobre las proteínas, carbohidratos, lípidos (fosfolípidos), ácidos nucleicos como también algunas vitaminas, hormonas, minerales y ciertos elementos esenciales presentes en las células.14 El incremento de la tolerancia de los microorganismos a estos compuestos ha tenido repercusiones en la salud humana desde sus efectos sobre las células y su relación con enfermedades.15 Esta resistencia puede darse de múltiples maneras principalmente de forma intrínseca como propiedades naturales del organismo o adquiridas, que producen genes de resistencia transferidos por elementos móviles de un organismo a otro,16 haciendo que esta respuesta bacteriana perdure a largo plazo en una especie determinada. La actividad de un compuesto varía notablemente entre los diferentes tipos de microorganismos e incluso entre distintas cepas de una misma especie.17 El mecanismo de resistencia adquirida más prevalente frente a los biocidas son las bombas de eflujo, proteínas transportadoras pertenecientes a las familias filogenéticas de tipo resistencia pequeña a multifármacos (SMR), presentado por bacterias Gram negativas y Gram positivas. Por otro lado un mecanismo de resistencia intrínseco relacionado con la tolerancia a los biocidas es la formación de biopelículas o biofilm que hace difícil el control de los patógenos.16,18,19
Una de las razones por la cuales se está presentando esta respuesta microbiana como adaptación al medio, es el uso indiscriminado de biocidas sin control, así como también, el desconocimiento de las propiedades de estos compuestos y la forma de uso en cantidades y concentraciones adecuadas.
El uso de biocidas a bajas concentraciones y a tiempos insuficientes de contacto produce cambios en la estructura bacteriana, que repercuten en la adaptación del microorganismo a estos compuestos y por consiguiente en la pérdida del efecto antimicrobiano. De ahí la importancia de establecer la sensibilidad de los microorganismos en las fases o ambientes en los que sean más susceptibles, el tipo de biocida que deba usarse para usos específicos, así como su adecuado manejo y riesgos potenciales. El objetivo principal es realizar una revisión bibliográfica sobre la respuesta bacteriana frente al uso de biocidas, abordando elementos teóricos que profundizan en la descripción de estos, su relación con el aumento de la tolerancia y resistencia bacteriana.
En esta revisión de tema se presenta el impacto del uso inadecuado de los biocidas, contribuyendo al conocimiento de los mecanismos microbianos emergentes y la constante lucha entre el control y las estrategias de contención de patógenos que involucran el uso de sustancias sintetizadas y la respuesta evolutiva microbiana a la presión de antibióticos y biocidas.
CLASIFICACIÓN DE BIOCIDAS
Los biocidas son sustancias que debido a sus propiedades ya sean físicas químicas o biológicas con efecto antimicrobiano pueden neutralizar, controlar y/o disminuir la carga bacteriana patógena.10,20,21 Estas sustancias son comúnmente utilizadas en diversos ámbitos de la vida cotidiana y principalmente en el ámbito hospitalario.14,22,23
Los biocidas se clasifican de acuerdo con su blanco de acción y el efecto especifico que ejercen dentro de los cuales se encuentran: preservativos, desinfectantes, antisépticos y esterilizantes. En donde los preservativos, son incluidos en la manufacturación de productos con base acuosa, evitando el sobrecrecimiento de microorganismos. Los desinfectantes, actúan como agentes químicos, eliminando el crecimiento bacteriano sobre objetos inanimados.10,24,25 Los antisépticos, que son sustancias que impiden el crecimiento microbiano destruyendo las superficies corporales o tejido vivo25 y los esterilizantes, que destruyen todas las formas vegetativas incluyendo esporas.26-28
Debido a que cada biocida tiene una composición, efecto y características diferentes frente al organismo patógeno y según las propiedades que tenga este para evadirla, se hace necesario clasificarlos según su composición, en oxidantes y no oxidantes. Los oxidantes, son aquellos que interfieren en la síntesis proteica de las células, actuando únicamente sobre la superficie de la biopelícula y manteniendo el interior, microbiológicamente activo, en donde estos a su vez, oxidan todo tipo de materia orgánica, provocando la muerte de los microorganismos.12,29 Dentro de este grupo se pueden encontrar: cloro, bromo, yodo, dióxido de cloro, ozono, peróxido de hidrógeno conjuntamente con algunas sales halógenas y de peróxido como P3-oxonia active.22 Por otro los de tipo no oxidante, generan una acción de envenenamiento lento de las células, alterando el metabolismo de alguna forma y penetrando en estas para finalmente alterar el DNA, el RNA o los sistemas de defensa celulares.22 Dentro de este grupo están: sales de amonio cuaternario, cloruro de benzalconio, cetrimida, cloruro de hexadecilpiridinio, fenoles, triclosán, hexachlorofeno, biguaninas, clorhexidia.27
MECANISMO DE ACCIÓN DE LOS BIOCIDAS Y RESPUESTA CELULAR
El control bacteriano mediante biocidas es aceptado en múltiples ámbitos pero el uso indiscriminado de estos productos ha hecho que las bacterias con múltiples mecanismos (bioquímicos, genéticos, moleculares y celulares) desarrollen estrategias inherentes y adquiridas, que les confiere evadir la acción de estos compuestos.30-33 Por lo tanto y como se ha mencionado, la acción del biocida esta mediada por factores, que permiten la injuria celular (daño celular irreversible) logrando el control del microorganismo y así generar la eliminación de la bacteria o el control de la carga microbiana de manera exitosa, estos factores corresponden a los relacionados con la composición del biocida, la estructura y ultraestructura celular.
La actividad antimicrobiana puede estar mediada por factores que influyen en la acción biocida como la composición de la membrana de la célula bacteriana, sinergia, temperatura, del microambiente y factores inherentes a la sustancia biocida como la dilución, concentración y método de exposición seleccionado para el cual va ser sometido el microorganismo.34
Cuando estos factores son identificados y pueden ser controlados y una vez establecidas las concentraciones ideales de uso del biocida sobre el organismo, como la lisis de la pared proteíca o lipoproteíca del organismo,15 los efectos de este son exitosos, dado que estos antimicrobianos actúan sobre múltiples puntos o dianas. 35 Como acción en la célula bacteriana el biocida genera cambios en los blancos celulares alterándolos de forma química, generando mutación o modificación enzimática, afectando usualmente una enzima metabólica esencial de la bacteria y su expresión, de esta manera se da la modificación de permeabilidad natural de la membrana externa, modificando el tamaño o número de las porinas, excreción activa del metabolitos acumulados en la célula a través de las proteínas que conforman los sistemas de eflujo.36-38 En la tabla 1 se describen algunos biocidas, su mecanismo de acción y blanco celular.
La respuesta celular a la acción y presión del biocida se presenta como un fenómeno que aumenta la resistencia frente a las diferentes concentraciones, es así como la bacteria puede resistir a la acción de los biocidas y los antibióticos mediante una propiedad natural (resistencia intrínseca) siendo este el mecanismo más común, o una propiedad adquirida por medio de elementos genéticos móviles.39,40
Mecanismos de resistencia intrínseca
La resistencia intrínseca a los biocidas suele ser un estado normal de tipo, genético, estructural o fisiológico, característica natural o heredada invariable, que se asocia con las diferentes especies bacterianas de tipo Gram positivas o Gram negativas y es predecible para cada una de ellas.25,31,41 Dentro de este mecanismo el más común es el cambio de permeabilidad de la envoltura microbiana, el cual se encarga de limitar las cantidades de biocida que penetran en la célula, disminuyendo la concentración del biocida en su interior.31 Es necesario tener en cuenta que para que un biocida o antimicrobiano alcance un sitio diana debe traspasar barreras externas, y en todos los microorganismos la ultra estructura es diferente, de manera que para que el biocida logre llegar a estos sitios de acción, deben realizarlo de otras formas, dependiendo de su naturaleza y composición.31,37,42
Debido a esto la bacteria presenta mecanismos intrínsecos que le confieren resistencia frente a los biocidas. Entre ellos se pueden encontrar: por transducción, que es una trasferencia de cualquier tipo de material genético, que se encuentre inserto al ADN bacteriano durante la fase de ensamblaje y se encapsula, este material puede ser un fragmento de ADN que no es completamente bacteriano o solo parte de este. Por conjugación, que consiste en la trasferencia del contenido genético del plásmido mediante una hebra sexual que les sirve como mecanismo de resistencia a sustancias; o por transformación en el que se hace un traspaso de ADN desnudo de una bacteria a otra receptora que lo incluye en su genoma.31,42,43
Una resistencia muy común tiene que ver con las Biopelículas o "biofilm", que están compuestas principalmente por agua, los propios microorganismos y una matriz de naturaleza polimérica la cual contiene en su mayoría exopolisacáridos y en menor proporción macromoléculas como proteínas; dicha matriz permite a las células mantenerse unidas, logrando una mayor interacción entre sí, además le confiere a los microorganismos protección contra diferentes sustancias como son los biocidas.44 Las bacterias colectivamente construyen comunidades especialmente complejas y funcionalmente diversas, denominadas biofilms, el crecimiento del biofilm comienza cuando las células que se adhieren a una superficie e inician la secreción de los componentes de la matriz extracelular. 45 La capacidad de formar biopelículas o "biofilm " involucra una o más especies bacterianas para lo cual el biocida deberá tener un mecanismo para modificar el patrón de la expresión génica o adquirir fenotipos para sintetizar la matriz de polisacáridos que les confiere una barrera fisicoquímica.26,46 La biopelicula provoca dificultad para el acceso del antimicrobiano al medio interno de la célula induciendo a la producción de enzimas degenerativas haciendo que tenga interacción la biopelicula y el microorganismo;47,48 la tasa de transporte de agentes antimicrobianos es importante, cuando las células sésiles intervienen con el agente antimicrobiano estas se exponen rápidamente a todas las células a la dosis completa y tendrá el efecto bactericida pero en otros casos son secuestrados por los glucanos presentes en la pared de las células biofilm, haciendo que la cantidad de sustancia biocida o antibiótica que realmente alcanza estas células sean demasiado bajas para ejercer un efecto antimicrobiano.49-51
Mecanismo de resistencia adquirida
La resistencia adquirida a los antisépticos y desinfectantes surge de dos maneras: bioquímica o genética, siendo la segunda por mutación o adquisición de material genético en forma de plásmidos o transposones; estas configuraciones permiten grandes arreglos de genes de resistencia para la mayoría de desinfectantes, al ser transferidos juntos en un solo evento de conjugación.52 Esta resistencia se genera para evitar que el antibiótico o la sustancia biocida se incorpore a la célula. La activación de estas bombas es mediada por plásmidos y es un importante mecanismo de resistencia a antibióticos, metales, desinfectantes y antisépticos catiónicos.31 En la resistencia, la forma genética o adquisición de plásmidos consisten en ADN extracromosómico, estos han evolucionado con el tiempo en las bacterias a través de diferentes puntos de mutaciones, inserciones y eliminaciones. Grandes porciones del ADN plásmido, contienen elementos de inserción y trasposones,53 facilitando intercambio de elementos genéticos particularmente de plásmidos conjugativos, capaces de movilizar otros plásmidos de un donante a una célula receptora, logrando de esta forma que los genes de resistencia puedan diseminarse rápidamente entre las comunidades bacterianas. 33,54,55 Los plásmidos conjugados de bajo número de copias, han adquirido mecanismos específicos de "adicción" para su persistencia a largo plazo, debido a la exposición repetida a antibiótico, los cuales favorecen la aparición de algunos linajes de plásmidos de resistencia en varios géneros de bacterias.56
Resistencia mediada por bombas de eflujo
Entre los diferentes mecanismos de resistencia que pueden encontrarse en las bacterias frente a la exposición de biocidas, se tienen las ocasionadas por bombas de eflujo, las cuales actúan como transportadores de membrana, que exportan sustancias toxicas desde el interior de la célula bacteriana al exterior.37,57 Estas proteínas se encuentran en microorganismos Gram positivos y Gram negativos, ya que poseen múltiples sistemas de membrana que cumplen funciones vitales en los mismos, como es el ingreso de nutrientes. En el caso de bacterias productoras de antibióticos, los sistemas de eflujo les confieren "autoinmunidad", lo que les va a permitir estar protegidas contra sustancias externas que puedan ser agresoras o toxicas para las bacterias.37,58
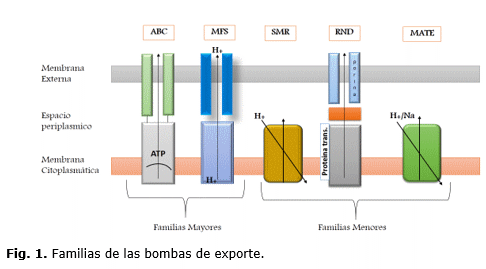
Por lo general los sistemas de eflujo están agrupados según las proteínas transportadoras basados en las similitud de la secuencia de aminoácidos (tamaño y estructuras secundarias);59,60 filogenéticamente las bombas de eflujo se clasificaron en cinco familias: familia de casete de unión al ATP (ABC), las cuales son dependientes de la hidrolisis de ATP, familia del facilitador mayor (MFS) que van ligadas a la fuerza de un protón motriz, familia de extrusión de multifármacos y tóxicos (MATE) que hacen intercambio mediante iones de Na+, familia de resistencia pequeña a multifármacos (SMR) y familia de resistencia a división por modulación(RND)37 en donde estas corresponden a sistemas que comparten un dominio de hidrolisis de ATP, que acoplan esta energía a varios procesos fisiológicos transmembrana.26,35,61 En la figura se muestran las familias expuestas.
En los sistemas de bombas de eflujo se ha podido establecer la participación de forma creciente de un componente iónico, específicamente del ion hidrogeno, desempeñando un papel principal en la resistencia a los antimicrobianos, especialmente en el caso de los biocidas, siendo de un sistema independiente TolC de un solo componente62. Dentro de los principales microorganismos involucrados en la resistencia a los biocidas por medio de las bombas de eflujo tenemos: Escherichia coli, Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa , Klebsiella pneumoniae , Serratia marcescens en las cuales los sistemas de bombeo eflujo proteico atraviesan la membrana externa, el periplasma y la membrana plasmática mediante un complejo proteico (proteína de membrana externa y una proteína de membrana de fusión mediada por la proteína (S)) de la bomba de eflujo.59 Este mecanismo esta mediado por genes que se expresan de acuerdo con la presión ejercida en el microambiente (tabla 2).
Los compuestos mayormente utilizados como biocidas son los compuestos de amonio cuaternario (Qac) son aditivos de rutina para productos comerciales, industriales10,64 cuya estructura básica es el catión amonio que al ser modificados han dado a lugar a distintos agentes desinfectantes presentar este tipo de acción, desde concentraciones de 0,25 % o mayores se asocian generalmente a aminas terciarias en las formulaciones desinfectantes aumentando su acción biocida.65 La mayoría de los productos Qac pertenecen a la familia de proteínas pequeñas resistentes a múltiples fármacos SMR,66 basándose en un gradiente electrolítico y una fuerza protón- motriz para ejercer su función, disminuyen la susceptibilidad a aminoglucósidos cuando las proteínas se sobre producen a partir de plásmidos.67
El mecanismo de resistencia a los biocidas no está relacionado específicamente con un género bacteriano, se ha descrito principalmente en bacterias ambientales, en donde se ha dado un uso intensivo de estos compuestos, y que confluye con la estabilidad de los biocidas en los ecosistemas naturales, lo que puede promover la aparición de organismos resistentes.68 Trabajos han demostrado que los biocidas pueden inducir a la expresión de bombas de eflujo MDR, lo que ocasionalmente produce un fenotipo de resistencia transitoria a los antibióticos la bomba de eflujo MDR conocida por conferir resistencia a los antibióticos en S. maltophilia, también es inducida por biocidas.69
En la búsqueda de alternativas frente a este fenómeno de resistencia/tolerancia las N-cloraminas son sustancias biológicas prometedoras debido a que sus probabilidades de inducir resistencia bacteriana son muy pocas ya que interactúan con proteínas vitales en las bacterias de una manera no específica. Por lo tanto, estos compuestos pueden ser utilizados potencialmente en variedad de funciones para evitar la selección de mutantes resistentes. Sin embargo, se requieren de procesos especiales para su aplicación.70
USO DE BIOCIDAS Y APLICACIONES EN SALUD HUMANA
Las instituciones de salud son lugares que poseen las condiciones que requieren algunas bacterias para crecer, y es un medio donde se facilita la colonización de estos microorganismos en personas, ya que dentro de estas instalaciones se encuentran pacientes con algún tipo de enfermedad o inmunosupresión.71 La piel es una fuente importante que actúa como foco de infecciones en sitio quirúrgico, por ello la mayoría de los antisépticos o biocidas van encaminados a la desinfección de superficie de la misma y así disminuir el riesgo de infección,72 la disponibilidad de los biocidas está limitada por la toxicidad. Los antisépticos más frecuentes en cuidados sanitarios son la clorhexidina, el alcohol y la povidona iodada.65 Estos se usan dependiendo la necesidad, en piel intacta; usualmente para incisiones quirúrgicas se hace uso de soluciones alcohólicas, donde se debe realizar una correcta aplicación, ya que en heridas puede ocasionar la aparición de abscesos y con ellos la aparición de bacterias. En piel no intacta, sobre las heridas no se aconseja el uso de antisépticos debido a que son de tipo citotóxicos ya que retrasarían la curación.73 Los agentes tóxicos deben ser metabolizados por la célula viva a su entrada en los hepatocitos del hígado. Los seres vivos se defienden de los productos químicos mediante la oxidación, metilación, acetilación, glucuronidación, sulfatación, entre otros, con el fin de solubilizarlos, disolverlos y excretarlos a través de la orina y otras vías.22,73 En sustancias iodadas existe la posibilidad de absorción sistémica de iodo a través de la piel y se ha descrito generación de hipotiroidismo en neonatos.
Por otro lado, la acción biológica de ciertas sustancias biocidas o productos químicos pueden afectar al ser humano a través de residuos en alimentos, en donde se determinan concentraciones de sustancias usadas para el control de microorganismos, o usados en los procesos de higienización de plantas de producción, se ha observado que con altos niveles pueden tener un efecto "alterador endocrino" puesto que pueden tener efectos activadores o inhibidores endocrinos a través de receptores o enzimas. Otros con uso de limpieza personal o en tratamientos odontológicos17, tienen riesgo de producir tinción de los dientes debido a que pueden precipitar o unirse a los cromógenos aniónicos de la dieta.
CONSIDERACIONES FINALES
Existe evidencia de la posible relación entre la resistencia antibiótica y el aumento en la tolerancia a los biocidas, debido a la múltiple exposición de la célula microbiana a la presión antibacteriana por estas sustancias ya que son de uso diario en múltiples procesos; lo que ha generado una respuesta evolutiva de características similares frente a los antibióticos y los biocidas. Las bacterias usan diferentes tipos de mecanismos de resistencia hacia los biocidas como se ha venido hablando anteriormente, pero el más frecuente es aquel mediado por bombas de flujo, especialmente aquellas bacterias pertenecientes a la familia de resistencia pequeña a multifármacos (SMR), frente a las sustancias compuestas por amonio cuaternario y la formación de biofilms.
Cabe mencionar que la efectividad de los biocidas está basada en el conocimiento de los mecanismos de acción, indicaciones de uso, los efectos adversos, compuestos químicos y las precauciones específicas de uso de acuerdo con el proceso y el ambiente de aplicación de la sustancia biocida.
Se observa que se está ante una posible amenaza latente por parte de los microrganismos dada la evidencia de los mecanismos de resistencia y aumento de la tolerancia a concentraciones altas de sustancias antimicrobianas que incluyen los biocidas; es una alerta que obliga a la exploración de otras estrategias de control de microorganismos y a la modificación de prácticas de uso de biocidas en todos los ámbitos.
Es por ello por lo que se debe continuar con los estudios que muestren la relación entre los mecanismos de resistencia o adaptación de la tolerancia a los biocidas y la resistencia cruzada con otros antimicrobianos, así como el estudio de las infecciones causadas por patógenos resistentes y tolerantes.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Anderson DJ, Podgorny K, Berríos-Torres SI, Bratzler DW, Dellinger EP, Greene L, et al. Strategies to Prevent Surgical Site Infections in Acute Care Hospitals: 2014 Update. Infect Control Hosp Epidemiol [Internet]. 2014 [citado 2018 Abr 19];35(6):605-27. Available from: https://www.cambridge.org/core/product/identifier/S0899823X00191937/type/journal_article
2. García Martín S. Los Biocidas: Incidencia Normativa y Social: Situación en la Comunidad de Madrid. [Internet ] Tesis doctoral. Madrid, España. Universidad Complutense de Madrid. 2010. [citado 2018 Abr 19] Available from: http://eprints.ucm.es/11971/1/T32548.pdf
3. Borrego S. Los biocidas vegetales en el control del biodeterioro del patrimonio documental . Perspectivas e impacto. Rev CENIC Ciencias Biológicas. 2015;46(3):259-69.
4. Ortega Morente E, Fernández-Fuentes MA, Grande Burgos MJ, Abriouel H, Pérez Pulido R, Gálvez A, et al. Biocide tolerance in bacteria. Int J Food Microbiol [Internet]. 2013 [citado 2018 Abr 19];162(1):13-25. Available from: http://dx.doi.org/10.1016/j.ijfoodmicro.2012.12.028
5. Konstantinou IK, Albanis TA. Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: A review. Environ Int. 2004;30(2):235-48.
6. Gnanadhas DP, Marathe SA, Chakravortty D. Biocides - resistance, cross-resistance mechanisms and assessment. Expert Opin Investig Drugs [Internet]. 2013 [citado 2018 Abr 19];22(2):191-206. Available from: http://www.tandfonline.com/doi/full/10.1517/13543784.2013.748035
7. Fernández-Cuenca F, Tomás M, Caballero-Moyano FJ, Bou G, Martínez-Martínez L, Vila J, et al. Reduced susceptibility to biocides in Acinetobacter baumannii: association with resistance to antimicrobials, epidemiological behaviour, biological cost and effect on the expression of genes encoding porins and efflux pumps. J Antimicrob Chemother. 2015;70(12):3222-9.
8. Wieck S, Olsson O, Kümmerer K. Possible underestimations of risks for the environment due to unregulated emissions of biocides from households to wastewater. Environ Int. 2016;94:695-705.
9. Orús P, Gomez-Perez L, Leranoz S, Berlanga M. Increasing antibiotic resistance in preservative-tolerant bacterial strains isolated from cosmetic products. Int Microbiol. 2015;18(1):51-9.
10. Pastrana Carrasco J, Garza Ramos JU, Barrios H, Morfin Otero R, Rodríguez Noriega E, Barajas JM, et al. Frecuencia del gen qacEΔ1 y resistencia a biocidas en aislamientos clínicos de enterobacterias productoras de β-lactamasas de espectro extendido. Rev Investig Clin. 2012;64(6 PART 1):535-40.
11. Prieto AMG, Wijngaarden J, Braat JC, Rogers MRC, Majoor E, Brouwer EC, et al. The two-component system ChtRS contributes to chlorhexidine tolerance in Enterococcus faecium. Antimicrob Agents Chemother. 2017;61(5):1-9.
12. Sauerbrei A. Is hepatitis B-virucidal validation of biocides possible with the use of surrogates? World J Gastroenterol. 2014;20(2):436-44.
13. Capita R, Riesco-Peláez F, Alonso-Hernando A, Alonso-Calleja C. Exposure of Escherichia coli ATCC 12806 to sublethal concentrations of food-grade biocides influences its ability to form biofilm, resistance to antimicrobials, and ultrastructure. Appl Environ Microbiol. 2014;80(4):1268-80.
14. Ribas Ozonas B. Biocidas: Datos sobre su evaluación para la salud, industria alimentaria e impacto ambiental. Monogr la Real Acad Nac Farm. 2010:99-127.
15. Wessels S, Ingmer H. Modes of action of three disinfectant active substances: A review. Regul Toxicol Pharmacol [Internet. 2013 [citado 2018 Abr 19];67(3):456-67. Available from: http://dx.doi.org/10.1016/j.yrtph.2013.09.006
16. Buffet-Bataillon S, Tattevin P, Maillard J-Y, Bonnaure-Mallet M, Jolivet-Gougeon A. Efflux pump induction by quaternary ammonium compounds and fluoroquinolone resistance in bacteria. Futur Microbiol. 2016;11(1):81-92.
17. Tronsmo A, Gjøen T, Sørum H, Godfroid J, Yazdankhah SP, Jelmert A, et al. Antimicrobial resistance due to the use of biocides and heavy metals: a literature review. Opinion of the Panel Panel on Microbial Ecology of the Norwegian Scientific Committee for Food Safety [Internet]. 2016;95. Available from: https://brage.bibsys.no/xmlui/handle/11250/2471729
18. Sanchez-Vizuete P, Orgaz B, Aymerich S, Le Coq D, Briandet R. Pathogens protection against the action of disinfectants in multispecies biofilms. Front Microbiol. 2015;6:1-12.
19. Ashraf MA, Ullah S, Ahmad I, Qureshi AK, Balkhair KS, Abdur Rehman M, et al. Green biocides, a promising technology: Current and future applications to industry and industrial processes. J Sci Food Agric. 2014;94(3):388-403.
20. López MC, Grande MJ, López RL, Gálvez A. Resistencia a biocidas de diferentes cepas de escherichia coli. Dialnet. 2010;23:121-136.
21. Hernández Navarrete MJ, Celorrio Pascual JM, Lapresta Moros C, Solano Bernad VM. Fundamentos de antisepsia, desinfección y esterilización. Enferm Infecc Microbiol Clin [Internet]. 2014 [citado 2018 Abr 19];32(10):681-8. Available from: https://www.sciencedirect.com/science/article/pii/S0213005X14001839
22. Escherichia DE. Resistencia a biocidas de diferentes cepas de diferentes cepas de escherichia coli. Anales de la Real Academia de Ciencias Veterinarias de Andalucía Oriental. 2010;23(1):121-36.
23. Seier-Petersen MA, Jasni A, Aarestrup FM, Vigre H, Mullany P, Roberts AP, et al. Effect of subinhibitory concentrations of four commonly used biocides on the conjugative transfer of Tn916 in Bacillus subtilis. J Antimicrob Chemother. 2014;69(2):343-8.
24. Rodrigues Barata AR, Rodríguez Espinosa J, Heras Mendaza F, Conde-Salazar Gomèz L. Kathon CG y Dermatología Laboral: Actualización. Med Segur Trab (Madr) [Internet]. 2012 [citado 2018 Abr 23];58(228):237-45. Available from: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0465-546X2012000300008&lng=en&nrm=iso&tlng=en
25. McDonnell G, Russell AD. Antiseptics and disinfectants: activity, action, and resistance. Clin Microbiol Rev. 2001 January;14(1):227.
26. Jara MA, Céspedes PF. Detección de genes de resistencia a biocidas en bacterias nosocomiales mediante la reacción en cadena de la polimerasa. Santiago de Chile: Universidad de Chile. 2009 [citado 2018 Abr 23];983. Available from: http://repositorio.uchile.cl/bitstream/handle/2250/131438/Detecci%C3%B3n-de-genes-de-resistencia-a-biocidas-en-bacterias-nosocomiales-mediante-la-reacci%C3%B3n-en-cadena-de-la-polimerasa.pdf?sequence=1&isAllowed=y
27. Almeida LB, Férnandez ML, López MC, López RL, Marín A. Resistencia a biocidas en cepas de salmonella sp. Aisladas de huevo. Dialnet. 2012;25(1):159-72.
28. March JK, Pratt MD, Lowe CW, Cohen MN, Satterfield BA, Schaalje B, et al. The differential effects of heat-shocking on the viability of spores from Bacillus anthracis, Bacillus subtilis, and Clostridium sporogenes after treatment with peracetic acid- and glutaraldehyde-based disinfectants. Microbiologyopen. 2015;4(5):764-73.
29. Diéguez CC. Biocidas. Eficacia. Criterios para su evaluación y autorización. Rev salud ambient. 2006;6(1-2): 56-60.
30. Cabrera C, Fabian G, Zuñiga A. La resistenacia de bacterias a antibioticos, antisepticos y desinfectantes. Una manifestacion de los mecanismos de supervivencia y adaptación. Colomb Med [Internet]. 2007 [citado 2018 Abr 23];38(2):149-58. Available from: http://www.redalyc.org/html/283/28338208/
31. Garrido AM, Burgos MJG, Márquez MLF, Aguayo MCL, Pulido RP, del Árbol JT, et al. Biocide tolerance in salmonella from meats in Southern Spain. Brazilian J Microbiol. 2015;46(4):1177-81.
32. Wales A, Davies R. Co-Selection of Resistance to Antibiotics, Biocides and Heavy Metals, and Its Relevance to Foodborne Pathogens. Antibiotics [Internet]. 2015 [citado 2018 Abr 23];4(4):567-604. Available from: http://www.mdpi.com/2079-6382/4/4/567
33. Mcdonnell G, Russell AD. Antiseptics and disinfectants: Activity, action, and resistance. Clin Microbiol Rev. 1999;12(1):147-79.
34. Morales Pérez M, García Milian AJ. Papel de la superfamilia ABC en la resistencia farmacológica. Horiz Sanit [Internet].2017 [citado 2018 Abr 23];16(2):93-101. Available from: http://www.scielo.org.mx/scielo.php?pid=S2007-74592017000200093&script=sci_arttext
35. Reynaldo MB, Flores MB, Viegas Caetano JA, Magariños MDC. Efficacy of biocides against hospital isolates of Staphylococcus sensitive and resistant to methicillin, in the province of Buenos Aires, Argentina [Eficacia de algunos biocidas contra estafilococos hospitalarios sensibles y resistentes a la meticilina en. Rev Panam Salud Publica/Pan Am J Public Heal [Internet]. 2004 [citado 2018 Abr 23];16(3):187-92. Available from: http://www.scopus.com/inward/record.url?eid=2-s2.0-14044260151&partnerID=40&md5=f677b3cd3d373dd76c5ec13840706827
36. Marchetti M, Errecalde J, Mestorino N. Dirección para correspondencia: Resistencia bacteriana a Los antimicrobianos ocasionada por bombas de Eflujo. Impacto en la Multirresistencia. AnAlectA Vet. 2011;40(312):40-53.
37. Vásquez Giraldo DF, Libreros Zúñiga GA, Crespo Ortiz MP. Effects of biocide exposure on P. Aeruginosa, E. coli and A. Baumannii complex isolates from hospital and household environments. Infectio [Internet]. 2017 [citado 2018 Abr 25];21(4):243-50. Available from: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85020191915&doi=10.22354%2Fin.v21i4.687&partnerID=40&md5=d3cb7d0c4fc162d409ec4c039c4cab4d
38. Cabrera Medina M, Borrero Reynaldo Y, Rodríguez Fajardo A, Angarica Baró, EM, Rojas Martínez O. Efecto de tres bioestimulantes en el cultivo de pimiento (capsicum annun, l) variedad atlas en condiciones de cultivo protegido. Ciencia en su PC [Internet]. 2011 [citado 2018 Abr 25];(4):32-42. Recuperado de: http://www.redalyc.org/articulo.oa?id=181324323003
39. de León Rosales SP, Arredondo Hernández R, López Vidal Y. Resistance to antibiotic: A serious global problem [La resistencia a los antibióticos: Un grave problema global]. Gac Med Mex [Internet. 2015 [citado 2018 Abr 25];151(5):681-9. Available from: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84948168242&partnerID=40&md5=9c28174bf1e1d2bb62564f47b3fba9a6
40. Curião TIG. Análisis fenotípico, genómico y bioinformático de los elementos genéticos asociados a resistencia a antibióticos y biocidas en enterobacterias. Madrid: Universidad Complutense; 2014. p. 221.
41. Lopatkin AJ, Meredith HR, Srimani JK, Pfeiffer C, Durrett R, You L, et al. Persistence and reversal of plasmid-mediated antibiotic resistance. Nat Commun [Internet]. 2017 [citado 2018 Abr 25];8(1). Available from: http://dx.doi.org/10.1038/s41467-017-01532-1
42. Fuchs LY, Chihu L, Conde C, González VM, Noguez AH, Calderón E, et al. Mecanismos moleculares de la resistencia bacteriana. Salud Pública de México [Internet]. 1994 [citado 2018 Abr 25];36(4):428-438. Available from: http://www.redalyc.org/articulo.oa?id=10636410
43. Trujillo M, Gutiérrez ÁM. Microbial Biofilms. Universidad de la Laguna. 2017 [citado 2019 Mar 28] . Available from: https://riull.ull.es/xmlui/bitstream/handle/915/5023/BIOFILMS%20MICROBIANOS.pdf?sequence=1
44. Billings N, Ramirez Millan M, Caldara M, Rusconi R, Tarasova Y, Stocker R, et al. The Extracellular Matrix Component Psl Provides Fast-Acting Antibiotic Defense in Pseudomonas aeruginosa Biofilms. PLoS Pathog. 2013 [citado 2018 May 02];9(8):e1003526. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3738486/
45. Ortiz S. Diversidad genética y persistencia ambiental de Listeria Monocytogenes en dos plantas de procesado de carne de cerdo ibérico: influencia de la resistencia a desinfectantes de amonio cuaternario. [Internet] Tesis Doctoral. Madrid, España. Universidad Complutense de Madrid. 2015 [citado 2018 May 02]. Available from: http://eprints.ucm.es/38371/1/T37495.pdf
46. Lavilla ML, Abriouel H, Benomar N, Gálvez A. Estudio de los determinantes genéticos de resistencias a biocidas y su papel en la resistencia cruzada con antibióticos en bacterias de origen alimentario. [Internet] Tesis Doctoral. Jaén, España. Universidad de jaén. 2014 [citado 2018 May 02]. Available from: http://hdl.handle.net/10953/694
47. Berrocal AM, Blas RH, Flores J, Siles M. Evaluación del potencial mutagénico de biocidas (vertimec y pentacloro) sobre cebolla. Rev Colomb Biotecnol. 2013;XV(1):17-27.
48. Van Acker H, Van Dijck P, Coenye T. Molecular mechanisms of antimicrobial tolerance and resistance in bacterial and fungal biofilms. Trends Microbiol [Internet]. 2014 [citado 2018 May 02];22(6):326-33. Available from: http://dx.doi.org/10.1016/j.tim.2014.02.001
49. Gabrilska RA, Rumbaugh KP. Biofilm models of polymicrobial infection. Future Microbiol. 2015;10(12):1997-2015.
50. Nelson-filho P, Louvain MC, Macari S, Lucisano MP, Silva RAB da, Queiroz AM de, et al. Microbial contamination and disinfection methods of pacifiers. J Appl Oral Sci [Internet]. 2015 [citado 2018 May 02];23(5):523-8. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1678-77572015000500523&lng=en&tlng=en
51. Pérez H, Robles A. Aspectos básicos de los mecanismos de resistencia bacteriana. Rev Med (Puebla) [Internet]. 2013 [citado 2018 May 08];4(4):186-91. Available from: http://www.medigraphic.com/pdfs/revmed/md-2013/md133i.pdf
52. Mathers AJ, Peirano G, Pitout JDD. The role of epidemic resistance plasmids and international high- risk clones in the spread of multidrug-resistant Enterobacteriaceae. Clin Microbiol Rev. 2015;28(3):565-91.
53. Silva RF, MendonçaSí SCM, CarvalhoLuí LM, Reis AM, Gordo I, Trindade S, et al. Pervasive sign epistasis between conjugative plasmids and Drug-Resistance chromosomal mutations. PLoS Genet. 2011 [citado 2018 May 08];7(7). e1002181 Available from: https://doi.org/10.1371/journal.pgen.1002181
54. Jutkina J, Marathe NP, Flach CF, Larsson DGJ. Antibiotics and common antibacterial biocides stimulate horizontal transfer of resistance at low concentrations. Sci Total Environ [Internet]. 2018 [citado 2018 May 08];616-617. Available from: https://doi.org/10.1016/j.scitotenv.2017.10.312
55. Kamruzzaman M, Shoma S, Thomas CM, Partridge SR, Iredell JR. Plasmid interference for curing antibiotic resistance plasmids in vivo. PLoS One. 2017;12(2):1-20.
56. De la Fuente NM, Villarreal JM, Díaz MA, García AP. Resistance. Evaluación de la actividad de los agentes antimicrobianos ante el desafío de la resistencia bacteriana. Rev mex cienc farm [Internet]. 2015 [citado 2018 May 08];46(2):7-16. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1870-01952015000200007&lng=es
57. Phillips-jones MK, Harding SE. Antimicrobial resistance ( AMR ) nanomachines - mechanisms for fluoroquinolone and glycopeptide recognition , efflux and / or deactivation. Biophys Rev. 2018;10(2):347-362.
58. Slipski CJ, Zhanel GG, Bay DC. Biocide Selective TolC-Independent Efflux Pumps in Enterobacteriaceae. Journal of Membrane Biology. 2017:1-19.
59. Andersen JL, He GX, Kakarla P, Ranjana KC, Kumar S, Lakra WS, et al. Multidrug efflux pumps from enterobacteriaceae, Vibrio cholerae and Staphylococcus aureus bacterial food pathogens. Int J Environ Res Public Health. 2015;12(2):1487-547.
60. Uicab Y, Canto-Canché B, Islas-Flores I. Revisión de las características de los transportadores ABC involucrados en patogénesis fúngica. Tecnociencia Chihuahua. 2010;IV(2):87-96.
61. Kresmann S, Arokia AHR, Koch C, Sures B. Ecotoxicological potential of the biocides terbutryn, octhilinone and methylisothiazolinone: Underestimated risk from biocidal pathways? Sci Total Environ [Internet]. 2018 [citado 2018 May 08];625:900-8. Available from: https://doi.org/10.1016/j.scitotenv.2017.12.280
62. Wassenaar T, Ussery D, Nielsen L, Ingmer H. Review and phylogenetic analysis of qac genes that reduce susceptibility to quaternary ammonium compounds in Staphylococcus species. Eur J Microbiol Immunol [Internet]. 2015 [citado 2018 May 08];5(1):44-61. Available from: http://www.akademiai.com/doi/abs/10.1556/EuJMI-D-14-00038
63. Munita JM, Arias CA. Mechanisms of Antibiotic Resistance. Microbiol Spectr. 2016 [citado 2018 May 08];4(2). Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4888801/ doi:10.1128/microbiolspec.VMBF-0016-2015.
64. Diomedi A, Chacón E, Delpiano L, Hervé B, Jemenao MI, Medel M, et al. Antisépticos y desinfectantes: apuntando al uso racional. Recomendaciones del Comité Consultivo de Infecciones Asociadas a la Atención de Salud, Sociedad Chilena de Infectología. Rev Chil infectología [Internet]. 2017 [citado 2018 May 08];34(2):156-74. Available from: http://www.scielo.cl/pdf/rci/v34n2/art10.pdf%0Ahttp://www.ncbi.nlm.nih.gov/pubmed/28632831%0Ahttp://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182017000200010&lng=en&nrm=iso&tlng=en
65. Wassenaar TM, Ussery DW, Ingmer H, Sepulveda E. The qacC Gene Has Recently Spread between Rolling Circle Plasmids of Staphylococcus , Indicative of a Novel Gene Transfer Mechanism. Front Microbiol. 2016:7.
66. Li XZ, Plésiat P, Nikaido H. The challenge of efflux-mediated antibiotic resistance in Gram-negative bacteria. Clin Microbiol Rev. 2015;28(2):337-418.
67. Blanco P, Hernando-Amado S, Reales-Calderon J, Corona F, Lira F, Alcalde-Rico M, et al. Bacterial Multidrug Efflux Pumps: Much More Than Antibiotic Resistance Determinants. Microorganisms [Internet]. 2016 [citado 2018 May 15];4(1):14. Available from: http://www.mdpi.com/2076-2607/4/1/14
68. Zhang L, Li X, Poole K. SmeDEF Multidrug Efflux Pump Contributes to Intrinsic Multidrug Resistance in Stenotrophomonas maltophilia SmeDEF Multidrug Efflux Pump Contributes to Intrinsic Multidrug Resistance in Stenotrophomonas maltophilia. Antimicrob Agents Chemother. 2001;45(12):3497-503.
69. De Silva M, Ning C, Ghanbar S, Zhanel G, Logsetty S, Liu S, et al. Evidence that a novel quaternary compound and its organic N-chloramine derivative do not select for resistant mutants of Pseudomonas aeruginosa. J Hosp Infect. 2015 [citado 2018 May 15];91(1):53-8. Available from: http://dx.doi.org/10.1016/j.jhin.2015.05.009
70. Alcaldía Mayor de Bogotá. Secretaria Distrital de Salud de Bogotá, D.C. Guías para la prevención, control y vigilancia epidemiológica de infecciones intrahospitalarias. Uso de desinfectantes. Bogotá: Esfera Editores Ltda; 2004.
71. Tuuli MG, Liu J, Stout MJ, Martin S, Cahill AG, Odibo AO, et al. A Randomized Trial Comparing Skin Antiseptic Agents at Cesarean Delivery. Obstet Gynecol Surv. 2016;71(6):322-4.
72. Hernández MJ, Celorrio JM, Lapresta C, Solano VM. Fundamentos de antisepsia, desinfección y esterilización. Enferm Infecc Microbiol Clin. 2014;32(10):681-8.
73. Arenas P, Gómez de Saravia S, Guiamet P, de la Paz J, Borrego S. Plantas con actividad biocida de aplicación en el control del biodeterioro que afecta al patrimonio cultural. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2007 [citado 2018 May 15];6(6):323-4. Available from: http://www.redalyc.org/articulo.oa?id=85617472006
Recibido: 18 de junio de 2018.
Aprobado: 20 de julio de 2018.
Giselle Di Filippo Iriarte. Universidad de Boyacá. Tunja, Colombia.
Correo electrónico: gdifilippo@uniboyaca.edu.co