Introducción
El cáncer de esófago (CE) es el séptimo cáncer más común en todo el mundo con una incidencia anual de más de 550 mil casos nuevos.1) En Cuba, es la décima causa más común en incidencia, y de muerte relacionada con cáncer.2) La incidencia de carcinoma de esófago varía mucho según la ubicación geográfica. Hay dos subtipos principales de CE, carcinoma epidermoide de esófago (CEp) y adenocarcinoma de esófago (ADC), que generalmente ocurren en el tercio proximal o distal del esófago, respectivamente.3) Aunque el CEp es el tipo patológico predominante de CE, la incidencia puede ser muy diferente entre diferentes países y regiones. Los pacientes con CEp representan el 90 % de los casos en China, Japón y países del sudeste de África, sin embargo, el ADC es más frecuente en EE.UU., Australia y Europa occidental. Recientemente, la evidencia acumulada ha sugerido que CEp y ADC son en realidad, dos enfermedades diferentes, ya que tienen factores de riesgo y perfiles genéticos bastante diferentes. En los CEp, el consumo de tabaco en diversas formas, alcohol, bebidas calientes y la mala nutrición siguen siendo los factores predisponentes predominantes.4,5
La piedra angular del tratamiento curativo ha sido la cirugía. Sin embargo, por diversas razones, la mayoría de los pacientes no son aptos para cirugía. Más del 50 % tiene tumores metastásicos o irresecables localmente avanzados al momento del diagnóstico. El pilar del tratamiento no quirúrgico es la quimioterapia o radioterapia, ya sean solas o en combinación. La quimiorradioterapia se ha convertido en el tratamiento estándar en pacientes con CEp localmente avanzado o metastásico, pero se relaciona con mayor riesgo de toxicidad, y supervivencia a 5 años menor de 15-20 %. Por tanto, la necesidad de equilibrar el resultado clínico y toxicidad, sin comprometer el beneficio de supervivencia ha llevado al desarrollo de terapias biológicas dirigidas como nuevas opciones de tratamiento.3,6,7
La sobreexpresión del receptor del factor de crecimiento epidérmico (EGFR) es detectada en 50 % -70 % de casos en cáncer de esófago, y se correlaciona con incremento de metástasis, disminución de supervivencia, mal pronóstico y resistencia al tratamiento.8) Nimotuzumab es un anticuerpo monoclonal humanizado anti-EGFR, que ha documentado resultados prometedores con mejora en la tasa de respuesta tumoral, y en general, en la supervivencia.9,10 En un estudio fase II controlado y aleatorizado, conducido por nuestro equipo de trabajo, se demostró que la combinación de nimotuzumab con la quimioradioterapia (QRT) convencional era eficaz, segura, y bien tolerada.11
Los registros de datos del “mundo real”, como el que presentamos aquí, pueden contribuir a generar hipótesis y plantear criterios de selección para desarrollar nuevos ensayos clínicos, y responder a nuevas preguntas de investigación. El objetivo del presente trabajo es evaluar la respuesta al tratamiento y supervivencia global, en pacientes con carcinoma epidermoide esofágico avanzado, tratados con nimotuzumab combinado con quimioradioterapia en la práctica clínica del mundo real.
Métodos
Se realizó un estudio retrospectivo y observacional en pacientes con diagnóstico de cáncer de esófago atendidos en el Servicio de Oncología Clínica del Hospital Clínico Quirúrgico "Hermanos Ameijeiras", en el período de enero 2013 a junio de 2019.
El universo quedó constituido por todos los pacientes con diagnóstico presuntivo de cáncer de esófago (n= 209). La muestra incluida en el estudio, debió cumplir con los criterios de selección: edad > 18 años, diagnóstico histológico confirmado de carcinoma epidermoide, haber sido discutida su conducta en el grupo multidisciplinario, haber recibido tratamiento de quimioradioterapia combinado con nimotuzumab, y adecuado seguimiento. La muestra quedó constituida por 94 pacientes. No se incluyeron 115 pacientes debido a: diagnóstico de adenocarcinoma (n= 45), etapas tempranas (n= 30), solo tratamiento paliativo (n= 37), y tres pacientes que una vez diagnosticados, y tomada la decisión terapéutica, abandonaron el estudio antes de iniciar el tratamiento propuesto.
Fueron realizados los estudios de extensión, estadificación y confirmación diagnóstica acorde al protocolo de actuación para esta enfermedad neoplásica aprobada en el hospital.12) Se realizaron examen clínico, exámenes hematológicos y hemoquímicos, ecografía (US) abdominal/pélvica, rayos x de tórax, y tomografía axial computarizada (TAC) torácica, abdominal y pélvica (simple y contrastada) en todos los pacientes. Se realizaron rayos x de esófago, estómago y duodeno, y endoscopia esófago-gástrica, donde se tomó biopsia, que fue analizada y confirmada en el Departamento de Patología. Se utilizó la octava edición de la clasificación TNM.13
Plan de tratamiento
El nimotuzumab (200 mg) se administró por vía intravenosa, en la fase de inducción, semanal, por seis semanas, y luego, cada catorce días, durante la fase de mantenimiento o consolidación. La quimioterapia de primera línea fue la seleccionada por el equipo médico, y la radioterapia: 1,8 Gy diario, por cinco días a la semana, hasta completar 50,4 Gy, a partir de la segunda semana.
La evaluación de respuesta se realizó según los criterios RECIST.14 Se evaluó a las cuatro semanas del último ciclo de radio-quimioterapia recibido. Los pacientes que fallecieron antes del período establecido para la primera evaluación se consideraron como progresores. Si se realizó la necropsia, entonces se tomó como respuesta el resultado de la misma, y como fecha de evaluación, la del fallecimiento. A los efectos prácticos, se agrupó bajo el término de respuesta objetiva a los pacientes que alcanzaron respuesta completa, más respuesta parcial, mientras que bajo control de la enfermedad se agruparon a aquellos que obtuvieron respuesta objetiva, más estabilización de enfermedad. La toxicidad fue evaluada por la clasificación del NCIC-CTC,15 donde sólo se recogió el mayor grado de toxicidad por cada paciente.
Procedimientos para la recogida de la información
Se revisó la base de datos creada al efecto, así como las historias clínicas, planillas de tratamiento de los pacientes diagnosticados con cáncer de esófago, y tratados en el servicio.
Procedimientos para el análisis de la información
Se confeccionó una base de datos en el programa Excel que se procesó con la ayuda del paquete estadístico SPSS- v.20.0. Se emplearon medidas de resumen para las variables cualitativas, frecuencias absolutas y relativas expresadas en porcentajes, además de la prueba estadística Chi-cuadrado de Pearson (x2) como método de análisis para evaluar la asociación entre variables. Se estimó la probabilidad de supervivencia global mediante el empleo del método de Kaplan Meier. Para la comparación de las diferentes curvas se empleó la prueba de Log-Rank y Breslow. En todas las pruebas se fijó un nivel de significación de 0,05, con un intervalo de confianza (IC) de 95 %.
Aspectos éticos
Se respetó la privacidad, confidencialidad e integridad de los datos obtenidos de los pacientes con la responsabilidad y obligación de no divulgar la identidad de los mismos. El protocolo de investigación fue evaluado y aprobado por el Consejo Científico y el Comité de Ética para la Investigación del HHA. Los procederes terapéuticos aplicados a los pacientes fueron explicados inicialmente o cuando hubo que realizar algún cambio en el tratamiento, los que forman parte del protocolo de actuación asistencial de atención a esta enfermedad, con el consentimiento informado asistencial. De ahí que no fuera necesario solicitar un consentimiento informado al paciente específicamente para esta investigación.
Resultados
La respuesta al tratamiento de nimotuzumab combinado con quimioradioterapia se presenta en la figura 1, donde se muestra que la tasa de respuesta objetiva y la tasa de control de enfermedad fueron 64,9 % y 83 %, respectivamente.
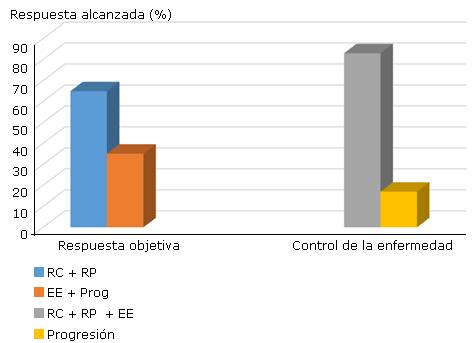 RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión.
RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión.Fig. 1 Respuesta al tratamiento.
La tabla 1 muestra las características clínicas - demográficas relacionadas con el paciente, las cuales reflejan predominio del sexo masculino, mayores de 60 años de edad, color de piel blanca, ECOG 1, localizados en el tercio medio, diferenciación moderada, y etapas localmente avanzadas. Es de destacar que ninguna de las variables analizadas tuvo una significación estadística en relación con la respuesta al tratamiento, excepto los pacientes con ECOG 0 y color de la piel no blanca, que se asocian con una mayor respuesta.
Tabla 1 Respuesta al tratamiento según variables relacionadas con el paciente y tumor (n= 94)

ECOG: escala de la Eastern Cooperative Oncology Group; BD: bien diferenciado; MD: moderadamente diferenciado; PD: poco diferenciado; RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión.
Fueron más frecuentes los pacientes que recibieron tratamiento con esquemas de quimioterapia con cisplatino y 5-fluouracilo, los que recibieron dosis superiores de quimioterapia al 75 % de lo planificado, dosis iguales o mayores de 50 Gy de radiaciones, y más de catorce dosis de nimotuzumab. Las variables relacionadas con mayor respuesta y significación estadística fueron aquellas que tuvieron una dosis de radiaciones de al menos 50 Gy, y más de catorce dosis de nimotuzumab (Tabla 2).
Tabla 2 Respuesta al tratamiento acorde a variables relacionadas con el tratamiento (n= 94)
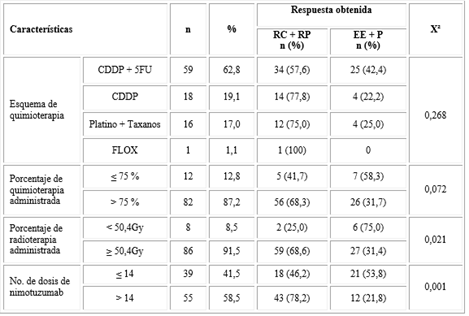
BD: bien diferenciado; MD: moderadamente diferenciado; PD: poco diferenciado; RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión; CDDP: cisplatino; 5FU: 5-fluouracilo; FLOX: esquema con oxaliplatino y 5-fluouracilo.
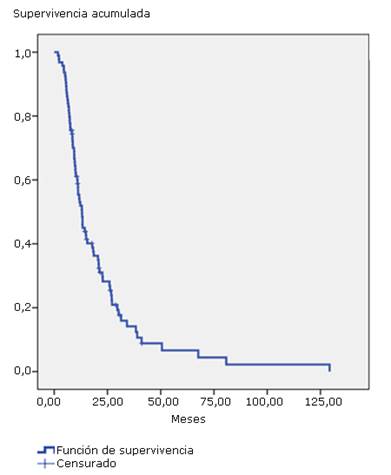
La mediana de supervivencia fue de 13,03 meses (IC95 %-10,9; 15,2) (Fig. 2).
La tabla 3 muestra una tendencia de mayor supervivencia en pacientes del sexo femenino, con localización en el tercio superior, y localmente avanzados, pero solo son estadísticamente significativos aquellos con ECOG cero, que tienen 1,9 veces mayor probabilidad de sobrevivir que los que tienen ECOG 1.
Tabla 3 Mediana de supervivencia global acorde a variables relacionadas con paciente y tumor (n= 94)
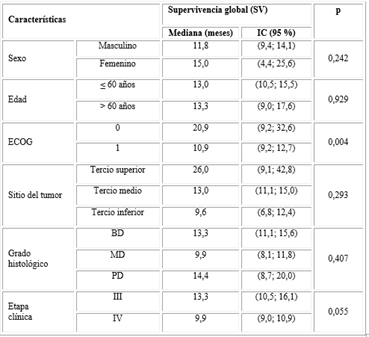
ECOG: escala de la Eastern Cooperative Oncology Group; BD: bien diferenciado; MD: moderadamente diferenciado;
PD: poco diferenciado; RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión.
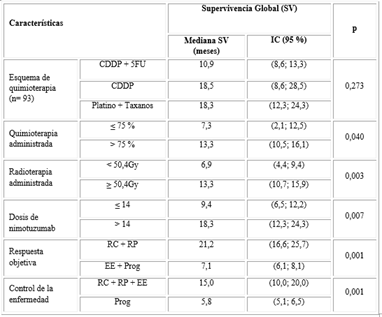
La tabla 4 muestra que los pacientes que recibieron dosis superiores de quimioterapia al 75 % de lo planificado, dosis iguales o mayores de 50 Gy de radiaciones, y más de catorce dosis de nimotuzumab, se asociaron significativamente con una mayor supervivencia (p < 0,05). Los pacientes que alcanzaron una respuesta objetiva tuvieron tres veces mayor probabilidad de sobrevivir que aquellos que no lo alcanzaron.
Tabla 4 Mediana de supervivencia global acorde a variables relacionadas con el tratamiento
(n= 94)
BD: bien diferenciado; MD: moderadamente diferenciado; PD: poco diferenciado; RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; Prog: progresión; CDDP: cisplatino; 5FU: 5 fluouracilo; FLOX: esquema con oxaliplatino y 5 fluouracilo. Se excluyó un paciente que recibió quimioterapia basada en oxaliplatino.
Las toxicidades más frecuentes observadas en la serie fueron las náuseas, vómitos, anemia y disfagia en más del 25 % de los pacientes. Solo 5,8 % de los pacientes presentaron toxicidades clasificadas como grado 3-5 (Fig. 3).
Discusión
Los estudios observacionales basados en datos reales obtenidos de la práctica clínica diaria Real world data (RWD por sus siglas en inglés) no pueden sustituir los datos de seguridad y eficacia generados por los ensayos clínicos aleatorizados exploratorios, pero pueden ayudar a complementarlos incorporando información de un gran número de pacientes en un entorno clínico real.16 Diferentes modalidades de tratamiento se han desarrollado para mejorar los resultados terapéuticos del cáncer de esófago, pero esta enfermedad sigue siendo una de las neoplasias más difíciles de curar. Especialmente porque se presenta con gran frecuencia en estadios localmente avanzados donde la cirugía con intención curativa no puede ofrecerse. Por tal motivo, la mayoría de los ensayos clínicos e investigaciones están dirigidas a este subgrupo de pacientes.3
Varios marcadores biológicos en el cáncer de esófago, han sido encontrados en los últimos años, entre los que se encuentran: el receptor del factor de crecimiento epidérmico (EGFR), el factor de crecimiento endotelial vascular (VEGF) y el protooncogén HER-2neu. Entre ellos, EGFR (también llamado HER-1) es un miembro de la familia HER de receptores de tirosina quinasa, que están codificados por el oncogén erbB, que se asocia a mal pronóstico.17 Se han desarrollado muchos fármacos para inhibir la señalización de EGFR, como cetuximab y nimotuzumab, que reconocen la región extracelular de EGFR para bloquear la unión de EGF al receptor, o erlotinib y gefitinib, inhibidores de pequeña molécula que actúan sobre la región intracelular del receptor. Estos fármacos dirigidos, mejoran las tasas de respuesta al tratamiento y la supervivencia libre de progresión, pero incrementan los costos, y los efectos secundarios, sin un beneficio claro en la supervivencia, en comparación a la quimioradioterapia convencional.18,19
La serie de pacientes presentada aquí, se corresponde con la presentación habitual de los pacientes con carcinoma epidermoide esofágico, y reportada por otros autores,20,21 donde existe un predominio del sexo masculino, presentación en la séptima década de la vida, tumor primario localizado en el tercio medio, y con ECOG entre 0 y 1. No obstante, el subtipo carcinoma epidermoide a diferencia del adenocarcinoma, es más frecuente en la raza negra.21
Luego que la quimiorradioterapia se convirtió en el manejo estándar para el cáncer de esófago localmente avanzado, se realizaron varios ensayos para examinar terapias más intensivas en un intento por mejorar los resultados. Las dosis más altas de radiación no aumentaron la supervivencia, ni el control local, y probablemente, incrementaron las muertes por toxicidad.22 Otros regímenes de quimioterapia no demostraron ser superiores al cisplatino y al fluorouracilo. En el ensayo PRODIGE5/ACCORD17, la mediana de supervivencia libre de progresión fue similar entre pacientes que recibieron fluorouracilo, y oxaliplatino o cisplatino con fluorouracilo (9,7 meses frente a 9,4 meses, respectivamente).23 La adición de agentes dirigidos a la quimiorradioterapia ha demostrado resultados prometedores en pequeños ensayos informados hasta ahora. Los resultados de un ensayo fase II que evaluó cetuximab, cisplatino y fluorouracilo concomitantes con radiación demostraron una tasa de respuesta completa de 38 % en pacientes con enfermedad localmente avanzada. Por el contrario, en el ensayo fase II del Southwest Oncology Group, la adición de cetuximab a la combinación no estándar de cisplatino e irinotecan con radioterapia concurrente dio como resultado una tasa de respuesta completa de sólo 6 %, con mala tolerancia. Otro estudio negativo es el ensayo fase II/III SCOPE 1, que evalúa la adición de cetuximab a un régimen de quimiorradioterapia con cisplatino, capecitabina y radioterapia administrada simultáneamente. Se observa una tasa libre de fracaso al tratamiento a las 24 semanas, más baja entre los pacientes tratados con cetuximab (66 % versus 77 %), y también se observa una mediana de SG más corta para estos pacientes (22 meses versus 25 meses).24,25
Por otra parte, Lorenzen y otros, en pacientes con carcinoma escamoso de esófago, aleatorizan en dos grupos: cisplatino/5FU y cisplatino/5FU más cetuximab. Las tasas de respuesta objetiva fueron superiores en el brazo de combinación con cetuximab (19 % versus 13 %), al igual que el beneficio clínico (75 % versus 57 %).26 La tasa de respuesta objetiva y de control de enfermedad obtenida en el presente estudio de 64,9 % y 83 %, respectivamente, fueron más altas que la obtenida por Lorenzen de 18 %, y 75 %, respectivamente, con mucha menor toxicidad grado 3-4 (5,8 % versus 50 %). La mediana de SV alcanzada en la serie, en la que se utilizó mayoritariamente la quimioterapia con cisplatino y fluouracilo supera en 3,5 meses al referido estudio.26
En un estudio fase II, realizado por Safrán y otros, utilizan carboplatino, paclitaxel y cetuximab semanal por 6 semanas y RT (50,4 Gy), y obtienen respuestas completas en 72 % de pacientes con CEp, aunque tras la resección quirúrgica, 60 % de los pacientes con respuesta completa, presenta enfermedad residual.27 Desafortunadamente, solo el 20 % de los pacientes incluidos, presentan carcinoma epidermoide, y todos los pacientes tienen tumores localmente avanzados. En la presente serie, los pacientes que utilizaron taxanos combinados con sales de platino, aunque con una muestra pequeña, obtuvieron 75 % de respuesta objetiva, y una mediana de SV de 18,3 meses, que es comparable a los resultados del referido estudio, así como a una menor toxicidad que éste y otros estudios como el de Suntharalingam y otros, en el que reportan hasta 73 % de toxicidades grado 3 a 5, producido fundamentalmente por la adición de cetuximab.28
Un metaanálisis recientemente publicado muestra que la adición de cetuximab a la terapia multimodal incrementa significativamente la tasa de respuesta objetiva y el control de la enfermedad en pacientes con carcinoma esofágico metastásico en comparación con los tumores localmente avanzados. Sin embargo, falla en incrementar la SV en ambos grupos de pacientes, con un aumento significativo de eventos adversos, tales como la diarrea (en dos veces), y el rash (en 16 veces) en el grupo de pacientes que utilizó cetuximab con respecto a los que no utilizaron cetuximab.29
Nimotuzumab es un anticuerpo monoclonal humanizado contra el EGFR, que ha demostrado tener una vida media más prolongada, un área bajo la curva más alta y una toxicidad cutánea grave rara, en comparación con otros inhibidores de EGFR.30 La mayor experiencia con el uso del nimotuzumab combinado con quimioradioterapia en este escenario se concentra en Cuba y China.
En Cuba, se realizó el primer estudio clínico controlado y aleatorizado, en pacientes con tumores epiteliales malignos de esófago, y los resultados obtenidos fueron superiores cuando se combinó nimotuzumab a la QRT, con incremento significativo de la tasa de control de enfermedad de 60,9 % en comparación a QRT sola (26,9 %). La mediana de supervivencia es superior en el grupo de nimotuzumab en comparación con el grupo control: 8,1 meses frente a 3 meses.11 En un estudio retrospectivo, se compara la eficacia de nimotuzumab versus cetuximab más quimiorradioterapia concurrente en pacientes con carcinoma epidermoide localmente avanzado de esófago, en el que la tasa de respuesta objetiva es 61,0 % para nimotuzumab versus 43,5 % para cetuximab, aunque sin diferencia significativa (p= 0,81), mientras que la mediana de SV del grupo nimotuzumab y cetuximab es 24,5 y 20,9 meses, respectivamente. Los resultados alcanzados en el presente estudio en pacientes con tumores localmente avanzados fueron inferiores a los reportados en el artículo de Jing.31
En un estudio retrospectivo, realizado en China, en 205 pacientes con diversos tumores epiteliales malignos en etapas avanzadas tratados con terapia combinada de nimotuzumab y quimioterapia, arroja que la edad, sexo y tratamientos previos podrían ser factores predictivos potenciales de supervivencia en pacientes chinos, y los pacientes que recibieron nimotuzumab con más de seis dosis y más de 200 mg/semana podrían beneficiarse más de la terapia con nimotuzumab.32) En otro estudio, desarrollado en Cuba, en el mundo real, se observa que los pacientes que reciben mayor número de dosis alcanzan una mediana de supervivencia de 18,0 meses, lo que constituye básicamente el núcleo principal de los largos supervivientes.33
En la presente investigación se demostró que el mayor número de dosis de nimotuzumab se asoció a una mayor probabilidad de respuesta objetiva (p= 0,001) y supervivencia (p= 0,007), y al igual que los estudios anteriormente mencionados, no se asociaron a una mayor toxicidad.32,33
Lu y otros, condujeron un ensayo clínico Fase II, monocéntrico, en un solo brazo donde evalúan la terapia combinada de nimotuzumab a cisplatino y paclitaxel en carcinoma escamoso avanzado esofágico. El índice de respuesta objetiva y de control de la enfermedad es de 51,8 %, y 92,9 %, respectivamente. La mediana de SV fue catorce meses.34
El ensayo NICE, fue conducido por un Grupo Cooperativo Brasileño, donde reclutan 107 pacientes con tumores esofágicos localmente avanzados, con edad media de 59 años, y 93 % con carcinoma epidermoide. La mediana de SV es 15,9 meses para el grupo de nimotuzumab combinado a QRT, y 11,5 meses, para el brazo de QRT. La toxicidad fue manejable en ambos brazos sin diferencias importantes en los eventos adversos (EA).35 No se identifican mutaciones en KRAS y EGFR, en 48 muestras (15 del brazo de control y 33 del brazo de nimotuzumab).35) Otro estudio demuestra la rareza de este tipo de mutaciones en las neoplasias malignas esofágicas, fundamentalmente en los carcinomas epidermoides.36
En resumen, nuestro estudio mostró que el nimotuzumab combinado a QRT en el tratamiento de pacientes con carcinoma epidermoide localmente avanzado o metastásico de esófago obtuvo óptimas tasas de respuesta objetiva y SV, sin acumulación de toxicidad a corto y largo plazo, y un buen perfil de toxicidad. No obstante, nuevos estudios deberán ser realizados al combinar nimotuzumab con quimioradioterapia, con cisplatino y paclitaxel, ya que hay evidencias de superioridad de este esquema sobre la combinación actualmente utilizada de platinos con fluoropirimidinas.37
A pesar de las limitaciones inherentes de cualquier estudio monocéntrico, y retrospectivo, no creemos que afecten las conclusiones enunciadas anteriormente, y reafirma el posicionamiento del nimotuzumab en combinación a la terapia estándar en este escenario tanto nacional como internacionalmente, dado el alto costo de los similares comercialmente disponibles (cetuximab o panitumumab). Por otra parte, se abren nuevas perspectivas para la realización de estudios futuros de combinación del nimotuzumab con las terapias existentes, en esta y otras localizaciones de cáncer, así como estudios económicos que avalen la utilización de este producto como parte de la estrategia terapéutica en la atención de pacientes con cáncer avanzado.