Introducción
El 11 de marzo de 2020 la Organización Mundial de la Salud declaró la COVID-19, causada por el SARS-CoV-2, como pandemia. Basada en el limitado conocimiento del nuevo virus y la fisiopatología de la enfermedad, la comunidad científica internacional buscó tratamientos que frenaran la hecatombe epidemiológica. En este contexto se consideraron necesarias las terapias antivirales (actúan sobre algunas de las etapas del ciclo vital infeccioso del virus) y las relacionadas con la respuesta del hospedero (suprimen la progresión de la enfermedad al bloquear alguno de los mecanismos fisiopatológicos de la infección); especialmente cuando surgieron variantes de mayor virulencia y la efectividad de las vacunas resultaba incierta, en cuanto a la especificidad y la duración de la protección.
Varios medicamentos ya establecidos constituyeron propuestas no-vacunales contra la COVID-19. Se realizaron más de 600 ensayos clínicos con antivirales, antibióticos, inmunomoduladores, antiinflamatorios, antioxidantes, y antitrombóticos.1 Sin embargo, ningún tratamiento resultó efectivo, a pesar de los alentadores resultados a nivel no-clínico. Una de las explicaciones para este fracaso estuvo en el empleo de medicamentos monoligandos (un único blanco farmacológico) frente a una enfermedad compleja con varios componentes etiopatológicos, como la hipoxemia, la reacción hiperinflamatoria, las cuagulopatías, el estrés oxidativo y la linfopenia asociada a la inducción de vías apoptóticas de muerte celular.2,3 Estos antecedentes determinaron una búsqueda bibliográfica de los medicamentos, establecidos en la práctica clínica, con el potencial de actuar multifuncionalmente sobre los mecanismos de la COVID-19. Esta comunicación breve tuvo como objetivo reseñar los mecanismos farmacológicos del azul de metileno en la terapia de la COVID-19.
Desarrollo
El azul de metileno es un derivado fenotiacínico que se sintetizó como colorante en 1876. En medicina se utilizó por primera vez como agente antimalárico por Paul Erlich en 1891.4 Actualmente se continúa usando como agente antimalárico y antídoto frente a tóxicos mitocondriales (cianuro, monóxido de carbono, nitritos), y en el tratamiento de la metahemoglobinemia, el síndrome vasoplégico en pacientes críticos y el choque séptico.5
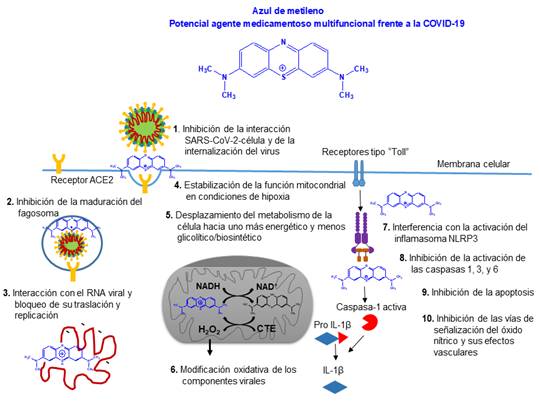
El empleo del azul de metileno para combatir la COVID-19 se sustentó en los siguientes aspectos: la inhibición de la interacción virus-célula y la replicación del RNA viral, la prevención de la maduración del fagosoma, la limitación del suministro de precursores biosintéticos para los componentes estructurales virales, la oxidación de los mecanismos estructurales del virus y los dependientes de la célula hospedera como la estabilización de la función mitocondrial aún en condiciones de hipoxia severa; además de la actividad antinflamatoria, antiapoptótica y la capacidad de interferir con las vías de señalización del óxido nítrico (fig.).5
Se resalta la capacidad del azul de metileno de favorecer la síntesis de ATP bajo hipoxia severa o inhabilitación de la respiración mitocondrial. Bajo estas condiciones se acumula el NADH con la consiguiente disminución de las concentraciones de su contraparte oxidada NAD+ que, a su vez, impide la descarboxilación oxidativa del ɑ-cetoglutarato (ciclo de Kreb) y la oxidación del gliceraldehído 3-fosfato (vía glicolítica). Esto provoca un colapso energético generalizado que puede llevar al fallo en múltiples órganos, complicación reconocida en pacientes críticos de COVID-19.5
El azul de metileno, por sus características redox, oxida directamente al NADH y regenera el NAD+. Con ello se reinician estas reacciones, y se producen fosforilaciones a nivel de sustrato (no dependen de la respiración mitocondrial) y síntesis de ATP.5 Por consiguiente, el tratamiento con azul de metileno, en condiciones de inhibición de la respiración mitocondrial, puede restaurar el balance energético celular al promover las fosforilaciones a nivel de sustrato. Asimismo, tiene un potente efecto antiinflamatorio porque activa el complejo multiproteico NLRP3 o inflamasoma, muy útil en la prevención de la reacción hiperinflamatoria o “tormenta de citosinas” en enfermos de COVID-19.5
La capacidad de inhibir las vías de señalización del óxido nítrico contribuye también a su efectividad antiinflamatoria; por tanto, reduciría las complicaciones vasculares asociadas al choque séptico vinculado a la infección (síndrome vasoplégico). Los efectos antiapoptóticos se relacionan con su capacidad de inactivar las caspasas 1, 3 y 6 vía interacción con sus sitios catalíticos. Este mecanismo podría prevenir la marcada linfopenia en pacientes con COVID-19, caracterizada por una reducción de linfocitos T CD4 y T CD8.5
Una amplia bibliografía sustenta los efectos protectores del azul de metileno frente al daño isquémico a corazón, pulmón, riñón, páncreas, hígado y cerebro.5 La farmacocinética lo distribuye por estos órganos, que son protegidos gracias a la combinación de los mecanismos mencionados anteriormente.
Las evidencias clínicas de los efectos del azul de metileno frente a la COVID-19 fueron muy escasas. Un ensayo clínico fase I (NCT04370288; 19 de abril de 2020) reportó que, después de la administración del azul de metileno (como parte de una combinación de medicamentos que contenía además vitamina C y N-acetil cisteína) a pacientes críticos, cuatro de cinco sobrevivieron porque se redujeron los niveles séricos de nitritos, la proteína reactiva C, la lactato deshidrogenasa y el l % de metahemoglobinemia, y mejoró el balance antioxidante.6 Igualmente, en una cohorte de 2500 pacientes franceses tratados con azul de metileno como parte de su atención oncológica no se detectaron enfermos de COVID-19.7
Una de las limitaciones de la propuesta del azul de metileno como terapia anti-COVID-19 se fundamentó en la falta de evidencias de mecanismos antivirales directos. Aunque un estudio demostró su capacidad antiviral in vitro al impedir la infección de células Vero E6 por la variante IHUMI-3 del SARS-CoV-2, con una concentración media (CI50) de 0,3 ± 0,03μM.8 También se señaló que inhabilitó (IC50= 3µM, aproximadamente) la interacción de fragmentos de la espícula del SARS-CoV-2 (S1) o el dominio de unión al receptor (RBD) con el receptor de la enzima convertidora de angiotensina -2 (ACE2) en sistemas experimentales libres de células y en células HEK293T, que expresaron el ACE2 y se expusieron a un pseudovirus con las espícula S del SARS-CoV-2.9 Los valores de CI50 en ambos tipos celulares no superaron las concentraciones plasmáticas que se alcanzaron luego de administraciones orales del azul de metileno en humanos (7-17µM),9 lo cual auguró un posible éxito en la clínica.
Conclusiones
La combinación en una única terapia efectos antivirales, antihipóxicos, antiinflamatorios, antiapoptóticos, vasculares y antioxidantes hacen del azul de metileno una alternativa interesante para tratar de forma multifuncional la COVID-19. A esta multiplicidad de mecanismos se añaden los resultados clínicos de las diferentes investigaciones, el bajo perfil de toxicidad, la farmacocinética privilegiada, el bajo costo y la posibilidad de fabricación en Cuba. Se recomienda realizar estudios de intervención en los hospitales para confirmar científicamente esta propuesta.