Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.32 n.2 Matanzas abr.-jun. 2009
ARTÍCULO DE INVESTIGACIÓN
Rasgos de semillas de árboles en un bosque siempreverde tropical de la Sierra del Rosario, Cuba
Seed traits of trees in an evergreen tropical forest of the Sierra del Rosario, Cuba
J.A. Sánchez, Bárbara Muñoz y Laura Montejo
Instituto de Ecología y Sistemática, Ministerio de Ciencia, Tecnología y Medio Ambiente. Carretera de Varona Km 3½ Capdevila, Boyeros, A.P. 8029, C.P. 10800, Habana 8, Cuba
E-mail: jasanchez@ecologia.cu
Resumen
Se estudiaron los rasgos de las semillas de 40 árboles de un bosque siempreverde tropical de la Reserva de la Biosfera Sierra del Rosario, Cuba. Las variables determinadas fueron: la masa fresca y seca de las semillas, el contenido de humedad inicial, la masa seca de las estructuras de defensa física (testa/endocarpo) y de las reservas (embrión/endospermo), y la proporción de recursos de la semilla distribuidos a las defensas físicas y a las reservas. Las variables seminales se analizaron por tres vías: 1) a nivel de comunidad; 2) por estrategia de regeneración (pioneras y no pioneras); y 3) por tiempo de dispersión de las semillas (estación seca, comienzos de la estación lluviosa y finales de la estación lluviosa). La masa fresca de las semillas tuvo un rango de 0,042 mg hasta 10 628,9 mg. El contenido de humedad inicial promedio fue de 17,3%, con un 9,3% en las pioneras y 19,4% en las especies de estadios avanzados de la sucesión; similar tendencia se observaron para la masa fresca y la masa seca de las semillas. La proporción de masa seca de las semillas destinada a las cubiertas seminales fue de un 46,1% para todas las especies y en las pioneras este valor fue superior (59,1%). El contenido de humedad inicial se correlacionó negativamente con el porcentaje de materia seca destinado a la formación de las cubiertas seminales y positivamente con la masa fresca de la semilla. Estas tres últimas variables no mostraron diferencias significativas cuando se analizaron por categoría de dispersión de las semillas.
Palabras clave: Árboles, semilla
Abstract
Seed traits of 40 trees in an evergreen tropical forest of the Sierra del Rosario Biosphere Reserve, Cuba, were assessed. The variables determined were fresh and dry seed mass, initial moisture content, dry mass of the seed structures for physical defense (testa/endocarp) and reserves (embryo/endosperm) and the amount of seed resources dedicated to physical defense and reserves. The seed variables were analyzed by three ways: 1) behavior at community level; 2) regeneration strategy (pioneers versus non-pioneers); and 3) time of seed dispersal (dry season, early and late rainy season). Seed fresh mass ranged from 0,042 mg to 10 628,9 mg. The mean initial moisture content was 17,3%, with 9,3% in pioneers and 19,4% in species belonging to advanced stages of succession; a similar trend was observed in fresh and dry seed mass. Proportion of dry seed mass in seed coats was 46,1% in all species, and in pioneer seeds this value was higher (59,1%). The initial moisture content was negatively correlated to the dry mass percentage involved in seed coat formation and positively correlated to fresh seed mass. These last three variables showed no significant difference when analyzed by category of seed dispersal.
Key words: Seed, trees
Introducción
Los bosques tropicales son bien conocidos por su alta riqueza de especies de plantas. En este ambiente, los árboles producen semillas que muestran una amplia diversidad en: masas, formas, estructuras de dispersión, composición química, contenido de agua, naturaleza de las reservas, mecanismos de dormancia, y patrones de germinación y de longevidad (Foster, 1986; Vázquez-Yanes y Orozco-Segovia, 1993; Rose y Poorter, 2003; Daws et al., 2005). Esta gran variabilidad en los rasgos morfológicos y fisiológicos de las semillas se debe fundamentalmente a las respuestas de las plantas a la presión del ambiente donde evolucionaron (Westoby et al., 2002); aunque no todos los rasgos de las semillas tienen un valor adaptativo en el ambiente ecológico actual (Vázquez-Yanes y Orozco-Segovia, 1993).
Entre los rasgos de las semillas más estudiados, en los árboles tropicales, se encuentran la masa de la semilla (fresca y/o seca) y su contenido de humedad. La masa de la semilla desempeña un papel fundamental en la reproducción, la dispersión, la germinación, el establecimiento y la capacidad competitiva de las plantas, y se considera una de las dimensiones más importante en la variación ecológica entre las especies (Leishman et al., 2000; Westoby et al., 2002; Poorter y Rose, 2005). Por otra parte, el contenido de humedad de la semilla es un buen indicador de su velocidad de germinación y su longevidad (Foster, 1986; Murdoch y Ellis, 2000). Sin embargo, otras características de las semillas también podrían mostrar las respuestas de las especies al ambiente, entre estos rasgos se destacan: las estructuras de defensa física (testa/endocarpo) y el contenido de nutrientes minerales en las reservas seminales (embrión/endospermo); dichos rasgos han sido escasamente estudiados en los árboles tropicales, aunque Grubb (1998) y Daws et al. (2005) han realizado valiosas contribuciones.
En Cuba, los primeros trabajos de caracterización morfofisiológica de las semillas de árboles de interés forestal se realizaron, fundamentalmente, en especies de estadios tempranos o tardíos de la sucesión de los bosques (Sánchez et al., 1997; Sánchez et al., 2002; Torres-Arias et al., 2002). Por otra parte, en nuestro país nunca se ha realizado un estudio a nivel de comunidad en dicha temática y para la Reserva de la Biosfera Sierra del Rosario (RBSR), donde se hizo la presente investigación, sólo se ha efectuado la caracterización seminal de cinco especies de árboles pioneros (Muñoz y Sánchez, 2000). Por consiguiente, el objetivo del presente estudio fue la caracterización de las semillas de 40 especies de árboles de un bosque siempreverde tropical de la RBSR.
Materiales y Métodos
Descripción del sitio. La RBSR se localiza en la parte más oriental de la Sierra del Rosario, Pinar del Río, Cuba (22º 45' N, 82º 50' W) y tiene una extensión de 25 000 ha. En la región, la temperatura media anual del aire es de 24,4ºC, el sistema montañoso está fuertemente diseccionado y las alturas varían desde 100 hasta 565 m. La flora, la vegetación y la geología de la RBSR se describieron ampliamente por Herrera et al. (1988). La precipitación total anual es de 2 300 mm, en diciembre, enero, febrero y marzo, fue baja y se incrementó en abril hasta alcanzar los máximos a partir de julio, y posteriormente disminuyó (desde octubre hasta noviembre) y alcanzó el mínimo en diciembre (Vilamajó et al., 1988). Basado en esta información y en la propuesta de Garwood (1983) y Sautu et al. (2006), se reconocieron tres estaciones de distribución de las lluvias (i.e., estaciones de dispersión/colecta): estación seca, de diciembre a marzo; comienzos de la estación lluviosa, de abril a julio; y finales de la estación lluviosa, de agosto a noviembre.
Especies seleccionadas y colecta de semillas. Las plantas estudiadas son especies pioneras y clímax (no pioneras) de la flora primaria de los bosques de la RBSR (Herrera et al., 1997). Sólo Albizia lebbeck es una especie naturalizada en la RBSR, como ocurre también en diferentes bosques del Archipiélago Cubano. Las arbóreas se seleccionaron sobre la base de su frecuencia en el sitio de estudio y la disponibilidad de semillas. La gran mayoría de las plantas estudiadas han sido usadas en la industria maderera y en sistemas silvopastoriles en Cuba (Betancourt, 1987; Toral et al., 2001), y todas están propuestas para planes de reforestación en los trópicos (Herrera et al., 1997). Los nombres de las familias se establecieron según Angiosperm Phylogeny Group (1998). Las especies seleccionadas presentaron un amplio rango de masa fresca de las semillas y pertenecen a 21 familias botánicas, entre las que se destacaron con un mayor número de especies: Fabaceae (8), Malvaceae (4) y Sapindaceae (4). En 24 especies el modo de dispersión fue la zoocoría.
Las semillas frescas se colectaron en la Estación Ecológica «El Salón» (sección central de la RBSR), cubierta por un bosque siempreverde estacional submontano, con una dosel cerrado de 30 m de altura y un 13% de árboles que pierden sus hojas durante los meses poco lluviosos. El endemismo en el sitio de colecta es pobre (11%) (Capote et al., 1983). Tres especies de las 40 estudiadas son endémicas (Schoepfia didyma, Calophyllum pinetorum y Juglans insularis). La colecta de las semillas se realizó desde el 2003 hasta el 2006. Muchos frutos se colectaron directamente de la planta madre usando una vara telescópica. Sólo los frutos de J. insularis fueron colectados del suelo, si se encontraban en buen estado de conservación. Los frutos frescos se limpiaron inmediatamente después de ser colectados; el secado de las semillas se realizó durante 72 h al aire y a la sombra. Después de separadas las semillas de los frutos, se mezclaron y se almacenaron en cajas de papel a 25ºC y 60% de humedad relativa en la oscuridad. Todos los ensayos se realizaron inmediatamente después de la colecta de las semillas.
En la tabla 1 se presenta para cada especie el tipo de diáspora (i.e., unidad de dispersión), el período de fructificación, el mes de colecta de las semillas y el tiempo de dispersión. Las especies se ordenaron por la masa fresca promedio de la semilla dentro de cada grupo ecológico. Para 38 especies, los frutos fueron colectados de cinco o más individuos; sólo en Ceiba pentandra y J. insularis la colecta se realizó de tres ejemplares, debido a la baja disponibilidad de árboles fructificados durante la recolección. El período de fructificación se refiere al tiempo de máxima producción de frutos durante el presente estudio; pero para algunas especies este período ha sido más largo, o durante todo el año como ocurre en Muntingia calabura (Vilamajó y Menéndez, 1988).
En este estudio, se consideró como semilla a una verdadera semilla o una diáspora (verdadera semilla más endocarpo). Las especies cuyas diásporas incluyen endocarpo de drupas fueron Allophylus cominia, Beilschmiedia pendula, Citharexylum spinosum, Cordia collococca, Eheretia tinifolia, J. insularis, Prunus occidentalis, Pseudolmedia spuria, S. didyma y Trema micrantha, y como cámara fue Andira inermis.
Características de las semillas. Se tomó por especie una muestra de 100 semillas, las que fueron separadas en sus partes componentes: testa/endocarpo y embrión/endospermo. Estas partes se secaron a 103 ± 2ºC por 17 horas (ISTA, 1999) y posteriormente se realizó la determinación de la masa mediante la suma de ambas partes. Al determinar la masa de la semilla, se removieron las partes frescas de las paredes del fruto, así como cualquier arilo o sarcotesta. Para calcular la distribución de masa en la semilla (i.e., partes asignadas a las reservas o defensas), se dividió la fracción de masa a las reservas (embrión/endospermo) o a las estructuras de defensa (testa/endocarpo) entre la masa seca total (Fenner, 1983; Grubb y Coomes, 1997; Sánchez et al., 1997; Daws et al., 2005). Los valores de ambas fracciones se multiplicaron por 100 para facilitar la interpretación de los datos. El contenido de humedad inicial se determinó por el método de secado a baja temperatura constante a 103 ± 2ºC por 17 horas (ISTA, 1999). Para todas las especies, se delimitaron seis categorías de tamaño de las semillas basado en su masa fresca, según Foster (1990). La masa fresca promedio se determinó a partir de una muestra de 100 semillas por especie.
Análisis estadístico. Se emplearon análisis de correlación de Pearson para comparar dos rasgos de las semillas a través de todas las especies y por grupos ecológicos; todas las variables de masa se transformaron por logaritmo previamente al análisis. Las comparaciones de rasgos de las semillas entre los grupos de dispersión se probaron por análisis de varianza de clasificación simple (ANOVA).
Resultados
La masa fresca de la semilla (i.e., tamaño de la semilla) presentó un rango de 0,042 mg (M. calabura; árbol pionero) hasta 10 628,93 mg (A. inermis; árbol no pionero) a través de las 40 especies estudiadas (tabla 2).
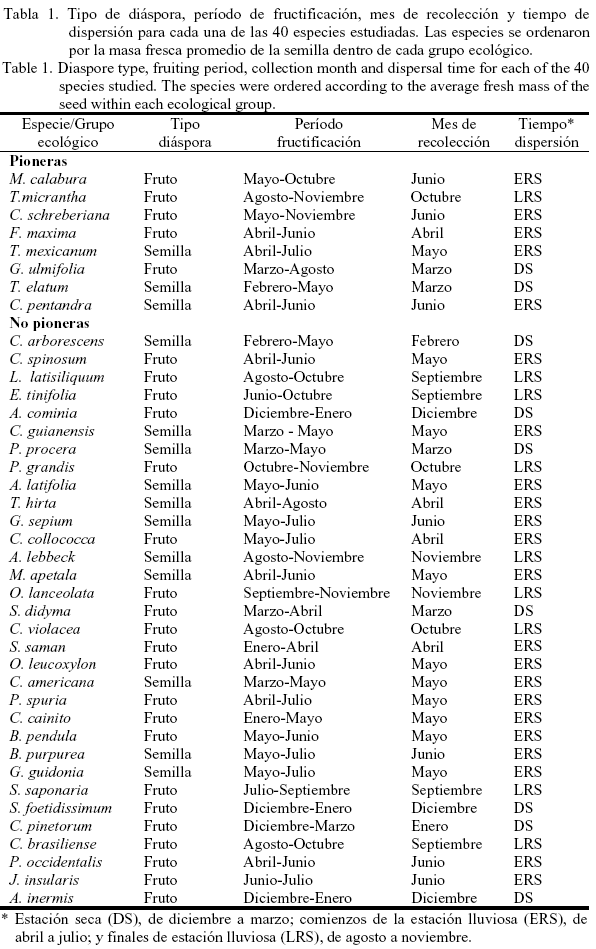
El tamaño de la semilla no se asoció con el modo de dispersión, ni con la altura de los árboles (datos no mostrados). La masa fresca de las semillas de 33 especies (85,0%) se agrupó en las categorías intermedias del tamaño de las semillas (10-99,9 mg y 100-999,9 mg) (fig. 1).
Todas las especies pioneras, excepto Talipariti elatum y C. pentandra, presentaron valores de masa fresca seminal significativamente inferiores a los de las especies no pioneras; en este último grupo sucesional Colubrina arborescens alcanzó el menor tamaño de las semillas (14,30 mg). La masa seca de la semilla tuvo un comportamiento muy similar a la masa fresca; el valor mínimo para esta variable se obtuvo en M. calabura (0,039 mg) y el máximo en A. inermis (6 189,52 mg) (tabla 3), con un valor medio para todas las especies de 497,3 mg y una mediana de 90,0 mg (tabla 4). El contenido inicial de agua de las semillas frescas varió de 6,2% en C. spinosum hasta 41,8% en A. inermis (tabla 3), con un valor medio entre especies de 17,3% y una mediana de 11,9%. Las semillas de las especies pioneras fueron más secas que aquellas de las especies no pioneras, y en este último grupo hubo una gran variación en el contenido de humedad.
El comportamiento de la masa seca de las cubiertas seminales (testa/endocarpo) y el de las reservas (embrión/endospermo) fueron muy similares, debido a que estas variables estuvieron correlacionadas entre sí y con la masa seca de las semillas. Los valores mínimos de la masa seca de las cubiertas y de las reservas se obtuvieron en M. calabura (0,002 mg y 0,036 mg, respectivamente). Las semillas de J. insularis mostraron los valores máximos de masa de las cubiertas seminales (4 062,07 mg) y las de A. inermis los de las reservas (3 749,64 mg). Entre todas las especies la masa seca de las cubiertas tuvo un valor promedio de 245,3 mg y una mediana de 23,4 mg; mientras que la masa seca de las reservas presentó una media de 252 mg y una medina de 62,2 mg (tabla 4). En las especies no pioneras se alcanzaron los valores máximos de ambas variables.
La proporción de la masa seca de la semilla destinada a la producción de estructuras protectoras (testa/endocarpo) se opone a la producción de reservas (embrión/endospermo). De este modo, M. calabura sólo logró un 7% de la materia seca destinado a las cubiertas y el máximo en el caso de la materia seca para las reservas (93%). En E. tinifolia se obtuvo el máximo porcentaje de materia seca de las semillas destinado a las cubiertas (91,5%) y el mínimo para la reservas (8,5%). Entre todas las especies la proporción de materia seca para las cubiertas seminales tuvo una media de 46,1% y una mediana de 46,2%. La media de esta variable en las especies pioneras fue superior (59,1%) al valor que alcanzaron las especies no pioneras (42,7%). Así, las especies pioneras asignaron mayores recursos a las estructuras protectoras de sus semillas, que a la fracción que representó las reservas seminales (tabla 4).
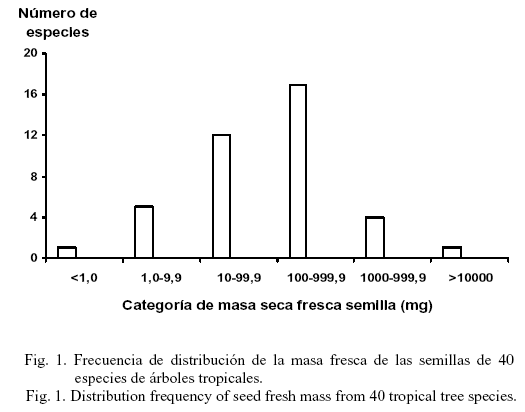
La relación entre los rasgos de las semillas en todas las especies se muestra en la figura 2 y, según las estrategias regenerativas, aparece en la tabla 5. La masa fresca se correlacionó positivamente con el contenido inicial de agua de las semillas frescas (fig.2a); al incrementarse el tamaño de la semilla aumentó su humedad, aunque esta última variable presentó una alta variabilidad en las especies no pioneras. La masa seca de las semillas se correlacionó casi perfectamente con la masa seca de las reservas (fig. 2b; r=0,97, P<0,001); también se correlacionó positivamente con la masa seca de las reservas y de las cubiertas, y estas dos últimas variables además se correlacionaron entre sí (datos no mostrados). Sin embargo, la masa seca no se correlacionó con el porcentaje de materia seca de la semilla destinado a las reservas (fig. 2c), lo cual se debió fundamentalmente a la gran variabilidad que presentó esta última variable en las especies no pioneras. En el grupo sucesional de los árboles pioneros, esta asociación fue significativa cuando M. calabura no se contempló en el análisis. Las semillas de M. calabura son las más pequeñas de las 40 especies estudiadas, pero alcanzaron los valores máximos en la proporción de la materia seca destinada a las reservas (tabla 3).
La masa seca de la reserva de las semillas se correlacionó negativamente con el porcentaje de materia seca destinada a las cubiertas seminales (fig. 2d), resultado que fue similar en las especies no pioneras y en las pioneras (sin M. calabura) (tabla 5). Esto significó que el porcentaje de la materia seca destinado a las estructuras de protección disminuyó con el incremento de las reservas seminales, aunque semillas de Sapindus saponaria, Sideroxylon foetidissimum y J. insularis (árboles no pioneros) mostraron valores altos de reservas y del porcentaje de la materia seca destinado a las cubiertas (tabla 3). Finalmente, la masa seca de la reserva se correlacionó positivamente con el contenido de humedad de las semillas frescas (fig.2e) y esta última variable se correlacionó negativamente con el porcentaje de materia seca destinado a las cubiertas (fig. 2f). En el análisis por estrategias de regeneración, ambas asociaciones sólo se establecieron para los árboles no pioneros (tabla 5).
Cuando las especies se agruparon por su tiempo de dispersión o de colecta, no hubo diferencias significativas para la masa fresca de las semillas, el contenido de humedad inicial y el porcentaje de materia seca destinado a las cubiertas (tabla 6), debido a la gran variabilidad dentro de cada tiempo de dispersión. Sin embargo, como promedio las semillas más grandes se colectaron en la estación seca, pero este grupo también mostró la mayor variabilidad en el tamaño, al abarcar plantas con semillas desde 5,91 mg (Guazuma ulmifolia) hasta 10 628,93 (A. inermis). Cuando no se contempló A. inermis en el análisis, la masa fresca fue mayor en las especies que se dispersaron al comienzo de la estación lluviosa; aunque tampoco se encontraron diferencias significativas entre los tiempos de dispersión. El máximo valor promedio del contenido de humedad inicial lo alcanzaron las especies que se dispersaron al comienzo de la estación lluviosa. La proporción de materia seca destinada a las cubiertas seminales tampoco difirió significativamente entre los tiempos de dispersión, como ya se comentó; no obstante, los valores máximos se obtuvieron en las semillas dispersadas en la estación seca y a finales de la estación lluviosa.
Discusión
En este estudio hubo seis órdenes de magnitud de diferencias entre el tamaño de las semillas más pequeñas y las más grandes (0,04210 628,93 mg). Este rango de variación es típico de diferentes floras del mundo (Leishman et al., 2000; Westoby et al., 2002) y se ha reportado con frecuencia para comunidades del Neotrópico, que involucran árboles pioneros y de estadios avanzados de la sucesión (Foster, 1986; Hammond y Brown, 1995; Sautu et al., 2006). También esta amplitud se ha encontrado en grandes árboles tropicales de un mismo grupo funcional (e.g., especies tolerantes a la sombra) (Grubb, 1998).
Varios factores microclimáticos y no microclimáticos afectan el tamaño y funcionamiento de las semillas de los árboles tropicales (Garwood, 1983; Grubb y Coomes, 1997); sin embargo, los requerimientos de luz para el establecimiento de las plántulas es el patrón más ampliamente reconocido que influye en la variación de dicho tamaño en las comunidades vegetales (Leishman et al., 2000; Rose y Poorter, 2003). Se conoce que especies maderables tropicales que ocupan sitios abiertos o perturbados tienen, como promedio, semillas más pequeñas que aquellas que habitan en lugares más estables y maduros (i.e., sitios más sombreados) (Foster, 1986; Hammond y Brown, 1995). Este patrón no es absoluto; por ejemplo algunas especies con semillas muy pequeñas (< 1 mg) en bosques húmedos, son muy tolerantes a la sombra (Grubb y Metcalfe, 1996; Metcalfe y Grubb, 1997). Además, Grubb (1998) propone que la variación en el tamaño podría estar más relacionada con los constreñimientos que imponen los dispersores, que con las posibles ventajas que podría tener un tamaño determinado de las semillas para el establecimiento de las plántulas en un determinado hábitat.
Foster y Janson (1985) propusieron que el patrón de distribución unimodal de la masa fresca de la semilla, hallado en 40 especies tropicales de todo el mundo, mostró condiciones de establecimiento intermedias para la mayoría de los árboles tropicales entre los tolerantes a la sombra y los dependientes de la luz. Este patrón de distribución de la masa fresca también se descubrió en el presente estudio (fig. 1). De hecho, la mayoría de las especies con semillas en la categoría intermedia de tamaño (10-1 000 mg) se establece indistintamente en los claros y sitios semiprotegidos (Herrera et al., 1997). También muchas especies de ambos grupos funcionales (pioneras y no pioneras) dispersaron sus semillas y frutos mediante los animales (fundamentalmente murciélagos); por tanto, no hay evidencias suficientes que permitan explicar las causas que produce la gran variabilidad en el tamaño de las semillas.
En el presente estudio, la masa de las semillas (i. e., seca y fresca) de las especies pioneras fue, como promedio, menor que la que presentaron las especies no pioneras o de estadios avanzados de la sucesión, tal como ha sido reportado para diferentes floras tropicales (Foster y Janson, 1985; Hammond y Brown, 1995). En Cuba, este resultado fue reportado inicialmente por Herrera et al. (1997), cuando estudiaron la masa seca de estas en 221 árboles de bosques húmedos y secos de la RBSR. Ellos también identificaron la variabilidad del tamaño de la semilla con la disponibilidad de la luz para el establecimiento de las plántulas, pero no mostraron evidencias experimentales que expliquen las causas de dicha asociación. Los valores de masa fresca y seca que se obtuvieron para las especies pioneras, fueron muy similares a los reportados por Muñoz y Sánchez (2000) para estos mismos taxones. La masa seca de las semillas reportada por Herrera et al. (1997) para los árboles de la RBSR no se pudo comparar con la del presente estudio, dado que los referidos autores agruparon en cuatro categorías de orden sucesional todas las variables empleadas en su contribución. No obstante, según R. A. Herrera (comunicación personal) las mayores diferencias en la masa de las semillas se concentraron en las especies de estadios avanzados de la sucesión.
La masa fresca de las semillas no se correlacionó con la altura que alcanzaron los árboles en el presente estudio. Grime et al. (1997) tampoco encontraron una correlación significativa entre ambas variables para 43 especies herbáceas de la flora británica; mientras que Foster y Janson (1985), Leishman et al. (2000) y Moles et al. (2004) informaron correlaciones significativas entre ambas variables. Es probable que la falta de asociación se deba a que se empleó la altura máxima alcanzada por los árboles en la RBSR. Se conoce que los valores máximos son muy vulnerables a los valores atípicos y, por tanto, pueden dar resultados no representativos (Moles et al., 2004). Sin embargo, Moles et al. (2004) obtuvieron una correlación positiva entre la masa de la semilla y la altura de las plantas cuando emplearon valores medios y máximos de altura de plantas.
Por otra parte, la masa fresca y el contenido de humedad se correlacionaron positivamente, y las semillas de las especies pioneras fueron como promedio las más secas. Sautu et al. (2006) obtuvieron un resultado similar, en un estudio que involucró 100 árboles nativos de un bosque estacional húmedo de Panamá. Vázquez-Yanes y Orozco-Segovia (1990, 1994) sugirieron que el reducido tamaño de las semillas en las especies pioneras y su bajo contenido de humedad, les permiten permanecer por cierto tiempo en el suelo sin sufrir daños celulares producidos por la deshidratación. Sin embargo, en semillas de 14 especies no pioneras también se obtuvieron bajos contenidos de humedad (<12%); por consiguiente, estas podrían sobrevivir igualmente en vegetaciones abiertas, como se propone para las especies pioneras. Ensayos experimentales para dilucidar esta hipótesis son factibles. Los contenidos de humedad de las semillas frescas de C. pentandra, Guarea guidonia, G. ulmifolia, S. saponaria, T. micrantha y Trichilia hirta fueron semejantes a los reportados por Sautu et al. (2006); pero los informados por estos autores para A. inermis (c.f. 57%) y Chrysophyllum cainito (c.f. 41%) fueron diferentes a los obtenidos para estas especies (c.f. 41% y 21%, respectivamente) en el presente estudio. También las especies pertenecientes a los géneros Calophyllum, Cupania y Trichospermum mostraron grandes diferencias en la humedad de sus semillas entre ambos sitios, que fue superior en todos los casos superiores para las colectadas de Panamá (Sautu et al., 2006). Vázquez-Yanes y Orozco-Segovia (1990) igualmente encontraron una gran variabilidad en el contenido de humedad de 17 especies de un bosque húmedo tropical de México. Ellos informaron, además, que la humedad y el tamaño de las semillas varió significativamente dentro de una misma especie, tal como sucede en A. inermis y P. occidentalis colectadas en bosques húmedos de la RBSR (J.A. Sánchez, datos no publicados).
La relación casi perfecta que se estableció entre la masa seca de las semillas y sus reservas o bien sus cubiertas seminales, a través de todas las especies y por estrategias de regeneración, evidenció que la masa seca de estas en los árboles estudiados es una buena medida de la cantidad de materia absoluta que se asignó a cada parte de la semilla; estos resultados se han demostrado también por Westoby et al. (1990), Wright y Westoby (1999) y Muñoz y Sánchez (2000). Sin embargo, esta relación no resultó tan obvia cuando se analizó la distribución de la masa de los distintos componentes de la semilla (testa/endocarpo y embrión/endospermo) con relación a la masa total. Los porcentajes de la masa seca destinados a la formación de las reservas o cubiertas seminales no se correlacionaron con la masa seca total a través de todas las especies, lo que indica que la cantidad de masa que se destina a cada componente de la semilla, posiblemente sea un compromiso individual de cada especie con sus requerimientos para la dispersión, la defensa de las semillas y el establecimiento de las plántulas (Foster, 1986). De hecho, en especies con semillas grandes (e.g., C. cainito, S. foetidissimum y J. insularis) más de la mitad de su masa se destinó a la formación de estructuras protectoras, y en las pequeñas, como M. calabura, más del 90% de su materia seca se empleó en la formación del embrión y sus reservas.
En cambio, en las especies pioneras, cuando no se contempló M. calabura en el análisis de correlación, se relacionó la masa seca con el porcentaje de la semilla destinado a las cubierta o a las reservas. En este grupo sucesional, al aumentar la masa de la semilla disminuyó el porcentaje de materia seca debido a las cubiertas seminales, es decir, que en las semillas más pequeñas se destinaron más recursos a la formación de estructuras protectoras (testa/endocarpo), posiblemente como vía para evitar la deshidratación y la depredación, y con esto incrementar su persistencia en el suelo. Este resultado no coincide con lo reportado para las especies tropicales pioneras de Panamá (Dalling et al., 1997; Pearson et al., 2002). Dalling et al. (1997) plantean que la persistencia de las semillas grandes de las especies pioneras (e.g., Apeaba membranacea, Guazuma ulmifolia, Luehea seemanni, Ochroma pyramidale, Trema micrantha y Trichospermum mexicanum) en el suelo, se debe a que presentan cubiertas seminales duras, debido a la dormancia física o fisiológica. Por su parte, Pearson et al. (2002) determinaron una correlación positiva entre el grosor de las cubiertas y la masa. Ellos sugieren, además, que estos rasgos disminuyen la depredación en las especies pioneras con semillas grandes, y con esto, se favorece su longevidad o persistencia en el suelo.
Las evidencias experimentales obtenidas en la RBSR con las semillas frescas de G. ulmifolia, T. elatum, T. micrantha y T. mexicanum no apoyan del todo la hipótesis propuesta por Dalling et al. (1997) y Pearson et al. (2002). En los bosques húmedos de la RBSR, las semillas de G. ulmifolia y T. elatum presentan dormancia y llegan al suelo en la estación seca (Muñoz et al., 2004; Montejo et al., 2005); no obstante, comienzan a germinar después de dos meses ó 15 días, respectivamente, de su estancia en el suelo cuando caen las lluvias que vienen con los frentes fríos del Norte. Por su parte, T. mexicanum en Cuba sólo ocupa sitios húmedos y semiprotegidos (Herrera et al., 1997), y al igual que T. micrantha sus semillas son dispersadas en la estación de lluvias y no presentan dormancia, tal como fue informado inicialmente por diversos autores (Muñoz, 1998; Sánchez et al., 2003; Sánchez y Muñoz, 2004). Sin embargo, para estas dos últimas especies también existen elementos que pueden justificar su persistencia en el banco de semillas de los bosques de la RBSR, como son su larga longevidad (registrada en experimentos de laboratorios por Sánchez, 2007), la termodormancia que adquieren las semillas de T. mexicanum a temperaturas fijas de 25ºC y 30ºC (Muñoz, 1998; Sánchez y Muñoz, 2004) y el registro de T. micrantha en el banco de semillas (Menéndez y Vilamajó, 1988). Por último, cabe señalar que los máximos valores del porcentaje de materia seca destinado a las cubiertas seminales se obtuvieron en especies clasificadas a priori como no pioneras (sensu Herrera et al., 1997) [e.g. E. tinifolia (91,5%), J. insularis (84,7%) y C. collococca (82,1%)]; esto podría estar relacionado también con mecanismos que disminuyan la acción de los depredadores y patógenos y/o la deshidratación de las semillas.
Las semillas de A. inermis, B. pendula, C. pentandra, C. cainito, G. ulmifolia y T. micrantha procedentes del presente estudio, asignaron más recursos a la formación de estructuras protectoras que sus congéneres cuando crecían en un bosque semideciduo de Panamá (Daws et al., 2005); dichos taxones también mostraron diferencias en los valores de masa seca entre ambos estudios. Según Foster (1986) y Nikolaeva (2004), esta variabilidad podría ser consecuencia de las condiciones bióticas y abióticas en que se desarrollaron las plantas madres.
A través de las 40 especies estudiadas se estableció una relación negativa entre la masa seca de la reserva de la semilla y el porcentaje de materia seca debido a las cubiertas (fig. 2d); esta relación fue consistente también en las especies no pioneras y en las pioneras, sin incluir M. calabura. Ello significó que con el incremento de las reservas de las semillas disminuyeron sus estructuras de protección. Un resultado similar se descubrió para 32 especies de árboles empleadas en un experimento de establecimiento por Sánchez (2007), pero en este caso hubo una relación negativa entre el porcentaje de materia seca debido a las cubiertas seminales y el contenido total de nitrógeno por semilla. Grubb y Burslem (1998), en un análisis intraespecífico que involucró especies de árboles de Albizia, Millettia y Neobalanocarpus, también hallaron que la proporción de la masa seca destinada a las estructuras protectoras disminuyó con el incremento de la masa seca del embrión más las reservas.
En cambio, Grubb et al. (1998) encontraron una relación positiva entre las defensas físicas de las semillas y la cantidad de nitrato, en un rango amplio de árboles tropicales. Sin embargo, es probable que la presión de selección a la que se encuentran sometidas las especies de los bosques húmedos de la RBSR, haya propiciado un incremento de las reservas de las semillas y su contenido de nutrientes para apresurar el crecimiento inicial de las raíces, y con esto asegurar un establecimiento exitoso de las plántulas jóvenes, sobre todo para aquellas especies que se establecen en micrositios con baja disponibilidad de nutrientes y de agua. Efectivamente, en las 32 especies que participaron en el experimento de establecimiento se determinó una relación positiva entre las reservas de las semillas y su contenido de cenizas (Sánchez, 2007). Por otra parte, la hipótesis ya discutida fue comprobada por Milberg et al. (1998) para especies no tropicales que crecen en suelos pobres en nutrientes y que están sometidos a una severa sequía durante el verano; aunque Fenner (1983), para especies no tropicales (24 especies de Asteraceae), reportó una relación negativa entre la masa de la semilla y su contenido de nutrientes (i.e., cenizas). También Kitajima (1996) no encontró relación entre ambas variables seminales para 12 especies maderables tropicales de Bignoniaceae, Bombacaceae y Leguminosae.
La masa fresca de la semilla y su contenido de humedad no mostraron diferencias significativas cuando se analizaron por el tiempo de dispersión de las especies, aunque ambas variables tendieron a disminuir en las que dispersaron sus semillas en la estación seca, cuando en este análisis no se contempló A. inermis. Los valores de masa fresca y contenido de humedad en A. inermis no sólo fueron los más altos del presente estudio, sino también resultaron atípicos para el comportamiento de dichas variables dentro del grupo de especies dispersadas en la estación seca del bosque de la RBSR. De hecho, las semillas de esta especie se dispersan en Cuba al principio de la estación seca, pero en bosques semideciduos de Panamá llegan al suelo al comienzo de la estación lluviosa (Daws et al., 2005; Sautu et al., 2006). Sautu et al. (2006) tampoco obtuvieron diferencias significativas para la masa fresca cuando la compararon por tiempo de dispersión; pero sí observaron diferencias en el contenido de humedad de las semillas, ya que las dispersadas en la estación seca fueron más secas que las de finales de la estación lluviosa. Los resultados del presente estudio y las evidencias aportadas por Sautu et al. (2006) demostraron que la masa fresca de las semillas (aunque tiende a ser menor en la estación seca) no presentó un patrón de tamaño bien definido entre estación de dispersión, debido a su gran variabilidad.
El porcentaje de materia seca destinado a las cubiertas seminales tampoco mostró diferencias significativas entre los tiempos de dispersión de las semillas; esta variable, además, se relacionó negativamente con el contenido de humedad (fig. 2f). De hecho, las que fueron dispersadas en la estación seca o a finales de la estación lluviosa, presentaron los máximos valores promedio para el porcentaje de materia seca destinado a las cubiertas, y los mínimos valores de masa fresca y de contenido de humedad (esto es cierto para la estación seca cuando no se contempló A. inermis en el análisis, tabla 5). Cuando Daws et al. (2005) separaron el tiempo de dispersión en dos categorías, obtuvieron que las semillas dispersadas en la estación lluviosa fueron más grandes y sensibles a la desecación que las de la estación seca. Ellos también determinaron que las especies sensibles a la desecación distribuyeron menos recursos a las defensas físicas que las especies con semillas tolerantes a la desecación.
En el presente estudio no existieron diferencias significativas para las variables anteriormente discutidas, aun después de separar la estación de dispersión de las semillas en dos categorías (J. A. Sánchez, datos no mostrados). Esto podría deberse, entre otras causas, a que se estudió una sola forma de vida, o bien a que no se tuvo en cuenta la relaciones filogenéticas entre las especies estudiadas. Sin embargo, también es muy probable que los árboles de los sitios húmedos de la RBSR no sigan el patrón determinado por Daws et al. (2005) para las especies de bosques semideciduos de Panamá. Por otra parte, en Cuba el patrón encontrado por Daws et al. (2005) pudiera aparecer en otros ecosistemas forestales, dado que la vegetación xerofítica es la predominante en el archipiélago cubano (López, 1998). Ensayos que involucren más especies y formas de vida, control filogenético y masa de la semilla, así como diferentes ecosistemas, son factibles para probar la hipótesis propuesta por Daws et al. (2005).
Agradecimientos
Agradecemos a Justo Artiga y Alejandro Gamboa por la asistencia en el campo. Esta investigación fue financiada por la Fundación Internacional para la Ciencia (D/3536-1) a J. A. Sánchez. El trabajo está dedicado a la memoria del Dr. Ricardo Antonio Herrera Peraza.
Referencias bibliográficas
1. Angiosperm Phylogeny Group. 1998. An ordinal classification for the families of flowering plants. Ann. Missouri Bot. Gard. 85:531
2. Betancourt, A. 1987. Silvicultura especial de árboles maderables tropicales. Editorial Científico-Técnica, Ciudad de La Habana. 424 p.
3. Capote, R.P. et al. 1983. La vegetación de la Estación Ecológica de Sierra del Rosario. Rev. Jardín Botánico Nac. 4:97
4. Dalling, J.W. et al. 1997. Soil seed bank community dynamics in seasonally moist lowland tropical forest, Panama. J. Trop. Ecol. 13:659
5. Daws, M.I. et al. 2005. Traits of recalcitrant seeds in a semi-deciduous tropical forest in Panama: some ecological implications. Funct. Ecol. 19:874
6. Fenner, M. 1983. Relationships between seed weight, ash content and seedling growth in twenty-four species of compositae. New Phytol. 95:697
7. Foster, R.B. 1990. Ciclo estacional de caída de frutos en la isla de Barro Colorado. En: Ecología de un bosque tropical: ciclos estacionales y cambios a largo plazo. (Eds. E.G. Jr. Leigh, A.S. Rand & D.M. Windsor). Editorial PRESENCIA LTDA, Colombia. p. 219
8. Foster, Susan. 1986. On the adaptive value of large seeds for tropical moist forest trees: a review and synthesis. Bot. Rev. 52:260
9. Foster, Susan & Janson, C.H. 1985. The relationship between seed size and establishment conditions in tropical woody plants. Ecology. 66:773
10. Garwood, Nancy. 1983. Seed germination in a seasonal tropical forest in Panama: a community study. Ecol. Monogr. 53:159
11. Grime, J.P. et al. 1997. Integrated screening validates primary axes of specialisation in plants. Oikos. 79:259
12. Grubb, P.J. 1998. Seeds and fruits of tropical rainforest plants: interpretation of range in seed size, degree of defence and flesh/seed quotients. En: Dynamics of tropical communities. Symposium of the British Ecological Society No. 37. (Eds. D.M. Newbery, H.H.T. Prins & N.D. Brown) Blackwell Science, Oxford. p. 1
13. Grubb, P.J. & Burslem, D.F.R.P. 1998. Mineral nutrient concentrations as a function of seed size within seed crops: implications for competition among seedling and defence against herbivory. J. Trop. Ecol. 14:177
14. Grubb, P.J. & Coomes, D.A. 1997. Seed mass and nutrient content in nutrient starved tropical rainforest in Venezuela. Seed Sci. Res. 7:269
15. Grubb, P.J. & Metcalfe, D.J. 1996. Adaptation and inertia in the Australian tropical lowland rainforest flora: contradictory trends in intergeneric and intrageneric comparisons of seed size in relation to light demand. Funct. Ecol. 10:512
16. Grubb, P.J. et al. 1998. Nitrogen-richness and protection of seed in Australian tropical rainforest: a test of plant defence theory. Oikos. 82:467
17. Hammond, D.S. & Brown, V.K. 1995. Seed size of woody plants in relation to disturbance dispersal, soil type in wet neotropical forests. Ecology. 76:2544
18. Herrera, R.A. et al. 1988. Ecología de los bosques siempreverdes de la Sierra del Rosario, Cuba. Proyecto MAB No. 1, 1974-1987. ROSTLAC, Montevideo. 760 p.
19. Herrera, R.A. et al. 1997. Ecotechnologies for the sustainable management of tropical forest diversity. Nature and Resources. 33:2
20. ISTA. 1999. International rules for seed testing. Seed Sci. & Technol. 27:155
21. Kitajima, K. 1996. Cotyledon functional morphology, patterns of seed reserve utilization and regeneration niches of tropical tree seedling. En: The Ecology of tropical forest tree seedling. (Ed. M.D. Swaine). Parthenon, New York. p. 193
22. Leishman, M.R. et al. 2000. The evolutionary ecology of seed size. En: Seeds: The ecology of regeneration in plant communities. (Ed. M. Fenner). CAB International, Wallingford. p. 31
23. López, A. 1998. Origen probable de la flora de Cuba. En: La diversidad biológica de Iberoamérica. II Volumen Especial. (Ed. G. Halffer). Acta Zoológica Mexica, Xalapa. p. 83
24. Menéndez, Leda & Vilamajó, Daysi. 1988. El banco de semillas. En: Ecología de los bosques siempreverdes de la Sierra del Rosario, Cuba. Proyecto MAB No. 1, 1974-1987. (Eds. R.A. Herrera, Leda Menéndez, Maria Rodríguez & Elisa García). ROSTLAC, Montevideo. p. 261
25. Metcalfe, D.J. & Grubb, P.J. 1997. The responses to shade of seedling of very small-seeded tree shrub species from tropical rain forest in Singapore. Funct. Ecol. 11:215
26. Milberg, P. et al. 1998. Seedling growth response to added nutrient depends on seed size in three woody genera. J. Ecol. 86:624
27. Moles, Angela. et al. 2004. Small-seeded species produce more seeds per square metre of canopy per year, but not per individual per lifetime. J. Ecol. 92:384
28. Montejo, Laura. et al. 2005. Dormancy and germination in Talipariti elatum seeds. Bot. Complut. 29:57
29. Muñoz, Bárbara. 1998. Patrones morfológicos y fisiológicos en semillas de algunas especies arbóreas pioneras. Tesis presentada en opción al título de M.Sc. en Ecología. Instituto de Ecología y Sistemática, Ciudad de La Habana. 93 p.
30. Muñoz, Bárbara et al. 2004. Germinación, dormancia y longevidad potencial de semillas de Guazuma ulmifolia. Pastos y Forrajes. 27:25
31. Muñoz, Bárbara & Sánchez, J.A. 2000. Patrones seminales en especies arbóreas pioneras y su relación con el continuum r-K. Acta Botánica Cubana. 146:18
32. Murdoch, A.J. & Ellis, R.H. 2000. Dormancy, viability and longevity. En: Seeds: The ecology of regeneration in plant communities. (Ed. M. Fenner). CAB International, Wallingford. p. 183
33. Nikolaeva, Marianna. 2004. On criteria to use in studies of seed evolution. Seed Sci. Res. 14:315
34. Pearson, T.R.H. et al. 2002. Germination ecology of neotropical pioneers: interacting effects of environmental conditions and seed size. Ecology. 83:2798
35. Poorter, Lourens & Rose, Simmoné. 2005. Light-dependent changes in the relationship between seed mass and seedling traits: a meta-analysis for rain forest tree species. Oecologia. 142:378
36. Rose, Simmoné & Poorter, Lourens. 2003. The importance of seed mass for early regeneration in tropical forest: a review. En: Long term changes in tropical tree diversity: studies from the Guyana Shield, Africa, Borneo and Melanesia. (Ed. H. TerSteege). Tropenbos series 22, Tropenbos International, Wageningen. p. 19
37. Sánchez, J.A. 2007. Dormancy and nutrient contents in seeds and their relation with the establishment of tropical trees. Informe Final del Proyecto de la Fundación Internacional para la Ciencia (D/3536-1), Stockholm. 97 p.
38. Sánchez, J.A. et al. 1997. Correlación entre el heteromorfismo somático y la respuesta germinativa de semillas de Mastichodendron foetidissimum (Jacq.) Cronq. Acta Botánica Mexicana. 38:1
39. Sánchez, J.A. et al. 2002. Correlación entre el tamaño de la semilla, la dormancia, la germinación y el vigor de las plántulas de Calophyllum pinetorum. Rev. Jardín Botánico Nac. 23:75
40. Sánchez, J.A. et al. 2003. Efectos de tratamientos robustecedores de semillas sobre la germinación y establecimiento de árboles pioneros bajo condiciones de estrés. Ecotropicos. 16:91
41. Sánchez, J.A. & Muñoz, Bárbara. 2004. Effects of hydration and scarification treatments on the germination of Trichospermum mexicanum. Seed Sci. & Technol. 32:621
42. Sautu, Adriana et al. 2006. Studies on the seed biology of 100 native species of tree in a seasonal moist tropical forest, Panama, Central America. For. Ecol. Manage. 234:245
43. Toral, Odalys et al. 2001. Colecta y potencialidades del germoplasma forrajero arbóreo en diferentes ecosistemas. Pastos y Forrajes. 24:105
44. Torres-Arias, Y. et al. 2002. Semillas y plántulas de algunas especies arbóreas de Moa. Acta Botánica Cubana. 163:17
45. Van der Pijl, L. 1982. Principles of dispersal in higher plants. Springer-Verlag, Berlin. 215 p.
46. Vázquez-Yanes, C. & Orozco-Segovia, Alma. 1990. Seed dormancy in the tropical rain forest. In: Reproductive ecology of tropical forest plants. (Eds. K.S. Bawa and M. Hadley) Parthenon, New Jersey. p. 247
47. Vázquez-Yanes, C. & Orozco-Segovia, Alma. 1993. Patterns of seed longevity and germination in the tropical rainforest. Ann. Rev. Ecol. Syst. 23:69
48. Vázquez-Yanes, C. & Orozco-Segovia, Alma. 1994. Signals for seeds to sense and respond to gaps. En: Exploitation of environmental heterogeneity by plants. (Eds. M.M. Caldwell and R.W. Pearcy) Academic Press, London. p. 209
49. Vilamajó, Daysi & Menéndez, Leda. 1988. Fenología de algunas especies importantes en Sierra del Rosario. En: Ecología de los bosques siempreverdes de la Sierra del Rosario, Cuba. Proyecto MAB No. 1, 1974-1987. (Eds. R.A. Herrera, Leda Menéndez, María Rodríguez & Elisa García) ROSTLAC, Montevideo. p. 243
50. Vilamajó, Daysi et al. 1988. Características climáticas. En: Ecología de los bosques siempreverdes de la Sierra del Rosario, Cuba. Proyecto MAB No. 1, 1974-1987. (Eds. R.A. Herrera, Leda Menéndez, María Rodríguez & Elisa García). ROSTLAC, Montevideo. p. 61
51. Westoby, M. et al. 2002. Plant ecological strategies: some leading dimensions of variation between species. Ann Rev. Ecol. Syst. 33:125
52. Westoby, M. et al. 1990. Seed size and plant growth form as factor in dispersal spectra. Ecology. 71:1307
53. Wright, I.J. & Westoby, M. 1999. Differences in seedling growth behaviour among species: trait correlations across species, and trait shifts along nutrient compared to rainfall gradients. J. Ecol. 87:85
Recibido el 2 de octubre del 2008
Aceptado el 24 de marzo del 2009













