Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.33 n.2 Matanzas abr.-jun. 2010
ARTICULO DE INVESTIGACION
Respuesta fisiológica y bioquímica de Stylosanthes guianensis cv. CIAT-184 y Centrosema molle al estrés por cloruro de sodio
Physiological and biochemical response of Stylosanthes guianensis cv. CIAT-184 and Centrosema molle to sodium chloride stress
Leticia Fuentes1, Y. Pérez1, Silvia Alemán1, Daynet Sosa2, Maryla Sosa1, S. González3,D. Infante2, Diamarys Domínguez2 y A.R. Mesa4
1Centro de Estudios Biotecnológicos. Universidad de Matanzas "Camilo Cienfuegos", Cuba
E-mail:leticia.fuentes@umcc.cu
2Fundación Instituto de Estudios Avanzados (IDEA), Caracas, Venezuela
3Facultad de Biología, Universidad de La Habana, Cuba
4EEPF "Indio Hatuey", Matanzas, Cuba
RESUMEN
Se realizó un estudio sobre el efecto de diferentes concentraciones de cloruro de sodio (NaCl) en plántulas de Stylosanthes guianensis cv. CIAT-184 y Centrosema molle, cultivadas en tierra vegetal. A los 15 días posteriores al tratamiento se determinaron la masa fresca, la masa seca, la relación raíz-brote y la distribución de la biomasa, así como la concentración de fenoles solubles, ligados a la pared y totales, además de la clorofila a, b y total. En ambos cultivares las raíces fueron los órganos más afectados con relación a la masa fresca y hubo un decrecimiento de la masa seca a elevadas concentraciones de NaCl. La relación raíz-brote mostró un aumento a 200 mM de NaCl en S. guianensis, mientras que no se observaron cambios significativos en C. molle. En la medida que la concentración de NaCl se elevó, la concentración de fenoles solubles aumentó sensiblemente en las raíces de ambas especies, así como los fenoles totales; mientras que en las hojas sólo se observaron aumentos en los niveles de fenoles solubles en S. guianensis. La concentración de clorofila a y total disminuyó significativamente a 200 mM de NaCl en ambos cultivares con relación al control. Los niveles de clorofila b disminuyeron en C. molle a 200 mM y se mantuvieron constantes en S. guianensis. El índice de estabilidad clorofílica mostró diferencias altamente significativas en C. molle (-8,154 y 269,1 para 100 y 200 mM de NaCl), a diferencia de S. guianensis que presentó una mayor estabilidad (20,47 y 31,37). La relación clorofila a/b decreció en Centrosema y no se observaron diferencias entre los tratamientos en Stylosanthes.
Palabras clave: Centrosema molle, clorofilas, compuestos fenólicos, salinidad, Stylosanthes guianensis
ABSTRACT
A study was conducted on the effect of different concentrations of sodium chloride (NaCl) on seedlings of Stylosanthes guianensis cv. CIAT-184 and Centrosema molle, cultivated on topsoil. Fifteen days after the treatment fresh mass, dry mass, root/shoot ratio and biomass distribution were determined, as well as the concentration of soluble phenols, cell wall-bound phenols and total phenols, in addition to chlorophyll a, b and total chlorophyll. In both cultivars the roots were the most affected organs regarding fresh mass and there was a decrease of dry mass at high concentrations of NaCl. The root/shoot ratio showed an increase at 200 mM of NaCl in S. guianensis, while no significant changes were observed in C. molle. As the concentration of NaCl increased, the concentration of soluble phenols increased noticeably in the roots of both species, as well as total phenols; while in the leaves increases in the levels of soluble phenols were observed only in S. guianensis. The concentration of chlorophyll a and total chlorophyll significantly decreased at 200 mM of NaCl in both cultivars with regards to the control. The levels of chlorophyll b decreased in C. molle at 200 mM and remained constant in S. guianensis. The chlorophyll stability value showed highly significant differences in C. molle (-8,154 and 269,1 for 100 and 200mM of NaCl), unlike S. guianensis which showed higher stability (20,47 and 31,37). The chlorophyll a/b ratio decreased in Centrosema and no differences were observed among treatments in Stylosanthes.
Key words: Centrosema molle, chlorophylls, phenolic compounds, salinity, Stylosanthes guianensis
Contenido
INTRODUCCIÓN
La salinidad de los suelos constituye uno de los estreses abióticos más importantes que limitan la productividad de las plantas (Khan y Panda, 2008), como consecuencia de afectaciones en un gran número de aspectos fisiológicos y bioquímicos como la germinación, el crecimiento vegetativo, el vigor, la floración, la fructificación, la fotosíntesis, la pérdida de agua, el desbalance en las concentraciones de iones que conlleva la toxicidad iónica celular y el estrés osmótico (Sairam y Tyagi, 2004; Khan y Panda, 2008). El estrés por salinidad induce la acumulación de especies reactivas del oxígeno (estrés secundario), causando daños a macromoléculas importantes como las proteínas y los ácidos nucleicos (Mittler, 2002); así como a los lípidos de la membrana, lo que ocasiona su deterioro y el aumento de la permeabilidad (Mandhania et al., 2006; Khan y Panda, 2008).
La capacidad que presentan las plantas para eliminar las especies reactivas del oxígeno constituye un elemento importante para tolerar los estreses ambientales (Ali y Abbas, 2003). El sistema antioxidante de las plantas incluye un grupo de compuestos primarios como carotenoides, flavonoides y compuestos fenólicos; así como enzimas antioxidantes tales como la catalasa, peroxidasas, polifenol oxidasa y ácido indolacético oxidasa (Ali y Abbas, 2003). Los compuestos fenólicos y flavonoides son considerados entre los productos del metabolismo secundario de mayor influencia y amplia distribución en el reino de las plantas, y desempeñan importantes funciones fisiológicas y ecológicas involucradas en la resistencia a diferentes tipos de estrés (Delalonde et al., 1996; Ayaz et al., 2000).
La búsqueda de variedades tolerantes al estrés salino constituye una de las prioridades del sector agropecuario para incrementar los rendimientos de importantes cultivares. Los estudios de identificación y caracterización de variedades tolerantes han estado basados en diversos criterios como la productividad, la supervivencia, el vigor, los daños en las hojas, la altura de las plantas y la velocidad relativa de crecimiento, además de los caracteres fisiológicos y bioquímicos (Gama et al., 2007).
El presente trabajo tuvo como objetivo determinar la influencia del cloruro de sodio en indicadores fisiológicos y bioquímicos de dos especies de leguminosas forrajeras: Stylosanthes guianensis cv. CIAT-184 y Centrosema molle, durante la fase de crecimiento vegetativo.
MATERIALES Y MÉTODOS
Las semillas de S. guianensis cv. CIAT-184 y C. molle fueron suministradas por la Estación Experimental de Pastos y Forrajes "Indio Hatuey". Estas se lavaron y desinfectaron en solución detergente (1 g/L), seguido de varios enjuagues e inmersión en etanol al 70%; después se introdujeron en hipoclorito de sodio al 5 y al 1% durante 15 y 20 minutos, respectivamente, seguidos en cada caso por tres enjuagues con agua destilada estéril. En el último paso se utilizó agua destilada a 8ºC como proceso de escarificación. Las semillas se pusieron a germinar en un suelo vegetal en frascos plásticos de 400 mL. Previo a la siembra de las semillas se determinó la capacidad de campo (CC) del suelo, mediante el método gravimétrico.
Las plantas se mantuvieron en casa de cultivo, con un fotoperíodo de 13 horas luz y a temperatura promedio diaria de 24ºC±2, con aplicación de riego al 90% de la CC hasta que desarrollaron las primeras hojas trifoliadas. Posteriormente se realizó un riego con solución de NaCl (0, 50, 100 y 200 mM) al 70% CC durante 15 días.
Se empleó un diseño completamente aleatorizado, con 15 unidades experimentales para cada tratamiento y tres repeticiones.
Determinación de los indicadores morfológicos y bioquímicos. Las raíces, los tallos y las hojas de las plántulas estresadas y no estresadas (control) se pesaron por separado en una balanza digital Sartorious, para la determinación de la materia fresca; mientras que en el caso de la materia seca los órganos similares de las plantas procedentes de las condiciones antes mencionadas, fueron previamente deshidratados en una estufa a 55ºC hasta obtener valores constantes. Con estos datos se estimaron, además, otros indicadores como la distribución de la biomasa y la relación raíz-brote.
Determinación de la concentración de fenoles. La extracción de los fenoles solubles se realizó en 10 volúmenes de metanol. Las muestras fueron homogeneizadas y centrifugadas a 27 200 g. El precipitado se resuspendió en NaOH 2M para la extracción de los fenoles ligados a las paredes celulares, y se neutralizó en igual volumen de HCl 2M (Gurr et al., 1992). La concentración de fenoles se determinó utilizando ácido clorogénico (0,05 mol.L-1) como patrón y los valores de absorbancia se determinaron a 760 nm. A partir de los valores de la concentración de fenoles solubles y de los ligados a la pared se calcularon las concentraciones de fenoles totales.
Determinación de la concentración de clorofila. En el caso de los pigmentos fotosintéticos se utilizaron fragmentos de 50 mg del foliolo central de la primera hoja trifoliada, los cuales fueron previamente lavados con agua destilada estéril y secados con papel de filtro. Estos fragmentos se maceraron en 5 mL de solución acuosa de etanol (Sigma) al 96%, en oscuridad. Para determinar el contenido de clorofila a y b, se emplearon las ecuaciones propuestas por Wintermans y de Mots (1965).
Ca (mg L-1)=13,95 (A665) - 6,68 (A649)
Cb (mg L-1)=24,96 (A649) - 7,32(A665)
Clorofila total: Ca+b (mg/g)=(20,2 A649) + (8,02 A665)
Ca= concentración de clorofila a
Cb= concentración de clorofila b
El índice de estabilidad clorofílica (IEC, %) se calculó mediante el contenido total de clorofila antes y después de estresadas las plántulas, a partir de la ecuación de Kumari et al. (2004).
IEC % = [(Contenido de clorofila antes del estrés - Contenido de clorofila después del estrés)/ Contenido de clorofila después del estrés]*100.
Procesamiento estadístico. Se determinó el ajuste de los datos a una distribución normal mediante la prueba de bondad de ajuste Kolmogorov-Smirnov y la homogeneidad de varianza mediante las pruebas de Bartlett (Sigarroa, 1985), y se procesaron mediante ANOVA de clasificación simple o multifactorial según correspondiera. Para comparar las medias se aplicó la prueba de rangos múltiples de Duncan. Los datos se procesaron según el paquete Statgraphic plus 5.1 sobre Windows.
RESULTADOS Y DISCUSIÓN
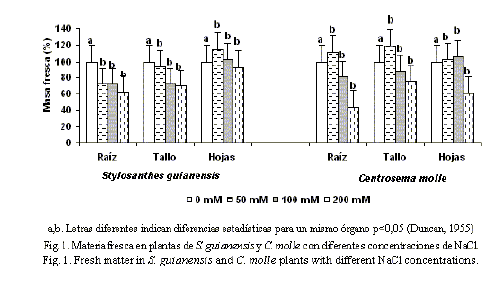
Peso fresco y peso seco. La adición de concentraciones elevadas de NaCl al sustrato provocó, de manera general, una disminución de materia fresca en la raíz, el tallo y las hojas de ambas especies (fig. 1). Sin embargo, se encontraron diferencias en la respuesta entre los órganos vegetativos y entre las variedades. En S. guianensis cv. CIAT-184 las raíces fueron las más sensibles, con una disminución significativa a partir de 50 mM; mientras que en el tallo y las hojas los cambios se observaron a partir de 100 mM y 200 mM, respectivamente.
En C. molle los cambios fueron significativos en 200 mM para la raíz, el tallo y la hoja, aunque los porcentajes para cada caso fueron inferiores en comparación con los hallados en S. guianensis cv. CIAT-184 a esta concentración.
El peso seco (fig. 2) en S. guianensis cv. CIAT-184 mostró una disminución a 50 mM para la raíz y el tallo y en las hojas a partir de 100 mM; mientras que en C. molle no se encontraron variaciones en el tallo y en la hoja entre los distintos tratamientos y el control; en la raíz el peso seco disminuyó en 200 mM.
El efecto negativo de la salinidad en el peso fresco y seco de los distintos órganos de la planta, ha sido referido por numerosos autores en trabajos con distintas especies vegetales. Los estudios de estrés salino en Eucalyptus camaldulensis (Qureshi et al., 2000), Hordeum vulgare L. (Ali y Abbas, 2003), Vicia faba (Khalafallah et al., 2008), Zea mays (Hu et al., 2007) y Helianthus annuus L. (Noreen y Ashraf, 2008), mostraron el efecto negativo del NaCl en la materia fresca y seca en las plántulas regadas con diferentes concentraciones de esta sal.
Los efectos fundamentales del cloruro de sodio sobre tales indicadores pueden estar asociados a una reducción del crecimiento, la división celular por mitosis, la toxicidad iónica (Caseira, 2006; Mohamedin et al., 2006), la reducción en la absorción de agua y la actividad metabólica debido a la toxicidad de los iones Na+ y Cl-, así como el déficit de nutrientes provocado por la interferencia iónica (Ghoulam et al., 2002).
Con relación a las diferencias entre los órganos vegetativos, de manera general, las raíces en ambas especies mostraron los valores más bajos en el peso fresco y el peso seco. Esto puede estar asociado a que este órgano se encuentra expuesto directamente al estrés salino, por lo cual el efecto desestabilizador del cloruro de sodio en el ambiente intra y extracelular es mayor en la raíz que en los restantes órganos. Por otra parte, las diferencias entre especies pueden estar determinadas por las características genéticas de cada una en particular y por la presencia de diversos mecanismos de respuesta fisiológica frente al estrés salino (Flowers y Hajibagheri, 2001; Ahmad et al., 2005), como la activación y desactivación de genes que permiten reestablecer la homeostasis iónica y osmótica, para lograr el funcionamiento fisiológico adecuado de las células, los tejidos y los órganos afectados.
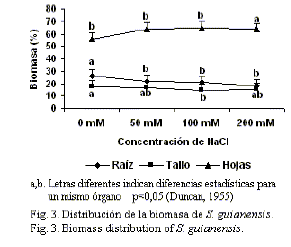
Distribución de la biomasa. Las figuras 3 y 4 muestran la distribución de la biomasa en las plántulas de Stylosanthes y Centrosema, respectivamente, después de dos semanas de riego con NaCl.S. guianensis mostró un aumento del porcentaje de masa fresca en las hojas respecto al total, con el aumento de las concentraciones de NaCl en el medio. Inversamente se observó una disminución significativa del porcentaje en las raíces de las variantes con NaCl; mientras que se mantuvo sin cambios significativos para el tallo. De manera similar, el porcentaje de masa fresca disminuyó en las raíces de C. molle; sin embargo, no hubo variación entre los tratamientos para las hojas y el porcentaje de masa fresca en el tallo aumentó a 200 mM.
La relación raíz/brote constituye un valor que depende de la distribución de los compuestos fotosintetizados por la planta, y se encuentra bajo la influencia de numerosos factores (Rogers et al., 1996); esta relación depende de la capacidad de la especie o la variedad para modificar la distribución de la masa seca, en función de elevar la tolerancia frente a condiciones estresantes.
Los resultados mostraron un aumento de la relación raíz-brote para S. guianensis a 200 mM (fig. 5), lo cual está relacionado con una mayor inhibición del crecimiento del brote bajo estas condiciones. Fisiológicamente puede estar asociado con un incremento en el flujo de los compuestos osmóticamente activos (como las proteínas) hacia las raíces, como un mecanismo para disminuir la diferencia del potencial de agua entre el medio con elevadas concentraciones de sales y los tejidos internos de la raíz, la cual es el órgano en contacto directo con el sustrato y enfrenta el estrés. Resultados similares han sido descritos por numerosos autores en plantas sometidas a estrés salino y/o hídrico (Okcu et al., 2005; Yagmur y Kaydan, 2008).
En contraste con estos resultados, no se encontraron diferencias significativas entre los distintos tratamientos para C. molle, lo cual pudiera ser un indicador de la carencia de factores genéticos intrínsecos de la especie, que propicien la síntesis y redistribución de compuestos osmóticamente activos hacia las zonas más afectadas por el estrés salino.
Contenido de fenoles en la raíz y las hojas. La concentración de los compuestos fenólicos es afectada frecuentemente por varios factores internos y externos, como la luz (Kefeli et al., 2003), los nutrientes (Lux-Endrich et al., 2000), el estrés hídrico por defecto y exceso, la radiación y las infecciones patógenas (Kefeli et al., 2003). También puede aumentar o disminuir en dependencia del estadio de la planta (Thomas y Ravindra, 1999).
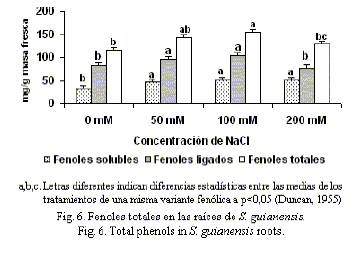
La exposición de las plántulas de S. guianensis al NaCl provocó un aumento en la concentración de fenoles totales en las raíces y el mayor valor se alcanzó a 100 mM (fig. 6). La concentración de fenoles solubles y ligados a la pared aumentaron significativamente después de la aplicación de NaCl. No obstante, a 200 mM se observó una disminución, lo cual puede estar determinado por una ruptura del metabolismo de los fenoles a elevadas concentraciones de esta sal.
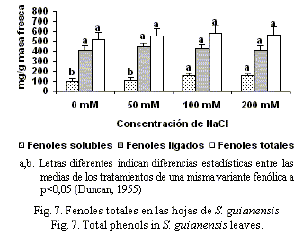
Aunque en las hojas de S. guianensis (fig. 7) no se encontraron cambios significativos en las concentraciones de fenoles ligados a la pared y totales, se pudo observar un aumento en la concentración de fenoles solubles a partir de 100 mM con respecto al control. Esto puede estar asociado a la translocación de los compuestos fenólicos desde la raíces hasta las hojas, donde se apreciaron aumentos significativos en la concentración de estos.
Resultados similares fueron reportados por Ali y Abbas (2003) en plántulas de H. vulgare L. estresadas con cloruro de sodio 100 mM, en las cuales se encontraron incrementos significativos en las raíces; mientras que en los brotes no se reportaron diferencias entre los tratamientos y el control.
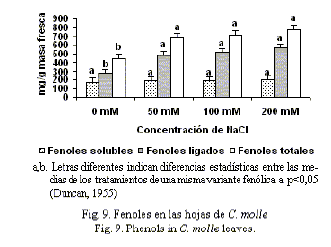
C. molle mostró incrementos significativos en la concentración de fenoles solubles y totales en las raíces (fig. 8); mientras que los fenoles ligados a la pared no mostraron cambios, lo que evidenció la capacidad de Centrosema para sintetizar fenoles bajo condiciones estresantes de cloruro de sodio. En las hojas (fig. 9), por el contrario, no se observaron diferencias en la concentración de fenoles solubles entre los distintos tratamientos, y hubo un aumento de los fenoles ligados a la pared que contribuyó a las diferencias entre el control y los distintos tratamientos con relación a la concentración de fenoles totales. El hecho de que no se hayan encontrado incrementos en los valores de fenoles solubles, puede estar asociado a la capacidad de esta especie para trasladar dichos compuestos a las partes aéreas de la planta.
Varios autores han reportado un incremento en los niveles de fenoles posteriormente a la aplicación de sales en el medio (Mazher et al., 2006); ello constituye un mecanismo de defensa antioxidante para la disminución de las concentraciones de especies reactivas del oxígeno, que afectan drásticamente el metabolismo celular y que se generan bajo condiciones de estrés abiótico (Hasegawa et al., 2000; Rahnama y Ebrahimzadeh, 2005).
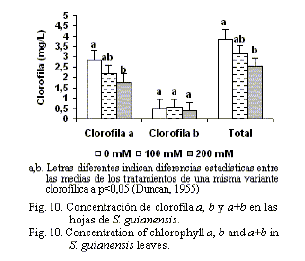
Contenido de clorofila. La concentración de clorofila puede ser utilizada como un indicador del estado metabólico celular (Yeo y Flowers, 1983). Un decrecimiento del contenido clorofílico se asocia con la toxicidad en los tejidos, debido a la acumulación de iones. La cuantificación del contenido de clorofila (a, b y total) mostró, para ambos cultivares, una disminución significativa en 200 mM de NaCl para clorofila a y total. Sin embargo, la concentración de clorofila b no varió en S. guianensis entre los tratamientos; mientras que en C. molle se observó diferencia entre el control y 200 mM. Por otra parte, se pudo observar al final del experimento una marcada clorosis en las plántulas tratadas con 200 mM de NaCl. Este fenómeno ha sido referido por varios investigadores (Agastian et al., 2000) en las hojas expuestas a largos períodos de estrés salino, lo que conlleva la caída de estas. (fig.10 y 11)
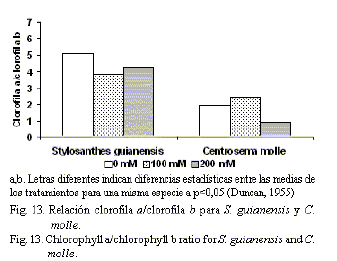
Por otra parte, se encontró una mayor estabilidad en el contenido clorofílico de S. guianensis a partir de los valores en el IEC (fig. 12); mientras que la relación clorofila a/clorofila b no varió, y en el caso de C. molle disminuyó a 200 mM de NaCl (fig. 13). Šiler et al. (2007) plantearon que la variación en el valor clorofila a/b puede estar asociada a cambios entre el contenido del fotosistema I y el fotosistema II bajo condiciones estresantes.
En la literatura se reporta un decrecimiento en los niveles de clorofila en diferentes especies de plantas sometidas a estrés salino (Mazher et al., 2006; Khalafallah et al., 2008, Khan et al., 2009). La reducción en el contenido de clorofila en las hojas en condiciones de estrés salino ha sido atribuida a varias causas: la destrucción de los pigmentos clorofílicos e inestabilidad de los complejos proteína-pigmentos (Levit, 1980); la interferencia de los iones salinos con la síntesis de novo de proteínas y componentes estructurales de la clorofila (Jaleel et al., 2007); así como a la concentración de sales en el medio, el tiempo de exposición y la especie (Šiler et al., 2007).
CONCLUSIONES
La aplicación de NaCl a las plántulas de S. guianensis y C. molle mostró un efecto negativo en el peso fresco y en el peso seco, y la raíz fue el órgano más sensible. La relación raíz-brote se mantuvo sin variación en Centrosema y aumentó en Stylosanthes, lo que sugiere un mecanismo adaptativo para tolerar el estrés salino. Los fenoles solubles y totales se incrementaron con el aumento de la concentración de NaCl en ambos cultivares y la raíz mostró los mayores incrementos, una respuesta bioquímica común en los vegetales ante variadas situaciones de estrés. La concentración de clorofila a disminuyó sensiblemente a 200 mM de NaCl, así como la clorofila total; mientras que la clorofila b disminuyó significativamente en C. molle. El IEC mostró una mayor estabilidad en S. guianensis, ya que no varió significativamente la relación clorofila a/b; en C. molle dicha relación disminuyó.
AGRADECIMIENTO
Al Dr.C. Orlando Suenin. Facultad de Agronomía (FAGRO), Universidad Central de Venezuela (UCV).
REFERENCIAS BIBLIOGRÁFICAS
1. Agastian, P. et al. Effect of salinity on photosynthesis and biochemical characteristic in mulberry genotypes. Photosynthetica. 38:287. 2000
2. Ahmad, M. et al. Varietal differences in agronomic performance of six wheat varieties grown under saline field environment. Int. J. Environ. Sci Tech. 2 (1):49. 2005
3. Ali, R.M. & Abbas, H.M. Response of salt stressed barley seedlings to phenylurea. Plan Soil Environ. 49 (4):158. 2003
4. Ayaz, F.F. et al. Water stress effects on the content of low molecular weight carbohydrates and phenolic acids in Ctenanthe setsa (Rosc.) Eichler. Can. J. Plant Sci. 80:373. 2000
5. Caseira, F. Distribución y producción total de materia seca en guayabo (Psidium guajava L. cv Palmira ICA-1) bajo estrés salino. Orinoquia. 10 (2):56. 2006
6. Delalonde, M. et al. Development of phenolic compounds in maize anthers (Zea mays) during cold pretreatment prior to androgenesis. J. Plant Physiol. 149:61. 1996
7. Flowers, T.J. & Hajibagheri, M.A. Salinity tolerance in Hordeum vulgare: ion concentrations in root cells of cultivars differing in salt tolerance. Plant and Soil. 23:1. 2001
8. Gama, P.B. et al. Physiological response of common bean (Phaseolus vulg. L.) seedlings to salinity stress. African J. of Biotechnology. 6 (2):79. 2007
9. Ghoulam, C. et al. 2002. Effect of salt stress on growth, inorganic ions and proline accumulation in relation to osmotic adjustment in fuie sugar beet cultivars. Environ. Exp. Bot. 47:39
10. Gurr, S.I. et al. Lignin and associated phenolic acids in cell walls. Molecular Plant Pathology and Practical Approach. 3:62. 1992
11. Hasegawa, P.M. et al. Plant cellular and molecular responses to high salinity. Annu. Rev. Plant Mol. Plant Physiol. 51:463. 2000
12. Hu, Y.Z. et al. Short-term effects of drought and salinity on mineral nutrient distribution along growing leaves of maize seedlings. Environmental and Experimetal Botany. 60:268. 2007
13. Jaleel, C.A. et al. NaCl as physiological modulator of proline metabolism and antioxidant potential in Phyllanthus amarus. C R Biologies. 330:806. 2007
14. Kefeli, V.I. et al. Phenolic cycle in plants and environment. J. Cell Mol. Biol. 2:13. 2003
15. Khalafallah, A.A. et al. Tolerance of seven Faba bean varieties to drougth and salt stresses. Research Journal of Agriculture and Biological Sciences. 4 (2):175. 2008
16. Khan, M.A. et al. Role of proline, K/Na ratio and chlorophyll content in salt tolerance of wheat (Triticum aestivum L.). Pak. J. Bot. 41 (2):633. 2009
17. Khan, M.H. & Panda, S.K. Alterations in root lipid peroxidation and antioxidative responses in two rice cultivars under NaCl-salinity stress. Acta Physyol Plant. 30:91. 2008
18. Kumari, M. et al. Physiological parameters goveming drought in maize. Indian J. Plant Physiol. 9 (2):203. 2004
19. Levit, J. Responses of plants to environmental stresses. Vol. II. Academic Press. New York. 1980.
20. Lux-Endrich, A. et al. Influence of nutrients and carbohydrate supply on the phenol composition of apple shoot cultures. Plant Cell Tissue Organ Culture. 60:15. 2000
21. Mandhania, S. et al. Antioxidant defense mechanism under salt stress in wheat seedlings. Biol. Plant. 227:227. 2006
22. Mazher, A.M. et al. Response of Dalgebia sissoo to sulphur application under saline condition. Am. Eur. J. Agric. Environ. Sci. 1: 215. 2006
23. Mittler, R. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7:405. 2002
24. Mohamedin, A.A.M. et al. Response of sunflower (Helianthus annuus L.) to plants salt stress under different water table depths. Journal of Applied Sciences Research. 2 (12):1175. 2006
25. Noreen, S. & Ashraf, M. Alleviation of adverse effects of salt stress on sunflower (Helianthus annuus L.) by exogenous application of salicylic acid: growth and photosynthesis. Pak. J. Bot. 40 (4):1657. 2008
26. Okcu, G. et al. Effects of salt and drought stresses on germination and seedling growth of pea (Pisum sativum L.). Turk J. Agric For. 29:237. 2005
27. Qureshi, T.M. et al. Performance of Eucalyptus camaldulensis under different types of salt-affected soils. Int. J. Agri. Biol. 2 (1):45. 2000
28. Rahnama, H. & Ebrahimzadeh, H. The effect of NaCl on antioxidant enzyme in potato seedlings. Biol. Plant. 49 (1):93. 2005
29. Rogers, H.H. et al. Root to shoot ratio of crops as influenced by CO2. Plant Soil. 187 (82):229. 1996
30. Sairam, R.K. & Tyagi, A. Physiology and molecular biology of salinity stress tolerance in plants. Current Science. 86:407. 2004
31. Sigarroa, A. Biometría y diseño experimental. Editorial Pueblo y Educación. La Habana. 743 p. 1985.
32. Šiler, B. et al. Effects of salinity on in vitro growth and photosynthesis of common centaury (Centaurim erythraea RAFN). Arch. Biol. Sci. Belgrade. 59 (2):129. 2007
33. Thomas, P. & Ravindra, M.B. Shoot tip culture in mango: Influence of medium, genotype, explant factors, season and decontamination treatments of phenolic exudation, explant survival and axenic culture establishment. J. Horticultural Sci. 72 (5):713. 1999
34. Yagmur, M. & Kaydan, D. Early seedling growth and relative water content of Triticales varieties under osmotic stress of water and NaCl. Research Journal of Agriculture and Biological Sciences. 4 (6):767. 2008
35. Yeo, A.R., & Flowers, T.J. Varietal differences in the toxicity of sodium ions in rice leaves. Physiologia Plantarum. 59:189. 1983
36. Wintermans, J.F. & de Mots, A. Spectrophotometric characteristics of chlorophylls a and b and their pheophytins in ethanol. Biochim. Biophys. Acta. 109:448. 1965
Recibido el 11 de noviembre del 2009
Aceptado el 25 de marzo del 2010