Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.33 n.2 Matanzas abr.-jun. 2010
ARTICULO DE INVESTIGACION
Efecto de la escarificación húmeda y seca en la capacidad germinativa de las semillas de Albizia lebbeck (L.) Benth.
Effect of moist and dry scarification on the germination capacity of seeds from Albizia lebbeck (L.) Benth.
Marlen Navarro1, G. Febles2, Verena Torres2 y Aida Noda2
1Estación Experimental de Pastos y Forrajes "Indio Hatuey"Central España Republicana, CP 44280, Matanzas, Cuba
E-mail: marlen.navarro@indio.atenas.inf.cu
2Instituto de Ciencia Animal. La Habana, Cuba
RESUMEN
Con el objetivo de favorecer la germinación en semillas de A. lebbeck almacenadas en condiciones ambientales, se evaluaron diferentes métodos presiembra mediante un diseño completamente aleatorizado con arreglo factorial 4 x 13 y 3 x 13 para la escarificación húmeda y la seca, respectivamente. En la escarificación húmeda se halló interacción significativa entre los factores estudiados (P<0,001). No se encontraron diferencias estadísticas entre el ácido y el agua caliente, en las semillas evaluadas a 1, 3, 6 y 7 mdia; mientras que estas mismas evaluaciones fueron estadísticamente diferentes al control y en todos los casos los valores resultaron inferiores a este último. La totalidad de las evaluaciones del remojo y el control no fueron significativas entre sí, mientras que difirieron del agua caliente y el ácido. En la escarificación seca la capacidad germinativa mostró interacción significativa (P<0,001). Los valores más altos se reportaron en 1, 2 y 3 mdia en semillas con un corte; estos porcentajes no difirieron entre ellos, pero sí del resto. Al comparar el corte con el pinchazo, se presentó un comportamiento estadísticamente diferente; en todas las evaluaciones los valores inferiores fueron los del pinchazo. Es necesario resaltar la eficacia del corte de cubierta y el remojo durante 24 horas en agua a temperatura ambiente como tratamientos de escarificación seca y húmeda, respectivamente, a pesar de los resultados aceptables mostrados por el control.
Palabras clave: Albizia lebbeck, almacenamiento, escarificación, germinación
ABSTRACT
With the objective of favoring germination in A. lebbeck seeds stored under ambient conditions, different pre-planting methods were evaluated by means of a completely randomized design with 4 x 13 and 3 x 13 factorial arrangement for moist and dry scarification, respectively. In moist scarification significant interaction was found among the studied factors (P<0,001). No statistical differences were observed between the acid and the hot water, in the seeds evaluated at 1, 3, 6 and 7 mos; while the same evaluations were statistically different from the control and in all cases the values were lower than the latter. All the soaking and control evaluations were not significant among themselves, while they differed from the hot water and the acid. In the dry scarification the germination capacity showed significant interaction (P<0,001). The highest values were reported in 1, 2 and 3 mos in seeds with one cut; these percentages did not differ among themselves but they did differ from the others. When comparing the cut with the puncture, a statistically different behavior was observed; in all the evaluations the lowest values were those of the puncture. It is necessary to emphasize the efficacy of the seed coat cut and the soaking for 24 hours in water at ambient temperature as dry and moist scarification treatments, respectively, in spite of the acceptable results shown by the control.
Key words: Albizia lebbeck, germination, scarification, storage
INTRODUCCIÓN
La germinación se define como aquellos eventos que se inician con la captación de agua por la semilla y finalizan con la elongación de los ejes embrionarios y la penetración de la radícula por las estructuras que rodean el embrión (Bewley, 1997). Según Besnier (1965) la aparición de la radícula a través de las cubiertas seminales es el primer indicio visible de la germinación. Esta marca la transición desde un estado dependiente de la fuente de nutrimentos (planta madre) hacia un germen independiente, capaz de tomar las sustancias minerales y crecer por sí solo; por ello la germinación conforma el eslabón final del proceso de manipulación de la semilla.
Para un amplio número de especies las semillas intactas no germinan cuando se les brindan las condiciones que normalmente favorecen el proceso germinativo (Cohn, 2006) y éstas pueden ser: humedad adecuada (agua), régimen apropiado de temperaturas, una atmósfera normal (oxígeno) y en algunos casos la luz (Hilhorst y Toorop, 1997). A este fenómeno en la fisiología de las plantas se le denomina con el término dormancia. Diversos esquemas para la clasificación de la dormancia se publicaron internacionalmente. Los más notables son los de Harper (1977), Nikolaeva (1969, 1977) y Lang (1987).
Dentro de la inmensa diversidad biológica que ofrecen las regiones tropicales, se encuentra la leñosa perenne Albizia lebbeck (L.) Benth. Diferentes estudios en Cuba (Febles y Ruiz, 2008) ratifican sus bondades como árbol multipropósito, por lo que se ha comenzado a utilizar en sistemas agroforestales para la producción animal.
El objetivo del presente trabajo fue evaluar la aplicación de diferentes métodos de escarificación húmeda y seca para favorecer la germinación, al emplear semillas de A. lebbeck almacenadas en condiciones ambientales.
MATERIALES Y MÉTODOS
Para el estudio de la germinación de las semillas se empleó un diseño completamente aleatorizado, con arreglo factorial 4 x 13 en el caso de la escarificación húmeda y 3 x 13 en la escarificación seca, en el que los factores estuvieron determinados por los métodos presiembra y los tiempos de almacenamiento.
A intervalos mensuales, en el momento de la siembra se aplicaron los métodos de escarificación que se relacionan en la tabla 1. La frecuencia de evaluación fue: 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12 meses de iniciado el almacenamiento (mdia), en cada uno de los tres años consecutivos, para lo cual se cosecharon semillas de la misma plantación progenitora.
Para las determinaciones de germinación se emplearon en cada evaluación 400 semillas, distribuidas en cuatro repeticiones (ISTA, 1999). Se realizaron conteos diarios durante 21 días y el riego fue a saturación.
Se interpretó la germinación como la capacidad de las estructuras fundamentales del embrión para iniciar el crecimiento, en términos visuales el momento de la aparición de la radícula (Côme, 1970).
Procesamiento estadístico de los resultados
Se realizó análisis de varianza según modelo de clasificación simple, en arreglo factorial 4 x 13 para la escarificación húmeda y 3 x 13 para la escarificación seca. Los datos se transformaron según ArcsenÖ(%+0,375); se utilizó la dócima de comparación múltiple de Duncan (1955) y las diferencias fueron declaradas significativas a valores de p<0,05. El procesamiento estadístico se llevó a cabo mediante el programa InfoStat versión 1.0 (Rienzo et al., 2001).
RESULTADOS Y DISCUSIÓN
Se encontró interacción significativa entre los factores estudiados (P<0,001) para la variable germinación (tabla 2).
El porcentaje más alto (40,85%) se obtuvo en el control con semillas sembradas a un mes de iniciado el almacenamiento (1 mdia). No obstante, según el test de Duncan (p<0,05) éste no difirió de los valores registrados por las semillas recién cosechadas (0 mdia) ni de 4 mdia en ninguno de los cuatro métodos presiembra (se incluye el control). Tampoco difirió de las germinaciones en el intervalo de 0 a 6 mdia para las semillas que previamente se mantuvieron por 24 horas en remojo en agua a temperatura ambiente, ni del control. Resulta necesario aclarar que en el intervalo anterior, el valor que se reportó a los 5 mdia en el control (27,79%) difirió del más alto obtenido en el estudio, no así del resto de las evaluaciones mencionadas. Esto expresa el comportamiento de la interacción.
En los métodos presiembra no se encontraron diferencias estadísticas entre el ácido y el agua caliente en las semillas evaluadas a 1, 3, 6 y 7 mdia; mientras que estos mismos tratamientos (métodos y meses) fueron estadísticamente diferentes al control y en todos los casos con valores inferiores a este último, lo que podría interpretarse como una posible afectación del ácido y el agua caliente al embrión, expresada en la germinación hasta los 7 mdia.
Resultados similares fueron informados por Toral y Machado (2002) en 76 especies arbóreas en las que el agua caliente (80°C) no fue un tratamiento efectivo para estimular el proceso germinativo.
Asimismo, es posible que las respuestas irregulares del agua caliente para estimular la germinación de A. lebbeck estén vinculadas estrechamente a que en este estudio la temperatura del agua (80°C) estuvo por encima de lo requerido para la detonación del proceso germinativo en esta especie. En estudios dirigidos por Smith et al. (2003) se determinó que las semillas de árboles como Celtis africana, Cordia sinensis y Melia volkensii requieren remojo en agua a 40°C.
Otra posible explicación es que en muchas especies que responden bien al agua caliente, la germinación decrece con el incremento del tiempo de exposición a dicho tratamiento (Teketay, 1996). Es válido recordar que en el presente experimento el tiempo de inmersión fue de tres minutos y de acuerdo con lo informado por Kannan et al. (1996), el método es más efectivo cuando el tiempo de inmersión es breve, ya que evita los daños en el embrión.
En este sentido, Albrecht (1993) reportó que la inmersión en agua a 90°C por un minuto produjo buenos resultados en la capacidad germinativa de Acacia mearnsii y Acacia melanoxylon; mientras que 30 segundos de remojo de las semillas de Acacia mangium en agua a altas temperaturas mantuvo la dormancia por cubierta dura (Bowen y Eusebio, 1981).
El agua caliente como tratamiento no indujo germinación en las semillas de Hypericum aviculariifolium subsp. depilatum var. Depilatum (Cirak et al., 2007), pero el agua a temperatura ambiente fue efectiva.
En la literatura aparecen reportes que coinciden con los resultados del presente experimento. En las semillas de Cratylia argentea la inmersión en ácido no favoreció la germinación con relación al testigo, al causar la muerte de un alto porcentaje de éstas (Sanabria et al., 2004); se observó que la exposición al ácido provocó la completa eliminación del tegumento, lo que posiblemente causara daños al embrión y, como consecuencia, se elevó el porcentaje de semillas muertas.
Algunos reportes indican al ácido sulfúrico como una solución para la eliminación de la dormancia en determinadas especies de leguminosas tropicales y subtropicales (Fariñas et al., 1997; CATIE, 2000a; Smith et al., 2003; Sanabria et al., 2004).
Otros aspectos que merecen ser discutidos y que apoyan la agresividad del agua caliente y el H2SO4 es que la germinación en el control fue superior, en muchos casos, a la de los dos métodos señalados. Además, lo mismo sucedió con los resultados del remojo, en comparación con estos pretratamientos. A ello se añade que la totalidad de las evaluaciones del remojo y el control no fueron significativas entre sí; mientras que difirieron de los métodos del agua caliente y el ácido.
Por otro lado, la región hiliar y el pleurograma son puntos relativamente débiles de la cubierta seminal, lo cual ha sido descrito con exactitud por Schmidt (2000); debido a ello son las zonas que más tienden a convertirse en permeables durante los pretratamientos (Kannan et al., 1996). En la especie A. lebbeck el pleurograma ocupa alrededor del 90% de la superficie seminal. Esta podría ser una de las explicaciones para entender el mecanismo de acción del remojo en agua por 24 horas, ya que a diferencia del resto de los métodos presiembra evaluados, el remojo no ocasiona agresión a la integridad de la simiente ni a su corteza seminal; dicha condición es indispensable para provocar la ruptura de la dormancia en semillas de árboles tropicales y, por consiguiente, la aparición de la radícula.
Sin embargo, al estudiar diferentes métodos de escarificación para las simientes de Cassia tormentosa y Cassia xiphoidea, Soto Pinto (1996) reportó que el remojo en agua a temperatura ambiente provocó bajos porcentajes de germinación.
Los beneficios del remojo en agua desde dos hasta 48 horas fueron reportados por Smith et al. (2003) para mejorar la germinación de muchas especies de árboles tropicales, como A. mearnsii, A. melanoxylon, Acacia nilotica, Adenanthera microsperma, Albizia amara, Albizia procera, Grevillea robusta, Trewia nidiflor y Pinus caribaea; y por CATIE (2000b) para Samanea saman, Erythrina poeppigiana, Leucaena salvadorensis, Pithecellobium dulce y Stryphnodendron microstachyum.
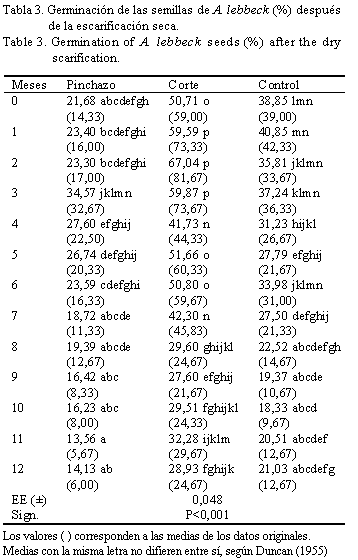
La tabla 3 muestra la interacción significativa (P<0,001) en la germinación, por el efecto combinado de los métodos presiembra en la escarificación seca y los meses de almacenamiento. Los valores más altos se encontraron en las evaluaciones 1, 2 y 3 mdia (59,59; 67,04 y 59,87%, respectivamente) con semillas que recibieron un corte en la cubierta antes de la siembra; estos porcentajes no difirieron entre ellos, pero sí del resto de las determinaciones.
Al comparar los resultados de la germinación de las semillas que previamente recibieron un corte de cubierta y las del grupo control, se observó que a excepción de 8, 9 y 12 mdia el resto de las evaluaciones difirieron según el test de Duncan (p<0,05) y las diferencias siempre estuvieron a favor del corte de cubierta, es decir, este método permitió a las semillas de albizia aumentar los porcentajes de germinación o lo que es lo mismo: rebasar el estado dormante o favorecer un contacto más rápido de las estructuras embrionarias con el agua y el oxígeno ambiental. Resulta oportuno aclarar que al comparar el corte con el pinchazo, la germinación fue estadísticamente diferente. En todos los casos la variable objeto de análisis se mantuvo en valores inferiores para el pinchazo, y a su vez este último método sólo difirió del control en las evaluaciones realizadas a 0, 1, 2 y 6 mdia, también con valores inferiores.
Estos resultados coinciden con los informados por Poulsen y Thomsen (1999), Taylor (2003) y Turner et al. (2005), quienes afirmaron que la destrucción de la impermeabilidad en un punto único de la cubierta seminal es normalmente suficiente para permitir la imbibición y el intercambio de gases.
En un estudio realizado por González y Navarro (2001) en A. lebbeck, para medir la germinación en condiciones de laboratorio, también se encontraron los valores superiores con el corte de cubierta (96,8%), con la diferencia de que en el citado estudio el máximo valor correspondió al inicio del almacenamiento, es decir a los 0 mdia.
Grus et al. (1984), Torres y Santos (1994), Bush et al. (1997), CATIE (2000b) y Willan (2000) han reportado resultados similares en otras especies.
En ensayos con ocho especies de Acacia spp. en Australia y Tailandia el corte fue uno de los mejores tratamientos, con valores de 90 vs 10% en el testigo. Con este método también se reportaron altos valores de germinación en dos especies endémicas de Kenya, de corteza dura: Acacia xanthophloea y Trachylobium verrucosum; mientras que en Zimbawe Acacia albida presentó más del 90% (Schmidt, 1988; Masamba, 1994).
Una valoración general de los resultados permite concluir que al analizar el comportamiento de la germinación, desde el inicio del almacenaje hasta los 7 mdia, se apreció una afectación debido al H2SO4 y al agua caliente, lo cual apoya el criterio acerca de la agresividad de ambos métodos presiembra al embrión; mientras que su efecto fue beneficioso entre 8 y 12 mdia, lo que pudo estar asociado a una mayor impermeabilización de las cubiertas seminales como resultado del aumento de la edad fisiológica de las simientes y las condiciones del almacén.
Aunque el remojo por 24 horas en agua a temperatura ambiente no provocó aumento ni disminución en la capacidad germinativa de las semillas, se deduce que dicho método ofrece determinadas posibilidades para ser considerado como una alternativa de escarificación húmeda en A. lebbeck. Se debe resaltar la eficacia del corte de cubierta como un método para la escarificación seca, a pesar de los resultados aceptables mostrados por el control. Es necesario mencionar que el corte debe ser realizado cuidadosamente para no dañar las semillas.
REFERENCIAS BIBLIOGRÁFICAS
1. Albrecht, J. Tree seed handbook of Kenya. Nairobi, Kenya: Gesellschaft für Technische Zusammenarbeir/Kenya Forestry Seed Centre Maguga, Kenya Forestry Research Institute. 264 p. 1993.
2. Besnier, F. Semillas: biología y tecnología. Ediciones Mundi-Prensa. Madrid, España. 394 p. 1965.
3. Bewley, J.D. Seed germination and dormancy. Plant Cell. 9:1055. 1997
4. Bowen, M.R. & Eusebio, T.V. Acacia mangium: updated information on seed collection, handling, and germination testing. Occasional technical and scientific notes, Seed Series 5. FAO/UNDP-MAL/78/009. Forest Research Centre. Sandakan, Sabah, Indonesia. 26 p. 1981.
5. Bush, M.S. et al. Viabilidad de las semillas pretratadas de Caesalpinia cyclocarpum (J.) Griseb y Leucaena leucocephala (Lam.) de Wit. Boletín Mejoramiento Genético y Semillas Forestales. 16:8. 1997
6. CATIE. Técnicas para la germinación de semillas forestales. Serie Técnica. Manual Técnico No. 39. CATIE-PROSEFOR-DFSC. Turrialba, Costa Rica. 54 p. 2000a.
7. CATIE. Manejo de semillas de 100 especies forestales de América Latina. Volumen 1. Serie Técnica. Manual Técnico No. 41. CATIE-PROSEFOR-DFSC. Turrialba, Costa Rica. 204 p. 2000b.
8. Cirak, C. et al. 2007. Breaking of seed dormancy in a Turkish endemic Hypericum species: Hypericum aviculariifolium subs. depilatum var. depilatum by light and some pre-soaking treatments. Journal of Arid Environments. 68:159
9. Cohn, M.A. 2006. Dormancy: an overview. In: The Encyclopedia of seeds: science, technology and uses (Eds. J.D. Bewley et al.). CABI Publishing. Wallingford, UK
10. Côme, D. 1970. Les obstacles à la germination. Masson et Cie editeurs, Paris. 162 p.
11. Fariñas, J.D. et al. Escarificación química de semillas de tres especies de Centrosema para sabanas bien drenadas. Zootecnia Tropical. 15 (2):221. 1997
12. Febles, G. & Ruiz, T.E. Evaluación de especies arbóreas para sistemas silvopastoriles. Avances en Investigación Agropecuaria. 12:4. 2008
13. González, Yolanda & Navarro, Marlen. Efecto de los tratamientos pregerminativos sobre la ruptura de dormancia en Albizia lebbeck. Pastos y Forrajes. 24:225. 2001
14. Grus, V.M. et al. Germinação de sementes de pau-ferro e cássia-javanesa submetidas a tratamentos para quebra de dormência. Rev. Bras. Sem. 6 (2):29. 1984
15. Harper, J.L. Population biology of plants. Academic Press, New York. 892 p. 1977.
16. Hilhorst, H.W.M. & Toorop, P.E. Review on dormancy, germinability, and germination in crop and weed seeds. Advances in Agronomy. 61:111. 1997
17. ISTA. International rules for seed testing. Seed Sci.Technol. 27. Supplement. 1999.
18. Kannan, C.S. et al. Seed dormancy and pre-treatments to enhance germination in select Albizia species. Journal of Tropical Forest Science. 8:369. 1996
19. Lang, G.A. Dormancy: A new universal terminology. HortScience. 22:817. 1987
20. Masamba, C. Presowing treatments on four African Acacia species: appropriate technology for use in forestry for rural development. Forest Ecology and Management. 64:105. 1994
21. Nikolaeva, M.G. Physiology of deep dormancy in seeds. Leningrad, Russia, Izdatel'stvo `Nauka'. (Traducción al Inglés por Z. Shapiro, National Science Foundation, Washington, DC.). 1969
22. Nikolaeva, M.G. Factors controlling the seed dormancy pattern. In: The physiology and biochemistry of seed dormancy and germination (A.A. Khan, Ed.). North-Holland, Amsterdam. p. 54. 1977
23. Poulsen, K. & Thomsen, K. Seed handling manual. Guidelines and logbook for seed processing. DFSC Technical Note No. 54. Danida Forest Seed Centre, Denmark. 19 p. 1999.
24. Rienzo, J.A. et al. InfoStat versión 1. Software estadístico. Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba, Argentina. 2001
25. Sanabria, D. et al. Germinación de semillas de las leguminosas arbustivas forrajeras Cratylia argentea y Cassia moschata sometidas a inmersión en ácido sulfúrico. Bioagro. 16 (3):225. 2004
26. Schmidt, L. A study of natural regeneration of transitional lowland rain forest and dry bushland in Kenya. MSc. Thesis. University of Aarhus. Copenhagen, Denmark. 93 p. 1988.
27. Schmidt, L. Handling of tropical and subtropical forest tree seed. DFSC. Hummleback, Denmark.511 p. 2000.
28. Smith, M. et al. Dormancy and germination. In: Tropical tree seed manual. USDA Forest Service's/Reforestation Nurseries & Genetics Resources. USA. p. 149 . 2003
29. Soto Pinto, M.L. Escarificación de semillas de leguminosas arbustivas Cassia tormentosa y C. xiphoidea. Boletín Mejoramiento Genético y Semillas Forestales. 14:5. 1996
30. Taylor, A.G. Seed treatments. In: Encyclopedia of applied plant sciences. (Eds. B. Thomas et al.). Elsevier Acad. Press. p. 1291. 2003
31. Teketay, D. Germination ecology of twelve indigenous and eight exotic multipurpose leguminous species from Ethiopia. Forest Ecology Management. 80:209. 1996
32. Toral, O. & Machado, R. Introducción, evaluación y selección de recursos fitogenéticos arbóreos. Pastos y Forrajes. 25 (1):1. 2002
33. Torres, S.B. & Santos, D.S.B. Superação de dormência em sementes de Acacia senegal (L.) Willd. e Parkinsonia aculeate (L.). Rev. Bras. Sem. 16 (1): 54. 1994
34. Turner, R. et al. Physical dormancy in seeds of six genera of Australian Rhamnaceae. Seed Sci. Res. 15:51. 2005
35. Willan, R.L. Pre-tratamiento de semillas. En: Técnicas para la germinación de semillas forestales. Serie Técnica. Manual Técnico No. 39. CATIE-PROSEFOR-DFSC. Turrialba, Costa Rica. 2000
Recibido el 3 de noviembre del 2009
Aceptado el 5 de enero del 2010