Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.33 n.4 Matanzas oct.-dic. 2010
ARTICULO DE INVESTIGACION
Efecto de productos bioactivos combinados con el biopreparado microbiano Azotofos en el crecimiento de Paspalum salam
Effect of bioactive products combined with the microbial biopreparate Azotofos on the growth of Paspalum salam
Gertrudis Pentón 1, Inés Reynaldo2 , R. Medina1 y G. Onono3
1Estación Experimental de Pastos y Forrajes "Indio Hatuey" Central España Republicana, CP 44280, Matanzas, Cuba
E-mail: gertrudis.penton@indio.atenas.inf.cu
2Instituto Nacional de Ciencias Agrícolas, La Habana, Cuba
3Facultad de Agronomía, Universidad de Matanzas "Camilo Cienfuegos", Matanzas, Cuba
RESUMEN
Con el objetivo de evaluar el efecto de los productos bioactivos y su combinación con Azotofos en el crecimiento de Paspalum salam (Paspalum vaginatum Sw. cv. Salam), se realizaron dos experimentos. Se empleó un diseño en bloques al azar con tres repeticiones y se probaron los productos bioactivos: Pectimorf® (a base de pectinas) y BIOBRAS-16® (a base de brasinoesteroides), y su combinación con el biopreparado microbiano Azotofos, que consiste en una mezcla en soporte húmico de Pseudomonas sp. y Azotobacter chroococcum. En el primer experimento se establecieron seis tratamientos a partir de los productos bioactivos, el biopreparado microbiano y su combinación. El segundo experimento consistió en probar distintos tiempos de imbibición de los propágulos en Pectimorf®. Se obtuvo a los 30 días de la siembra una significativa superioridad en el porcentaje de esquejes enraizados en los tratamientos con BIOBRAS-16® y Pectimorf®, superior a 89%; mientras que el testigo no superó el 69%. La combinación del Pectimorf® con el Azotofos aumentó el porcentaje de esquejes enraizados. En cuanto a la biomasa total acumulada, el mejor resultado se obtuvo en el tratamiento con Pectimorf (0,84 g/individuo). Con respecto al tiempo de imbibición, los tratamientos testigo hidratado y sin hidratar no superaron el 69% de esquejes enraizados, y fueron diferentes significativamente del tiempo de imbibición 60 min. que alcanzó 100%. Se concluye que el Pectimorf® fue la mejor alternativa para estimular el crecimiento de P. vaginatum cv. Salam. Los resultados indicaron además que los esquejes deben mantenerse imbibidos en Pectimorf® durante 60 minutos.
Palabras clave: Biomasa, enraizamiento , Paspalum salam
ABSTRACT
In order to evaluate the effect of bioactive products and their combination with Azotofos on the growth of Paspalum salam (Paspalum vaginatum Sw. cv. Salam), two trials were conducted. A randomized block design was used with three repetitions and the bioactive products Pectimorf® (based on pectins) and BIOBRAS-16® (based on brassinosteroids), and their combination with the microbial biopreparate Azotofos, which consists in a mixture on humic support of Pseudomonas sp. and Azotobacter chroococcum. In the first experiment six treatments were established from the bioactive products, the microbial biopreparate and their combination. The second trial consisted in testing different imbibition times of the propagules in Pectimorf®. A significant superiority was found 30 days after planting in the percentage of rooted cuttings in the treatments with BIOBRAS-16® and Pectimorf®, higher than 89%; while the control did not exceed 69%. The combination of Pectimorf® with Azotofos increased the percentage of rooted cuttings. Regarding the total cumulative biomass, the best result was obtained in the treatment with Pectimorf (0,84 g/individual). As to the imbibition time, the treatments hydrated control and non-hydrated one did not exceed 69% of rooted cuttings; significantly different from the imbibition time 60 min, which reached 100%. Pectimorf ® was concluded to be the best alternative to stimulate the growth of P. vaginatum cv. Salam. The results also indicated that the cuttings must remain imbibed in Pectimorf® for 60 minutes.
Key words: Biomass, Paspalum salam, rooting
Contenido
INTRODUCCIÓN
El género Paspalum Linn. pertenece a la familia Gramineae, subfamilia Panicoideae, y tuvo su origen en la zona de América tropical. En la actualidad se encuentra ampliamente distribuido en todo el continente americano y en Australia. Se adapta a climas calientes e incluye especies que se desarrollan bien en suelos de baja fertilidad y mal drenaje (Martínez et al., 1986).
Paspalum vaginatum cv. Salam se presenta como una especie promisoria, resistente a la sequía y la salinidad (Hernández et al., 1998), que con un régimen adecuado de riego puede reducir hasta un 25% del consumo de agua con relación a la bermuda y también permite ahorrar entre un 25 y 50% de los fertilizantes (Duncan, 2006). El modo de reproducción es apomíctico (Martínez et al., 1986), por lo que la siembra se puede efectuar mediante semilla vegetativa (a través de rizomas y estolones) preferentemente en los meses de primavera. Sin embargo, su lento establecimiento y su desarrollo poco precoz obligan a buscar opciones que garanticen una mayor competencia en las edades tempranas, respecto a la flora acompañante. Los productos bioactivos y su combinación con los biopreparados microbianos constituyen una alternativa, que además es congruente con el medio ambiente.
Es conocido que cuando las plantas se inoculan con bacterias y hongos benéficos, que transforman el nitrógeno y otros macronutrientes y micronutrientes, se produce un marcado incremento de los procesos de absorción y translocación de los nutrientes (Pulido et al., 2003). Ello se revierte en un mayor crecimiento, el mejoramiento de los indicadores hídricos de las plantas y una inducción del desarrollo del sistema radical (Morte et al., 2001; Dell'Amico et al., 2002). En cuanto a los productos bioactivos, Góngora et al. (2004) destacaron los efectos inductores de los mecanismos de tolerancia al estrés por salinidad y sequía, a partir del pretratamiento a las semillas de tomate y arroz con sustancias promotoras del crecimiento vegetal basadas en análogos de brasinoesteroides u oligogalacturónidos, y la interacción de ellos con hongos micorrizógenos. Otros autores se han referido al Fitomas-E®, BIOBRAS-16® y EnerPlant®, como bioestimuladores exitosos. Sin embargo, en la actualidad también se emplean la Quitosana y el Pectimorf®.
El uso de biopreparados microbianos resulta particularmente exitoso en el género Paspalum. Se conoce acerca de su capacidad para asociarse con microorganismos del suelo, fijadores-transformadores de nitrógeno, y solubilizadores de fósforo. Benzion y Quesenberry (citados por Martínez et al., 1986) inocularon varios genotipos de P. notatum con Azospirillum brasilensi JM 125 A2 y encontraron que estos incrementaron su peso seco desde 18 hasta 22,9% y un diploide fue el único genotipo que disminuyó su peso seco. Pereira (citado por Martínez et al., 1986) se refirió a la efectividad de la asociación de P. notatum con Azotobacter paspali.
El objetivo del presente trabajo fue evaluar el efecto de dos productos bioactivos y su combinación con un biopreparado a base de Pseudomonas sp. y Azotobacter chroococcum en el crecimiento inicial de Paspalum salam (P. vaginatum Sw. cv. Salam).
MATERIALES Y MÉTODOS
Los experimentos se realizaron en la Estación Experimental «Indio Hatuey», situada entre los 22° 48' 7'' de latitud Norte y los 81° 2' de longitud Oeste, a 19,01msnm, en la provincia de Matanzas, Cuba. El período experimental fue de 30 días, y se enmarcó entre los meses de febrero y marzo del año 2009.
El acumulado de precipitaciones fue significativamente bajo (tabla 1), lo que se corresponde con la media del período correspondiente a los primeros meses del año, reconocida esta etapa como la de mayor sequía en Cuba.
La especie evaluada fue P. vaginatum cv. Salam. El material vegetativo se obtuvo de un banco de semilla básica. Los esquejes se seleccionaron de la zona media de las plantas, con una longitud de 15 cm y cuatro o más yemas. La siembra se realizó en bandejas de poliespuma, divididas en cubículos con capacidad de 144 cm3; estas se mantuvieron durante todo el período experimental expuestas a cielo abierto. El sustrato empleado consistió en una mezcla de suelo arenoso, extraído del campo de golf de Varadero (Cuba), y materia orgánica a partir de humus de lombriz, en una relación 2:1. El riego se realizó cada dos días.
Todos los productos se aplicaron en el momento de la siembra. Estos consistieron en:
• Pectimorf®, a base de pectinas, obtenido en el Laboratorio de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas (La Habana, Cuba). Se aplicó a razón de 10 mg/L, por el método de inmersión de los propágulos.
• BIOBRAS-16®, a base de brasinoesteroides, producido por la Facultad de Química de la Universidad de La Habana (Cuba). Se aplicó por el método de inmersión de los propágulos.
• Azotofos, un preparado microbiano consistente en una mezcla en soporte húmico de Pseudomonas sp. y A. chroococcum . Se aplicó a razón de 10 g/L, por el método de inmersión.
Experimento 1. Efecto de los productos bioactivos y su combinación con Azotofos.
Los tratamientos fueron los siguientes:
• Testigo hidratado durante 30 minutos en agua clara.
• Azotofos
• Azotofos + Pectimorf®
• Azotofos + BIOBRAS-16®
• Pectimorf®
• BIOBRAS-16®
Se realizaron las siguientes mediciones:
1. Porcentaje de esquejes enraizados (%).
2. Peso de la biomasa total (g/individuo).
Experimento 2. Efecto del tiempo de imbibición en Pectimorf.
Los tratamientos fueron los siguientes:
• Testigo sin hidratación previa a la plantación.
• Testigo hidratado durante 120 minutos en agua clara.
• Imbibición durante 30 minutos en Pectimorf.
• Imbibición durante 60 minutos en Pectimorf.
• Imbibición durante 90 minutos en Pectimorf.
• Imbibición durante 120 minutos en Pectimorf.
Se realizaron las siguientes mediciones:
3. Porcentaje de esquejes enraizados (%).
4. Longitud máxima de las raíces (cm).
5. Peso de la biomasa radical (g).
Análisis matemático y diseño
En ambos experimentos se empleó un diseño de bloques al azar con tres repeticiones. El paquete estadístico utilizado fue Infostat, versión libre, a través del modelo ANOVA y la prueba de comparación de Duncan. En el primer experimento se procedió a través de un análisis multifactorial, donde los factores de variación fueron los productos bioactivos y los biopreparados microbianos. En el segundo experimento el factor de variación fue el tiempo de imbibición, por lo que se realizó un análisis simple.
RESULTADOS Y DISCUSIÓN
En la tabla 2 se presenta el efecto del Azotofos, el Pectimorf® y el BIOBRAS-16®, y sus combinaciones. La combinación del Pectimorf® con el biopreparado microbiano significó un aumento sensible del porcentaje de esquejes enraizados, respecto al testigo y a cada producto por separado. Ello corrobora el marcado efecto de la combinación del Azotofos, cuyo mayor impacto se manifestó en la estimulación del crecimiento. El Pectimorf® actuó mayormente en función del desarrollo de las raíces. El BIOBRAS-16® y su combinación con Azotofos produjo un alto porcentaje de esquejes enraizados, lo cual se explica por la significativa influencia de los brasinoesteroides en el crecimiento celular y las bacterias promotoras de crecimiento presentes en el biopreparado, que además de facilitar el acceso de las raíces a los elementos minerales, exudan sustancias de bajo peso molecular aprovechables por la planta. Todo esto conlleva un aumento del vigor de los propágulos (Noriega, 2009).
En cuanto a la biomasa total el mejor resultado se obtuvo en el tratamiento con Pectimorf, lo que se justifica por ser las pectinas un componente mayoritario de la pared celular de los organismos vegetales, donde actúan como una especie de cemento celular que une, a través de las hemicelulosas, las microfibrillas de celulosa, y contribuye a su fortaleza (Naranjo, 2005). Estas oligosacarinas son moléculas señalizadoras derivadas de los polisacáridos que componen la pared celular de las plantas y poseen en su constitución elementos auxínicos y citoquinínicos semejantes a aquellos de los reguladores artificiales del crecimiento. Se han utilizado en muchos cultivos con excelentes resultados, similares a lo obtenido con BIOBRAS-16 (Jomarrón et al., 2000).
La combinación de Azotofos con los productos bioactivos y el BIOBRAS-16® no superaron los acumulados alcanzados por el testigo.
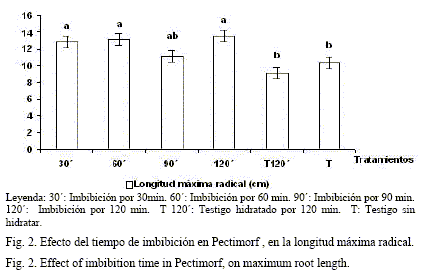
En las figuras 1 y 2 se presenta el efecto de diferentes tiempos de imbibición de los propágulos en Pectimorf®, comparados con el testigo sin tratar. Se puede apreciar que los tratamientos testigo hidratado y sin hidratar tuvieron los valores de enraizamiento más bajos (59,5 y 69,8% de esquejes enraizados) y difirieron significativamente del tiempo de imbibición de 60 minutos en Pectimorf®, que alcanzó el 100%. Los valores más altos de longitud máxima de las raíces se alcanzaron en los tiempos 30, 60 y 120 minutos, en contraste con los testigos sin tratar.
Tomando en consideración lo sugerido por Inés Reynaldo (comunicación personal) acerca de los tiempos de imbibición de 15 a 30 minutos para las posturas de hortalizas, y entre tres y cuatro horas para las semillas de pepino y quimbombó, el mejor resultado en el presente trabajo con el tiempo de imbibición de 60 minutos indica que el volumen óptimo de sustancia activa que se difundió hacia el interior de las células y su efecto en la inducción de los procesos ligados al enraizamiento, dependen de la especie vegetal y del material de propagación. En cuanto a la producción acumulada de biomasa verde radical (fig. 3), el tratamiento de 60 minutos tuvo un efecto significativamente mayor y hubo un descenso a partir de 90 minutos. El tratamiento de 90 minutos coincidió con la peor repuesta, lo cual debe ser objetivo de futuros estudios con vista a profundizar en la acción del producto bioactivo. El efecto positivo del Pectimorf® en la concentración y el tiempo de imbibición adecuados, según el cultivo de que se trate, está determinado por la acción que ejerce el producto en los procesos fisiológicos de alargamiento y diferenciación celular. Según González et al. (2002), el efecto de este producto en la organogénesis es el más sensible de los estudiados, lo que confirma que puede regular un proceso fundamental para el desarrollo de las plantas, como la formación de órganos.
Terrero (2010) señala que para obtener una respuesta satisfactoria al Pectimorf se mezcla entre 5 y 20 mg del Pectimorf® en un litro de agua, rango similar al utilizado para las hormonas tradicionales al expresarlas en unidades de concentraciones molares. En el presente estudio la concentración fue de 10 mg, por lo que se considera importante realizar pruebas con diferentes concentraciones con el objetivo de potenciar el efecto del producto, el cual ofrece, entre sus ventajas adicionales, su solubilidad en el medio acuoso (empleado para preparar los medios de cultivo) y su estabilidad en las condiciones utilizadas para esterilizar los medios (Terrero, 2010).
Según el autor, el Pectimorf® (subproducto de la industria citrícola) es de bajo costo y se encuentra disponible en el mercado cubano, por lo que constituye una alternativa en la sustitución de los reguladores tradicionales del crecimiento. Núñez et al. (1996) demostraron que las oligosacarinas inducen el enraizamiento y el crecimiento vegetativo, y además mejoran la simbiosis soya-Bradyrizobium.
CONCLUSIÓN
Se concluye que el Pectimorf® es la mejor alternativa para estimular el crecimiento inicial de P. vaginatum cv. Salam. Los resultados indicaron, además, que los esquejes deben mantenerse en imbibición en Pectimorf® durante 60 minutos antes de la siembra. "Indio Hatuey"
REFERENCIAS BIBLIOGRÁFICAS
1. Dell'Amico, J. et al. Water and growth parameter responses to tomato plants associated with arbuscular mycorrhizae during drought and recovery. J. Agric. Sci. 138:387. 2002
2. Duncan, R. El periodigolf. "Algunos proyectos de golf en España solo podrán usar Paspalum".Disponible en: http://www.madridiario.es/elperiodigolf/content/index.php?option=com_content&task= view&id=2993&Itemid=38 . [Consulta: 8 de abril del 2009] . 2006
3. Góngora, A. et al. Influencia de diferentes proporciones de NPK y los momentos de aplicación de Biobrás 16 en la fase de semillero del cultivo del tabaco variedad Habana 92. En: Memorias del XIV Congreso Científico del INCA. La Habana, Cuba. p. 115. 2004
4. González, S. et al. Las oligosacarinas y los brasinoesteroides como reguladores del crecimiento en la biotecnología vegetal. En: Congreso Científico del INCA. Memorias. [cd-rom]. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. 2002
5. Hernández, L. et al. Evaluación de gramíneas cespitosas para el fomento de campos de golf y áreas de jardinería. Pastos y Forrajes. 21:323. 1998
6. Jomarrón, I.R. et al. Polyhidroxispirostenones as plant growth regulators. European Patent Bulletin. Number 2000/29. 2000
7. Martínez, M. et al. Paspalum spp. Pastos y Forrajes. 8:157. 1986
8. Morte, A. et al. Growth and water relations in mycorrhizal and non-mycorrhizal Pinus halepensis plants in response to drought. Biol. Plant. 44 (2):263. 2001
9. Naranjo, O. Evaluación del Pectimorf y Biobras-16 en la variedad de tabaco Habana 92. Trabajo de Diploma. Universidad de Granma, Cuba. p. 21. 2005
10. Noriega, A.V. Eficaz regulador para que las plantas crezcan más. La Habana. Disponible en: http://www.elhabanero.cubaweb.cu. Consulta: 28 de marzo del 2009. 2009
11. Núñez, M. et al. Influencia de un análogo de Brasinoesteroide en el crecimiento y la actividad metabólica de plantas jóvenes de tomate. Cultivos Tropicales. 17 (3):26. 1996
12. Pulido, L.E. et al. La biofertilización con rizobacterias y hongos micorrízicos arbusculares en la producción de posturas de tomate (Lycopersicon esculentum Mill.) y cebolla (Allium cepa l). I. Crecimiento vegetativo. Cultivos Tropicales. 24 (1):15. 2003
13. Terrero, J.C. Evaluación de 3 sustancias bioestimulantes en el cultivo del pepino (Cucumis sativus, L.) en condiciones de organopónico. [En línea]: http://www.monografias.com.feu.udg@udg.co.cu. Consulta: 10 de agosto del 2010. 2010
Recibido el 10 de julio del 2009
Aceptado el 15 de mayo del 2010