Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.34 no.3 Matanzas jul.-sep. 2011
ARTÍCULO DE INVESTIGACIÓN
Uso del EcoMic® y el producto bioactivo Pectimorf® en el establecimiento de dos especies forrajeras
Use of EcoMic® and the bioactive product Pectimorf® in the establishment of two forage species
Gertrudis Pentón1, Inés Reynaldo2, G. J. Martín1, R. Rivera2 y Katerine Oropesa1
1Estación Experimental de Pastos y Forrajes "Indio Hatuey' Central España Republicana, CP 44280, Matanzas, Cuba
E-mail: gertrudis.penton@indio.atenas.inf.cu
2Instituto Nacional de Ciencias Agrícolas, Mayabeque, Cuba
RESUMEN
Con el objetivo de evaluar el efecto de EcoMic®, Pectimorf® y/o su combinación en el establecimiento de las especies forrajeras Morus alba L. (morera) y Sorghum bicolor L. (sorgo), se realizaron dos experimentos. El primero se hizo con M. alba, inoculada o no con HMA, y se evaluaron las variables del rendimiento y la supervivencia de las plantas a los 90 y 240 días. El experimento con S. bicolor se realizó durante 30 días a partir de la siembra, y se evaluó la germinación de las semillas y las variables del rendimiento a los 7, 15 y 30 días. Los tratamientos fueron: testigo, inoculación con HMA, imbibición en Pectimorf, y su combinación. Se empleó un diseño en bloques al azar, con tres repeticiones. Se obtuvo respuesta de la morera a la inoculación con HMA a los 90 días de establecimiento, en términos de peso verde de las raicillas y las raíces, que triplicaron los resultados del testigo. A los 240 días las plantas inoculadas duplicaron el rendimiento del testigo y no hubo diferencias significativas en la supervivencia, en el incremento de biomasa comestible por unidad de área foliar, ni en la relación del sistema asimilativo por unidad de biomasa comestible. En el sorgo, el empleo combinado del Pectimorf® y el EcoMic® produjo un aumento significativo, respecto al testigo, en la germinación de las semillas a los 30 días (89 vs 58%), la altura efectiva (4,04 vs 3,55 cm), el grosor de la base del tallo (0,18 vs 0,15 cm), el área del limbo, el número de hojas abiertas (4 vs 3) y el largo de las hojas. Se concluye que los productos EcoMic® y Pectimorf®, así como su combinación constituyen una alternativa efectiva para el establecimiento de las especies forrajeras estudiadas.
Palabras clave: Crecimiento, Morus alba L., rendimiento, Sorghum bicolor L.
ABSTRACT
In order to evaluate the effect of EcoMic®, Pectimorf® and/or their combination on the establishment of the forage species Morus alba L. (mulberry) and Sorghum bicolor L. (sorghum), two trials were conducted. The first one was done with M. alba, inoculated or not with AMF, and the plant yield and survival variables were evaluated after 90 and 240 days. The experiment with S. bicolor was conducted for 30 days after planting and seed germination and yield variables were evaluated after 7, 15 and 30 days. The treatments were: control, inoculation with AMF, imbibition in Pectimorf, and their combination. A randomized block design was used, with three repetitions. Response of mulberry to the inoculation with AMF was obtained after 90 days of establishment, in terms of green weight of the rootlets and roots, which tripled the results of the control. After 240 days the inoculated plants doubled the yield of the control and there were no significant differences in survival, increase of edible biomass per leaf area unit, or relationship of the assimilative system per edible biomass unit. In sorghum, the combined use of Pectimorf® and EcoMic® produced a significant increase, as compared to the control, in seed germination 30 days after planting (89 vs 58%), effective height (4,04 vs 3,55 cm), stem base diameter (0,18 vs 0,15 cm), leaf blade area, number of open leaves (4 vs 3) and leaf length. The products EcoMic® and Pectimorf®, as well as their combination, are concluded to constitute an effective alternative for the establishment of the studied forage species.
Key words: Growth, Morus alba L., Sorghum bicolor L., yield.
INTRODUCCIÓN
El uso de biofertilizantes y productos bioactivos es una práctica común en la agricultura actual. En el caso de los biofertilizantes basados en hongos micorrízico arbusculares (HMA), estos son reconocidos por su capacidad de incrementar la producción agrícola de modo sustentable y ecológicamente aceptable (entre un 15 y 50%). Sus beneficios están relacionados con:
• la nutrición, debido a que aumentan la capacidad de absorción del sistema radical; son particularmente exitosos en los suelos tropicales deficientes en fósforo asimilable;
• las relaciones con el agua (permiten absorber agua a potenciales más bajos que los pelos radicales);
• la estructura del suelo (mejoran las propiedades físicas, aumentan la formación de agregados);
• los metales pesados (aumentan la tolerancia); y
• los patógenos radicales (aumentan la tolerancia).
Con respecto al producto bioactivo Pectimorf®, su principio activo es la pectina que se obtiene como subproducto de la industria citrícola. Es un producto de bajo costo, y las ventajas de su uso están relacionadas con:
• la germinación;
• el vigor de las plantas y la supervivencia durante las etapas tempranas del desarrollo vegetativo (tiene un efecto estimulante en el crecimiento radical);
• los organismos patógenos (estimula los mecanismos de defensa); y
• la sequía y la salinidad (inductor de mecanismos de tolerancia).
No obstante a todo lo anterior, en el sector ganadero el EcoMic® y el Pectimorf® se explotan de manera insuficiente. Algunas investigaciones con el producto comercial a base de HMA informan de su empleo en plantaciones de leucaena (Leucaena leucocephala) (Cuesta et al., 2006; Reyes, 2006) y de stylo (Stylosanthes guianensis) (González et al., 2004), y en pastos como estrella (Cynodon nlemfuensis), brachiaria (Brachiaria decumbens) y guinea (Panicum maximum = Megalothyrsus maximum) (Vieito et al., 2006). Del producto bioactivo no se tienen referencias.
De ahí que en el presente trabajo se planteara como objetivo evaluar el efecto del producto EcoMic® (a base de HMA), el producto bioactivo Pectimorf® y/o su combinación, en el establecimiento de las especies forrajeras Morus alba L. (morera) y Sorghum bicolor L (sorgo).
RESULTADOS Y DISCUSIÓN
Ubicación. El estudio se realizó en la Estación Experimental «Indio Hatuey» (22º 48'7'' de latitud norte y 79º 32' y 2'' de longitud oeste) ubicada a 19,9 msnm.
Características del suelo y el clima. El suelo del lugar es del tipo Ferralítico Rojo (Hernández et al., 2003), con buen drenaje superficial e interno. La composición química se caracterizó por contenidos de Na, K, Ca y Mg, que variaron entre 0,04 y 0,08; 0,10 y 0,14; 10,8 y 16,0 y 3,2-3,7 cmol/kg, respectivamente.
El P varió entre 13,0 y 22,0 ppm y la MO entre 1,50 y 2,22%, mientras que el pH fue de 6,1-6,3.
Procedimiento experimental. Se realizaron dos experimentos independientes (por especie). En el caso de la morera, el estudio, en condiciones de campo, se desarrolló en dos momentos de la etapa de establecimiento del cultivo: 90 y 240 días. La siembra, por estacas, se hizo al final de la época de lluvias, en un marco de siembra de 1,0 x 0,5 m, con orientación este-oeste. Las parcelas quedaron formadas por 48 plantas en un área de 24 m2.
El experimento con sorgo se realizó durante los primeros 30 días a partir de la siembra de las semillas, en bandejas de poliespuma divididas en cubículos con capacidad de 144 cm3. El sustrato empleado consistió en una mezcla de suelo y materia orgánica a partir de humus de lombriz, en una relación 2:1.
El producto EcoMic® es el soporte comercial de los HMA. La cepa de hongo utilizada fue Glomus fasciculatum (Hoi like), obtenida a partir de inóculos certificados, con un contenido de 20-25 esporas/g de inoculante. La inoculación se realizó por el método de inmersión de las semillas o del extremo inferior de las estacas en una pasta fluida (0,8 kg/L de H2O), recomendado por Rivera et al. (2003).
El producto bioactivo Pectimorf®, a base de oligosacarinas del tipo pectina, fue obtenido en el Laboratorio de Fisiología y Bioquímica Vegetal del INCA (provincia Mayabeque, Cuba) y aplicado a razón de 10 mg/L, por el método de inmersión de las semillas.
Tratamientos:
• Experimento de morera
- Testigo
- Inoculación con HMA
• Experimento de sorgo
- Testigo
- Inoculación con HMA
- Imbibición con Pectimorf
- Inoculación con HMA más imbibición con Pectimorf
Indicadores evaluados
En el experimento de morera se evalúo:
- El número de ramas (u), el peso verde de las raicillas (g), el peso verde de las raíces (g) y el rendimiento de masa seca de las hojas (g/planta) a los 90 días de establecimiento del cultivo.
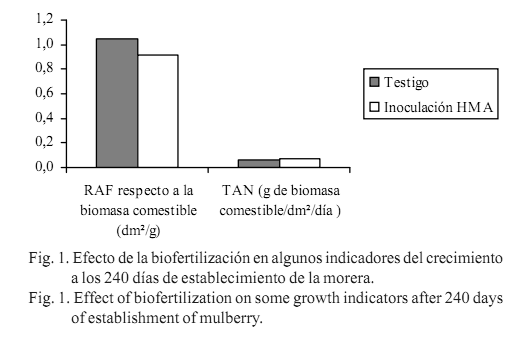
- La supervivencia (%), la altura efectiva (cm), el número de ramas (u), la relación de área foliar (RAF dm2/g), la tasa de asimilación neta en la biomasa comestible (TAN, g/dm2/día), el rendimiento de masa seca de las hojas (RMSH, g/planta) y el rendimiento de masa seca de la biomasa comestible (RMSBC, g/planta) a los 240 días de establecimiento del cultivo.
En el experimento de sorgo se evaluó: la germinación (%), la altura efectiva (cm), el grosor de la base del tallo (cm), el número de hojas abiertas y el largo de las hojas (cm).
Diseño experimental. En ambos experimentos se empleó un diseño en bloques al azar, con tres repeticiones.
Análisis matemático. El procesamiento de los resultados se realizó a través del modelo lineal general ANOVA, y las medias se compararon a través de la prueba de comparación múltiple de Duncan (1955), para un nivel de significación de 0,05. El paquete estadístico empleado fue Infostat, versión libre. Las variables número de ramas, peso verde de las raicillas y peso verde de las raíces se transformaron según «x.
RESULTADOS Y DISCUSIÓN
Es conocido que tanto el biofertilizante EcoMic® (a base de HMA) como el producto bioactivo Pectimorf®, ejercen su influencia sobre las especies vegetales, fundamentalmente a través de las raíces y las raicillas. Ello les atribuye una especial importancia para la supervivencia y el desarrollo de los cultivos durante la fase de establecimiento, debido a que las plantas con raíces más desarrolladas, más finas, bien distribuidas y con mayor proporción de pelos absorbentes, atraen más elementos nutricionales. A su vez, la velocidad de absorción es mayor con el incremento de los carbohidratos en la raíz y favorece la acumulación del sustrato respiratorio, con el consiguiente aumento del suministro de energía.
La relación mutualista entre la planta y el hongo está relacionada con el suministro de carbohidratos que aquella pone a disposición del huésped. Según Yamashita (1985), la sacarosa y el almidón son los carbohidratos almacenados más metabolizables en el tallo de las plantas de la morera.
Se conoce que durante el rebrote y el enraizamiento de las estacas de morera, la cantidad acumulada de carbohidratos en los tallos leñosos decrece rápidamente en función de los nuevos órganos en desarrollo. Al respecto, Yamashita (1985) observó que los cambios de su contenido en el floema fueron muy pequeños durante los primeros dos días, y en los 12 días posteriores ocurrió una caída drástica (35 a 10 mg de sacarosa/g de peso seco y de 50 a 10 mg de almidón/g de peso seco). A partir de dicho momento el contenido de sacarosa se elevó hasta 20 mg/g de peso seco, y después del día 20 permaneció estable, lo cual justifica el intenso crecimiento radical de las estacas de morera inoculadas con HMA (tabla 1).
El número de ramas no difirió entre tratamientos (tabla 1) y los valores fueron de dos y tres ramas como promedio. Noda et al. (2004) plantearon que a partir de los 30 días de la plantación de la morera en la época de lluvias, puede apreciarse un gran número de brotes y ramas en las plantas. En el presente trabajo, la limitada emisión de ramas coincidió con las condiciones meteorológicas que caracterizaron la época de seca por la que atravesó el cultivo a partir de los 60 días de su establecimiento. No obstante, fue notable la respuesta a la biofertlización en el peso verde de las raicillas y el peso verde de las raíces (indicadores en los que las plantas inoculadas triplicaron los resultados del testigo), así como en el rendimiento de masa seca en las hojas que fue significativamente superior.
Acerca de ello se plantea que las especies vegetales con menos capacidad para absorber el fósforo y los micronutrientes del suelo, son las más dependientes de los hongos micorrízicos arbusculares. Su elevada aptitud para la micorrización se relaciona, además, con la morfología de las raíces, con la ausencia de raíces finas y de pelos radicales bien desarrollados, y con un elevado potencial de crecimiento (Riera, 2002). Padma et al. (2000), al referirse a los hongos simbióticos micorrízicos que colonizan la corteza de las raíces de la morera, destacaron su importante papel en la eficiencia de la movilización del fósforo y la disponibilidad de un grupo de micronutrientes, así como en el crecimiento y desarrollo de las plantas.
La respuesta de las raíces y las hojas a la inoculación con HMA coincidió con los resultados de Tikader y Roy (1999), quienes observaron en 10 accesiones exóticas de morera en Bengal que el enraizamiento tuvo una correlación positiva con la longitud del tallo, el número de hojas y su peso, el peso del tallo, el peso de la biomasa total, el peso de la raíz, su longitud, el volumen y el número de las raíces.
Los resultados demostraron la importancia agronómica y ecológica de la biofertilización con HMA para el establecimiento de especies forrajeras en Cuba, ya que aumentó la tolerancia de las plantas a las condiciones de estrés (tabla 2). Pulido (2002) y Medina et al. (2006) señalaron que en numerosas especies de plantas, la simbiosis hongo-hospedero favoreció la absorción de agua como resultado del incremento de la conductividad hidráulica y la recuperación más rápida de la turgencia en situaciones de estrés hídrico o sequía. Reddy et al. (1998) informaron una respuesta significativa en términos de crecimiento en plantas de morera cv. S13 micorrizadas; dicho resultado fue validado posteriormente en condiciones semiáridas de producción (Reddy et al., 2000).
Cabe señalar que M. alba es una planta de rápido establecimiento, que puede durar entre ocho y 12 meses en las condiciones de Cuba (Domínguez et al., 2001), y según FAO (1990) debe crecer libremente durante 270 días antes de comenzar su explotación intensiva. Dicha especie manifiesta alta susceptibilidad a la presencia de plantas arvenses, principalmente en la época de lluvias, por lo que se suele plantar en los meses de septiembre y octubre para su establecimiento durante la época seca. Al iniciar la nueva época de lluvias, en dependencia del estado de la plantación, se realiza el corte de establecimiento. Debe considerarse que la cantidad de fitoplasma en los órganos de las plantas está muy relacionada con el período de crecimiento. Los estudios realizados por Dai-Qun et al. (1998) demostraron que en el tallo de morera dicho indicador manifestó un incremento significativo en los meses de lluvia; sin embargo, durante el invierno seco fue casi indetectable. En las hojas esta situación se comportó de manera similar y los valores máximos se manifestaron en el mes de agosto. En las raíces fue menor la cantidad de fitoplasma y no hubo grandes cambios entre las épocas.
La producción de masa seca comestible por planta (tabla 2) permitió estimar entre 1,0 y 2,5 t de MS comestible/ha en el testigo y en la inoculación con HMA, respectivamente, lo que superó los valores reportados por Fernández et al. (2002) durante el establecimiento de cuatro variedades de morera, en un suelo Pardo grisáceo ligeramente ácido, con un acumulado de precipitaciones de 1 100 mm (12% de las lluvias en el período seco).
El efecto de la inoculación con HMA en los indicadores del rendimiento de la morera a los 240 días de establecimiento, coincide con lo informado por Setua et al. (1999) y Setua et al. (1999a) acerca de la influencia directa de la inoculación de morera con Glomus mosseae en el crecimiento en altura, el número de hojas por planta, el área foliar y el contenido de humedad foliar, con un incremento del peso seco de biomasa foliar de 27,4%. En el presente trabajo las plantas inoculadas duplicaron el rendimiento del testigo, sin diferencias significativas en el incremento de la biomasa comestible por unidad de área foliar (fig. 1), lo que explica que no hubiera variaciones importantes en el balance entre la fotosíntesis y la respiración. Tampoco existió diferencia notable en la relación del sistema asimilativo por unidad de biomasa comestible. Ello sugiere que los cambios en las características morfológicas suceden en el sistema radical, lo que determina efectos positivos en todo el organismo vegetal.
Con respecto a S. bicolor, también constituye una prioridad el empleo de las micorrizas. Su establecimiento exige del control estricto de la competencia de especies arvenses, las cuales retardan el cultivo. Por otra parte, la falta de regadío o de lluvias oportunas reduce el gradiente de potencial de agua entre el suelo y las raíces. Sin este transporte de agua que permite absorber iones, las raíces tendrían que ser mucho más extensas y más finamente divididas para obtener los nutrientes. De ahí que aumentar su capacidad competitiva, a partir de un mayor desarrollo radical y crecimiento apical, revista una significación vital.
El sorgo es un cultivo altamente exigente a condiciones agrometeorológicas específicas, para evitar el exceso o la deficiencia de agua durante el crecimiento y desarrollo de la planta. Correa (2001) planteó que la época de siembra está relacionada con la temperatura del suelo; a menor temperatura, aumentan las pérdidas. Pocas plantas son tan asertivas como el sorgo con respecto a la necesidad de espacio vital. Las raíces de este tipo de cultivo liberan toxinas al suelo que impiden el desarrollo de las plantas invasoras. Estas propiedades alelopáticas del sorgo son más fuertes que en otras plantas (Pérez et al., 2010). Sin embargo, como las plántulas son débiles y crecen muy lentamente después de la germinación, el efecto de la competencia con las malezas durante las primeras tres o cuatro semanas después de la emergencia puede ser devastador. Es el período en que debe mantenerse limpio el cultivo.
Los HMA y los compuestos activos a base de oligosacarinas, han mostrado un potencial significativo en la elevación del vigor y la supervivencia de las especies herbáceas durante las etapas tempranas del desarrollo vegetativo. Las investigaciones realizadas en arroz para
su cultivo en las zonas semiáridas, demostraron que el pretratamiento de las semillas con soluciones de Pectimorf® estimuló además los mecanismos de tolerancia a la sequía y la salinidad (Vázquez, 2008).
En Cuba el Pectimorf® se ha validado en pepino, papa, ajo, caña, arroz, tomate y cítricos, entre otros cultivos (Terrero, 2010). Por otra parte, según los estudios realizados por Veeraswamy et al. (1992) la interacción de los hongos micorrizicos y los brasinoesteroides (estos últimos son productos bioactivos), tiene un efecto significativo en la producción de sorgo.
En la figura 2 se puede observar el efecto por el empleo combinado del Pectimorf® y el EcoMic® en la germinación de las semillas, con diferencias significativas del testigo, que a los siete días no había superado el 40% de germinación, y a los 30 días solo alcanzó el 58%. En la figura 3 las imágenes contrastantes entre el testigo y el tratamiento con Pectimorf® muestran su efecto significativo en el crecimiento de la fracción aérea y subterránea de las plantas.
El tratamiento con Pectimorf® permitió duplicar la intensidad de crecimiento apical y de las raíces en los primeros 15 días (fig. 4). Aunque no hubo diferencias significativas, existió una tendencia a que el grosor de la base del tallo fuera mayor en el tratamiento con Pectimorf®.
En la tabla 3 se puede observar que la aplicación de EcoMic® y/o Pectimorf® se manifestó en una estimulación del crecimiento, lo cual fue referido por Naranjo (2005) para el caso del tabaco.
Diferentes eventos permiten explicar dichos resultados. La estimulación del crecimiento de las plantas en presencia de hongos micorrízico arbusculares no tiene que estar necesariamente asociada con la solubilización de los elementos poco móviles en el suelo o presentes a bajas concentraciones. Mecanismos como la producción de fitohormonas, vitaminas o aminoácidos pueden estar ligados a los efectos de estos microorganismos (Rivera et al., 2003; Siqueira et al., 2010). Con respecto a los polisacáridos pécticos, estos son los responsables absolutos de la cohesión intercelular en la lámina media de la pared celular (Taiz, citado por Anon, 2010).
A comienzo de los años 80, un gran número de investigaciones se dirigieron hacia un nuevo enfoque sobre la función de la pared celular de las plantas y los polímeros que la constituyen, por ser reservorio natural de un grupo de moléculas señalizadoras conocidas como oligosacarinas. Estas son oligosacáridos solubles producidos por la degradación parcial de los polímeros constituyentes de la pared celular, y son activos biológicamente a muy bajas concentraciones, lo cual caracteriza a este grupo de biomoléculas como una nueva jerarquía hormonal en el contexto de la comunicación entre las plantas y el medio ambiente (Aldington, citado por Anon, 2010). De esta forma, la pared celular pudiera actuar como una especie de seudoglándula o depósito de precursores de una clase de moléculas reguladoras que, una vez liberadas, son capaces de controlar diversas funciones relacionadas con el crecimiento, el desarrollo, la organogénesis y la defensa contra las plagas y las enfermedades (Darvill y Albersheim, citados por Anon, 2010). La pectina constituye el 0,25 y 4% de la composición de la semilla y el hollejo de uva, respectivamente, y es uno de los cuatros compuestos fibrosos reconocidos en dichos órganos (hemicelulosa, celulosa, lignina y pectina).
Las concentraciones óptimas de Pectimorf® en los medios de cultivo para obtener una respuesta biológica satisfactoria oscilan entre los 5 y 20 mg/L, rango similar al utilizado para las hormonas tradicionales. Este biorregulador tiene, como ventajas adicionales, su solubilidad en el medio acuoso que se emplea para preparar los medios de cultivo y su estabilidad para esterilizar los medios (http://www.inca.edu.cuproductospdfpectimorf.pdf).
De manera general, el significativo crecimiento del sorgo tratado con el EcoMic®, el Pectimorf® y su combinación, responde a que por una parte el Pectimorf® influye en la activación de la división celular y la elongación de las paredes celulares (Naranjo, 2005), y por otra, la simbiosis micorrízica potencia la eficiencia del suministro de nutrientes a las plantas.
Se concluye que los productos EcoMic®, Pectimorf®, y su combinación constituyen una alternativa efectiva para el establecimiento de las especies forrajeras M. alba L. y S. bicolor L.
REFERENCIAS BIBLIOGRÁFICAS
1. Anon. Aprovechamiento de subproductos agrícolas. Universidad de Cádiz. España. http://www2.uca.es/dept/quimica_organica/byprodlinea.htm. Consulta: diciembre del 2010. 2010.
2. Correa, A. El sorgo en producción animal. Gacetilla Informativa No 166. CREAS Zona Oeste. Argentina. http://www.produccion-animal.com.ar/produccion_y_manejo_pasturas /maiz_sorgo/39-sorgo_forrajero_en_produccion_animal.pdf. 2001
3. Cuesta, I. et al. Impacto de Glomus mosseae en la agroforestería. Programa y resúmenes. XV Congreso Científico. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. p. 119. 2006
4. Dai-Qun, W. et al. Relationship between the seasonal temperature variation and the amounts of phytoplasmas in mulberry trees. Scientia-Silvae-Sinicae. 34(5):74. 1998
5. Domínguez, A. et al. Comportamiento inicial de dos especies de morera en fase de establecimiento. Pastos y Forrajes. 24:203. 2001
6. FAO. Sericulture training manual. Agricultural Services Bulletin. No. 80. Rome. 117 p. 1990
7. Fernández, J. et al. Evaluación de 4 variedades de Morus alba en la producción de forraje en suelo Pardo Grisáceo de las Tunas. Memorias V Taller Internacional Silvopastoril "Los árboles y arbustos en la ganadería tropical" y I Reunión regional de morera. [cd-rom]. EEPF "Indio Hatuey". Matanzas, Cuba. 2002
8. González, P.J. et al. Efectos de las aplicaciones de vermicompost y hongos micorrizógenos arbusculares en Stylosanthes guianensis (AUBL.) SW. Programa y resúmenes. XIV Congreso Científico. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. p. 156. 2004
9. Hernández, A. et al. Nuevos aportes a la clasificación genética de suelos en el ámbito nacional e internacional. Instituto de Suelos. Ministerio de la Agricultura. AGRINFOR. La Habana, Cuba. 145 p. 2003
10. Medina, Laura R. et al. Aislamiento e identificación de especies de hongos micorrízicos arbusculares (HMA) provenientes de climas áridos y salinos. Programas y resúmenes. XV Congreso Científico. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. p. 118. 2006
11. Naranjo, O. Evaluación del Pectimorf y Biobras-16 en la variedad de tabaco Habana 92. Trabajo de Diploma. Universidad de Granma. Granma, Cuba. p. 21. 2005
12. Noda, Yolai et al. Comportamiento de nuevas variedades de Morus alba (L.) durante la fase de vivero. Pastos y Forrajes. 27:131. 2004
13. Padma, S.D. et al. Mycorrhiza association in mulberry. Bulletin of Indian-Academy of Sericulture. 4 (2):18. 2000
14. Pérez, A. et al. Caracterización y potencialidades del grano de sorgo (Sorghum bicolor L. Moench). Pastos y Forrajes. 33:3. 2010
15. Pulido, L.E. Hongos micorrízicos arbusculares y rizobacterias promotoras del crecimiento vegetal: alternativas para la producción de posturas de tomate (Lycopersicon esculentum Mill.) y cebolla (Allium cepa L.). Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. 138 p. 2002
16. Reddy, M.P. et al. Response of S13 mulberry variety to VAM inoculum under semiarid condition. Indian Journal of Plant Physiology. 3 (3):194. 1998
17. Reddy, M.P. et al. Effect of VAM inoculation and addition of phosphorus on the growth of S13 mulberry saplings. Indian Journal of Sericulture. 39 (1):12. 2000
18. Reyes, J. Respuesta de Leucaena leucocephala cv. Perú a la inoculación con rizobio en áreas ganaderas afectadas por salinidad. Resúmenes. IV Congreso Latinoamericano de Agroforestería para la producción pecuaria sostenible. III Simposio sobre los sistemas silvopastoriles para la producción ganadera sostenible. EEPF "Indio Hatuey". Matanzas, Cuba. p. 28. 2006
19. Riera, M.C. Manejo de la biofertilización con hongos micorrízicos arbusculares y rizobacterias en secuencias de cultivos sobre suelo Ferralítico Rojo. Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. Instituto Nacional de Ciencias Agricolas. La Habana, Cuba. 120 p. 2002
20. Rivera, R. et al. Manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: el Caribe. (Rivera, R. y Fernández, K., Eds.). Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. 166 p.. 2003
21. Setua G.C. et al. Effect of vesicular arbuscular mycorrhizal association on `S 1' mulberry (Morus sp.) at nursery stage. Indian J. Agr. Sci. 69 (3):201. 1999
22. Setua, G.C. et al. Response of direct inoculation of vam on growth, leaf yield and phosphorus uptake in mulberry (Morus alba). Indian J. Agr. Sci. 69 (6):444. 1999a
23. Siqueira, J.O. et al. Micorrizas: 30 anos de pesquisas no Brasil. Ed. Universidade Federal de Lavras, Brasil. 716 p. 2010
24. Terrero, J.C. Evaluación de 3 sustancias biostimulantes en el cultivo del pepino (Cucumis sativus, L.) en condiciones de organopónico. http://www.monografias.com/trabajos46/cultivo-pepino/cultivo-pepino.shtml. Consulta: diciembre del 2010. 2010
25. Tikader, A. & Roy, B.N. Correlation and path analysis studies in rooting parameters of exotic mulberry germoplasm accesions (Morus spp). Indian J. of Forestry. 22 (4):357. 1999
26. Vázquez, Adelina. Pectimorf: eficaz regulador para que las plantas crezcan más. http://www.cadenahabana.cu/noticias/científicas. [Consulta: 8 de agosto del 2008]. 2008
27. Veeraswamy, J. et al. Interaction effect of Glomus intraradices and Azospirillum lipoferum on sorghum. Indian J. Microbiol. 35:305. 1992
28. Vieito, E. et al. Efecto de la fertilización con micorrizas en la bermuda 5 (Cynodon dactylon Pers) durante la época de seca. Programa y resúmenes. XV Congreso Científico. Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. p. 122. 2006
29. Yamashita, T. Carbon, nitrogen and energy source. Requirement during shooting in mulberry plants. JARQ. 19 (1):49. 1985
Recibido el 18 de enero del 2010
Aceptado el 15 de mayo del 2011