Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.34 no.4 Matanzas sep.-dic. 2011
ARTÍCULO DE INVESTIGACIÓN
Caracterización morfoagronómica e isoenzimática de 23 accesiones de Leucaena spp.
Morphoagronomic and isoenzymatic characterization of 23 Leucaena spp. accessions
Hilda B. Wencomo¹, Alba Álvarez2, O. Coto3, Maykelis Díaz1 y R. Ortíz4
¹Estación Experimental de Pastos y Forrajes "Indio Hatuey". Central España Republicana, CP 44280, Matanzas, Cuba
E-mail: hilda.wencomo@indio.atenas.inf.cu
2Centro de Aplicaciones Tecnológicas y de Desarrollo Nuclear (CEADEN), Cuba
3Instituto de Investigaciones de Fruticultura Tropical (IIFT), Cuba
4Instituto Nacional de Ciencias Agrícolas (INCA), Cuba
Resumen
El objetivo de este trabajo fue valorar el grado de diversidad existente en 23 accesiones de Leucaena, atendiendo a los caracteres morfoagronómicos e isoenzimáticos. Se incluyeron cinco especies de este género (L. leucocephala, L. lanceolata, L. diversifolia, L. macrophylla y L. esculenta), además de los cultivares comerciales. Se evaluó: la altura de la planta, el número de ramas, el grosor del tallo, el comportamiento de los patrones fenológicos de floración y fructificación, el número de pinnas por hoja y de pínulas por pinna, entre otros. Se realizaron además los análisis electroforéticos peroxidasas (Prx),α- y ß- esterasas (Est), malato deshidrogenasa (Mdh) y alcohol deshidrogenasa (Adh). Las accesiones cumplieron con los criterios de selección predeterminados en cuanto a los caracteres morfoagronómicos, aunque no en el mismo tiempo. En este sentido, se destacaron L. leucocephala cv. Cunningham, cv. Perú, CIAT-9119, CIAT-9438, CIAT-751, CIAT-7988, CIAT-7384, CIAT-7929, CIAT-17480, cv. Ipil-Ipil y cv. CNIA-250; L. lanceolata CIAT-17255 y CIAT-17501, y L. diversifolia CIAT-17270. Se pudo detectar la existencia de variabilidad genética dentro de la colección. Los sistemas isoenzimáticos (esterasas y peroxidasas) resultaron polimórficos en la muestra estudiada, principalmente las esterasas. Por otra parte, el análisis de diversidad genética permitió diferenciar L. leucocephala con una mayor claridad respecto al resto de las especies estudiadas, aunque no se ganó en discriminación dentro de la especie.
Palabras clave: Evaluación, Leucaena spp., recursos genéticos.
Abstract
The objective of this work was to evaluate the existing diversity degree in 23 Leucaena accessions, regarding the morphoagronomic and isoenzymatic characteristics. Five species of this genus were included (L. leucocephala, L. lanceolata, L. diversifolia, L. macrophylla and L. esculenta), in addition to the commercial cultivars. The following aspects were evaluated: plant height, number of branches, stem diameter, performance of the phenological flowering and fructification patterns, number of pinnae per leaf and of pinnules per pinna, among others. Besides the electrophoretic analyses peroxidases (Prx),α- and ß- esterases (Est), malate dehydrogenase (Mdh) and alcohol dehydrogenase (Adh) were conducted. The accessions fulfilled the predetermined selection criteria regarding the morphoagronomic characteristics, although not in the same time. In this sense, L. leucocephala cv. Cunningham, cv. Peru, CIAT-9119, CIAT-9438, CIAT-751, CIAT-7988, CIAT-7384, CIAT-7929, CIAT-17480, cv. Ipil-Ipil and cv. CNIA-250; L. lanceolata CIAT-17255 and CIAT-17501, and L. diversifolia CIAT-17270, stood out. The existence of genetic variability within the collection could be detected. The isoenzymatic systems (esterases and peroxidases) turned out to be polymorphic in the studied sample, mainly esterases. On the other hand, the analysis of genetic diversity allowed differentiating L. leucocephala more clearly as compared to the other studied species, although no better discrimination was made within the species.
Key words: Evaluation, genetic resources, Leucaena spp.
INTRODUCCIÓN
El estudio de los árboles y los arbustos para su empleo en la ganadería con diferentes propósitos productivos, de forma dirigida o espontánea, no es una actividad nueva (Murgueitio, 2003). En la actualidad la reconversión social y ambiental de la ganadería es una urgencia y una prioridad para la región latinoamericana y caribeña; la agroforestería pecuaria, como sistema no agresivo al entorno, puede constituir una parte sustancial de este proceso de cambio (Funes, 2004).
Sin embargo, el fomento de estos sistemas implica la selección de especies ecológica y económicamente apropiadas para los fines que se persiguen. De ahí la necesidad de la puesta en marcha de un programa encaminado a la búsqueda, la introducción, la evaluación y la selección de estos importantes fitorrecursos, como una fase imprescindible para su futura extensión.
Se debe señalar, además, que para la introducción de nuevas especies o accesiones en los sistemas anteriormente citados, es importante la adecuada caracterización, identificación y evaluación del material mediante descriptores agromorfológicos o morfoagronómicos. No obstante, estos rasgos son alterables por factores abióticos, como el ambiente, y bióticos, como la edad del cultivo. Es ahí donde la caracterización de la diversidad genética (Acosta, 1999), mediante técnicas bioquímicas como la electroforesis (de proteínas o isoenzimas), desempeña un papel importante como complemento de la caracterización y evaluación morfoagronómica, al igual que el análisis directo de ADN (Schmidt et al., 2003), lo cual permite tener conocimientos más amplios y profundos del material evaluado.
Los principales estudios de caracterización e identificación del género Leucaena realizados en Cuba, en Leucaena leucocephala (Ruiz y Febles, 2006), se han centrado en los caracteres morfoagronómicos bajo condiciones de campo o en experimentos aislados, incluyendo solamente las cuatro variedades registradas como comerciales, pertenecientes a esta especie. Pese a ello, hasta el momento no se han realizado estudios de caracterización más detallados que incluyan los marcadores isoenzimáticos, así como un mayor número de especies de este género.
La electroforesis de isoenzimas favorece el empleo de marcadores genéticos, que generalmente son más eficientes que los morfológicos, a pesar de estar influidos por la acción ambiental y depender del tejido y estadio de desarrollo de la planta que se evalúa. Asimismo, son relativamente sencillos, poco costosos y codominantes; permiten distinguir los genotipos homocigóticos y heterocigóticos y desarrollar, por tanto, estudios de mapeo y ligamiento, de genética poblacional, entre otros (Álvarez, 2005).
Atendiendo a lo anteriormente expuesto, se desarrolló el presente trabajo con el objetivo de valorar el grado de diversidad existente en un grupo de accesiones de Leucaena, provenientes del banco de germoplasma de la EEPF "Indio Hatuey", según sus caracteres morfoagronómicos e isoenzimáticos.
MATERIALES Y MÉTODOS
El trabajo relacionado con los caracteres morfoagronómicos se desarrolló en áreas de la EEPF «Indio Hatuey» y el de las isoenzimas en el Centro de Aplicaciones Tecnológicas y Desarrollo Nuclear (CEADEN), en La Habana.
Caracterización morfoagronómica del germoplasma
Localización. El estudio se realizó en las áreas de la EEPF "Indio Hatuey", la cual se encuentra ubicada en los 22º 48' y 7'' de latitud Norte y los 79º 32' y 2'' de longitud Oeste, a una altitud de 19,9 msnm, en el municipio de Perico, provincia de Matanzas, Cuba (Academia de Ciencias de Cuba, 1989).
Características del suelo. El experimento se llevó a cabo en un suelo de topografía llana, con pendiente de 0,5 a 1,0% y clasificado por Hernández et al. (2003) como Ferralítico Rojo lixiviado, húmico nodular ferruginoso hidratado, de rápida desecación, arcilloso y profundo sobre calizas. Este tipo es equivalente al grupo de los Ferrosoles, en el sistema de clasificación de la FAO-UNESCO (Alonso, 2003). La profundidad promedio hasta la caliza es de 150 cm.
Material vegetal utilizado. De las 180 accesiones que existen en la colección de Leucaena spp. (conservada en el banco de germoplasma de la Institución) se tomaron 23 (tabla 1) como representativas de la población, las cuales fueron evaluadas anteriormente en condiciones de vivero; de cada una de ellas se evaluaron cuatro plantas.
Establecimiento. En el período experimental no se utilizó riego ni fertilización. El experimento se inició cuando las plántulas alcanzaron aproximadamente entre los 30 y 45 cm (tres meses de edad), con una apariencia saludable; se trasplantaron al campo cuatro plántulas de cada una de las accesiones, en surcos espaciados a 6 m y con una separación de 3 m entre plantas.
La altura de las plantas se midió a partir del momento del trasplante, con una regla graduada en centímetros, ubicada en posición perpendicular y siempre en contacto con el suelo. También se contó el número de ramas y se midió el grosor del tallo con un pie de rey. Todas estas mediciones se realizaron en las cuatro plantas trasplantadas y con una periodicidad mensual, hasta que se consideró que estaban establecidas en función de los criterios predeterminados.
De acuerdo con lo planteado por Seguí et al. (2002), las accesiones debían cumplir con dos o más de los criterios evaluativos considerados: altura de 1,5 a 2,0 m; número de ramas mayor que 10; grosor del tallo entre 0,5 y 0,8 cm; y rendimiento de biomasa comestible de 0,75 (o más) kg de MS/planta en un período no mayor de 14 meses.
Fase de floración y fructificación. En esta fase se observó el comportamiento de los patrones fenológicos de floración y fructificación en todas las accesiones, con una frecuencia semanal, y se consideró el 50% o más de flores y de frutos. Para ello se utilizó la simbología establecida por Machado et al. (1999).
Además, se contó el número de pinnas por hoja y de pínulas por pinna; se midió la longitud (mm) y el ancho de las pínulas (mm), la cantidad de legumbres por cabezuela, la longitud de las legumbres (mm) y el ancho (mm). Se tuvo en cuenta la forma de las pinnas, el tipo y la posición de las glándulas y el color de las flores. Estas mediciones y observaciones, en el caso de las hojas y sus componentes, se realizaron en 15 hojas por planta e igual número para el caso de las flores y los frutos (Cronquist, 1981).
La disponibilidad de biomasa se estimó mediante la simulación del ramoneo que realizan los animales (Lamela, 1998), según la altura de consumo (hasta 2 m). Para ello se aplicó la técnica del ordeño de las partes más tiernas de las plantas, las hojas y los tallos finos, hasta aproximadamente 3 mm de diámetro. El material verde se pesó y se separó de forma manual en sus diferentes fracciones el material comestible y el no comestible e inmediatamente se pesaron ambas partes y se calculó el valor de cada material por árbol. Asimismo, se determinó el rendimiento en el corte de establecimiento; para ello se extrajeron muestras de 300 g de forraje verde, a las cuales se les calculó el porcentaje de materia seca.
Detección del polimorfismo enzimático
Material vegetal y extracción enzimática. Para los análisis isoenzimáticos se emplearon rebrotes nuevos (de las hojas) de cada una de las accesiones. Las muestras se tomaron en horas tempranas de la mañana (7:00 a 9:00 a.m.), se guardaron en la nevera y posteriormente se congelaron a -70°C. Las extracciones se realizaron en frío, según lo recomendado por González (2002) y Álvarez (2005).
Preparación de las muestras y electroforesis. Se maceraron en un mortero 0,5 g de hojas en nitrógeno líquido y se les añadió 500 µL de sacarosa al 20% (Soltis y Soltis, 1989). Los extractos se guardaron en tubos Eppendorf de 0,5 µL a -4°C, hasta su posterior utilización. Las primeras corridas electroforéticas se realizaron en gel de poliacrilamida (PAGE), utilizando un gel de separación de 8,5% con tampón de corrida Tris-Glicina 0,04 M de pH 8,3, y gel concentrador de 4% en cámara de electroforesis vertical (Model V 16) y en sistemas tampón discontinuos para las isoenzimas peroxidasas, α- y ß- esterasas, malato deshidrogenasa y alcohol deshidrogenasa, según las metodologías descritas por Álvarez et al. (2000). En todas las corridas se añadieron 30 µL de cada una de las muestras y 10 µL de tampón de carga (BC).
Sobre la base de los estudios isoenzimáticos reportados para especies de este género (como Leucaena shannonii), se probó con el tampón de extracción empleado por Chamberlain et al. (1996), con el cual se observaron bandas muy tenues y aún poco definidas. Se le hicieron varios ajustes a este protocolo, hasta que se estandarizó el método de extracción de los sistemas isoenzimáticos utilizados. En este sentido, se maceraron 0,5 g del tejido foliar en nitrógeno líquido y se añadió tampón de extracción 1/1 (m/v). El extracto se centrifugó a 14 000 rpm durante tres minutos y se colectó el sobrenadante para la electroforesis. Se empleó un tampón Tris-Citrato pH 8,3 al que se añadió KCl 0,08%, MgCl2 0,2%, EDTA 0,04%, 0,5 mL de Tritón x 100 1%, 2 mL 10% DTT y 25 mg PVP-40 4%.
Las corridas se efectuaron en cámaras de electroforesis vertical (Model V 16) y geles de poliacrilamida (al 8,5% para peroxidasas y alcohol deshidrogenasas y al 12% para esterasas), a 4°C, a 120 V, 20 mA, durante cuatro horas.
Tinción. Se realizaron las tinciones específicas para peroxidasas (Prx EC. 1.11.1.7),α- y ß- esterasas (Est EC. 3.1.1-), malato deshidrogenasa (Mdh EC. 1.1.1.37) y alcohol deshidrogenasa (Adh EC. 1.1.1.1), según Álvarez et al. (2000). Las corridas electroforéticas se repitieron tres veces y sólo se registraron las bandas consistentes y reproducibles. Los fenotipos isoenzimáticos de cada accesión se registraron como presencia/ausencia de cada banda (1/0, respectivamente).
Procesamiento estadístico. Los resultados se procesaron mediante el análisis de componentes principales (ACP) (Morrison, 1967), en el cual se tomó como criterio aquellas componentes principales que presentaron valores propios superiores a uno y factores de suma o de preponderancia mayor que 0,70.
Se aplicó el análisis de conglomerados para la agrupación y selección de las accesiones, utilizando como índice de similitud la distancia euclidiana, a partir de lo obtenido en el ACP (Torres et al., 2006), y se determinaron los estadígrafos media y desviación estándar para las variables analizadas en esta etapa. De esta forma se dispuso de grupos de especies que permitieron hacer un análisis más sencillo y objetivo de su comportamiento. Todos los análisis se realizaron a través del programa estadístico SPSS® versión 11.5 para Microsoft® Windows® (Visuata, 1998).
La matriz binaria de datos isoenzimáticos se usó para generar una matriz de similitud genética entre todos los pares de genotipos, expresada como el complemento del coeficiente de Dice (Dice, 1945), usando el programa SIMQUAL del paquete estadístico NTSYS-pc versión 2 (NTSYS-pc, 1997). Se hizo un análisis de conglomerados, basado en la matriz de similitud de Dice; para ello se generó un dendrograma en el programa SHAN, del mismo paquete estadístico. El criterio de agregación utilizado fue el Método de la Media Aritmética de Grupos no Ponderada (UPGMA) (Sneath y Sokal, 1973). También se determinó la correlación cofenética (r), para hallar la homogeneidad entre la matriz de similitud y el dendrograma, y para representar la exactitud de la técnica utilizada (NTSYS-pc, 1997).
RESULTADOS Y DISCUSIÓN
Caracterización morfoagronómica
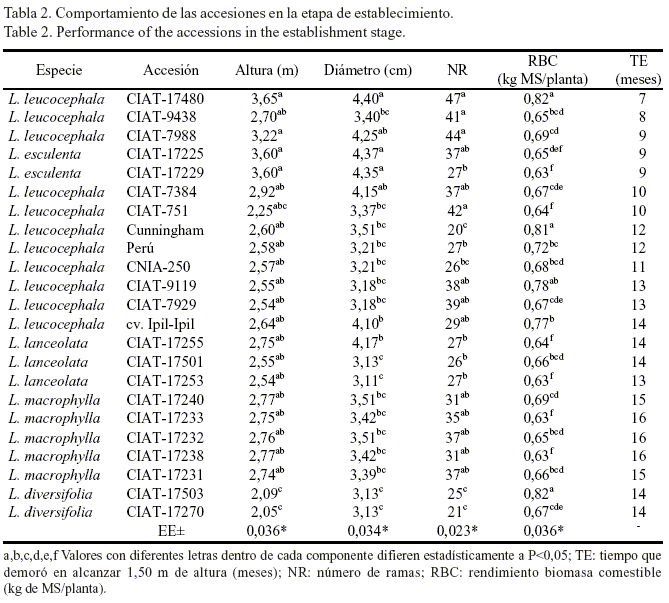
En la tabla 2 se muestra el comportamiento de las accesiones en la etapa de establecimiento, además del tiempo que demoró cada una en alcanzar 1,50 m de altura. Se comprobó que algunas accesiones podrían comenzar a explotarse antes de los 12 meses de trasplantadas, como ocurrió en L. leucocephala CIAT-17480; esta fue la primera que alcanzó la altura prefijada, con sólo siete meses de plantada, y al concluir la etapa presentó una altura de 3,65 m y un rendimiento de biomasa comestible de 0,82 kg de MS/planta.
Hubo diferencias significativas (P< 0,05) entre las accesiones en cuanto a la altura, el diámetro del tallo y el número de ramas. Se pudo constatar que las siete primeras accesiones se destacaron con respecto a las variedades comerciales L. leucocephala cv. Cunningham, cv. Perú y cv. CNIA-250 en dichos indicadores. El comportamiento de este último cultivar coincide con los resultados de Machado y Núñez (1994) y Wencomo (2008).
La altura fue similar para todas las accesiones, excepto para L. diversifolia CIAT-17503 y CIAT-17270, las cuales mostraron valores más bajos en el diámetro y el número de ramas. En la mayoría de los casos, las plantas que presentaron la mayor altura coincidieron con las de mayor número de ramas; ello indica que en estas accesiones se pudiera obtener una mayor producción o disponibilidad de biomasa, lo cual es muy importante para la producción de forraje y, por ende, para la alimentación animal. En este sentido, Dávila y Urbano (1996) informaron similares resultados en 13 cultivares de L. leucocephala, en los cuales los valores más bajos de altura coincidieron con los más bajos en diámetro, número de ramas y rendimiento promedio de materia seca.
L. leucocephala CIAT-17480 y CIAT-7988 fueron las accesiones con mayor número de ramas (47 y 44, respectivamente), seguidas de L. leucocephala CIAT-751 y CIAT-9438 (con 42 y 41 para cada una). Se encontraron más brotes en las plantas más altas y vigorosas. Las variedades comerciales L. leucocephala cv. Cunningham, cv. Perú y cv. CNIA-250, a pesar de encontrarse dentro de las accesiones que alcanzaron con mayor rapidez el establecimiento, tuvieron un comportamiento poco sobresaliente en cuanto a la altura y el número de ramas a los 14 meses (tabla 2).
Es probable que el lento crecimiento inicial en las plantas de las accesiones de este género sea de índole específica, y la accesión, pese a las diferencias existentes, no parece desempeñar un papel decisivo cuando se trata de obtener un material con un establecimiento mucho más rápido. La lentitud en la especie L. leucocephala, en sus primeros estadios, fue indicada también por Cooksley (1974) y constituye una de las limitaciones más adversas en Cuba para su establecimiento; las observaciones parecen indicar que esto sucede de forma similar en las accesiones de las otras especies de Leucaena.
Ello pudiera estar relacionado, además, con la cantidad de área foliar, la dinámica del crecimiento y la expansión foliar (Díaz, 2006), al igual que con la partición de la biomasa con cierta prioridad durante las primeras semanas hacia el sistema radical; ello se confirma con las investigaciones realizadas por Shelton (2000), quien afirmó que este órgano en los árboles tiene un alto componente de raíces permanentes estructurales, así como un sistema de raicillas que son las responsables de la asimilación del agua y los nutrientes.
El aumento que ocurre posteriormente en el crecimiento de las plantas puede que esté vinculado con una marcada producción de hojas (Stür et al., 1994) o con el arribo a niveles satisfactorios de índice de área foliar, indicador que según Díaz (2006) está muy relacionado con el crecimiento y desarrollo de las plantas. De manera general, fue evidente que la dinámica de establecimiento de las plantas en las especies de este género presentó diferencias en su comportamiento entre las accesiones; por ello, no debe ser analizada de forma estática y arbitraria, sino tomando en consideración diferentes factores tanto bióticos como abióticos.
Durante esta etapa de evaluación todas las accesiones cumplieron con los criterios de selección predeterminados, aunque no en el mismo tiempo, lo cual pudo estar asociado a las características genotípicas de la planta, a la capacidad de utilización de los nutrientes presentes en el suelo o a la eficiencia con que estos fueron utilizados por las plantas. Se destacaron las accesiones L. leucocephala cv. Cunningham, cv. Perú, CIAT-9119, CIAT-9438, CIAT-751, CIAT-7988, CIAT-7384, CIAT-7929, CIAT-17480, cv. Ipil-Ipil y cv. CNIA-250; L. lanceolata CIAT-17255 y CIAT-17501, y L. diversifolia CIAT-17270. La presencia de estas tres últimas en el mismo grupo que las de L. leucocephala puede indicar que se comportan de manera muy similar en función de los indicadores evaluados.
La fenología es un elemento interesante que se debe tener en consideración en esta etapa y en otras del desarrollo del vegetal, incluso durante su explotación, ya que puede servir como pauta en el manejo de la plantación. Por ello, la comprensión del ciclo de los eventos fenológicos (floración, fructificación y producción de hojas), el manejo, la planificación de los recursos para la colecta, la cosecha, el procesamiento de la semilla y su conservación, son necesarios e imprescindibles para la eficiente planificación de las colectas de semillas. Un análisis particular de este factor se detallará a continuación.
En las tablas 3 y 3a se observan las diferencias fenotípicas o morfológicas entre las accesiones. Todas las especies del género Leucaena poseen hojas bipinnadas y estas y las pínulas son opuestas. Las accesiones de las especies L. lanceolata y L. macrophylla presentan pinnas ovaladas o elípticas, con base débilmente asimétrica; mientras que las de las especies L. esculenta, L. diversifolia y L. leucocephala tienen pinnas lineales o lineales-oblongas con base fuertemente asimétrica. El número de pares de pinnas por hoja varía de 4 a 18 y el número de pares de pínulas por pinna de 10 hasta 50; aunque en otras especies pueden llegar a alcanzar valores superiores (Hughes, 1998).
Asimismo, las accesiones de L. leucocephala presentaban glándulas elípticas y cóncavas; mientras que las de L. lanceolata eran redondas elípticas, en forma de cúpula, excepto para la accesión CIAT-17253 en la que no se observó la presencia de estas a pesar de ser una de las características de la especie como tal. En el caso de las accesiones de L. diversifolia se encontraron glándulas discoides, poco profundas, en forma de taza y elípticas o triangulares redondas; mientras que las de L. macrophylla eran elípticas, convexas, redondas y cónicas, excepto para la accesión CIAT-17231 que tampoco presentó glándula. En las accesiones de L. esculenta estas eran planas, elípticas, grandes, poco profundas, cóncavas y en forma de taza. Según Hughes (1997), las glándulas constituyen un indicador de identificación de las especies de este género, ya que su número y disposición es muy variable.
Todas las accesiones tenían semillas ovaladas y coloración de carmelita claro a carmelita oscuro, al igual que las legumbres; presentaban flores blancas, excepto L. diversifolia CIAT-17270 que tenía flores rosadas, rojizas o morado pálido. Según Anon (2003) las flores, los frutos y las semillas son indicadores que sirven para identificar las especies de este género.
Las diferencias fenotípicas en cada una de las especies y accesiones de Leucaena fueron informadas por Hughes (1998). El conocimiento de estas diferencias es importante al utilizar las especies en el fomento de un determinado sistema (silvopastoril o no), ya que ello tiene una marcada influencia en el manejo que se les dé o en el propósito productivo para el cual sean destinadas. Por ejemplo, las diferencias en el comportamiento de los patrones fenológicos de floración y fructificación de cada una de ellas brindarían la posibilidad de poder usarlas indistintamente en la misma unidad de área: unas para la producción y cosecha de semillas y otras en función de la producción de biomasa, para estudios futuros de mejoramiento o para definir cuándo debe realizarse o no la poda.
Detección del polimorfismo isoenzimático
De los sistemas isoenzimáticos probados peroxidasas (Prx),α- y ß- esterasas (Est), malato deshidrogenasa (Mdh) y alcohol deshidrogenasa
(Adh) los primeros fueron polimórficos, a diferencia de los últimos en los cuales no se visualizaron las bandas. El análisis cualitativo de la composición electroforética de los sistemas en el tejido foliar permitió apreciar un total de 23 bandas en las 23 accesiones estudiadas.
Con respecto a las isoenzimas α- y ß- Est, se debe señalar que están constituidas por un grupo complejo de proteínas asociadas con proteínas intracelulares específicas, que muestran un total de ocho sitios polimórficos en el caso del tomate (Florido et al., 2002). El marcado polimorfismo que se presenta en este sistema ha sido informado también por otros autores al estudiar el nivel de poliploidía en clones de plátano (Román et al., 1997), en el tejido foliar de tomate (Florido et al., 2002) y en la caracterización de clones de yuca (Schmidt et al., 2003), lo que ha permitido diferenciar accesiones en estos cultivos.
De igual forma se pudo constatar que no aparecieron isoformas Adh y Mdh en el tejido foliar; este resultado se corresponde con lo planteado por Menezes et al. (1995), quienes informaron que en condiciones normales la actividad enzimática de estos sistemas desaparece en etapas muy tempranas del desarrollo de las plantas, a pesar de que puede inducirse cuando se presentan condiciones de anaerobiosis (Iglesias, 1994). No se debe descartar que esto puede deberse a problemas de concentración de las muestras, el manejo de estas o la sensibilidad de la técnica.
A partir de lo antes señalado se reafirma que no todos los sistemas tampones y procedimientos de extracción son efectivos para todas las enzimas de un tejido, ni para todas las condiciones de laboratorio. Como ejemplo se puede citar a Ramírez et al. (1987), quienes probaron 16 sistemas isoenzimáticos en cinco tipos de tejidos de yuca y sólo recomendaron α- y ß- Est para la caracterización e identificación de duplicados de la colección del mencionado cultivo. Por ello pudiera inferirse que para las accesiones estudiadas sólo pueden recomendarse los sistemas de peroxidasas y α y ß esterasas, independientemente de que debe probarse con otros que se hayan utilizado en diferentes cultivos. Al respecto, se conoce que las plantas requieren generalmente más de una isoforma de una enzima particular, de manera tal que se garantice una catálisis eficiente (Álvarez, 2005).
Asimismo, debe considerarse que las isoenzimas son de expresión génica y, por lo tanto, dependen del tipo de tejido y de su desarrollo; por ello la ausencia de bandas en los diferentes patrones isoenzimáticos no solo se debe a las necesidades de esas enzimas en los diferentes tejidos, sino también a la comigración de proteínas y a la diferencia de zonas geográficas, pues a pesar de que la mayoría no son influidas por el ambiente, según Schmidt et al. (2003), los patrones electroforéticos de unos pocos sistemas (entre los que se incluye Prx, Est, Aps, Sod y Cat) pueden ser modificados por factores bióticos y abióticos, de manera tal que en esas condiciones se altere el funcionamiento de los genes que codifican para esas enzimas. De igual forma, debe señalarse que las isoenzimas también pueden variar según las especies que se evalúen, la edad, el manejo, el clima, la presencia o no de enfermedades y la posición del órgano que se muestrea, entre otros.
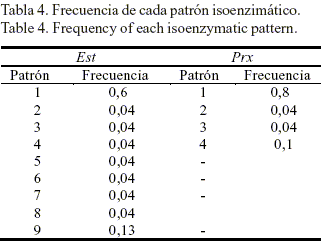
En la tabla 4 se muestra la frecuencia de cada patrón en las 23 accesiones. El nivel de polimorfismo isoenzimático detectado en la muestra pudiera considerarse medio, ya que la mayoría de los patrones presentaron frecuencias muy altas (60 y 80% de la muestra con un mismo patrón para Est y Prx, respectivamente) y muy pocas accesiones mostraron patrones únicos (siete para Est y dos para Prx).
Se comprobó la existencia de una alta resolución electroforética para dichos sistemas (tabla 5), lo que indica que son de utilidad en la evaluación del polimorfismo varietal en este material; se demostró que las enzimas peroxidasas y esterasas son las más recomendadas, por su polimorfismo, como refirieron Schmidt et al. (2003).
Resultados similares fueron obtenidos al realizarse el análisis integral de la variabilidad enzimática en L. leucocephala (Harris et al., 1994a) y en L. shannonii (Chamberlain et al., 1996), al igual que en mutantes de arroz de la variedad J-112 (Díaz et al., 2001), donde se detectó la existencia de algunos sitios de actividad enzimática polimórfica (González, 1996). En general, las isoenzimas peroxidasas y esterasas se encuentran entre los sistemas más polimórficos en las plantas (Fuentes, 2003).
Atendiendo a los resultados del análisis isoenzimático, los sistemas α- y ß- esterasas resultaron ser los de mayor polimorfismo en cuanto al número de bandas polimórficas que permitieron detectar, el número de patrones electroforéticos y su frecuencia en la muestra; ello se corresponde con lo reportado acerca del alto polimorfismo de este sistema para otras especies vegetales (Schmidt et al., 2003).
A partir de la frecuencia de aparición de las bandas de los sistemas isoenzimáticos, mediante el programa SHAN, se obtuvo el dendrograma
(fig. 1), en el que se muestra el agrupamiento de las accesiones en tres grupos (I, II y III). El grupo I estuvo formado por dos subgrupos (IA y IB). El subgrupo IA incluyó todas las accesiones de L. leucocephala, dos accesiones de L. lanceolata (CIAT-17255 y CIAT-17501) y una de L. diversifolia (CIAT-17270); mientras que el subgrupo IB resultó heterogéneo, se incluyeron L. macrophylla (tres accesiones), L. esculenta, L. lanceolata y L. diversifolia, representadas estas últimas por una accesión. En el grupo II se incluyó L. macrophylla CIAT-17232 y en el grupo III L. macrophylla CIAT-17238 y L. esculenta CIAT-17225.
En el grupo I se encuentran las accesiones que tuvieron un comportamiento morfoagronómico destacado en cuanto a los indicadores, a las que se unen las variedades comerciales actualmente utilizadas en los sistemas silvopastoriles, todas ellas con un potencial productivo aceptable. Se debe destacar que dentro de este grupo las afinidades genéticas fueron mayores. El resto de las accesiones tuvieron un comportamiento diferente en su fenotipo, con respecto a las del grupo I.
Los grupos varietales se formaron a valores bajos de distancia genética, considerando un nivel de truncadura de 0,35, lo que sugiere un alto nivel de similitud genética para los sistemas enzimáticos probados. Ello era de esperar, dado que se trata de marcadores isoenzimáticos que corresponden a regiones codificantes y altamente conservadas en el genoma. A pesar de que la muestra incluyó variedades de cinco especies diferentes de Leucaena, no se pudo apreciar una correspondencia completa entre los grupos y las principales especies analizadas, con la excepción de L. leucocephala (subgrupo IA).
Es válido señalar que el hecho de poder diferenciar la especie L. leucocephala de las demás, aunque no se lograra la diferenciación entre sus accesiones, constituye un valioso aporte a este tipo de estudio y al futuro del mejoramiento genético de las especies de este género. En el caso de las demás especies se observó similitud genética; sin embargo, ello también significó un paso de avance en el estudio genético y en la caracterización, aspecto que debe estar relacionado estrechamente con que L. leucocephala ha sido objeto de diversos programas de mejoramiento con respecto a las demás y de las cuales se tiene poca información en este sentido, ya que según reportes de Chamberlain et al. (1996) solo se tienen en cuenta como progenitores en los programas anteriormente mencionados.
Estos resultados evidencian la base relativamente estrecha de variación isoenzimática existente en el material evaluado y se corresponden, en general, con lo planteado por Harris et al. (1994a) y Chamberlain et al. (1996), quienes informaron acerca de la gran homogeneidad isoenzimática presente en el género Leucaena; ello se corrobora con las investigaciones efectuadas por Harris et al. (1994b), que revelaron la presencia de un bajo nivel de polimorfismo incluso al utilizar técnicas moleculares, como el polimorfismo de la longitud de los fragmentos de restricción (RFLP).
A través de este estudio se pudo descartar la posibilidad de que existieran genotipos duplicados, lo cual hubiese sido imposible determinarlo a través de la caracterización y evaluación morfológica. En este sentido sería útil aumentar el número de sistemas isoenzimáticos en el análisis, con vistas a lograr mayor cobertura del genoma, entre ellos: aspartato aminotransferasa (AAT), fosfoglucosa isomerasa (PGI), isocitrato deshidrogenasa (IDH), fosfoglucomutasa (PGM) y shikimato deshidrogenasa (SDH); estos han mostrado polimorfismo en los estudios de diversidad genética realizados en otras especies de Leucaena (Harris et al., 1994b; Chamberlain et al., 1996) y en cultivos tales como el tomate, el arroz, el plátano y la yuca (Florido et al., 2002; Fuentes, 2003; Schmidt et al., 2003).
De acuerdo con los resultados se concluye que los indicadores morfoagronómicos evaluados explicaron la variabilidad en cuanto al comportamiento en el establecimiento. Leucaena spp. mostró su capacidad de floración y fructificación, con diferencias entre los individuos estudiados. En este sentido se destacaron las accesiones L. leucocephala cv. Cunningham, cv. Perú, CIAT-9119, CIAT-9438, CIAT-751, CIAT-7988, CIAT-7384, CIAT-7929, CIAT-17480, cv. Ipil-Ipil y cv. CNIA-250; L. lanceolata CIAT-17255 y CIAT-17501, y L. diversifolia CIAT-17270. Se estandarizaron los sistemas isoenzimáticos α- y ß-esterasas y peroxidasas en la determinación del polimorfismo isoenzimático de estas especies. El análisis de los patrones isoenzimáticos α- y ß- estera-sas y peroxidasas permitió diferenciar a L. leucocephala con mayor claridad que el resto, aunque no se ganó en diferenciación dentro de la especie y las esterasas fueron las más polimórficas. Se comprobó que no existían genotipos duplicados en la colección de Leucaena; se detectó homogeneidad genética a nivel isoenzimático en las accesiones y afinidad genética entre ellas.
Por ello, se recomienda combinar los análisis morfoagronómicos y genético-bioquímicos para la caracterización de los bancos de germoplasma, además de continuar con la búsqueda de nuevas formas polimórficas del cultivo, incorporando, en lo posible, técnicas que detecten un mayor polimorfismo, que permitan revelar la variación existente a nivel de ADN y contar con la variabilidad genética suficiente para explotar en Leucaena. Se sugiere incluir un mayor número de accesiones de las especies poco representadas en este trabajo (L. lanceolata, L. diversifolia, L. macrophylla y L. esculenta).
REFERENCIAS BIBLIOGRÁFICAS
1. Academia de Ciencias de Cuba. Nuevo Atlas Nacional de Cuba. Instituto Cubano de Geodesia y Cartografía. La Habana, Cuba. p. 41. 1989
2. Acosta, R. Caracterización citogenética, morfoagronómica y genético-bioquímica de diez clones de plátano burro (Musa spp., Grupo ABB). Tesis de Grado. Facultad de Biología. Universidad de La Habana, Cuba. 65 p. 1999
3. Alonso, J. Factores que intervienen en la producción de biomasa de un sistema silvopastoril leucaena (Leucaena leucocephala cv. Perú) y guinea (Panicum maximum cv. Likoni). Tesis presentada en opción al grado de Doctor en Ciencias Agrícolas. La Habana, Cuba. 109 p. 2003
4. Álvarez, A. Análisis de la diversidad genética de variedades tradicionales de arroz (Oryza sativa l.) basado en marcadores morfoagronómicos y moleculares. Tesis en opción al Título de Máster en Biología vegetal. Mención Biología vegetal. La Habana, Cuba. 95 p. 2005
5. Álvarez, A. et al. Genetic diversity analysis in rice mutants using isozyme and morphological markers. Cultivos Tropicales. 21 (4): 39. 2000
6. Anon. Leucaena leucocephala (Lam) de Wit. http://www.rockfound.org.mx/pumilabies.html/2002 [Consulta: noviembre 2008]. 2003
7. Chamberlain, J.R. et al. Patterns of isozyme variation in the Leucaena shannonii Alliance (Leguminosae: Mimosoidae). Silvae Genetica. 45:1. 1996
8. Cooksley, D.G. A study of preplanting herbicide, nitrogen, burning and post-emergence cultivation on the establishment of Leucaena leucocephala. Qd. J. Agric. Anim. Sci. 31:271. 1974
9. Cronquist, A. An Integrated system of clasification of flowering plants. Colombia University Press, New York. 1262 p. 1981
10. Dávila, C. & Urbano, D. Leguminosas arbóreas en la zona sur del Lago de Maracaibo. En: Leguminosas forrajeras arbóreas en la agricultura tropical. (Ed. T. Clavero). Centro de Transferencia de Tecnología en Pastos y Forrajes. Universidad del Zulia, Venezuela. p. 101. 1996
11. Díaz, M. Fotosíntesis. En: Compendio de Conferencias del Programa de la Maestría en Pastos y Forrajes. Curso: Fundamentos de la Producción de Pastos. EEPF "Indio Hatuey". Matanzas, Cuba. 13 p. 2006
12. Díaz, S. et al. Caracterización bioquímica de accesiones de arroz (Oryza sativa L.). Cultivos Tropicales. 22: 47. 2001
13. Dice, L.R. Measures of the amount of ecologic association between species. Ecology. 26: 297. 1945
14. Florido, M. et al. Caracterización morfoagronómica y bioquímica de 20 accesiones de tomate (Lycopersicon spp.). Cultivos Tropicales. 23: 61. 2002
15. Fuentes, J.L. Diversidad genética y utilización comercial de variedades de arroz en Cuba. Tesis en opción al grado de Doctor en Ciencias Agrícolas. Instituto Nacional de Ciencia Agrícolas. La Habana, Cuba. 140 p. 2003
16. Funes, F. Sistemas ganaderos agroecológicos. Experiencias del Instituto de Investigaciones de Pastos y Forrajes y su red de estaciones experimentales. Simposio Internacional sobre Ganadería agroecológica. La Habana, Cuba. p. 1. 2004
17. González, C. Detección del polimorfismo genético mediante marcadores bioquímicos en plantas. En: Marcadores moleculares. Nuevos horizontes en la genética y la selección de las plantas. (Eds. M.T. Cornide et al.). Editorial Félix Varela, La Habana, Cuba. p. 36. 2002
18. González, L.M. Uso de la radioinducción de mutaciones en la obtención de genotipos de arroz tolerantes a la salinidad. Tesis en opción al grado de Doctor en Ciencias Agrícolas. Instituto "Jorge Dimitrov". Granma, Cuba. 92 p. 1996
19. Harris S.A. et al.. Genetic variation in Leucaena leucocephala (Lam.) de Wit. (Leguminosae: Mimosoidae). Silvae Genetica. 43:2. 1994a
20. Harris, S.A. et al. A phylogenetic analysis of Leucaena (Leguminosae:Mimosoideae). Pl. Sys. Evol. 191:1. 1994b
21. Hernández, A. et al. Nuevos aportes a la clasificación genética de suelos en el ámbito nacional e internacional. Instituto de Suelos. Ministerio de la Agricultura. AGRINFOR. La Habana, Cuba. 145 p. 2003
22. Hughes, C.E. Species delimitation and new taxa and combinations in Leucaena (Leguminosae). Contributions University Michigan Herbarium. 21: 277. 1997
23. Hughes, C.E. Leucaena. Manual de recursos genéticos No. 37. Oxford Forestry Institute. Department of Plant Sciences. University of Oxford. p. 91. 1998
24. Iglesias, L. Utilización de marcadores bioquímicos y moleculares en el mejoramiento genético de la papa. Cultivos Tropicales. 15:108. 1994
25. Lamela, L. Métodos de muestreo y mediciones en sistemas silvopastoriles. En: Compendio de conferencias para el Diplomado en Silvopastoreo. EEPF «Indio Hatuey», Matanzas, Cuba. 1998
26. Machado, R. et al. Caracterización de variedades de Leucaena leucocephala para la producción de forrajes. I. Establecimiento. Pastos y Forrajes. 17:13. 1994
27. Machado, R. et al. Metodología para la colecta, conservación y caracterización de especies herbáceas, arbóreas y arbustivas útiles para la ganadería. Pastos y Forrajes. 22:181. 1999
28. Morrison, D. Multivariate statistical methods. Mc Graw-Hill Book Company. New York, USA. 150 p. 1967
29. Murgueitio, E. Investigación participativa en sistemas silvopastoriles integrados: La experiencia de CIPAV en Colombia. En: Taller Internacional "Ganadería, desarrollo sostenible y medio ambiente". La Habana, Cuba. 207 p. 2003
30. NTSYS-pc. Numerical taxonomy and multivariate analysis system, version 2.0. Exeter Software, Setauket, New York. 1997
31. Ramírez, H. et al. Isozymes electrophoregrams of sixteen enzymes in five tissue of cassava (Manihot esculenta Crantz) varieties. Euphytica. 36: 39. 1987
32. Román, M.J. et al. Caracterización isoenzimática de 17 clones diploides de plátano fruta Musa spp. Biología. 11:61. 1997
33. Ruiz, T.E. & Febles, G. Agrotecnia para el fomento de sistemas con leguminosas. En: Recursos forrajeros herbáceos y arbóreos. (Ed. Milagros Milera). EEPF "Indio Hatuey", Matanzas, Cuba-Universidad de San Carlos de Guatemala, Guatemala. p. 103. 2006
34. Schmidt, A. et al. Caracterización de clones de yuca (Manihot esculenta) mediante marcadores proteicos e isoenzimáticos. Interciencia. 28:690. 2003
35. Seguí, E. et al. Informe final del proyecto «Caracterización botánica y morfoagronómica de una colección de Leucaena spp. y selección de las mejores accesiones para los sistemas agroforestales». PNCT "Mejoramiento vegetal y recursos fitogenéticos". CITMA, La Habana/EEPF «Indio Hatuey», Matanzas, Cuba. 50 p. (Mimeo). 2002
36. Shelton, H.M. Potential and limitation of Leucaena spp. for Silvopastoril System. En: Simposio Internacional: Sistemas Agroforestais Pecuarios na America de Sul (cd rom), Brasil. 2000
37. Sneath, P. & Sokal, R. Numerical Taxonomy. Freeman. San Francisco, EE.UU. 73 p. 1973
38. Soltis, D.E. & Soltis, P. Isozymes in plant biology. Department of Botany, Washington State University, Pullman, Washington. 45 p. 1989
39. Stür, W.W. et al. Desfoliation and management of forage tree legumes. In: Tree legumes in tropical agriculture (Eds. R.C. Gutteridge and H.M. Shelton). CAB International. Wallingford, UK. p. 144. 1994
40. Torres, V. et al. Modelo estadístico para la medición del impacto de la innovación o transferencia tecnológica en la rama agropecuaria. Informe técnico. Instituto de Ciencia Animal. La Habana, Cuba. 2006
41. Visuata, B. Análisis estadístico con SPSS para Windows. Vol. II. Estadística multivariante (Ed. C. Fernández). Madrid, España. p. 24. 1998
42. Wencomo, H.B. Evaluación morfoagronómica e isoenzimática y selección de accesiones de Leucaena spp. con fines silvopastoriles. Tesis presentada en opción al grado de Doctor en Ciencias Agrícolas. La Habana, Cuba. 191 p. 2008
Recibido el 14 de noviembre del 2011
Aceptado el 1 de diciembre del 2011