Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.35 no.2 Matanzas abr.-jun. 2012
ARTÍCULO DE INVESTIGACIÓN
Caracterización cultural y morfológica e identificación de diez aislamientos de Fusarium procedentes de semillas de Leucaena leucocephala cv. Perú almacenadas Cultural and morphological characterization and identification of ten Fusarium isolates from stored Leucaena leucocephala cv. Peru seeds
J. C. Lezcano¹, B. Martínez² y O. Alonso¹
¹Estación Experimental de Pastos y Forrajes "Indio Hatuey". Central España Republicana, CP 44280, Matanzas, Cuba
E-mail: juan.lezcano@indio.atenas.inf.cu
²Centro Nacional de Sanidad Agropecuaria, Mayabeque, Cuba
RESUMEN
El objetivo de este trabajo fue caracterizar cultural y morfológicamente diez aislamientos de Fusarium, obtenidos de semillas de L. leucocephala cv. Perú almacenadas, con vistas a su clasificación taxonómica. Sus cultivos puros se conservaron en tubos Eppendorf con medio Agar Papa y Dextrosa (APD), en cámara fría a 10°C. La siembra de cada aislamiento se realizó en tres placas Petri, esterilizadas, de 9 cm de diámetro; estas contenían, separadamente, los medios APD y Agar Papa Sacarosa (APS), que constituyeron las réplicas; se colocó en su centro un disco micelial de 7 mm de diámetro, procedente de cultivos con 10-15 días de edad, sembrados también en dichos medios. Posteriormente, las placas se sellaron con papel parafinado y se incubaron durante diez días a 25°C, con alternancia de 8 h de luz/16 h de oscuridad, o a oscuridad constante. Las variables culturales medidas fueron: el color de la colonia en el anverso y el reverso, la textura y el crecimiento lineal y aéreo; y como morfológicas se evaluaron: el tamaño, la forma y el color de las estructuras vegetativas y reproductivas que aparecieron en los cultivos. Se utilizó un diseño completamente aleatorizado y los datos se procesaron estadísticamente a través de un análisis descriptivo. Para la identificación de los hongos se utilizaron diferentes claves taxonómicas. Los aislamientos 10, 18 y 29 se correspondieron con las características descritas en la literatura científica para la especie Fusarium oxysporum Schlecht; el 17, el 28 y el 30, con Fusarium sambucinum Fuckel; el 27, con Fusarium semitectum Berk & Rav.; el 25 y el 26, con Fusarium incarnatum (Rob) Sacc, y el 31, con Fusarium chlamydosporum Wollenw & Reinking, lo que permitió la identificación de cinco especies de Fusarium asociadas a las simientes almacenadas.
Palabras clave: Fusarium, identificación, Leucaena leucocephala cv. Perú, semillas.
ABSTRACT
The objective of this work was to characterize cultural and morphologically ten Fusarium isolates, obtained from stored Leucaena leucocephala cv. Peru seeds, aiming at their taxonomic classification. Their pure cultures were preserved in Eppendorf tubes with Potato Dextrose Agar (PDA) medium, in cold chamber at 10ºC. Each isolate was planted in three sterilized Petri dishes, of 9 cm diameter; they contained, separately, the PDA and Potato Sucrose Agar (PSA) media, which constituted the replicates; at their center a mycelial disk was placed, of 7 mm diameter, from 10-15-day-old cultures, also planted in such media. Afterwards, the dishes were sealed with wax paper and incubated for ten days at 25ºC, alternating 8 h of light/16 h of darkness, or in constant darkness. The measured cultural variables were: colony color on the obverse and reverse, texture and lineal and aerial growth; and the morphological variables were: size, shape and color of the vegetative and reproductive structures which appeared in the cultures. A completely randomized design was used, and the data were statistically processed through a descriptive analysis. For the fungi identification different taxonomic keys were used. Isolates 10, 18 and 29 were in correspondence with the characteristics described in scientific literature for the species Fusarium oxysporum Schlecht; 17, 28 and 30, to Fusarium sambucinum Fuckel; 27, to Fusarium semitectum Berk & Rav.; 25 and 26, to Fusarium incarnatum (Rob) Sacc, and 31, to Fusarium chlamydosporum Wollenw & Reinking, which allowed the identification of five Fusarium species associated to the stored seeds.
Key words: Fusarium, identification, Leucaena leucocephala cv. Peru, seeds.
INTRODUCCIÓN
Uno de los géneros fungosos más investigados por la comunidad científica internacional lo constituye Fusarium Link, el cual agrupa numerosas especies de trascendental importancia para la agricultura, la economía y la salud de los animales y el hombre, debido a su acción devastadora.
No obstante, desde el punto de vista benéfico, existen algunas cepas antagonistas (por ejemplo, de la especie Fusarium oxysporum Schlecht), que se han utilizado como agentes de control biológico (Arbeláez, 2000) y micoherbicidas (Magani et al., 2011). Un número mayor de especies se reconoce como toxicogénicas y fitopatógenas, y al informarlas se relacionan con diversas enfermedades en diferentes cultivos, tales como: la marchitez de las plantas, las manchas y los añublos foliares; el aborto de las flores y la pudrición de las raíces, los tallos, los frutos y los granos (López et al., 2004; Formiga y Paz, 2009; Pérez et al., 2009; Ocom et al., 2011).
En la leguminosa arbórea Leucaena leucocephala importante arbustiva multipro-pósito para la ganadería en Cuba y sus cultivares también se han observado los efectos devastadores de estos agentes, principalmente asociados a la pudrición de sus simientes o la disminución de su poder germinativo (hasta un 50%), al retardo del desarrollo y la supervivencia de las plántulas emergidas en condiciones de campo, o a su pudrición (Moreno et al., 1988; Delgado et al., 1989; Pupo y Heredia, 1998; Lezcano et al., 2007; Borges y Urdaneta, 2010). De ahí que el objetivo de este trabajo fuera conocer qué especies del género Fusarium estaban asociadas a las semillas de leucaena almacenadas, cuya identificación se realizó a través de su caracterización cultural y morfológica.
MATERIALES Y MÉTODOS
Localización. Las investigaciones se desarrollaron en el laboratorio de micología vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA), en Mayabeque, y el de protección de plantas de la Estación Experimental "Indio Hatuey", en Matanzas, Cuba.
Material vegetal. Los aislamientos se hicieron de semillas de L. leucocephala cv. Perú con seis y 18 meses de almacenamiento al ambiente, procedentes del almacén de la finca de semillas "La Rioja", que pertenece a la Empresa Pecuaria "José Martí" en la provincia de Matanzas, Cuba.
Prueba de patología. Se aplicó a las semillas el test de cámara húmeda (ISTA, 1999).
Aislamientos de Fusarium. Se utilizaron diez aislamientos puros de Fusarium (No. 10, No. 17, No. 18, No. 25, No. 26, No. 27, No. 28, No. 29, No. 30 y No. 31), conservados en tubos Eppendorf con medio Agar Papa y Dextrosa (APD).
Siembra de los aislamientos. La siembra se realizó en tres placas Petri de cristal, esterilizadas, de 9 cm de diámetro, que constituyeron las réplicas, las cuales contenían los medios de cultivos APD y Agar Papa Sacarosa (APS); para ello se colocó en su centro un disco micelial de 7 mm de diámetro, procedente de cultivos con 10-15 días de edad, sembrados también en dichos medios. Posteriormente, las placas se sellaron con papel parafinado (parafilm) y se incubaron durante 10 días a 25°C, con alternancia de 8 h de luz/16 h de oscuridad, o a oscuridad constante, según lo requerido para cada aislamiento.
Caracterización cultural. Los caracteres cualitativos y cuantitativos evaluados fueron: color de la colonia en el anverso y el reverso (mediante la tabla de colores de Rayner, 1970), textura, pigmentación del medio (por apreciación visual del pigmento producido y su intensidad), crecimiento lineal (diámetro de la colonia expresado en centímetros por día, obtenido en dos mediciones diarias a las 8:00 a.m. y a las 4:00 p.m. hasta el décimo día) y crecimiento aéreo.
Caracterización morfológica. Se tuvo en cuenta: la presencia o ausencia de los macroconidios y los microconidios, las clamidosporas y los esporodoquios; así como la forma y el tamaño de los dos primeros, el tamaño y la posición de las segundas, y la coloración de los terceros.
A cada una de estas estructuras, presentes en las preparaciones microscópicas, se les hicieron 50 mediciones, para lo cual se usó una escala micrométrica acoplada a un microscopio óptico Zeiss Estandar 25 (con lentes oculares 10-100 x), con el objetivo de corroborar la clasificación de la especie de Fusarium. Diseño experimental y análisis estadístico. Se empleó un diseño completamente aleatorizado y los datos se procesaron estadísticamente a partir de un análisis descriptivo. Clave taxonómica. Para la identificación de las especies de Fusarium se utilizaron las claves propuestas por Booth (1969), Booth (1977), Singh et al. (1991) y López (2003). También se consideraron algunos criterios relacionados con la taxonomía del género Fusarium, expuestos por Gerlach y Nirenberg (1982), Nelson et al. (1983) y López et al. (1999).
RESULTADOS Y DISCUSIÓN
En cuanto a la caracterización cultural de los aislamientos No. 10, No. 18 y N o. 29, se observaron colonias de crecimiento rápido (con 64 mm como promedio al séptimo día de incubación), cuando se cultivaron en APD a 25°C. Además, presentaron un micelio aéreo abundante y algodonoso, a veces afelpado, de color blanquecino, con tonalidades rosa violáceo y púrpura, fundamentalmente en el centro de la colonia (fig. 1a); y una pigmentación variable, con predominio de los colores rosa violáceo y púrpura en el anverso de la placa, y azul grisáceo-verdoso en el reverso de esta.
Desde el punto de vista morfológico, los aislamientos se caracterizaron por presentar conidióforos que surgieron lateralmente de las hifas en el micelio aéreo, simples y ramificados; esporodoquios ausentes,células conidiógenas monolocales y subcilíndricas; macroconidios hialinos, de semicurvos o casi rectos (falcados) a curvados, puntiagudos en sus extremos, con tres a cinco septos de 26,10-36,74 x 3,0-4,54 µm (fig. 1b) y célula basal en forma de pie; microconidios (fig. 1c) hialinos formados en falsas cabezas y abundantes, de forma oval a elíptica, con uno o dos septos de 3,58-4,06 x 2,06-3,02 µm; y clamidosporas de 6,6-10,19 µm de tamaño, abundantes, esféricas (globosas), subglobosas, de paredes lisas, terminales o intercalares y dispuestas individualmente o en pares a lo largo de la hifa.
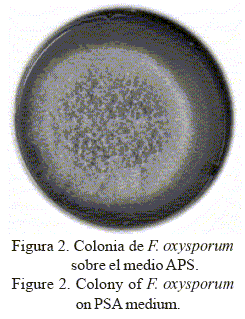
En APS a 25°C, dichos aislamientos mostraron colonias blanquecinas con tonalidades violetas (fig. 2), de crecimiento abundante (superior a 40 y 60 mm al cuarto y séptimo día de incubación); pigmentación variable, con predominio de los colores crema blancuzco con alguna tonalidad violeta vinácea en el anverso de la placa y azul violáceo a pálido por su reverso; células conidiógenas monolocales, subcilíndricas; microconidios ovales, elipsoidales, rectos y curvados, formados en falsas cabezas de 4-10 x 2,5-3,5 µm, producidos en fialides laterales simples y cortas; macroconidios falciformes, generalmente de tres a cinco septos, de 26,5 a 58,3 x 2,8-4,1 µm, atenuados hacia ambos extremos con la célula apical aguda y ligeramente encorvada y la célula basal en forma de pie; y clamidosporas abundantes formadas en hifas, globosas, simples o en pares, intercalares o terminales.
Resultados similares fueron informados por Booth (1969), Booth (1977), Nelson et al. (1983), Singh et al. (1991), López et al. (1999), López (2003), Dueñas et al. (2007) y Pierobom y Del Ponte (2011), los cuales coinciden con las características del hongo Fusarium oxysporum Schlecht, cuya fase teleomorfa no se conoce.
Los aislamientos No. 17, No. 28 y No. 30 se caracterizaron culturalmente por presentar colonias de crecimiento rápido (de 60-78 mm de diámetro como promedio a los 10 días de incubación, a 25°C sobre APD); micelio aéreo abundante, algodonoso, de color blanquecino y salmón; pigmentación variable, con predominio del color salmón por el anverso de la placa, lo cual corrobora lo planteado por López (2003). Los resultados en cuanto a la ausencia de esporodoquios coinciden con los hallados por este autor, a pesar de que los estudios morfológicos no se hicieron en el mismo medio de cultivo (Agar agua hojas de clavel). Los conidióforos también se observaron sobre las hifas en el micelio aéreo, inicialmente eran simples y después ramificados; además, coincidió la presencia de células conidiógenas monolocales, aunque escasamente presentes en los cultivos estudiados. Otros resultados similares fueron: los macroconidios se observaron falciformes, con tres a cinco septos de 9,5-50 x 2,6-7 µm, con la célula apical abruptamente inclinada y aguda y la célula basal pedicelada; los microconidios ausentes y las clamidosporas simples o dispuestas en grupos, terminales, globosas a subglobosas de 4,5-10,7 µm, y de paredes lisas.
En el medio APS se obtuvieron colonias de crecimiento rápido (de 55 µm al séptimo día de la incubación a 25°C), cuya coloración varió de melocotón a naranja. Por otra parte, se observó un micelio aéreo abundante y algodonoso; los macroconidios se produjeron solamente en la parte dorso ventral, con célula apical puntiaguda, de tres a cinco septos, 30-50 x 3,8-5,1 µm (fig. 3); los microconidios ausentes y las clamidosporas globosas de 5,7-10,3 µm de diámetro, de paredes lisas, simples o algunas dispuestas en cadenas. Estas características coinciden con las citadas por Booth (1977) y Pierobom y Del Ponte (2011) para la especie Fusarium sambucinum Fuckel (fase teleomorfa: Gibberella pulicaris (Fr.) Sacc).

Con respecto al aislamiento No. 27 en APD, las colonias presentaron un crecimiento rápido cuando se incubaron durante10 días a 25°C (de 90 mm de diámetro como promedio). Al mismo tiempo se pudo apreciar la presencia de micelios aéreos abundantes, algodonosos, de coloración variable, de blanquecina con tonalidades coral claro a pardo naranja claro; macroconidios fusiformes, formados sobre el micelio aéreo en los conidióforos ramificados, con tres (de 12-38 x 2,3-4,6 µm) a cinco septos (20-37 x 3,2-4,01 µm) y con célula basal en forma de cuña y apical puntiaguda (fig. 4) y clamidosporas pardas, globosas, intercalares, dispuestas en solitario o en cadena, de 8 a 13 µm. De igual forma se observó la ausencia de microconidios, lo que coincide con lo señalado por Booth (1977), López et al. (1999) y Pierobom y Del Ponte (2011) para la especie Fusarium semitectum Berk. & Rav (sinonimia: F. pallidoroseum) (estado teleomorfo: no se conoce).

En los aislamientos No. 25 y No. 26 se observaron colonias de crecimiento rápido (de 56-77 mm de diámetro como promedio) sobre APD al séptimo día de incubación a 25°C. Los micelios aéreos se caracterizaron por su relativa abundancia y apariencia algodonosa, de color blanquecino en los cultivos jóvenes, y ocre y miel en los de mayor edad. La pigmentación del medio presentó una coloración naranja claro a salmón y se tornó algo pardusca finalmente (con un tono café). López y López (2004) obtuvieron un resultado similar con el empleo de los medios de cultivos Agar Papa Sacarosa No. 1 y No. 3, donde también apreciaron esta misma coloración naranja salmón cerca del centro de la colonia, seguida de un tono café más intenso.
En cuanto a los caracteres morfológicos que más distinguieron estos aislamientos, se destacaron: la ausencia de esporodoquios y microconidios, y que los conidióforos que surgieron lateralmente de las hifas en el micelio aéreo, al principio se presentaron simples y más tarde ramificados. Los macroconidios se caracterizaron por ser lanceolados, con tres a cinco septos generalmente, de 6,7-48 x 1,9-5,6 µm, atenuados hacia ambos extremos, con una célula apical recta y muy atenuada, y una basal ligeramente papilada; las clamidosporas estaban esparcidas, aunque generalmente se encontraron intercaladas entre las hifas, solitarias y en pares, de globosas a subglobosas, con una pared lisa y un tamaño que osciló desde 5,5 hasta 9,5 µm. De manera general, estos caracteres corroboran, en gran medida, los informados por López (2003) para la especie Fusarium incarnatum (Rob.) Sacc. (estado teleomorfo: no se conoce).
Las colonias del aislamiento No. 31 sobre APS fueron de textura flocosa y presentaron una coloración blanca inicialmente, la cual se tornó de color rojo intenso en cultivos envejecidos. En el anverso de la placa se pudo observar una pigmentación de color amarillo cremoso, y en el reverso esta fue rojo brillante, rojo vino o rojo carne, lo cual coincide con lo citado por Sing et al. (1991). Por otra parte, en APD se observó un crecimiento rápido de las colonias (de 71-74 mm de diámetro como promedio), cuando se incubaron durante siete días a 25°C. El micelio aéreo fue abundante, afelpado, polvoriento, de color blanco, el cual pasó por rosa hasta rojo carmín y formaba halos concéntricos (fig. 5); la pigmentación del medio fue de color rojo carmín y a veces rojo vino. No se observaron los esporodoquios. Los conidióforos primarios surgieron lateralmente de las hifas en el micelio aéreo, en ocasiones variaron desde simples hasta ramificados; los secundarios se presentaron en menor cuantía y estaban muy ramificados. Los microconidios estaban formados en falsas cabezuelas, fusiformes, con un septo, y medían 4,0-16,3 x 1,7-3,7 µm. Los macroconidios eran falciformes, de tres a cinco septos, algo curvados, y medían 4,8-46,5 x 1,6-4,3µm. Las clamidosporas eran abundantes, de globosas a subglobosas, de paredes lisas, algunas con ornamentos, de 6,8-16,3 µm; unas estaban en posición terminal o intercaladas, otras formaban cadenas; esta descripción se corresponde con lo señalado por López (2003) para la especie Fusarium chlamy-dosporum Wollenw & Reinking (estado teoleomorfo: no se conoce).

Se concluye que la caracterización cultural y morfológica de los diez aislamientos en estudio permitió la identificación de cinco especies de Fusarium asociadas a las semillas almacenadas de L. leucocephala cv. Perú, entre las que se citan: F. oxysporum, F. sambucinum, F. semitectum, F. incarnatum y F. chlamydosporum, de acuerdo con los caracteres evaluados. Además, es importante señalar que la segunda y la cuarta especie se informan por primera vez para esta leguminosa, y el resto para el cultivar Perú.
REFERENCIAS BIBLIOGRÁFICAS
1. Arbeláez, G. Algunos aspectos de los hongos del género Fusarium y de la especie Fusarium oxysporum. Agronomía colombiana. 17:11. 2000
2. Booth, C. Fusarium oxysporum. In: Descriptions of pathogenic fungi and bacteria. Commonwealth Mycological Institute (CAB) (Set 22). Kew, Surrey, England. No. 211. s/p. 1969 3. Booth, C. Fusarium: laboratory guide to the identification of the major species. Commonwealth Mycological Institute (CAB), Ferry Land, Kew, Surrey, England. 58 p. 1977
4. Booth, C. Fusarium semitectum. In: Descriptions of pathogenic fungi and bacteria. Commonwealth Mycological Institute (CAB). Kew, Surrey, England. No. 573. s/p. 1978
5. Borges, J. & Urdaneta, July. Efecto de Fusarium sp. en la germinación, fenología y supervivencia de plántulas de Leucaena leucocephala (Lam.) de Wit. Agronomía Tropical. 60 (2):155. 2010
6. Delgado, A. et al. Estudio de la gomosis bacteriana en legumbres de Leucaena leucocephala (Lam) de Wit. Pastos y Forrajes. 12:127. 1989
7. Dueñas, J.M. et al. Caracterización de especies del género Fusarium en el cultivo del garbanzo (Cicer arietinum) en las provincias Ciudad de La Habana y La Habana. Temas de Ciencia y Tecnología. 11 (32):63. http://www.utm.mx/temas/temas-docs/nota4t32.pdf. 2007
8. Formiga, W. & Paz, M. Aspectos gerais e morfológicos do fungo Fusarium sp. Curso Taxonomía de Fusarium. EMBRAPA. Recursos genéticos e biotecnología. Brasilia-DF. [en línea] Disponible en: http://fitopatologia1.blogspot.com/2010/10/aspectos-gerais-e-morfologicos-do fungo.html. 2009
9. Gerlach, W. & Nirenberg, Helgard. The genus Fusarium a Pictorial Atlas. Mitt. Biol. Bundesanstet für Land-und Forstwirtschaft, Berlin-Dahlem. 406 p. 1982
10. ISTA. International rules for seed testing. Seed Science and Technology. Supplement. 27. 302 p. 1999
11. Lezcano, J.C. et al. Determinación de la calidad de las semillas de Leucaena leucocephala cv. Perú almacenadas al ambiente. Pastos y Forrajes. 30 (1):107. 2007
12. López, Danay. Contribución al diagnóstico de las especies del género Fusarium Link. Tesis presentada en opción al título académico de Maestro en Ciencias en Sanidad Vegetal. Mención Fitopatología. Universidad Agraria de La Habana. La Habana. Cuba. 61 p. 2003
13. López, Danay & López, María O. Influencia de diferentes tipos de agar y del sellado de las placas sobre la pigmentación y el crecimiento micelial de las especies de Fusarium. Fitosanidad. 8 (3):3. 2004
14. López, Danay et al. Especies de Fusarium de Cuba sobre nuevos sustratos. Revista Protección Vegetal. 19 (1):14. 2004
15. López, María O. et al. Manual para la identificación de los hongos fitopatógenos de la caña de azúcar en Cuba. Acta Botánica Cubana. 124:75. 1999
16. Magani, E.I. et al. Integrated management of parasitic plant Striga hermontica in maize using Fusarium oxysporum (Mycoherbicide) and post-emergence herbicides in the Nigerian savanna. Tropical and Subtropical Agroecosystems. 14:731. 2011
17. Moreno, J. et al. Evaluation of diseases of Leucaena species in the Cauca Valley, Colombia. Leucaena Research Report. 9:40. 1988
18. Nelson, P. et al. Fusarium species. An Illustrated manual for identification. The Pennsylvania State University Park, University Park and London. 1983
19. Ocom, Vanessa et al. Detecção e influência de Fusarium spp. na qualidade fisiológica de sementes de pepino. Ciência Rural. 41 (2):193. 2011
20. Pérez, V. et al. Reacción de clones naturales e híbridos de la FHIA de bananas y plátanos a las poblaciones de Cuba de Fusarium oxysporum f.sp. cubense, agente causal de la marchitez por Fusarium o mal de Panamá. Fitosanidad. 13 (4):237. 2009
21. Pierobom, C. & Del Ponte, M. Fusarium. Manual de sanidade de sementes. [en línea] Disponible en: http://faem.ufpel.edu.br/dfs/patologiasementes/cgi-bin/sementes/procura.cgi. 2011
22. Pupo, Elsie & Heredia, Irma. Lista de hongos asociados a las semillas de Leucaena leucocephala. Boletín técnico (Instituto de Investigaciones de Sanidad Vegetal, Cuba). No. 1, p. 26. 1998
23. Rayner, R.W. A mycological colour chart. Commonwealth Mycological Institute. Kew, Surrey, England. 1970
24. Singh, K. et al. An Illustrated manual on identification of some seed-borne Aspergilli, Fusaria, Penicillia and their mycotoxins. Danish Goverment Institute of Seed Pathology for Developing Countries, Denmark. 133 p. 1991
Recibido el 22 de noviembre del 2011
Aceptado el 11 de abril del 2012













