Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.35 no.3 Matanzas jul.-set. 2012
ARTÍCULO DE INVESTIGACIÓN
Efecto in vitro del extracto acuoso de Dichrostachys cinerea (L.) Wight & Arn. en el desarrollo de las fases exógenas de estrongílidos gastrointestinales de ovinos
In vitro effect of the aqueous extract of Dichrostachys cinerea (L.) Wight & Arn. on the development of exogenous stages of gastrointestinal strongyles in sheep
J. Arece, Yaíma Roche, Y. López y M. Molina
Estación Experimental de Pastos y Forrajes "Indio Hatuey" Central España Republicana, CP 44280, Matanzas, Cuba
Email: javier.arece@indio.atenas.inf.cu
RESUMEN
Se evaluó el efecto in vitro de extractos acuosos de hojas de marabú (Dichrostachys cinerea) en la eclosión de huevecillos, el desarrollo larvario y la migración de las larvas del tercer estadio de estrongílidos gastrointestinales. Los tratamientos fueron tres concentraciones de extractos acuosos de hojas de marabú (500, 250 y 125 mg/mL), soluciones de albendazol y levamisol, así como el Phosphate Buffer Saline (PBS) y el dimetilsulfóxido (DMSO) como controles; el diseño fue completamente aleatorizado. Los porcentajes de eclosión presentaron diferencias significativas entre postratamientos. El PBS ocasionó la mayor tasa de eclosión (96,68%); el 30,51% eclosionó con el albendazol y los extractos de hojas de marabú mostraron tasas de eclosión moderadas (entre 49,75 y 66,54%), al parecer dependientes de la dosis. El desarrollo de las larvas L1/L2 a las L3 tratadas con extracto acuoso de marabú también presentó efectos dosis-dependientes y diferencias significativas con respecto a los grupos controles positivos y negativos. La dosis de 500 mg/mL inhibió el desarrollo larvario en porcentajes similares a los del albendazol (8,89 y 1,28%, respectivamente). El medio PBS no interfirió en la capacidad de migración de las larvas, mientras que con el levamisol los valores se redujeron de 86,45 a 93,92%; los extractos acuosos también redujeron significativamente dicha migración, con valores entre 77,67 y 48,97%. Los extractos acuosos de D. cinerea presentaron actividad antihelmíntica in vitro en los tres estadios de desarrollo del ciclo exógeno de los estrongílidos gastrointestinales de ovinos; esta actividad resultó más evidente en el desarrollo y la migración de las larvas de estos nemátodos.
Palabras clave: Dichrostachys cinerea, ovinos, parásitos.
ABSTRACT
The in vitro effect of aqueous extract of leaves from Dichrostachys cinerea on egg hatching, larval development and migration of third-stage larvae of gastrointestinal strongyles, was evaluated. The treatments were three concentrations of aqueous extracts of D. cinerea leaves (500, 250 and 125 mg/mL), albendazole and levamisole solutions, as well as Phosphate Buffer Saline (PBS) and dimethyl sulfoxide (DMSO) as controls; the design was completely randomized. The hatching percentages showed significant differences among post-treatments. PBS caused the highest hatching rate (96,68%); 30,51% hatched with albendazole and the D. cinerea leaf extracts showed moderate hatching rates (between 49,75 and 66,54%), seemingly dose-dependent. The development of L1/L2 larvae to L3 treated with aqueous D. cinerea extract also showed dose-dependent effects and significant differences with regards to the positive and negative control groups. The dose of 500 mg/mL inhibited larval development in similar percentages as those of albendazole (8,89 and 1,28%, respectively). The PBS medium did not interfere in the larval migration capacity, while with levamisole the values were reduced from 86,45 to 93,92%; the aqueous extracts also significantly reduced such migration, with values between 77,67% and 48,97%. The aqueous D. cinerea extracts showed in vitro anthelmintic activity in the three development stages of the exogenous cycle of gastrointestinal strongyles in sheep; this activity was more evident in the larval development and migration of these nematodes.
Key words: Dichrostachys cinerea, parasites, sheep.
La búsqueda de alternativas que minimicen el uso de los antihelmínticos para el control parasitario en pequeños rumiantes constituye un reto para la producción animal mundial, ya que su uso indiscriminado ha provocado una resistencia generalizada a los principales medicamentos antiparasitarios (Arece et al., 2004; Wolstenholme et al., 2004), lo que se agudiza por el lento desarrollo a corto plazo de productos con actividad antiparasitaria.
Actualmente, existen diferentes estrategias encaminadas a solucionar la problemática del parasitismo gastrointestinal en los ovinos, entre las que se destacan las relacionadas con el uso de plantas que tienen potencialidades antiparasitarias (Athanasiadou et al., 2001; Githiori et al., 2006; Marie-Magdeleine et al., 2010).
En los estudios in vivo con plantas nativas de diferentes países se ha reportado una mejor respuesta de los animales ante la infestación parasitaria, lo que se atribuye a: 1) los efectos directos, relacionados con la influencia de algún metabolito secundario de las plantas sobre los parásitos (fundamentalmente taninos condensados), y 2) los efectos secundarios, vinculados a un incremento del estado de resiliencia de los animales, por una mejora en la dieta, al consumir este tipo de plantas (Kyriazakis et al., 2010).
Por otra parte, también se han realizado investigaciones in vitro para determinar la actividad de los extractos de plantas en la inhibición de la eclosión de huevecillos, y también en el desarrollo de la migración larvaria y en la motilidad de parásitos adultos (Marie-Magdeleine, 2009). Estos estudios han permitido la selección de un gran número de plantas, de las que se tiene alguna evidencia de actividad antiparasitaria.
En Cuba existen experiencias del uso de fitofármacos en el control parasitario; el resultado de mayor impacto se generó con Bromelia pinguin (piña de ratón), la cual fue efectiva ante Haemonchus spp. en terneros (Marrero et al., 1994). En México se empleó contra Oesophagostomum columbianum en ovinos (Olivares, 2001).
Dentro de los principales metabolitos secundarios a los que se les atribuyen efectos antiparasitarios se encuentran los taninos condensados TC (Wolstenholme et al., 2004). El marabú (Dichrostachys cinerea (L.) Wight & Arn.) es un arbusto con elevados niveles de este metabolito (Pedraza et al., 2008), por lo que posee potencial para el control parasitario ya que sus TC no necesitan ser desactivados (adición de polietilenglicol o NaOH) antes de suplementar a los pequeños rumiantes con el follaje ya sea fresco o en forma de harina (Mlambo et al., 2004).
En Cuba esta planta constituye una fuente importante de alimento en muchos de los sistemas productivos de ovejas y cabras, fundamentalmente durante el periodo poco lluvioso. Es por ello que el objetivo del trabajo fue evaluar las propiedades antiparasitarias in vitro de extractos acuosos de D. cinerea, en tres fases del ciclo biológico de estrongílidos gastrointestinales en ovinos.
MATERIALES Y MÉTODOS
El estudio se desarrolló en el laboratorio de parasitología de la EEPF "Indio Hatuey". Las hojas de marabú se cosecharon en el área de pastoreo de la institución, en el horario de la mañana. Se realizó una extracción acuosa con solución de Phosphate Buffer Saline (PBS) en fresco, con el uso de nitrógeno líquido, mediante el método descrito por Díaz et al. (2010). Se preparó una solución madre de 500 mg/mL, a partir de la cual se prepararon tres concentraciones para utilizarlas en los ensayos: 500, 250 y 125 mg/mL, identificadas como MAR-500, MAR-250 y MAR-125, respectivamente.
Prueba de eclosión de huevos (PEH)
Los ensayos se hicieron a partir de las modificaciones a las técnicas descritas por Hubert y Kerboeuf (1984) y Marie-Magdeleine et al. (2010). Se evaluaron seis tratamientos, que correspondieron a las tres concentraciones del extracto de hojas de marabú (MAR-500, MAR-250 y MAR-125), el PBS y el dimetilsulfóxido (DMSO) como controles positivos, y el albendazol 0,5% (ABZ), como control negativo. Se colectaron huevos de estrongílidos de animales infestados (Hubert y Kerboeuf, 1992) y se depositaron en placas de cultivo celular de 24 pocillos, para ser enfrentados con las diferentes soluciones o tratamientos experimentales. Los huevos se incubaron durante 48 h y, transcurrido ese tiempo, se detuvo la eclosión con 100 µL de solución de Lugol. Las larvas y los huevos se contaron en 20 alícuotas de 10 µL y se determinó el porcentaje de eclosión. El diseño fue completamente aleatorizado, con seis réplicas por tratamiento.
Prueba de desarrollo larvario (PDL)
Los estudios se hicieron a partir de las modificaciones realizadas a las técnicas descritas por Hubert y Kerboeuf (1984) y Assis et al. (2003). Se emplearon los mismos tratamientos que en la PEH. El principio del ensayo consistió en exponer los huevos eclosionados a las distintas soluciones, para evaluar el desarrollo de las larvas L1/L2 hacia L3 o larvas infestantes, según la técnica propuesta por Marie-Magdeleine et al. (2010). Las L1/L2 se obtuvieron mediante el procedimiento descrito en la PEH y se alimentaron con una solución nutritiva. A las 48 h se aplicaron las soluciones y después de ocho días se detuvo el proceso de muda con 100 µL de solución de Lugol. Se contaron las L1/L2 y las L3, y se determinó el porcentaje de larvas infestantes.
Prueba de migración larvaria (PML)
El principio de esta prueba consistió en enfrentar las larvas del tercer estadio obtenidas mediante coprocultivos (Roberts y O´Sullivan, 1952) a las tres concentraciones del extracto acuoso, a un control positivo (PBS) y a uno negativo (levamisol, LV). Se empleó el método descrito por Marie-Magdeleine et al. (2010), que consistió en enfrentar una cantidad conocida de larvas L3 a las soluciones, en un tubo de ensayo Falcon® cónico, durante dos horas. Después de sucesivos lavados con PBS, se pusieron a migrar a través de un tamiz de 20 µm en un dispositivo preparado con este fin. A continuación se determinó la cantidad de larvas migradas y se calculó el porcentaje de migración.
Análisis estadístico
Los datos se procesaron con el paquete estadístico SPSS®. Los valores porcentuales (X) de cada prueba se transformaron (arcosenoÖ X ), para realizar un análisis de varianza de clasificación simple. Se comprobó la homogeneidad de las varianzas y la distribución normal de los datos. Las diferencias entre las medias se calcularon mediante la prueba de comparación de rangos múltiples de Duncan (1955).
RESULTADOS Y DISCUSIÓN
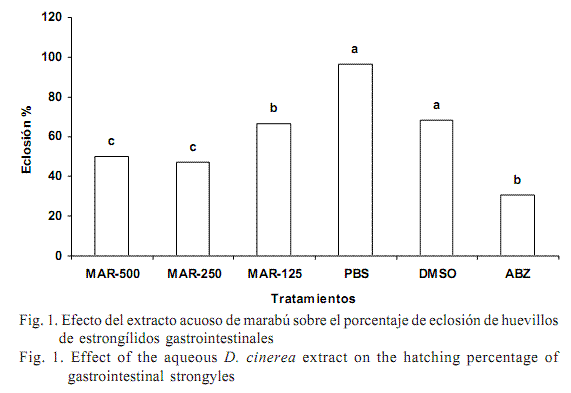
En la figura 1 se muestra el efecto de los extractos acuosos de marabú y los respectivos grupos controles, en la eclosión de los huevecillos. Los porcentajes de eclosión mostraron diferencias significativas (p<0,01): el PBS tuvo las mayores tasas de eclosión (96,68%), mientras que ante el albendazol eclosionó el 30,51% de estos, lo cual demuestra la efectividad de este fármaco sobre la viabilidad de los huevecillos de los nemátodos gastrointestinales (Martin et al., 1997).
Por su parte, los extractos acuosos de hojas de marabú permitieron tasas de eclosión moderadas (entre 49,75 y 66,54%), al parecer dosis-dependientes. Estos valores fueron similares a los obtenidos con extractos acuosos de semillas de papaya (Carica papaya) e inferiores a los de hojas de yuca (Manihot esculenta) (12,35%) y plátano (Musa paradisiaca) (6,14%), informados en el Caribe oriental (Guadalupe) por Marie-Magdeleine (2009).
El desarrollo de las larvas L1/L2 a las L3 con el extracto acuoso de marabú también presentó efectos dosis-dependientes (fig. 2) y diferencias significativas (p<0,01) con respecto a los grupos controles positivos y negativos. La dosis de 500 mg/mL inhibió el desarrollo larvario en porcentajes similares a los del albendazol (8,89 y 1,28%, respectivamente; p<0,01). Estos valores son inferiores a los reportados para el extracto acuoso de semilla de C. papaya (Marie-Magdeleine, 2009) y similares a los obtenidos con semillas de Cucurbita moschata (Marie-Magdeleine et al., 2009) y follaje de paradiso (Melia azedarach) (Cala et al., 2012). En el presente estudio, los principales efectos se observaron en las larvas del primer y el segundo estadio (desarrollo larvario), aunque también fueron considerables en las L3 pues inhibieron significativamente (p<0,01) la actividad migratoria de estas (fig. 3). Cala et al. (2012) obtuvieron un comportamiento similar en M. azedarach y Trichilia claussenii.
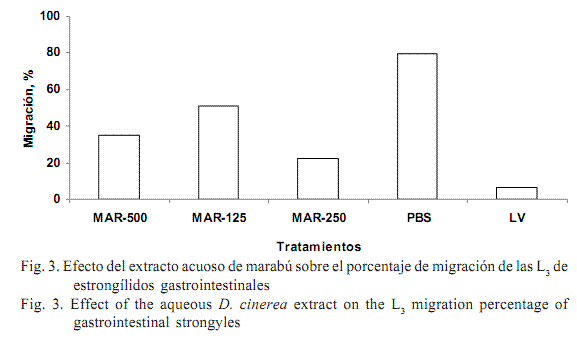
El efecto de los extractos acuosos en la migración de las larvas L3 se muestra en la figura 3. El PBS no interfirió notablemente en la capacidad de migración de las larvas, mientras que el levamisol mostró una reducción de 86,45 a 93,92% (p<0,01) en este indicador. Por su parte, los extractos de marabú también redujeron significativamente (p<0,01) la migración, con valores entre 77,67 y 48,97%. Esto pudo deberse a los efectos directos de los taninos condensados libres presentes en esta planta, los cuales interfieren en la capacidad de movimiento de las larvas, o a la intervención directa en la pérdida de la cutícula.
El marabú es considerado como una planta tanífera, con valores de 178,4 g/kg de MS de este metabolito secundario (Mlambo et al., 2004). En Cuba, Pedraza et al. (2008) reportaron contenidos de polifenoles totales de 120 g/kg de MS.
La forma en que actúan los TC continúa en debate, y existen dos hipótesis; la primera de ellas se sustenta en los posibles efectos directos de estas sustancias, al poseer la capacidad de formar complejos con las proteínas libres de los parásitos del tracto gastrointestinal (Mueller-Harvey, 2006), por lo que se reduce la capacidad de asimilación de los nutrientes. Además, estos son capaces de unirse a la cutícula de la larva (rica en glicoproteínas) y causar su muerte (Cala et al., 2012). Por otro lado, se ha demostrado que los TC disminuyen la capacidad de fecundación de los parásitos (Martínez-Ortíz de Montellano et al., 2010) y tienen efectos directos sobre los estadios adultos que causan lesiones estructurales de importancia, lo cual propicia la muerte del parásito (Manolaraki et al., 2010; Martínez-Ortíz de Montellano, 2010).
La segunda hipótesis se basa en que los taninos condensados pueden interferir indirectamente en la biología parasitaria, a través del incremento en la respuesta inmunológica de los animales (Hoste et al., 2006). Ello pudiera estar relacionado con el incremento del flujo y la absorción de proteínas y aminoácidos directamente en el intestino delgado, como resultado de una menor degradación de estas en el rumen, debido a la presencia de los taninos. En este sentido, Aróstica (2011) informó bajas tasas de infestación parasitaria en cabras, en áreas de pastoreo con predominio de marabú, la cual constituye prácticamente la única fuente de alimentación durante el periodo poco lluvioso en las condiciones de Cuba.
Este estudio evidenció la existencia de posibles efectos dosis-dependientes en la eclosión y el desarrollo larvario, que no quedaron tan claros en el caso de la migración larvaria, ya que las dosis más altas fueron más efectivas en los dos ensayos sobre las primeras fases de vida de estos parásitos. Probablemente estos efectos estén relacionados con la presencia de la cutícula en las L3, lo que las hace más resistentes que los estadios anteriores (L1 y L2).
La investigación demostró los efectos antihelmínticos in vitro del extracto acuoso de hojas de marabú, con efectos dosis-dependientes en la eclosión y el desarrollo larvario. Los mejores resultados se obtuvieron con la concentración de 500 mg/mL. Se recomienda el diseño de estudios in vivo que permitan confirmar la actividad antiparasitaria en los parásitos adultos.
AGRADECIMIENTOS
Esta investigación fue financiada por la International Foundation for Science (Proyecto B/4610) y la Estación Experimental de Pastos y Forrajes "Indio Hatuey" (Proyecto Institucional 9567).
REFERENCIAS BIBLIOGRÁFICAS
1. Arece, J. et al. Comparative efficacy of six anthelmintic for the control of nematodes in sheep in Matanzas, Cuba. Small Ruminant Research. 5 (1-2):61. 2004
2. Aróstica, N. Comportamiento de los nemátodos gastrointestinales en cabras lecheras sometidas a tratamientos antiparasitarios selectivos. Tesis presentada en opción al título académico de Máster en Prevención. Universidad Agraria de La Habana, Mayabeque, Cuba. 86 p. 2011
3. Assis, L.M. et al. Ovicidal and larvicidal activity in vitro of Spigelia anthelmia Linn. extracts on Haemonchus contortus. Veterinary Parasitology. 117:43. 2003
4. Athanasiadou, S. et al. Direct anthelmintic effects of condensed tannins towards different gastrointestinal nematodes of sheep: in vitro and in vivo studies. Veterinary Parasitology. 99:205. 2001
5. Cala, A.C. et al. In vitro anthelmintic effect of Melia azedarach L. and Trichilia claussenii C. against sheep gastrointestinal nematodes. Experimental Parasitology. 130:98. 2012
6. Díaz, Maykelis et al. Determinación de antioxidantes en variedades e híbridos de Morus alba. Pastos y Forrajes. 33:301. 2010
7. Githiori, J.B. et al. Use of plants in novel approaches for control of gastrointestinal helminths in livestock with emphasis on small ruminants. Veterinary Parasitology. 139:308. 2006
8. Hoste, H. et al. The effects of tannin-rich plants on parasitic nematodes in ruminants. Trends in Parasitology. 22:253. 2006
9. Hubert, J. & Kerboeuf, D. A new method for culture of larvae used in diagnosis of ruminant gastrointestinal strongylosis: Comparison with fecal cultures. Canadian Journal of Comparative Medicine. 48:63. 1984
10. Hubert, J. & Kerboeuf, D. A microlarval development assay for the detection of anthelmintic resistance in sheep nematodes. Veterinary Record. 130:442. 1992
11. Kyriazakis, I. et al. Nutritional strategies to control gastrointestinal parasitism in small ruminants. Advances in Animal Biosciences. 1:390.2010
12. Manolaraki, F. et al. Anthelmintic activity of some mediterranean browse plants against parasitic nematodes. Parasitology. 137:684. 2010
13. Marie-Magdeleine, Carine. Etude de ressources végétales tropicales pour un usage anthelminthique en élevage de ruminants. Tesis presentada en opción al grado de Doctor en Ciencias Agronómicas. Universidad de las Antillas. Guadalupe F.W.I. 276 p. 2009
14. Marie-Magdeleine, Carine et al. In vitro effects of Cucurbita moschata seed extracts on Haemonchus contortus. Veterinary Parasitology. 161:99. 2009
15. Marie-Magdeleine, Carine et al. In vitro effects of Tabernaemontana citrifolia extracts on Haemonchus contortus. Research in Veterinary Science. 89 (1):88. 2010
16. Marrero, Evangelina et al. Actividad antihelmíntica de Bromelia pinguin L (Bromeliaceae) en terneros. Revista de Salud Animal. 16 (1-3):63. 1994
17. Martín, R.J. et al. Target sites of anthelmintics. Parasitology. 114:S111. 1997
18. Martínez-Ortíz de Montellano, Cintli. Mécanismes d'action de plantes riches en tanins sur les nématodes gastrointestinaux adultes des petits ruminants. Tesis presentada en opción al grado de Doctor en Ciencias Agropecuarias. Universidad de Toulouse, Francia. 124 p. 2010
19. Martínez-Ortíz de Montellano, Cintli et al. Effect of a tropical tannin-rich plant Lysiloma latisiliquum on adult population of Haemonchus contortus in sheep. Veterinary Parasitology. 172:283. 2010
20. Mlambo, V. et al. Tanniniferous Dichrostachys cinerea fruits do not require detoxification for goat nutrition: in sacco and in vivo evaluations. Livestock Production Science. 90:135. 2004
21. Mueller-Harvey, I. Unravelling the conundrum of tannins in animal nutrition and health. Journal of the Science of Food and Agriculture. 86:2010. 2006
22. Olivares, J. Oesophagostomum columbianum: Puesta en evidencia, caracterización y control en ovinos de la región de Huichapán, Estado de Hidalgo, México. Tesis presentada en opción al grado de Doctor en Ciencias Veterinarias. CENSA. La Habana, Cuba. 137 p. 2001
23. Pedraza, R. et al. Indicadores fenológicos y valor nutritivo in vitro del marabú, Dichrostachys cinerea, durante la época seca. Zootecnia Tropical. 26 (3):219. 2008
24. Roberts, F.H.S. & O´Sullivan, J.P. Methods for egg counts and larval cultures for strongyles infesting the gastrointestinal tract of cattle. Australian Agricultural Research. 1:99. 1952
25. Wolstenholme, A.J. et al. Drug resistance in veterinary helminths. Trends in Parasitology. 20:469. 2004
Recibido el 5 de julio del 2012
Aceptado el 21 de julio del 2012