Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.37 no.1 Matanzas ene.-mar. 2014
ARTÍCULO DE INVESTIGACIÓN
Efecto del NaCl en plántulas de curarí (Tabebuia serratifolia) en condiciones de laboratorio
Effect of NaCl on curarí (Tabebuia serratifolia) seedlings under laboratory conditions
Maribel Ramírez1, Yunaica Piña2, L. Ordoñez2, Belkys Bracho3 y D. García4
1Departamento de Botánica, Facultad de Agronomía, Universidad del Zulia (LUZ), Maracaibo, Edo. Zulia, Venezuela
2Ingeniero Agrónomo egresado de LUZ
3Departamento de Estadística, Facultad de Agronomía, LUZ
4FMF-Freiburg Materials Research Center / Institute of Forest Utilization and Work Science, Freiburg i. Br., Germany
E-mail: mcramire@fa.luz.edu.ve
RESUMEN
El objetivo de este trabajo fue evaluar el efecto del cloruro de sodio (NaCl) durante la germinación y el desarrollo inicial de las plántulas de curarí (Tabebuia serratifolia), en condiciones de laboratorio. Las semillas se colocaron en cinco concentraciones de NaCl: 2, 4, 6, 8 y 10 dS m-1, y en agua destilada (testigo), con una conductividad eléctrica entre 0,02 y 0,04 dS m-1. Se empleó un diseño experimental completamente al azar, con cinco repeticiones, y se aplicó un análisis de varianza. Se determinó el porcentaje de germinación (PG) y la tasa de germinación (TG); y se midió la longitud del tallo (LT), la longitud de la raíz (LR), el área cotiledonal (AC), la biomasa fresca (BF) y la biomasa seca (BS). La concentración de NaCl mostró efectos significativos para las variables PG, TG, BS, LT, LR y AC. Se obtuvo un 79,6 % de germinación y una TG de 1,66 días, cuando las semillas se sometieron a 6 dS m-1 de NaCl. Las concentraciones de 8 y 10 dS m-1 disminuyeron significativamente el PG, la LT y el AC de las plántulas, y retardaron la TG. Se concluye que las plántulas de curarí mostraron tolerancia a la condición salina del NaCl hasta 6 dS m-1, por lo que esta especie se puede utilizar con fines agroforestales en los sistemas de producción agropecuaria, así como en la recuperación de áreas que presenten problemas moderados de salinidad.
Palabras clave: árboles de propósito múltiple, estrés, supervivencia.
ABSTRACT
The objective of this work was to evaluate the effect of sodium chloride (NaCl) during the germination and initial growth of curarí (Tabebuia serratifolia) seedlings under laboratory conditions. The seeds were placed in five concentrations of NaCl: 2, 4, 6, 8 and 10 dS m-1, and in distilled water (control), with an electric conductivity between 0.02 and 0.04 dS m-1. A completely randomized experimental design was used, with five repetitions, and a variance analysis was applied. The germination percentage (GP) and germination rate (GR) were determined; and the stem length (SL), root length (RL), cotyledonal area (CA), fresh biomass (FB) and dry biomass (DB) were measured. The concentration of NaCl showed significant effects for the variables GP, GR, DB, SL, RL and CA. A germination of 79.6 % and a GR of 1,66 days were obtained when the seeds were subject to 6 dS m-1 of NaCl. The concentrations of 8 and 10 dS m-1 significantly decreased GP, SL and CA of the seedlings and delayed the GR. It is concluded that the T. serratifolia seedlings showed tolerance to the saline condition of NaCl up to 6 dS m-1, for which this species can be used with agroforestry purposes in livestock production systems, as well as in the recovery of areas that show moderate salinity problems.
Key words: multipurpose trees, stress, survival.
INTRODUCCIÓN
En Venezuela existe una gran diversidad de árboles silvestres con un alto potencial de uso (Hoyos, 1992), incluyendo el agroforestal (Ramírez et al., 2012). El curarí (Tabebuia serratifolia) es una especie multipropósito, nativa de la selva lluviosa amazónica del norte de Sudamérica (Justiniano et al., 2000), la cual tiene una gran importancia económica, maderable y ornamental en Brasil (Machado et al., 2002) y es considerada como óptima para los sistemas agroforestales y los programas de recomposición vegetal en áreas degradadas de Bolivia (Vargas et al., 2000). Sin embargo, en Venezuela no se le ha dado la importancia que merece, a pesar de ser una especie nativa. En la actualidad aun se encuentra en los bosques naturales, las zonas rurales y los sistemas agropecuarios del país, en diferentes condiciones ambientales (incluyendo la salina), donde crece de manera natural. En los estados Zulia y Falcón es común observarla en las unidades de producción agropecuaria, en las que predomina y, a menudo, es confundida con el araguaney (Tabebuia chrysantha). Por otra parte, hoy en día el curarí se encuentra en peligro de extinción, debido a la tala ya que su madera, de excelente calidad y durabilidad, se utiliza en artesanías, muebles y estantillos, entre otros , la quema y el crecimiento indiscriminado del urbanismo, la actividad comercial y la producción agropecuaria sin planificación ni educación ambiental. Una forma sencilla de rescatar e incluir el curarí en los sistemas de producción es mediante el desarrollo de las plántulas o árboles pequeños que crecen naturalmente en los campos o bosques.
La salinidad de los suelos es uno de los problemas ambientales más antiguos que afectan el rendimiento de los cultivos y la distribución de las plantas en la naturaleza (Camejo y Torres, 2000; Martínez et al., 2010). Debido al aumento constante de los suelos salinizados, es necesario el establecimiento de criterios y métodos de laboratorio rápidos y confiables para evaluar la tolerancia de las especies a diferentes condiciones de salinidad, sobre la base de las afectaciones de la germinación, el crecimiento de las plántulas y la supervivencia (González et al., 2002).
En este sentido, no se dispone de información sobre el efecto de la salinidad en la germinación y el desarrollo inicial de las plántulas. Solo existe un estudio realizado en Brasil, en el que se indica que la germinación fue rápida en rangos de temperatura entre 25 y 35 ºC, en condiciones de laboratorio, con agua no salina (Machado et al., 2002). Sin embargo, en otras especies se ha informado el efecto de las sales de NaCl en la germinación (Meza et al., 2004; García et al., 2011), la altura de la plántula, la longitud de la raíz y la acumulación de biomasa seca (Argentel et al., 2006a). Sobre la base de estas premisas, así como de la necesidad de recuperación de esta especie y su inclusión en los sistemas agroforestales, se realizó este trabajo con el objetivo de evaluar el efecto de diferentes concentraciones de NaCl durante la germinación y el desarrollo inicial de las plántulas de curarí, en condiciones de laboratorio.
MATERIALES Y MÉTODOS
El experimento se realizó en el laboratorio de propagación de plantas de la Facultad de Agronomía, Universidad del Zulia (LUZ). Las semillas de curarí se recolectaron de los árboles ubicados en el sector Jagüey de Monte, parroquia La Concepción (municipio Jesús Enrique Lossada, estado Zulia).
Tratamientos y diseño. Las semillas se extrajeron de las vainas maduras, antes de la dehiscencia. Después, en condiciones de laboratorio (25 °C), se colocaron en bandejas plásticas grandes y descubiertas hasta que se desprendieron las semillas del fruto; se descartaron las pequeñas o deformes, y se distribuyeron uniformemente sobre un papel absorbente. Posteriormente se rociaron con el fungicida Vitavax® al 0,5 % (Ramírez et al., 2012), se dejaron secar por cuatro días (a 25°C), y se almacenaron a 10 ºC durante ocho meses.
Las semillas se expusieron a distintas concentraciones salinas de NaCl (2, 4, 6, 8 y 10 dS m-1), ajustadas mediante un conductímetro (Copenhagen type CDM 2 dn.107361). Como testigo se utilizó agua destilada, con un rango de conductividad eléctrica entre 0,02 y 0,04 dS m-1.
Procedimiento. Las semillas se colocaron en bandejas plásticas transparentes, de 12,5 cm de ancho por 15,5 cm de largo por 4,5 cm de alto, con dos hojas de papel absorbente y 15 mL de cada solución, bajo luz fluorescente continua y a 25 ºC. Se realizó un riego a los siete días, con la solución salina correspondiente a cada tratamiento.
Durante ocho días se evaluó el número de semillas germinadas, para determinar el porcentaje de germinación (PG) y la tasa de germinación (TG) (Perozo et al., 2006). A los quince días después del montaje del experimento se midió la longitud del tallo (LT), la longitud de la raíz (LR), el área cotiledonal (AC), la biomasa fresca (BF) y la biomasa seca (BS). Para ello, se seleccionaron al azar cinco plántulas de cada repetición (se descartaron las de los bordes de la bandeja). La LT se midió con una regla, desde el ápice hasta la base del tallo; y la LR, desde la base del tallo hasta el ápice de la raíz principal; ambas variables se expresaron en centímetros. Para determinar el AC, se cortaron con un bisturí los cotiledones de cada plántula y se colocaron en un medidor de área foliar; mientras que para la BF se pesaron cada una de las plantas en una balanza analítica (Mettler Toledo, AB204-S/FAST). Después de este proceso se procedió al secado en una estufa a 74 ºC, durante 48 horas, para obtener la BS (mg).
Se utilizó un diseño completamente al azar, con cinco repeticiones por tratamiento y 20 semillas como unidad experimental, para un total de 100 semillas por tratamiento. Se aplicó un análisis de varianza y la prueba de Tukey, cuando se detectaron efectos significativos, para la comparación de medias (SAS, 2010).
RESULTADOS Y DISCUSIÓN
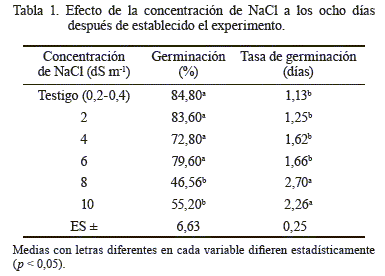
El análisis de varianza mostró diferencias significativas (p < 0,05) entre las concentraciones de NaCl para el PG en las semillas de curarí. No hubo diferencias significativas entre el testigo y las concentraciones 2, 4 y 6 dS m-1 de NaCl; pero sí entre este grupo y el resto de los tratamientos (tabla 1). Las condiciones de 8 y 10 dS m-1 de NaCl tuvieron un comportamiento similar, así como los menores porcentajes de germinación (46,56 y 55,2 %), lo que demostró el efecto inhibitorio de dichas concentraciones en los procesos fisiológicos y bioquímicos de la germinación: imbibición de agua, activación y síntesis de enzimas, digestión y translocación de sustancias hacia los puntos de crecimiento del eje embrionario (Azcón y Talón, 2008). En tomate, las concentraciones extremas de NaCl han ocasionado cambios físicos y químicos en las semillas, así como retardo y disminución de la germinación (Camejo y Torres, 2000).
La tolerancia de las semillas a la salinidad durante la germinación es una medida de la habilidad de estas para soportar los efectos de las altas concentraciones de sales solubles en el medio, lo que disminuye el potencial hídrico y provoca una menor disponibilidad de agua. Por tanto, deben generar suficiente potencial osmótico para mejorar el estatus hídrico de los embriones y permitir su crecimiento (Cortés y Saavedra, 2007).
El alto porcentaje (capacidad de germinación) observado en las soluciones de hasta 6 dS m-1 de NaCl (72,8-84,8 %) evidenció que el curarí tuvo un alto grado de tolerancia a la salinidad (fig. 1) y una tolerancia media en las concentraciones más altas (8 y 10 dS m-1 de NaCl). Tal resultado se consideró promisorio para la especie, debido a que no se dispone de este tipo de información. Algunos trabajos realizados con semillas de otras especies evidencian que cada una tiene un comportamiento o tolerancia diferente a la salinidad, ya que concentraciones de NaCl iguales o superiores a 2,5 dS m-1 en níspero (Meza et al., 2004), 6 dS m-1 en parchita (Meza et al., 2007), 18 dS m-1 en pasto agropiro alargado (Bazzigalupi et al., 2008), 34 dS m-1 en quinoa (Chilo et al., 2009) y 10 dS m-1 de KCl en el forraje coquia (García et al., 2011) disminuyeron la germinación.
La concentración de NaCl provocó diferencias significativas en la tasa de germinación (tabla 1) o número de días promedio requerido para la germinación. Se detectaron dos grupos: el primero, constituido por el testigo y las concentraciones 2, 4 y 6 dS m-1de NaCl; y el segundo, formado por las de 8 y 10 dS m-1 de NaCl. Las dos últimas concentraciones prolongaron los días para que ocurriera la germinación. Esta respuesta coincide con lo observado en el pasto agropiro alargado (Bazzigalupi et al., 2008) y en el forraje coquia (García et al., 2011). La reducción del porcentaje de germinación, así como el atraso en el inicio de dicho proceso con el aumento del estrés salino, se relacionaron con la sequía fisiológica inducida, debido a que con el aumento de la concentración de sales en el medio germinativo disminuye el potencial osmótico y, consecuentemente, el potencial hídrico.
No se observaron diferencias significativas entre las concentraciones de NaCl en cuanto a la biomasa fresca de las plántulas de curarí (tabla 2), aunque se apreció una ligera reducción a partir de 4 dS m-1, lo cual se podría asociar a que en la mayoría de las plantas disminuye la absorción de agua y de nutrientes importantes como el nitrógeno, el sodio y el potasio, indispensables para el desarrollo, en presencia de sales (Barkla et al., 2008).
De acuerdo con el análisis de varianza, entre las concentraciones de NaCl hubo diferencias significativas en la acumulación de biomasa seca en las plántulas de curarí (tabla 2). Esta variable disminuyó significativamente a partir de 2 dS m-1 de NaCl, lo cual fue más marcado en las concentraciones de 8 y 10 dS m-1 de NaCl. Además, constituyó otro indicador de la disminución del crecimiento de las plántulas de curarí bajo estrés salino. Estos resultados coinciden con lo señalado para otras especies, como la coquia (García et al., 2011), el trigo (Argentel et al., 2006b) y el guayabo (Casierra, 2006), en las cuales hubo una menor acumulación de biomasa seca a medida que se incrementó la concentración de sales en el agua de riego. En el caso del trigo, la biomasa seca fue el indicador más sensible ante la afectación causada por las sales de NaCl (Argentel et al., 2006b). La tolerancia del curarí a dicha sal se relaciona con el hecho de que este árbol se desarrolla naturalmente en condiciones áridas (incluyendo las salinas), lo que demuestra su capacidad de adaptación.
Por otra parte, las plantas son capaces de desarrollar mecanismos adaptativos para sobrevivir en condiciones de alta salinidad, entre los que se encuentra la acumulación y el depósito del sodio a lo largo del eje de crecimiento, en un gradiente de concentración que tiende a ser mayor en las partes jóvenes de las hojas, donde es aislado para prevenir el daño. Este ión es depositado y secuestrado dentro de la vacuola central de las células vegetales, comportamiento asociado al intercambiador de sodio/protones (Na+/H+) que es activado por la bomba de protones del tonoplasto V-ATPasa (Barkla et al., 2008).
En cuanto a la longitud del tallo, se detectaron diferencias significativas entre los tratamientos (tabla 2). Entre el testigo y las concentraciones de 2, 4 y 6 dS m-1 de NaCl no hubo diferencias significativas, pero sí con respecto al resto de los tratamientos. Ello indica que la longitud del tallo se afectó, debido al estrés que produce el riego salino a partir de niveles iguales y mayores que 6 dS m-1 de NaCl. Dichos resultados tienen cierta similitud con los de un estudio realizado en lechuga (Lesmes et al., 2007), en el que la inclusión de NaCl en el agua de riego inhibió el alargamiento de los brotes. Sin embargo, en tomate, las afectaciones en el tallo causadas por la salinidad han sido irreversibles (Morales et al., 2010). Por su parte, Barkla et al. (2008) informaron que la acumulación de sodio en las células de las plantas se vuelve tóxica y afecta a una gran variedad de procesos metabólicos (incluyendo las enzimas que participan en la fotosíntesis). Por ello, el crecimiento de las plantas se inhibe desde que comienza el estrés debido a las sales.
El análisis de varianza mostró que hubo diferencias significativas entre los tratamientos en cuanto a la longitud de la raíz (tabla 2). En el testigo y en las soluciones 2 y 4 dS m-1 de NaCl, las plántulas presentaron un comportamiento similar y alcanzaron la mayor longitud de la raíz; mientras que en las de 6, 8 y 10 dS m-1 de NaCl esta variable disminuyó. Sin embargo, estas dos últimas concentraciones difirieron de 6 dS m-1 y las raíces presentaron poco desarrollo y una coloración marrón, debido posiblemente al deterioro del sistema radical por la exposición a altas concentraciones salinas, lo cual ha sido informado en otras investigaciones (Morales et al., 2010; García et al., 2011). En caraota (García et al., 2010) el órgano más sensible al estrés por salinidad fue la raíz, en concentraciones mayores de 12 dS m-1 de NaCl.
En níspero, la raíz fue el órgano que acumuló la mayor cantidad de sodio, en comparación con la parte aérea (Meza et al., 2004). Las plantas poco resistentes a las sales no son capaces de dirigir el sodio a las partes maduras; por tanto, lo mantienen en las raíces. Por tal motivo, en las plantas susceptibles o poco tolerantes el sodio absorbido tiende a concentrarse en las células radicales, donde se produce toxicidad y se inhibe el paso del agua y los nutrientes necesarios para su desarrollo (Barkla et al., 2008).
Los valores de la longitud de la raíz obtenidos en las concentraciones de 8 y 10 dS m-1 de NaCl, mostraron que las raíces presentaron poco desarrollo. Esto provocó la existencia de una menor superficie de absorción de solutos y agua, y, por ende, bajos valores de la longitud del tallo y la biomasa seca. Este comportamiento se asoció al hecho de que las sales alteran la absorción de agua, afectan el crecimiento de los órganos de la planta y tienen efectos tóxicos (Cortés y Saavedra, 2007; García et al., 2011).
En tuna una planta CAM (metabolismo ácido crasuláceo), al igual que en las plantas con metabolismo fotosintético C3 y C4, el incremento de la salinidad aumentó el contenido de prolina en el clorénquima y el hidroparénquima de los cladodios y las raíces, como respuesta general a los cambios en el potencial osmótico externo. El incremento de la prolina previene la entrada de iones tóxicos a los tejidos y/o mantiene el funcionamiento de las bombas necesarias para excluir el exceso de NaCl, con lo que se evita la inhibición enzimática. Dicho aumento puede deberse a la síntesis de novo y a la disminución en la tasa de síntesis de las proteínas y/o degradación de las proteínas ricas en prolina (Franco y Véliz, 2007).
La concentración de NaCl tuvo efectos significativos en el área cotiledonal (tabla 2); entre el testigo y las concentraciones de 2, 4 y 6 dS m-1 de NaCl no hubo diferencias significativas. Sin embargo, en las condiciones de 8 y 10 dS m-1 de NaCl el área cotiledonal se redujo, los cotiledones tendieron a arrugarse y, en algunos casos, presentaron manchas cloróticas; además, las plántulas no desarrollaron hojas verdaderas.
En níspero hubo una reducción del área cotiledonal con la concentración de 8,5 dS m-1 de NaCl, lo que se asocia al efecto negativo de las sales en la parte aérea de la planta (Meza et al., 2004). En dos variedades de caraota (García et al., 2010), el uso de 8 dS m-1 de NaCl produjo un efecto drástico en las plantas, con clorosis y necrosis en las hojas a los siete y 14 días de desarrollo, que pudo ocasionar la disminución del contenido relativo de la clorofila y el incremento de la peroxidación de los lípidos a nivel foliar. En lechosa (Parés et al., 2008), la concentración de 8 dS m-1 de NaCl ocasionó variaciones en el índice estomático, la densidad estomática y el espesor de los tejidos foliares. Los síntomas observados en las plántulas de curarí en estrés salino tienen cierta coincidencia con lo señalado para otras especies (Meza et al., 2004; García et al., 2010).
Los resultados de esta investigación representan una importante contribución, ya que no existen otras al respecto, y además sientan las bases para posteriores estudios en esta especie. Se concluye que la concentración de NaCl influyó significativamente en el porcentaje de germinación, la tasa de germinación, la longitud del tallo y de la raíz, el área cotiledonal y la biomasa seca de curarí. Dichas variables constituyen excelentes marcadores o indicadores de crecimiento y morfológicos tempranos, de la tolerancia de este árbol a la salinidad por NaCl. El menor crecimiento o longitud de la raíz principal, así como la coloración marrón de los tejidos, permitieron reconocer rápidamente los síntomas del estrés salino en dicha especie. Las plántulas de curarí mostraron tolerancia a la condición salina de NaCl hasta 6 dS m-1, por lo que se pueden utilizar con fines agroforestales en los sistemas de producción agropecuaria y en la recuperación de áreas que tengan problemas moderados de salinidad.
AGRADECIMIENTOS
Se agradece al CONDES-LUZ por el financiamiento parcial de esta investigación, en el proyecto «Propagación de especies de interés hortícola y autóctonas de la altiplanicie de Maracaibo y sus alrededores con fines de recuperación de siembra, bosques y áreas verdes».
REFERENCIAS BIBLIOGRÁFICAS
1. Argentel, L.; González, L. M. & Plana, R. Respuestas de 12 variedades de trigo a la salinidad en las etapas iniciales del crecimiento. Cultivos tropicales. 27 (3):41-44, 2006a.
2. Argentel, L.; González, L. M. & Plana, R. Efecto de las altas concentraciones salinas sobre la germinación y el crecimiento del trigo (Triticum aestivum) variedad Cuba-C-204. Cultivos tropicales. 27 (3):45-48, 2006b.
3. Azcón, J. & Talón, M. Fundamentos de fisiología vegetal. 2da ed. Madrid: McGraw-Hill Interamerican, 2008.
4. Barkla, B.; Vera, R.; Balderas, E. & Pantoja, O. Mecanismos de tolerancia a la salinidad en plantas. En: F. Rebolledo y A. López, eds. Una ventana al quehacer científico. México, D.F.: Instituto de Biotecnología, UNAM. p. 263-272, 2008, http://www.ibt.unam.mx/computo/pdfs/libro_25_aniv/capitulo_23.pdf. [28/6/2013].
5. Bazzigalupi, O.; Pistorale, S. & Andrés, A. Tolerancia a la salinidad durante la germinación de semillas provenientes de poblaciones naturalizadas del pasto agropiro alargado (Thinopyrum ponticum). Ciencia e Investigación Agraria. 35 (3):277-285, 2008.
6. Camejo, Daymi & Torres, W. La salinidad y su efecto en los estadios iniciales del desarrollo de dos cultivares de tomate (Lycopersicon esculentum Mill). Cultivos tropicales. 21 (2):23-26, 2000.
7. Casierra, F. Distribución y producción total de materia seca en guayabo (Psidium guajava L. cv. Palmira ICA-1) bajo estrés salino. Orinoquia. 10 (2):59-66, 2006.
8. Chilo, G.; Vacca, M.; Carabajal, R. & Ochoa, M. Efecto de la temperatura y salinidad sobre la germinación y crecimiento de plántulas de dos variedades de Chenopodium quinoa. Agriscientia. 26:15-22, 2009.
9. Cortés, V. & Saavedra, G. Algunos efectos de la salinidad en cultivos de tomate y prácticas agronómicas de su manejo. IDESIA. 25 (3):47-58, 2007.
10. Franco, V. & Véliz, J. Respuestas de la tuna (Opuntia ficus-indica. I. Mill) al NaCl. Interciencia. 32 (2):125-130, 2007.
11. García, J. P. S.; Valdés, A.; Facio, F.; Arce, L. & Burciaga, H. Calidad fisiológica de semilla de coquia (Kochia scoparia (L.) Roth) a diferentes niveles de salinidad con KCl. Revista Agraria -Nueva Época. 8 (3):12-17, 2011.
12. García, M.; García, G. & Sanabria, M. Efecto de la salinidad sobre el crecimiento, daño oxidativo y concentración foliar de metabolitos secundarios en dos variedades de caraota (Phaseolus vulgaris L.). Interciencia. 35:840-846, 2010.
13. González, L. M.; González, María C. & Ramírez, R. Aspectos generales sobre la tolerancia a la salinidad en las plantas cultivadas. Cultivos tropicales. 23 (2):27-37, 2002.
14. Hoyos, J. Árboles tropicales ornamentales cultivados en Venezuela. Venezuela: Sociedad de Ciencias Naturales La Salle. Monografía 38, 1992.
15. Justiniano, M.; Fredericksen, T. & Nash, D. Ecología y silvicultura de especies menos conocidas Tajibos o Lapachos Tabebuia spp. Proyecto de Manejo Forestal Sostenible. Santa Cruz, Bolivia: BOLFOR, 2000.
16. Lesmes, R.; Molano, Ángela; Miranda, D. & Chaves, B. Evaluación de concentraciones de sal (NaCl) en el agua de riego sobre el crecimiento de lechuga `Batavia' (Lactuca sativa L.). Revista Colombiana de Ciencias Hortícolas. 1 (2):222-235, 2007.
17. Machado, C.; Olivera, J.; David, A. & Guimarães, R. Metodologia para a condução do teste de germinação em sementes de ipê-amarelo (Tabebuia serratifolia (Vahl) Nicholson). CERNE. 8 (2):17-25, 2002.
18. Martínez, Nallely; López, C.; Basurto, M. & Pérez, Ramona. Efectos por salinidad en el desarrollo vegetativo. Medio Ambiente y Desarrollo Sustentable. V (3):156-161, 2010.
19. Meza, N.; Arizaleta, M. & Bautista, D. Efecto de la salinidad en la germinación y la emergencia de semillas de parchita. (Passiflora edulis f. flavicarpa). Revista de la Facultad de Agronomía (LUZ). 24 (1):69-80, 2007.
20. Meza, N.; Pereira, A. & Bautista, D. Efecto de la salinidad en la germinación y emergencia de semillas de níspero (Manilkara achras Miller Fosberg). Revista de la Facultad de Agronomía (LUZ). 21 (supl.):60-66, 2004.
21. Morales, D.; Rodríguez, P.; Dell´Amico, J.; Torrecilla, A. & Sánchez, M. Efecto del estrés por NaCl en el crecimiento y las relaciones hídricas en plantas de tomate (Solanum lycopersicum L.) durante el periodo vegetativo. Cultivos tropicales. 31 (4):76-81, 2010.
22. Parés, J.; Arizaleta, M.; Sanabria, María E. & García, Grisaly. Efecto de los niveles de salinidad sobre la densidad estomática, índice estomático y grosor foliar en plantas de Carica papaya L. Acta Botánica Venezuelica. 31 (1):27-34, 2008.
23. Perozo, A.; Ramírez, M.; Gómez, A. & Buitrago, N. Germinación y caracterización morfológica de plántulas de merey (Anacardium occidentale L.) tipo Amarillo. Revista de la Facultad de Agronomía (LUZ). 23 (1):17-27, 2006.
24. Ramírez, Maribel; Suárez, Hallely; Regino, Marines; Caraballo, Brigida & García, D. Respuesta a tratamientos pregerminativos y caracterización morfológica de plántulas de Leucaena leucocephala, Pithecellobium dulce y Ziziphus mauritiana. Pastos y Forrajes. 35 (1):29-41, 2012.
25. SAS. SAS/ STAT User's guide, Release 9.1.3. Cary, USA: SAS Inst., 2010.
26. Vargas, C.; Lawrence, A. & Eid, M. Árboles y arbustos para sistemas agroforestales en los valles interandinos de Santa Cruz, Bolivia. Santa Cruz de la Sierra, Bolivia: Editorial FAN, 2000.
Recibido el 11 de julio de 2013
Aceptado el 14 de octubre de 2013