Introducción
La morera (Morus alba L.) se introdujo en Cuba con fines forrajeros para la alimentación animal, y se ha demostrado que posee excelentes cualidades nutricionales para la alimentación de diferentes especies de animales (Noda-Leyva y Martín-Martín, 2017). Esta planta tiene una gran capacidad adaptativa a diferentes condiciones edafoclimáticas, puede producir entre 10 y 12 t de materia seca por hectárea al año, contiene de 20 a 25 % de proteína bruta, y la digestibilidad de la materia seca es superior a 80 % (Martín et al., 2014). Además, es reconocida por su valor comercial en la industria cosmética y medicinal, y sus propiedades fitoquímicas antioxidantes e hipoglucemiantes han sido ampliamente utilizadas en la producción de medicamentos (Huh et al., 2017).
La propagación de la morera se realiza generalmente por estaca; sin embargo, en dependencia del cultivar existen ciertos aspectos -como la baja tasa de supervivencia y de multiplicación, así como la dificultad de enraizamiento-que limitan la propagación de esta especie vegetal con fines productivos (Castro-Ramírez, 2010).
La propagación in vitro de especies vegetales ha surgido como una alternativa valiosa para la propagación de especies de interés económico y ornamental, debido a que posibilita la producción de grandes cantidades de plantas en un período de tiempo relativamente corto; es una excelente herramienta para la preservación y recuperación de especies que han disminuido significativamente sus poblaciones y para la mejora genética.
Los programas de mejora genética de la morera están orientados al incremento de los rendimientos del follaje. Sin embargo, debido a la alta heterocigocidad y a los largos períodos para la regeneración de las plantas, las técnicas convencionales de mejoramiento genético están limitadas; por ello ha sido necesario complementarlas con modernas técnicas biotecnológicas, tales como el cultivo de tejidos, técnicas moleculares de recombinación del ADN y marcadores moleculares (Vijavan et al., 2014).
El éxito de las técnicas de cultivo de tejidos depende esencialmente de tener bien establecido un protocolo que incluya las diferentes etapas del proceso, como son la propagación, el enraizamiento y la aclimatación de las plantas (Resende et al., 2015).
En Cuba se han realizado diversos trabajos de investigación orientados a establecer un protocolo eficiente de propagación in vitro de la morera, entre los que se destacan los de Salas et al. (2005) y Salas et al. (2011), encaminados a la propagación de esta planta mediante organogénesis en medio de cultivo semisólido y en sistemas de inmersión temporal. Asimismo, es de señalar que aunque los estudios relacionados con la aclimatación de plantas de morera provenientes de cultivo de tejidos son escasos, Salas et al. (2005) obtuvieron valores de supervivencia entre 60 y 70 % cuando evaluaron el efecto del sustrato, además de los caracteres morfológicos de las plantas en condiciones de campo.
Las plantas que provienen del cultivo de tejidos, generalmente, requieren de tratamientos para prevenir su muerte después de transferidas a condiciones ex vitro, ya que las producidas in vitro son incapaces de resistir los cambios de ambiente a los que se enfrentan, debido a que se han desarrollado en un ambiente aséptico, con variaciones mínimas de temperatura, alta humedad y disponibilidad de nutrientes y baja concentración de dióxido de carbono. Por ello, la transferencia debe realizarse de forma gradual; durante esta etapa se produce un retorno gradual al funcionamiento autotrófico de las vitroplantas, así como la recuperación de las características morfológicas y fisiológicas normales (Silva et al., 2017).
Tomando en consideración todo lo anteriormente mencionado se realizó esta investigación que tuvo como objetivo evaluar la influencia del tamaño y el tipo de sustrato en la aclimatación de plantas in vitro de M. alba.
Materiales y Métodos
El estudio se realizó en el área de aclimatación del Centro de Estudios de Biotecnología Vegetal perteneciente a la Facultad de Ciencias Agropecuarias, en la Universidad de Granma (UDG) -Cuba-, en el periodo de octubre 2017 a junio de 2018.
Se hicieron tres experimentos; el material vegetal utilizado en el primero y en el segundo consistió en vitroplantas de M. alba de la variedad acorazonada, enraizadas durante 60 días en un medio de cultivo constituido por las sales Murashige y Skoog (1962), suplementadas con ácido indolbutírico 1 mg.L-1, tiamina 1 mg.L-1, mioinositol 100 mg.L-1, sacarosa 20 g. L-1, y solidificado con agar 6 g.L-1 El pH fue ajustado a 5,7. En el tercer experimento se utilizaron plantas de morera aclimatizadas durante 30 días en condiciones ex vitro, con una longitud de 7,03 cm y seis hojas, como promedio.
Todos los experimentos se desarrollaron en la casa de adaptación del Centro de Estudios de Biotecnología Vegetal de la Facultad de Ciencias Agropecuarias, bajo una malla sarán de color negro, para regular la iluminación.
En el primer y el segundo experimento las plantas se extrajeron de los frascos de cultivo. Las raíces se lavaron de forma cuidadosa con abundante agua, para eliminar los restos del medio de cultivo; y se colocaron en un recipiente con agua corriente, para evitar su deshidratación, durante un período de 13 a 14 horas antes de ser trasplantadas a las condiciones ex vitro.
En el momento de plantar se cubrió totalmente el sistema radical de las vitroplantas con el sustrato, presionando ligeramente para garantizar que estas se fijaran. Se utilizaron bandejas de polieturano de 70 alveolos, con una capacidad de cada alveolo de 120 cm3 de sustrato; en cada uno se plantó una vitroplanta, y todas fueron cubiertas con pomos de cristal transparente durante siete días, con el fin de mantener una humedad relativa alta y con ello disminuir la pérdida de agua. Después de transcurrido este tiempo se eliminó la cubierta.
En el tercer experimento se utilizaron bolsas de polietileno negro, llenas hasta las tres cuartas partes con la mezcla del sustrato a evaluar. El riego en todos los experimentos se realizó diariamente con una regadera manual, hasta que el sustrato estuvo saturado.
Para todos los experimentos se utilizó un diseño completamente aleatorizado con tres réplicas. En cada repetición se plantaron 15 vitroplantas, para un total de 45 por tratamiento.
En el experimento 1 se estudió la influencia del tamaño en la aclimatización de plantas in vitro de morera. Estas fueron clasificadas de acuerdo con su longitud en tres grupos y ello permitió conformar los tratamientos siguientes: T1: pequeñas (1,5-2,5 cm), T2: medianas (2,5- 3,5 cm), T3: grandes (> 3,5 cm). Se utilizó como sustrato una mezcla de suelo (70 %)-estiércol vacuno (20 %)-zeolita (10 %).
Por su parte, en el experimento 2 se estudió la influencia del tipo de sustrato en la aclimatización de plantas in vitro de morera. Las plantas se seleccionaron con la mayor homogeneidad posible en relación con su longitud (2,5-3,0 cm). Se evaluaron tres mezclas de sustrato, seleccionadas de acuerdo con los resultados obtenidos en otros estudios con especies leñosas (Cholo-Masapanta y Delgado-Rodríguez, 2011). Los tratamientos fueron los siguientes: T1: suelo (70 %)-estiércol vacuno (20 %)-zeolita (10 %), T2: suelo (45 %)-estiércol vacuno (45 %)-zeolita (10 %), T3: suelo (90 %)-zeolita (10 %).
Mientras, en el experimento 3 se estudió el efecto del tipo de sustrato en el crecimiento de plantas provenientes de la fase de aclimatización en condiciones de vivero. Las plantas de morera aclimatizadas durante 30 días se extrajeron cuidadosamente de las bandejas para conservar el sustrato (mota), y se colocaron de forma individual en bolsas de polietileno negro que contenían diferentes mezclas de sustrato. Se evaluaron los siguientes tratamientos: T1: suelo (70 %)-estiércol vacuno (20 %)-zeolita (10 %), T2: suelo (45 %)-estiércol vacuno (45 %)-zeolita (10 %), T3: suelo (90 %)-zeolita (10 %). A los 30 días de sembradas se tomaron las 45 plantas de cada tratamiento, y se evaluaron las variables siguientes:
Longitud de las plantas (cm): se midió con una regla, desde la base del tallo hasta el ápice de la hoja superior.
Número de hojas por planta: se determinó por conteo del número de hojas totalmente extendidas.
Longitud de las hojas (cm): se midió con una regla, desde la inserción del limbo con el peciolo hasta el ápice de la hoja.
Ancho de la hoja (cm): se midió con una regla, por la parte más ancha de la hoja.
Análisis estadístico. La normalidad se comprobó por la prueba de Kolmogorov-Smirnov, y la homogeneidad de las varianzas, por el test de Levene. Para las variables que cumplieron con los supuestos se realizó un análisis de varianza; mientras que la variable supervivencia se procesó mediante un análisis de diferencias de proporciones. En los casos donde hubo diferencias significativas entre las medias, se aplicó la prueba de comparación múltiple de rango de Tukey para p ≤ 0,05. Se utilizó el paquete estadístico Infostat 2017 (Di Rienzo et al., 2017).
Resultados y Discusión
Influencia del tamaño en la aclimatación de las vitroplantas de morera
El adecuado tamaño y la buena calidad de las vitroplantas es un factor importante a considerar durante la fase de aclimatización, porque de ello dependerá la supervivencia, la velocidad de crecimiento y la producción final en la fase de campo.
Las vitroplantas cultivadas durante 30 días en condiciones ex vitro mostraron diferencias en la supervivencia; se alcanzaron valores significativamente superiores con las de menor longitud (1,5-2,5 cm) respecto al resto de los tratamientos, los cuales no difirieron entre sí (tabla 1). En todos los tratamientos la supervivencia se consideró alta; y las vitroplantas presentaban hojas turgentes, totalmente extendidas, de color verde oscuro característico de la especie.
Tabla 1 Influencia del tamaño en la aclimatización de vitroplantas de morera a los 30 días posteriores a la siembra.
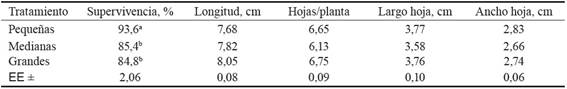
Medias con letras diferentes por columna difieren significativamente, según prueba de Tukey, para p < 0,05.
Los buenos resultados en este indicador pudieran atribuirse al adecuado manejo durante esta fase, a las condiciones ambientales en las cuales se desarrolló el experimento y a las características de la especie, que la hacen resistente a las condiciones ex vitro. Ello coincide con lo obtenido por Pérez-Alonso et al. (2016) en la aclimatización de plantas in vitro de Aloe vera L. (sábila) y por Salas et al. (2011) en vitroplantas de morera, quienes consideran que las condiciones de cultivo en las cuales se desarrolla el proceso de aclimatización son determinantes para obtener altos valores de supervivencia.
El resto de las variables morfológicas no mostraron diferencias significativas en los tratamientos al final del periodo; sin embargo, debe destacarse que las plantas de menor tamaño alcanzaron los mayores incrementos en longitud (5,38 cm) y en número de hojas, lo que indica que fueron capaces de recuperarse más rápido del estrés inicial originado por el trasplante a condiciones ex vitro y reiniciar el crecimiento y desarrollo en un menor tiempo, en comparación con las de mayor tamaño; ello pudiera estar asociado a una mejor conformación y calidad del follaje y del sistema radical de las plantas de menor talla.
Palhares et al. (2004), al evaluar la influencia del tamaño de las plantas in vitro durante la aclimatización de Eucalyptus urograndis obtenidas en sistemas de inmersión temporal, obtuvo el mayor porcentaje de supervivencia (63 %) y los mayores valores en las variables de crecimiento (longitud, número de hojas y número de raíces emitidas) en las plántulas con menores tallas. Los autores concluyeron que, al parecer, no es la talla la variable que tiene mayor efecto en la supervivencia de las plántulas de E. urograndis durante la aclimatización, sino la calidad de los diferentes órganos que la conforman.
La calidad y el número total de hojas de las plantas tienen un efecto directo en el éxito de la aclimatización. En todos los tratamientos se observó un incremento en la emisión de hojas nuevas, sin diferencias significativas entre ellos, y tampoco hubo diferencias en el ancho y el largo de las hojas. La mayoría de los estudios del tejido foliar de las plantas que provienen de condiciones in vitro refieren que el mesófilo de estas hojas posee un tejido en empalizada poco desarrollado, generalmente formado por una sola capa de células y en lo fundamental compuesto por tejido esponjoso con grandes espacios intercelulares (Molina-El-Hage et al., 2008; Soares y Savonitti, 2016). Ello limita que tengan una óptima funcionalidad, por lo que la emisión de nuevas hojas en condiciones ex vitro causa directamente un mayor crecimiento y desarrollo de las plántulas, ya que alcanzan una mayor actividad fotoautotrófica.
Por su parte Albany et al. (2006), al establecer una metodología de propagación in vitro de la sábila, evaluaron la influencia del tamaño de las vitroplantas (pequeñas: < 5 cm, medianas: 5-10 cm, grandes >10 cm) durante la fase de aclimatización. No hubo diferencias significativas en el porcentaje de supervivencia, en función del tamaño de las vitroplantas. Después de 60 días de adaptación a las condiciones ex vitro todas las plantas estaban vivas y mostraron un crecimiento uniforme, a pesar de las diferencias de tamaño al momento del trasplante.
Influencia del tipo de sustrato en la aclimatación de las vitroplantas de morera
Entre los factores con mayor influencia en la aclimatización de las vitroplantas se encuentra el tipo de sustrato y su composición, el cual determina una adecuada retención de humedad y los componentes químicos para proveer a la planta de agua y nutrientes; y, al mismo tiempo, ejerce una influencia significativa en la arquitectura del sistema radical, lo que influye en el estado nutricional y la translocación de agua en las plantas. Por ello, es necesario prestar especial atención a su selección y uso.
La supervivencia de las vitroplantas no mostró diferencias significativas entre los tratamientos, con valores superiores al 80 %, los cuales pueden considerarse aceptables para las condiciones en las que se desarrolló el experimento (tabla 2).
Tabla 2 Efecto del tipo de sustrato en la aclimatización de plantas in vitro de morera a los 30 días posteriores a la siembra.
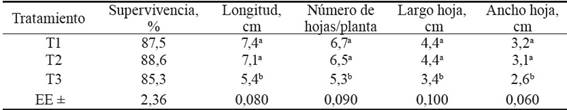
Medias con letras diferentes en una misma columna difieren estadísticamente según Tukey para p≤0,05.
Estos resultados pudieran estar asociados al manejo y a las condiciones en las cuales se mantuvieron las plantas durante la aclimatización: la humedad adecuada, que se garantizó por la frecuencia y el tipo de riego y por el uso de cobertores en la casa de cultivo; una iluminación moderada, a través de las mallas de sombreo; y el mantenimiento de las plantas in vitro durante la fase de multiplicación y enraizamiento en cámara de crecimiento con luz solar, con un fotoperiodo de 13-11 h de luz/oscuridad.
El estiércol, uno de los componentes utilizados en las mezclas de los sustratos, al añadirse al suelo, contribuye a mejorar sus propiedades biológicas y físico-químicas, ya que resulta una importante fuente de energía y de nutrientes para el ecosistema edáfico (Cairo-Cairo y Álvarez-Hernández, 2017).
La adición de zeolita a los sustratos favorece la aireación, la absorción de nutrientes por la planta y el mejor suministro de agua, lo que conduce a obtener una planta de excelente calidad fisiológica en la fase de aclimatización (Urbina-Sánchez et al., 2006).
El tipo de sustrato empleado tuvo efecto significativo en el crecimiento y desarrollo de las plantas in vitro en la casa de cultivo. Los mejores resultados para todas las variables se obtuvieron al emplear el sustrato compuesto por 70 % de suelo-20 % de estiércol vacuno y 10 % de zeolita (T1), sin diferencias significativas con T2 (mezcla de 45 % de suelo-45 % de estiércol vacuno y 10 % de zeolita), pero significativamente superiores a T3 (mezcla de 90 % de suelo y 10 % de zeolita). Estos resultados indican el efecto beneficioso de la inclusión de estiércol vacuno en estas mezclas, lo cual pudiera estar asociado a la mejoría de las propiedades físicas del sustrato y al contenido de nutrientes y materia orgánica que se logra con la adición del estiércol.
Resultados similares en la variable supervivencia fueron informados por Salas et al. (2011), quienes hallaron valores superiores al 90 % en vitroplantas de M. alba provenientes de sistemas de inmersión temporal y de medios de cultivo semisólidos en diferentes sustratos y mezclas de sustratos compuestos por zeolita y humus de lombriz.
Al respecto, Clapa et al. (2015) reportaron 90 % de supervivencia en vitroplantas de Morus nigra L. cuando utilizaron mezclas de sustratos sólidos comerciales. Sin embargo, en un estudio para la aclimatación de plantas in vitro de esta especie, en el que se utilizó como sustrato una mezcla de suelo, vermicompost y arena (1:1:2), Gogoi et al. (2017) observaron un severo marchitamiento y baja supervivencia (40 %) cuando las plantas fueron transferidas directamente al invernadero, lo cual fue atribuido al poco desarrollo de los estomas y de la cera epicutilar, que ocasionó la pérdida de agua en la superficie de las hojas.
Por su parte, Indacochea-Ganchozo et al. (2017) evaluaron la aclimatación de tres especies forestales en peligro de extinción [Myroxylon balsamum (L.) Harms, Tabebuia crhysantha y Tabebuia billbergii (Bureau & K.Schum.) Standl.], con el empleo de un sustrato compuesto por 40 % de arena de río, 40 % de humus de lombriz y 20 % de aserrín de madera descompuesta. La aclimatación de las vitroplantas de las tres especies se logró en un periodo de diez semanas, con una supervivencia de 65, 80 y 70 %, respectivamente; y las vitroplantas alcanzaron un tamaño entre 17,07 y 19,53 cm y un número de hojas que varió entre 7 y 14 por planta.
Efecto del tipo de sustrato en el crecimiento de vitroplantas en condiciones de vivero
En la mayoría de los cultivos, las plantas obtenidas por cultivo de tejidos requieren ser trasplantadas a bolsas de polietileno hasta que las vitroplantas alcancen los requerimientos de calidad para su plantación en condiciones de producción.
Las variables longitud de las plantas y número de hojas por planta fueron significativamente superiores en T1 y T2, en comparación con T3 (tabla 3); mientras que las variables largo y ancho de la hoja no mostraron diferencias significativas entre los tratamientos. Los resultados pueden estar dados por la inclusión de estiércol vacuno en los sustratos de T1 y T2, el cual contribuye a mejorar las propiedades físicas y químicas de los suelos y es una fuente de materia orgánica y nutrientes que favorece el desarrollo de las plantas.
Tabla 3 Influencia del tipo de sustrato sobre el desarrollo de vitroplantas de morera en condiciones de vivero.
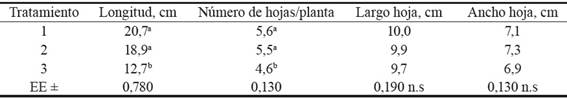
Medias con letras diferentes por columna difieren significativamente según prueba de Tukey para p < 0,05.
En una investigación realizada por Vílchez et al. (2015), se comparó el crecimiento en vivero de plántulas y vitroplantas de guayabo cv. Enana Roja Cubana EEA-1840, sobre un sustrato compuesto por una mezcla de abono y arena lavada de río en proporción 3:1. Durante los 70 días después del trasplante, se evaluaron con una frecuencia quincenal los componentes fisiológicos del crecimiento, tales como: acumulación de materia seca, tasa de crecimiento del cultivo, índice de crecimiento relativo, tasa de asimilación neta, área foliar, número de hojas y longitud del tallo y de la raíz. Durante los primeros 28 días después del trasplante, las plántulas superaron a las vitroplantas en acumulación de materia seca y en crecimiento; pero posteriormente, y hasta culminar el período de evaluación, las vitroplantas superaron a las plántulas en los indicadores evaluados. Tales resultados coinciden con los obtenidos en este trabajo, donde se observó un crecimiento y desarrollo de las vitroplantas a medida que transcurrió el tiempo de aclimatación; al final del periodo de evaluación se obtuvieron plantas normales y vigorosas, con la talla apropiada para ser plantadas en el campo.
Por su parte, Adriano-Anaya et al. (2013) investigaron el uso de compost durante la etapa de aclimatación de vitroplantas de banano clon Gran Enano (Musa AAA) en bolsas de polietileno. Los resultados indicaron que el desarrollo de las plantas fue inhibido en los sustratos con más de 30 % de compost, lo que se atribuyó a un posible efecto de fitotoxicidad causado por las características químicas de los sustratos de siembra, por lo que los autores asumieron que el contenido de sales en los sustratos pudo ser el factor que limitó el desarrollo de las plantas. En la presente investigación los sustratos no mostraron fitotoxicidad en ninguna de las combinaciones empleadas.
Se concluye que el empleo de plantas in vitro con un tamaño entre 1,5 y 2,5 cm y mezclas de sustratos compuestas por suelo-estiércol vacuno y zeolita en una relación 70-20-10 % y 45-45-10 % durante la aclimatación permitió alcanzar altos valores de supervivencia y mayor crecimiento y desarrollo de las plantas de M. alba.