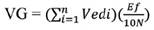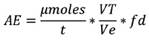Introducción
En la actualidad, existe una tendencia global hacia una agricultura sostenible con el uso mínimo de productos químicos, que desequilibran el medio ambiente y causan daños a la salud humana y animal. La obtención de nuevos bioproductos que estimulen el crecimiento y el desarrollo de los cultivos constituye una estrategia importante para desarrollar un manejo agroecológico de los ecosistemas. Entre estos productos se encuentran los bioplaguicidas, los bioestimulantes y los biofertilizantes, por ejemplo, los microorganismos eficientes (Ullah et al., 2012).
El uso de bioproductos, como el IHPLUS®, se basa en la inoculación de cultivos mixtos de microorganismos beneficiosos al suelo, y contribuye al desarrollo de la agricultura ecológica, ya que es una tecnología de bajo costo (Olle, 2015). Estos productos a base de microorganismos se utilizan tradicionalmente para estimular la germinación, el crecimiento y el desarrollo de las plantas, debido a que producen numerosos compuestos bioactivos (Biswas et al., 2014; Chagas Jr. et al., 2015); para el control de enfermedades presentes en el suelo (Grosu et al., 2015); y, más recientemente, se emplean de manera exitosa en la reducción de los contaminantes orgánicos como resultado de la actividad industrial (Khatab et al., 2015).
En Cuba, el sorgo (Sorghum bicolor L. Moench). cv. UDG-110, de polinización libre, fue introducido y seleccionado en la Universidad Central Marta Abreu de Las Villas a finales de 1990. El periodo comprendido entre la siembra y germinación varía de 3 a 5 días. A partir de la siembra y hasta la diferenciación floral transcurren de 35 a 45 días, etapa en la cual la planta tiene una altura de 45 a 55 cm. La floración o antesis es de 6 a 8 días; en esta fenofase la planta alcanza su máxima área foliar, y su altura fluctúa entre 122 y 142 cm (García-Martín, 1993).
El sorgo está considerado como un cultivo multipropósito de importancia en la economía agrícola mundial, y representa un recurso de valor para la alimentación animal y humana por su potencial nutritivo elevado. El grano es rico en contenido proteico y micronutrientes, y constituye una opción para las personas celíacas e intolerantes por la ausencia de gluten. Además, es una planta ideal para la sostenibilidad del sistema agroalimentario (Proietti et al., 2015). Por tanto, el presente trabajo tuvo como objetivo evaluar el efecto del bioproducto IHPLUS® y tiempos de inmersión en el proceso de germinación de S. bicolor cv. UDG-110.
Materiales y Métodos
Material vegetal. Se utilizaron semillas certificadas de sorgo UDG-110 las cuales fueron proporcionadas por la Estación Experimental de Pastos y Forrajes Indio Hatuey, de la provincia de Matanzas.
IHPLUS ® . Los experimentos se realizaron con el lote 31 de inóculo líquido de IHPLUS®, al que se le realizó la prueba de calidad; así, el conteo total de los principales grupos de microorganismos beneficiosos se encontró dentro de lo establecido y no tuvo crecimiento de patógenos.
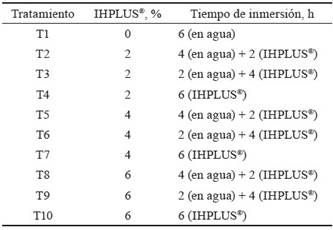
Tratamientos. Las semillas de S. bicolor fueron tratadas previamente con diferentes concentraciones de IHPLUS® y distintos tiempos de inmersión. Posteriormente fueron colocadas sobre dos capas de papel de filtro, en placas Petri de 5 cm de diámetro para la germinación (tabla 1).
Indicadores morfofisiológicos
Prueba de germinación. La prueba de germinación se realizó en placas Petri de 5 cm de diámetro. Se emplearon cuatro réplicas (placas Petri) por tratamiento, con 25 semillas de sorgo cada una. Las semillas se colocaron en papel de filtro humedecido con agua, en una proporción de tres veces el peso del sustrato seco (ISTA, 2014). El proceso de germinación se evaluó diariamente durante siete días, y los resultados fueron expresados en porcentaje de plántulas normales. El ensayo de germinación se desarrolló en un cuarto de crecimiento a temperatura de 25 ± 2 ºC, con un fotoperiodo de 16 h día-1 (flujo de fotones fotosintéticos: 35 µmol m-2 s-1).
Evaluación del valor de germinación (VG). Se determinó mediante la fórmula de Djavanshir y Pourbeik (1976).
Donde:
Ved |
velocidad de emergencia diaria, calculada como el porcentaje de la emergencia acumulada entre el número de días desde el inicio de la prueba. |
N |
frecuencia o número de Ved que se calcularán durante la prueba. |
Ef |
porcentaje de la emergencia de plántulas al final de los días de la prueba. |
Indicadores morfológicos. Se evaluaron las longitudes (cm) de la raíz y de la parte aérea de las plántulas a los siete días de germinadas, con el uso de papel milimetrado.
Indicadores bioquímicos
Actividad enzimática α-amilasa. El extracto enzimático se realizó en frío, por homogenización del material vegetal (plántulas de siete días de germinadas), en una solución tampón de citrato de sodio pH 5,0 en proporción 1:2 (p/v). La mezcla se centrifugó durante 10 minutos a 10 000 rpm y 4 ºC. El sobrenadante se colectó para la determinación de la actividad enzimática.
La actividad α-amilasa se determinó como se describe a continuación. A 0,4 mL de una solución de almidón al 1 % (p/v) en tampón de fosfato de sodio 20 mmol.L-1 pH 6,9, se le agregó 0,1 mL del extracto enzimático y se dejó reaccionar durante 10 min a 37 ºC. La reacción se detuvo con la adición de 0,5 mL de ácido 3,5-dinitrosalicílico. Posteriormente la mezcla reaccionante se calentó a 100ºC durante 10 minutos y se le agregó 1,2 mL de agua destilada. La absorbancia se determinó a 546 nm. La actividad enzimática se expresó como µmoles×min-1 de glucosa liberados por μg de proteína a pH 6,9 y 37 ºC.
El cálculo de la actividad enzimática (AE) se realizó mediante la fórmula siguiente:
Donde:
T |
tiempo del ensayo |
VT |
volumen total del ensayo (0,5 mL) |
Ve |
volumen de la muestra (0,1 mL) |
Fd |
factor de dilución del extracto enzimático |
Todas las mediciones espectrofotométricas descritas fueron realizadas en un espectrofotómetro UV/VIS Ultrospec 2000 (Pharmacia Biotech, Suecia).
Método de extracción del material vegetal para determinar el contenido de azúcares reductores y proteínas solubles totales . La extracción y cuantificación de proteínas y azúcares reductores se realizó en las raíces y en la parte aérea de las plántulas de S. bicolor, a los siete días de iniciado el experimento de germinación. El material vegetal fue macerado en frío con solución tampón de fosfato de sodio 50 mmol.L-1, pH 7,0 y en una proporción 1:3 (p/v). El homogenizado se centrifugó a 10 000 rpm y se colectó el sobrenadante, el cual se conservó a -20 ºC hasta el momento de las determinaciones.
Azúcares reductores . El contenido de azúcares reductores fue determinado por el método del ácido dinitrosalisílico, y se empleó la D-glucosa (Sigma) como azúcar patrón (Miller, 1959). Los valores de absorbancia fueron leídos a una longitud de onda de 456 nm. La concentración se expresó en mg mL-1 a partir de la curva patrón.
Proteínas solubles totales . El contenido proteico se determinó colorimétricamente mediante el método descrito por Lowry et al. (1951), con el uso de albúmina de suero bovino (BSA) como patrón. Los valores de absorbancia se obtuvieron a 750 nm y las concentraciones (mg mL-1) se determinaron mediante la curva patrón.
Diseño experimental. Se utilizó un diseño completamente aleatorizado. Para los ensayos de germinación se realizaron cuatro réplicas (placa Petri) por tratamiento, y en el caso de los análisis bioquímicos se hicieron por triplicado. Se tomaron cinco muestras por tratamiento, mientras que para la evaluación de parámetros morfológicos y fisiológicos se analizaron 10.
Análisis estadístico. Los datos fueron procesados con el paquete estadístico SPSS®, versión 15.0 para Windows®. Se determinó el ajuste de los datos a una distribución normal, mediante la prueba de bondad de ajuste Kolmogorov (Sigarroa, 1985). Los datos cumplieron los supuestos de homogeneidad de varianza y distribución normal, y se procesaron mediante un ANOVA. Se usó la prueba de rangos múltiples de Tukey para la comparación entre las medias.
Resultados y Discusión
Indicadores morfofisiológicos
Germinación de S. bicolor con la aplicación de IHPLUS ®
En la figura 1 se muestra el efecto de IHPLUS® sobre el porcentaje de germinación de S. bicolor, durante siete días. A las 24 horas, las semillas tratadas con el bioproducto mostraron una mayor respuesta; los valores más elevados se obtuvieron a los siete días con la variante 6 %-4 h de inmersión, con un porcentaje de germinación superior al 80 %.

Figura 1 Porcentaje de germinación de semillas de S. bicolor, tratadas con diferentes concentraciones de IHPLUS® y tiempos de inmersión.
Estos resultados coindicen con los obtenidos por Babu y Balasaravanan (2017), quienes aislaron y caracterizaron cepas bacterianas provenientes de la rizosfera que presentaban buenas características como promotoras del crecimiento de las plantas. La inmersión de semillas de Solanum melongena L. en soluciones que contenían estas bacterias produjo un incremento del porcentaje de germinación (97 %), en comparación con el del control (60 %). De manera similar, la inmersión de semillas de Solanum lycopersicum L. en un biopreparado a base de cepas halotolerantes de Bacillus megaterium provocó un aumento del porcentaje de germinación respecto al control en condiciones de salinidad (Chookietwattana y Maneewan, 2012).
El incremento en el porcentaje de germinación observado en los tratamientos con IHPLUS®, durante los primeros días del experimento, puede estar relacionado con la entrada hacia el interior de las semillas de sustancias reguladoras del crecimiento, tales como auxinas, citoquininas y giberelinas producidas por los microorganismos del IHPLUS® durante el proceso de imbibición (Khatab et al., 2015; Thakur y Parikh, 2015; Damam et al., 2016). Como refieren Taiz y Zeiger (2013) y Mohite (2013), estos compuestos estimulan procesos como la división y el alargamiento celular, que permiten el crecimiento de las diferentes estructuras vegetales.
Los valores de germinación en los tratamientos con IHPLUS® fueron superiores a los del control. Los mejores resultados se obtuvieron con los tratamientos 6 %-4h y 4 %-4h (fig. 2). Los tratamientos con el bioproducto adelantaron en 24 h el día pico al tratamiento control, cuyo valor más alto de germinación se observó a las 48 horas de iniciado el experimento.
Estos resultados coinciden con los obtenidos por Higa (1991), quien informó un incremento en la velocidad de la germinación con la aplicación de microorganismos eficientes, cuya composición incluía principalmente bacterias ácido lácticas, bacterias fotosintéticas, levaduras y actinomicetos que están presentes comúnmente en el suelo. Un efecto similar en el vigor de germinación se evidenció en semillas de tomate (Solanum lycopersicum L.) y maíz (Zea mays L.) con la aplicación de productos naturales a base de hongos y bacterias, respectivamente, presentes en la rizosfera (Mahadevamurthy et al., 2016).
Longitud de las plántulas
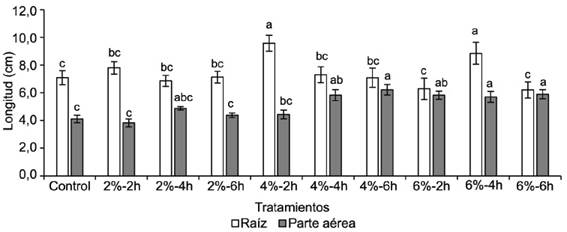
La aplicación del IHPLUS® en diferentes concentraciones y tiempos de inmersión estimuló el crecimiento de las raíces y de la parte aérea de las plántulas de S. bicolor (fig. 3). En el caso de las raíces, los valores más altos se obtuvieron con los tratamientos 4 %-2h y 6 %-4h; mientras que para la parte aérea los mejores resultados se lograron con las concentraciones 4 %-4 y 6h y con todos los tratamientos de 6 %.
Las diferencias observadas entre los tratamientos con IHPLUS® y el control pueden estar asociadas con el balance hormonal que se establece en el interior de las semillas, entre los distintos reguladores del crecimiento endógenos y exógenos. La concentración de auxinas y la interacción entre estas con otros reguladores del crecimiento tienen un papel fundamental en la respuesta fisiológica de las plantas (Lambrecht et al., 2000).
Estos resultados coinciden con los obtenidos por diferentes autores, quienes estudiaron el efecto de distintos biopreparados a base de microorganismos aislados de la rizosfera, sobre el proceso de germinación y crecimiento de plántulas de especies como Medicago sativa L. (Carrillo-Castaňeda et al., 2002), Solanum lycopersicum L. (Agrawal y Agrawal, 2013), Oryza sativa L. (Jamil et al., 2014), Cicer arietinum L. (Biswas et al., 2014) y Cerasus sachalinensis Kom. (Qin et al., 2016).
Indicadores bioquímicos
Actividad α-amilasa
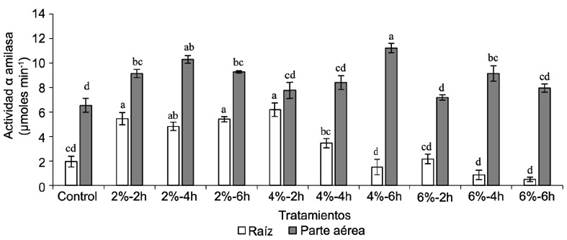
La actividad de α-amilasa en las raíces y en la parte aérea de las plántulas de sorgo, proveniente de las semillas tratadas con diferentes concentraciones de IHPLUS® y tiempos de inmersión, se muestra en la figura 4. En el caso de las raíces, los valores más altos se correspondieron con los tratamientos al 2 % y al 4 %-2h; mientras que para el resto de los tratamientos y el control no se observaron diferencias significativas. Para la parte aérea, con IHPLUS® al 2 %, 4 %-6h y 4 %-4h se obtuvieron valores superiores a los del control.
El aumento en la actividad α-amilasa en algunos tratamientos con IHPLUS® puede estar relacionado con la presencia de giberelinas en el producto evaluado y su absorción por las semillas durante el proceso de imbibición, o con la inducción de la expresión genética de esta enzima por componentes del producto aplicado. El aumento en los niveles de esta fitohormona en los tejidos vegetales pudo estimular la expresión de la α-amilasa (Taiz y Zeiger, 2013).
Resultados similares en el aumento de la actividad de esta enzima también fueron referidos por Mohd Din et al. (2014) y Soares et al. (2014) en semillas de arroz (Oryza sativa L.) tratadas con biofertilizantes a base de rizobacterias. Los valores obtenidos por estos autores, de igual forma, demostraron que en la actividad amilolítica influyen varios factores, tales como el genotipo de la planta, la composición y la concentración de microorganismos presentes en el producto natural, y su momento fisiológico.
Azúcares reductores
Tanto en la raíz como en la parte aérea de las semillas tratadas con IHPLUS®, se observó un aumento en el contenido de azúcares reductores en comparación con los respectivos controles (fig. 5). En las raíces hubo un incremento notable en el tratamiento 4 %-6h del producto, la cual fue superior al resto de los tratamientos con aplicación de IHPLUS®. Los mejores resultados en la parte aérea fueron observados en los tratamientos con 2 % del producto.
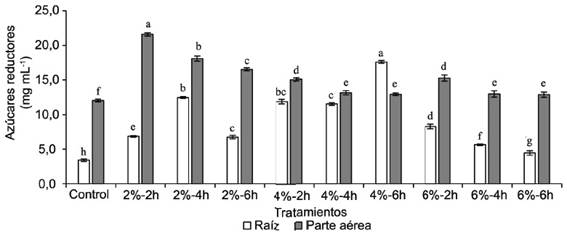
Figura 5 Contenido de azúcares reductores en la raíz y en la parte aérea de plántulas de S. bicolor cv. UDG-110
El incremento en el contenido de azúcares reductores puede estar relacionado con el aumento de la actividad amilolítica en los tejidos vegetales. Al respecto Morais et al. (2016), en estudios similares realizados en maíz (Zea mays L.), también observaron cambios en dicha actividad en las semillas tratadas con soluciones de bacterias, lo cual es esencial para la degradación del almidón y la producción de sustratos respiratorios para el crecimiento y desarrollo del embrión.
Proteínas solubles totales
La aplicación de IHPLUS® incrementó el contenido de proteínas solubles totales en las raíces y en las partes aéreas de las plántulas. Los tratamientos con las dosis de 4 y 6 % mostraron valores más elevados en relación con los restantes y con el control (fig. 6). Estos resultados sugieren un incremento en el metabolismo de las proteínas, que puede estar relacionado con una mayor disponibilidad de azúcares reductores, como la glucosa; estos azúcares, además de ser utilizados en la obtención de energía metabólica durante la respiración celular, constituyen esqueletos carbonados para la síntesis de aminoácidos y proteínas. Por otra parte, la aplicación del producto pudiera provocar un incremento en la expresión de enzimas relacionadas con el proceso de traducción.
Conclusiones
La aplicación de IHPLUS® a semillas de S. bicolor cv. UDG-110 tuvo un efecto positivo sobre el proceso de germinación, al incrementar el porcentaje, el valor de germinación y el crecimiento de los órganos vegetativos, lo que indica la presencia de compuestos bioactivos que lo estimularon. Los resultados en cuanto a los indicadores morfofisiológicos estuvieron relacionados con la respuesta bioquímica, ya que aumentó el contenido de azúcares reductores y proteínas solubles, como resultado de un incremento de la actividad α-amilasa u otras enzimas amilolíticas y del metabolismo proteico. El IHPLUS® mostró ser un bioproducto efectivo para estimular el proceso de germinación del sorgo, con potencialidades para contribuir al desarrollo de la agricultura agroecológica actual.