Introducción
Uno de los problemas que enfrenta la Organización Mundial de la Salud en la actualidad es la resistencia que hacen las bacterias a los antibióticos. Esta problemática suscita la búsqueda de nuevos fármacos de origen botánico que, por tener mecanismos de acción diferentes, constituyen una alternativa viable ante los medicamentos convencionales, que además de ser costosos, tienen efectos adversos (Shamsudin et al., 2022).
Ricinus communis L. (higuereta) es una especie de la familia Euphorbiaceae, que se utiliza en la medicina tradicional para tratar diversas enfermedades infecciosas (Kebede y Shibeshi, 2022). Se considera un recurso forrajero no convencional por su valor proteico-energético y la alta degradabilidad ruminal que presenta (Ramírez et al., 2017; Palma-García, 2018). Recientemente, Ramírez-Navarro et al. (2020) demostraron que su inclusión en las dietas para ovinos no afectaba los indicadores productivos, por lo que la consideran como una alternativa nutricional.
En los estudios fitoquímicos con extractos de hojas, raíces y corteza de R. communis se ha señalado la presencia de metabolitos secundarios (flavonoides, terpenos, saponinas, taninos, glucósidos y alcaloides). Estos compuestos poseen los principios activos que constituyen la base de las propiedades biológicas útiles para el sector agropecuario y médico-farmacéutico (Rashmi et al., 2019; Nawaz et al., 2022). Sin embargo, el perfil fitoquímico de las plantas depende de numerosos factores, entre los que se destacan las condiciones edafoclimáticas, la variedad y el genotipo (Rahul et al., 2022), por lo que es necesario realizar estudios con la flora local con el propósito de corroborar si se mantienen las potencialidades para su uso en el tratamiento de enfermedades infecciosas. Es por ello que el objetivo de esta investigación fue evaluar las propiedades fitoquímicas y antibacterianas de extractos de hojas de R. communis.
Materiales y Métodos
Localización. Los estudios se realizaron en los laboratorios del Centro de Estudios Biotecnológicos (CEBIO) de la Facultad de Ciencias Agropecuarias de la Universidad de Matanzas, Cuba.
Selección, identificación y caracterización del material vegetal . Las plantas de R. communis se obtuvieron del Jardín Botánico de la Universidad de Matanzas, localizado en las coordenadas, 23°02′06″N 81°30′36″O / 23.034377-81.507485. La identificación taxonómica se realizó por especialistas de esta entidad a partir del herbario y de los caracteres morfológicos in situ. Se seleccionaron 2,5 kg de hojas frescas de 15 plantas adultas, que tenían entre 2,0 y 2,5 m de altura. Las plantas no presentaban daños mecánicos, síntomas de enfermedades o ataque de plagas. La colecta se realizó en febrero de 2019 en el horario comprendido entre 8:00 y 9:00 a.m. La temperatura promedio del mes fue de 21,5 ºC. El suelo del área se clasifica como Ferralítico Rojo típico.
Preparación de los extractos. Las hojas se lavaron con agua destilada y se secaron durante 48 h en una estufa de circulación natural a 45 ºC. El material seco se trituró a un tamaño de partícula de 1 mm, con la ayuda de un molino eléctrico. Los extractos se prepararon a partir de 100 g de muestra y 2 L de solvente; los alcohólicos con etanol al 90 % y los acuosos con agua destilada. Las mezclas se colocaron en agitación sobre una zaranda orbital (HDL®APPARATTUS) a 160 r.p.m. durante 24 h y después se filtraron con papel Whatmann # 40. Los sobrenadantes se almacenaron en frascos ámbar a 4 ºC. Los sólidos remanentes se volvieron a homogenizar en 1 L durante otras 24 h. Una vez filtrados, los sobrenadantes obtenidos se adicionaron a los anteriores.
Los extractos se concentraron al vacío con el auxilio de un rotoevaporador (Heidolfph, Alemania). Los sedimentos se colocaron en placas Petri y se secaron en una estufa a 50 ºC (Mohammed et al., 2013). Los sólidos secos se almacenaron en frascos ámbar hasta su utilización en los estudios fitoquímicos y en las pruebas microbiológicas.
Determinación cualitativa de los metabolitos secundarios. La determinación de los metabolitos secundarios se realizó según el procedimiento descrito por Chigodi et al. (2013). Los contenidos se evaluaron de manera cualitativa mediante el sistema no paramétrico de cruces (MINSAP, 1997): +++ = abun-dante, ++ = moderado, + = bajo, - = ausencia (tabla 1).
Tabla 1 Procedimientos para determinar los metabolitos secundarios.
| Metabolitos | Ensayo | Reactivos/procedimiento | Resultado positivo |
|---|---|---|---|
| Flavonoides | Prueba del hidróxido de sodio | A 100 mg de extracto seco se adiciona 1 ml de NaOH 0,1 mol L-1 y después se agrega igual volumen de HCL 0,1 mol L-1. | Color amarillo |
| Terpenoides | Prueba de Salkowski | Se mezclan 100 mg de extracto seco con 1 ml de cloroformo y 2 ml de H2SO4 concentrado. | Color rojizo-pardo |
| Taninos | Prueba del cloruro férrico | A 100 mg de extracto seco se adicionan 2 ml de agua destilada. La mezcla se calienta en baño María y se filtra. Al sobrenadante se le adicionan dos gotas de una disolución de cloruro férrico al 5 % en metanol (1:1). | Color verde oscuro o azul oscuro |
| Saponinas | Prueba de la espuma | A 100 mg de extracto seco se añaden 3 ml de agua destilada y se agita vigorosamente. | Formación de espuma persistente |
| Esteroides | Prueba de Salkowski | Se mezclan 100 mg de extracto seco con 3 ml de CHCl3. Se adicionan 2 ml de H2SO4 concentrado por los lados del tubo de ensayo. | Color rojo en la capa superior y verde en la capa de H2SO4 |
| Cumarinas | Prueba del hidróxido de sodio | Se mezclan 100 mg de extracto seco con 3 ml de agua destilada. La mezcla se agita y se filtra. A 1 ml del filtrado se adiciona 1 ml de NaOH al 10 %. | Color amarillo |
| Antraquinonas | Prueba del amonio | Se mezclan 200 mg de extracto seco con 3 ml de HCl al 10 %. La mezcla se calienta a 100 ºC durante tres minutos en baño María y se filtra. El sobrenadante se deja enfriar hasta alcanzar temperatura ambiente y se le adicionan 3 ml de CHCl3 y unas gotas de disolución de amonio al 10 %. Esta mezcla se vuelve a calentar en baño de María durante tres minutos. | Color rosado |
| Glucósidos cardiotónicos | Prueba de Keller Kiliani | Se mezclan 200 mg de extracto seco con 5 ml de agua destilada. La mezcla se agita y se filtra. A 3 ml del sobrenadante se adicionan 2 ml de ácido acético glacial, que contiene una gota de cloruro férrico al 1 % y 1 ml de H2SO4 concentrado. | Anillo pardo en la interfase junto a un anillo púrpura por debajo. |
Contenido de azúcares reductores (AR). Se determinó por el método del ácido dinitrosalicílico con la utilización de la D-glucosa (Sigma) como patrón (Miller, 1959). La absorbancia se midió a una longitud de onda de 456 nm.
Contenido de proteínas solubles totales (PST). Se determinó colorimétricamente por el método de Lowry et al. (1951) con albúmina de suero bovino (BSA) como patrón. Los valores de absorbancia se midieron a una longitud de onda de 750 nm y las concentraciones (mg ml-1) se determinaron a través de una curva patrón.
Contenido de fenoles solubles, ligados a la pared y totales. La extracción de los fenoles se realizó según el método descrito por Quiñones-Galvez et al. (2021). Para los fenoles solubles se mezclaron 100 mg de muestra en 1 ml de metanol. La suspensión se agitó vigorosamente en un equipo vortex (IKA® Vortex 3). Luego se centrifugó a 15 000 r.p.m. durante 5 min. para colectar el sobrenadante.
La extracción de los fenoles ligados a la pared celular se realizó a partir del precipitado obtenido en el procedimiento anterior. Se adicionaron 250 ml de hidróxido de sodio, 2 mol L-1 al sólido remanente y se homogenizó con ayuda de un vortex. Posteriormente la mezcla se neutralizó con igual volumen de ácido clorhídrico (2 mol L-1) y se volvió a centrifugar en iguales condiciones para obtener el sobrenadante. Las concentraciones de los fenoles solubles y ligados a la pared celular se determinaron colorimétricamente con el uso de ácido clorogénico (0,05 mol L-1) como patrón. Los valores de absorbancia se obtuvieron en un espectrofotómetro, a longitud de onda de 725 nm Ultrospect 2000 (Pharmacia Biotech, Suecia).
Actividad antibacteriana. La actividad antibacteriana in vitro del extracto etanólico se evaluó ante la bacteria Gram positiva S. aureus ATCC 25923 y las bacterias Gram negativas E. coli ATCC 25922, Proteus sp. y K. pneumonie. El ensayo se realizó por el método de difusión en pocillos, según el procedimiento descrito por Kebede y Shibeshi (2022).
Las cepas se rejuvenecieron previamente en un medio de caldo cerebro-corazón a 37 °C. Con posterioridad, se inocularon en un medio de caldo Mueller-Hinton con la ayuda de un hisopo estéril y se incubaron a 37 °C hasta obtener una turbidez equivalente al tubo a 0,5 en la escala de McFarland. Los pocillos se realizaron con la ayuda de un horadador estéril de 8 mm de diámetro y se les adicionó 100 µL (200 mg ml-1) de extracto (Arekemase et al., 2019). Similar volumen se utilizó en los controles. Todas las placas se incubaron durante 18 h a 37 °C.
Como control negativo se utilizó la disolución hidroalcohólica, con la que se preparó el extracto etanólico. Como control positivo se tomaron los antibióticos cefalexina 30 μg para S. aureus (Gram positiva) y amikacina 30 μg para las Gram negativas. La actividad antibacteriana se obtuvo a partir del diámetro de la zona de inhibición del crecimiento bacteriano (Voleti et al., 2022).
Análisis estadístico. La determinación cualitativa de los metabolitos secundarios, la actividad antibacteriana y las lecturas de absorbancia para la cuantificación de los azúcares reductores, proteínas solubles totales y fenoles se realizaron por triplicado. Los datos se procesaron con el paquete estadístico Statgraphic plus 5.1 sobre Windows, después de comprobar que los dados se ajustaban a una distribución normal mediante la prueba de bondad de ajuste Kolmogorov-Smirnov. Para la homogeneidad de varianza se realizaron las pruebas de Bartlett. Para la comparación entre las medias se realizó un análisis de varianza de clasificación simple, y para determinar la actividad antimicrobiana la prueba de rangos múltiples de Tukey. A los datos referidos al contenido de proteínas solubles totales, azúcares reductores y fenoles, que no cumplieron las premisas antes señaladas, se les realizó la prueba de Kruskal-Wallis, con un nivel de confianza de 95 %. Para la comparación entre las medias se aplicó la prueba de Student Newman-Keuls (p < 0,05).
Resultados y Discusión
Estudio fitoquímico. Los extractos acuosos y etanólicos de hojas de R. communis mostraron abundantes compuestos terpenoides y taninos (tabla 2). Los flavonoides se detectaron de forma notable en el extracto etanólico y moderados en el acuoso. Aunque en concentraciones menores, las cumarinas prevalecieron en el extracto acuoso. Los esteroides y las saponinas fueron otros de los metabolitos hallados como traza en ambos extractos. No se encontraron antocianinas, antraquinonas o glucósidos cardiotónicos.
Tabla 2 Índices de metabolitos secundarios, proteínas solubles totales y azúcares reductores en extractos acuosos y etanólicos de hojas de R. communis.
| Metabolitos secundarios | Extracto | |
|---|---|---|
| Acuoso | Etanólico | |
| Flavonoides | ++ | +++ |
| Terpenos | +++ | +++ |
| Antocianinas | - | - |
| Esteroides | + | + |
| Saponinas | + | + |
| Taninos | +++ | +++ |
| Cumarinas | ++ | + |
| Glucósidos cardiotónicos | - | - |
| Antraquinonas | - | - |
| PST, mg ml-1 | 13,39 ± 0,21 | 14,66 ± 0,23 |
| AR, mg ml-1 | 4,48 ± 0,09 | 6,62 ± 0,11 |
Contenido: +++ = abundante, ++ = moderados, + = bajo, - = ausencia.
Diferencias estadísticas entre extractos para un mismo metabolito, según la prueba de Kruskal-Wallis (p < 0,05). ± Error Estándar
PST: contenido de proteínas solubles totales, AR: contenido de azúcares reductores
Los contenidos de proteínas solubles totales y azúcares reductores fueron superiores en el extracto etanólico (p < 0,05). Las variaciones con relación al contenido relativo de los metabolitos se atribuyeron a las diferencias que existen en sus polaridades.
Estos resultados coinciden con estudios en los que también se encontró presencia de taninos, saponinas, esteroides, terpenos y flavonoides (Maldonado-Santoyo y Morales-López, 2022; Wadankar et al., 2022). En contraste con los resultados de esta investigación, Nawaz et al. (2022) hallaron glucósidos cardiotónicos y antocianinas, lo que puede estar asociado a diversos factores, como el genotipo, las condiciones edáficas y climáticas, la edad fisiológica de la planta, el momento de colecta y las técnicas utilizadas para la extracción y detección de los metabolitos secundarios (Rahul et al., 2022).
La presencia de los metabolitos en los extractos de R. communis ratifican que esta planta es una fuente potencial de sustancias bioactivas, con aplicaciones en el campo farmacéutico, tecnológico y en la medicina humana y veterinaria. Diversos trabajos científicos han puesto en evidencia que los compuestos polifenólicos, los taninos, los flavonoides, las cumarinas y los ácidos fenólicos poseen propiedades antioxidantes, antibacterianas, antifúngicas, antivirales y anticancerígenas (Kaczmarek, 2020; Kebede y Shibeshi, 2022; Fink, 2023; Nguyen et al., 2023).
Los contenidos de los fenoles ligados a la pared celular fueron significativamente superiores (p < 0,05) a los solubles (36,54 vs 19,11 mg ml-1) y los fenoles totales alcanzaron valores elevados (figura 1). La presencia de estos compuestos polifenólicos también ha sido referenciada por Nawaz et al. (2022).
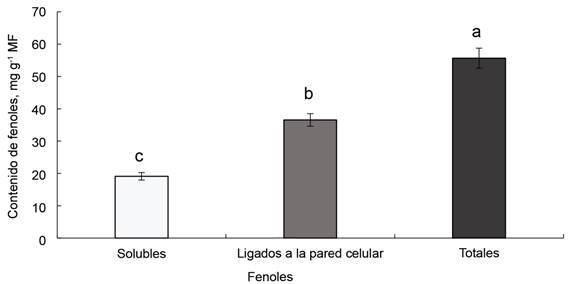 Letras diferentes indican diferencias significativas entre extactos, sugún prueba de Student Newman-Keuls (p < 0,005)
Letras diferentes indican diferencias significativas entre extactos, sugún prueba de Student Newman-Keuls (p < 0,005)Figura 1 Contenidos de fenoles solubles ligados a la pared celular y totales en extractos etanólicos de hojas de R. communis.
En los últimos años, se ha profundizado en los mecanismos de acción de los metabolitos secundarios sobre los microorganismos patógenos. Y esto es porque, a diferencia de los antibióticos tradicionales, las bacterias expuestas a estos compuestos no desarrollan resistencia antimicrobiana.
Los flavonoides disminuyen la viabilidad celular, ya que al aumentar en los microorganismos la permeabilidad de las membranas promueven la salida de componentes celulares importantes, como son los ácidos nucleicos (Thebti et al., 2023).
Los taninos afectan los procesos metabólicos porque, además de reducir las actividades de las enzimas y de otros polipéptidos mediante interacciones hidrofóbicas y enlaces por puentes de hidrógeno, tienen la capacidad de quelatar un cofactor esencial para la producción de ATP y NADPH, que es el hierro. Esta interferencia en la generación de energía metabólica conlleva a la muerte de los microorganismos (Kaczmarek, 2020; Nguyen et al., 2023).
Las saponinas también demostraron tener actividad antibacteriana, asociada a la naturaleza hidrofóbica e hidrofílica de su estructura química, que le confiere un carácter anfipático a la molécula. Esta característica permite que el metabolito penetre con facilidad en las membranas biológicas y altere sus propiedades físicas, lo que provoca la muerte del microorganismo (Dong et al., 2020).
Los compuestos terpenoides debilitan las membranas de las bacterias y aumentan su permeabilidad, acción que además de afectar la transferencia de iones, las funciones de las proteínas de las membranas y de las enzimas celulares, inhibe la síntesis de ADN (Mutlu-Ingok et al., 2020).
Actividad antibacteriana. La evaluación de la actividad antibacteriana se realizó con el extracto etanólico, debido al efecto superior que muestran los solventes alcohólicos con relación a los acuosos (Voleti et al., 2022). Los resultados mostraron efecto antibacteriano elevado ante S. aureus, con halos de inhibición de 15,33 mm, aunque estadísticamente inferior al control positivo (tabla 3). Con respecto a las bacterias Gram negativas, la mayor actividad se obtuvo frente a Proteus sp., con halos de inhibición de 8,67 mm, seguido de E. coli, con valores promedio de 5,67 mm. El extracto no mostró actividad antibacteriana ante Klebsiella sp.
Tabla 3 Actividad antibacteriana de extractos etanólicos de hojas de R. communis.
| Tratamiento | ||||
|---|---|---|---|---|
| DZI, mm | EE ± | DZI, mm | EE ± | |
| Amikazina (control +) | 24,00a | 0,58 | - | - |
| Cefalexina (control +) | - | - | 14,83a | 0,58 |
| Disolución hidroalcohólica | 1,03c | 0,33 | 0,00c | 0,00 |
| Extracto de |
15,33b | 0,88 | 5,67b | 0,67 |
| Tratamiento | ||||
| DZI, mm | EE ± | DZI, mm | EE ± | |
| Amikazina (control +) | - | - | - | - |
| Cefalexina (control +) | 12,00a | 0,33 | 4,00 | 0,2 |
| Disolución hidroalcohólica | 0,00c | 0,00 | 0,00 | 0,00 |
| Extracto de |
8,67b | 0,88 | 0,00 | 0,00 |
DZI: diámetro de la zona de inhibición.
Los datos representan medias de tres réplicas
Letras diferentes indican diferencia significativa según prueba de rangos múltiples de Tukey (p < 0,05).
Estos resultados se corresponden con los referidos por El-Kahlout et al. (2018), quienes observaron que el extracto etanólico de las hojas de higuereta (200 mg ml-1) presentó actividad antibacteriana inferior ante S. aureus y superior en E. coli. Los autores citados también refieren que el extracto no mostró actividad sobre Klebsiella sp. Las discrepancias halladas se atribuyen a diferencias en la resistencia de las cepas utilizadas, aunque no se descartan otros factores que pueden afectar las concentraciones finales de los metabolitos, como son los ambientales o los procesamientos de extracción.
La efectividad del extracto ante la bacteria Gram positiva S. aureus fue superior a la obtenida ante las Gram negativas evaluadas. Este resultado coincide con lo observado por Byadgi et al. (2017), y puede estar relacionado con la complejidad de las paredes celulares que poseen las bacterias Gram negativas. Estos grupos bacterianos tienen, además de la capa de peptidoglicano, otra capa de lipopolisacáridos que constituye una barrera para la entrada de metabolitos secundarios hidrosolubles de acción antibacteriana (Kaczmarek, 2020). Por otra parte, la resistencia de las bacterias Gram negativas puede estar asociada a la capacidad de estas cepas de producir enzimas y/o toxinas que degradan los compuestos bioactivos presentes en el extracto (Arekemase et al., 2019).
Estudios recientes, pero con extractos metanólicos, ratificaron la presencia de los compuestos bioactivos como sus efectos antibacterianos sobre las mismas cepas evaluadas (Kebede y Shibeshi, 2022; Voleti et al., 2022). Sin embargo, refieren halos de inhibición superiores ante las bacterias Gram negativas, respuestas que se pueden atribuir a diferencias genotípicas entre las cepas y/o con el potencial de extracción del solvente utilizado.
La actividad antibacteriana observada en esta investigación está relacionada con la acción sinérgica de los compuestos bioactivos encontrados, como flavonoides, terpenoides, taninos, cumarinas, saponinas y polifenoles, que se definen como agentes antibacterianos de distintos microrganismos patógenos (Nguyen et al., 2023; Thebti et al., 2023).
Conclusiones
Las hojas de R. communis contienen compuestos bioactivos con propiedades antibacterianas que tienen un uso potencial para el tratamiento de enfermedades infecciosas en los animales como en el hombre. Es por ello que resulta de interés promover otros estudios que permitan avalar y potenciar su utilización en la medicina tradicional.














