Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión On-line ISSN 2075-5635
Nucleus no.60 Ciudad de La Habana jul.-dic. 2016
CIENCIAS NUCLEARES
Fósforo-32 e itrio-90 como opciones en el tratamiento del dolor óseo metastásico
Phosphorous-32 and Yttrium-90 as options in the treatment of metastatic bone pain
Alejandro Alberti Ramírez1, Enrique García Rodríguez2, Jorge Cruz Arencibia1, José Morín Zorrilla1
1 Centro de Isótopos (Centis), Ave. Monumental y Carretera La Rada km 3½, San José de las Lajas, Mayabeque, Cuba
2 Hospital General Docente Enrique Cabrera, Calzada Aldabó 11117 esquina E, Boyeros, La Habana, Cuba
RESUMEN
En el trabajo se estima la prevalencia del dolor óseo metastásico en nuestro país en no menos de 3 750 pacientes. Se examina, asimismo, el papel del Fosfato de sodio-[![]() ], de eficacia comparable y menor costo que el de otros radiofármacos, lo que hace posible el renacer de su uso. Aunque más radiotóxico, ello no lo invalida como opción, lo que se evidencia también en la experiencia cubana. El Centro de Isótopos (Centis) puso en marcha una línea de producción con posibilidad de obtener hasta 37 GBq (1 Ci) de
], de eficacia comparable y menor costo que el de otros radiofármacos, lo que hace posible el renacer de su uso. Aunque más radiotóxico, ello no lo invalida como opción, lo que se evidencia también en la experiencia cubana. El Centro de Isótopos (Centis) puso en marcha una línea de producción con posibilidad de obtener hasta 37 GBq (1 Ci) de ![]() de alta calidad cada semana. El hecho de que se produzca por separación electroquímica mediante un generador de radionúclidos, a partir del 90Sr, hace que no se requiera importación de materia prima radiactiva, prácticamente, por tiempo indefinido, es decir, que el radionúclido estaría disponible de manera sostenible. Al tener el
de alta calidad cada semana. El hecho de que se produzca por separación electroquímica mediante un generador de radionúclidos, a partir del 90Sr, hace que no se requiera importación de materia prima radiactiva, prácticamente, por tiempo indefinido, es decir, que el radionúclido estaría disponible de manera sostenible. Al tener el ![]() una energía de emisión β- mayor, pudiera pensarse que debiera ser más radiotóxico que el
una energía de emisión β- mayor, pudiera pensarse que debiera ser más radiotóxico que el ![]() . Sin embargo, se dan evidencias de que el
. Sin embargo, se dan evidencias de que el ![]() en forma de fosfato es más radiotóxico que el 90Y en forma de citrato. En Europa un radiofármaco basado en un liofilizado de EDTMP y Cloruro de itrio-[
en forma de fosfato es más radiotóxico que el 90Y en forma de citrato. En Europa un radiofármaco basado en un liofilizado de EDTMP y Cloruro de itrio-[![]() ] ha tenido buen efecto para el alivio del dolor en 191 pacientes. (Centis) tiene registrado el Cloruro de itrio-[
] ha tenido buen efecto para el alivio del dolor en 191 pacientes. (Centis) tiene registrado el Cloruro de itrio-[![]() ] para marcaje y se trata de introducir en el mercado un radiofármaco con este precursor radioactivo y el liofilizado importado, a los efectos de dar adecuada atención al importante número de pacientes que se beneficiarían.
] para marcaje y se trata de introducir en el mercado un radiofármaco con este precursor radioactivo y el liofilizado importado, a los efectos de dar adecuada atención al importante número de pacientes que se beneficiarían.
Palabras claves: radiofármacos, esqueleto, dolor, metástasis, fosforo 32, itrio 90, tejidos óseos.
ABSTRACT
In this paper the prevalence of metastatic bone pain is estimated in our country in no less than 3 750 patients. Moreover, the role of ![]() -phosphate, which effectiveness is comparable to other radiopharmaceuticals, and the possible return to its previous general use, as it is cheaper, is examined. The fact that
-phosphate, which effectiveness is comparable to other radiopharmaceuticals, and the possible return to its previous general use, as it is cheaper, is examined. The fact that ![]() is considered more radiotoxic doesn’t invalidate it as a treatment option, which is also evidenced by the Cuban experience. The Center of Isotopes (Centis) has established a production line of up to 37 GBq (1 Ci) per week of high quality
is considered more radiotoxic doesn’t invalidate it as a treatment option, which is also evidenced by the Cuban experience. The Center of Isotopes (Centis) has established a production line of up to 37 GBq (1 Ci) per week of high quality ![]() . The fact of its being obtained through a radionuclide generator by electrochemical separation from
. The fact of its being obtained through a radionuclide generator by electrochemical separation from ![]() makes the import of radioactive raw material practically not required for indefinite time. This implies that the radionuclide could be available in a sustainable way. By having the
makes the import of radioactive raw material practically not required for indefinite time. This implies that the radionuclide could be available in a sustainable way. By having the ![]() greater β- emission energy, it might be more radiotoxic than
greater β- emission energy, it might be more radiotoxic than ![]() . Nevertheless, some evidences show that
. Nevertheless, some evidences show that ![]() in the form of orthophosphate is more radiotoxic than 90Y citrate. In Europe, a radiopharmaceutical consisting of a lyophilized kit of EDTMP and
in the form of orthophosphate is more radiotoxic than 90Y citrate. In Europe, a radiopharmaceutical consisting of a lyophilized kit of EDTMP and ![]() Chloride solution was able to relief pain in 191 patients. Centis has registered the
Chloride solution was able to relief pain in 191 patients. Centis has registered the ![]() chloride solution for labeling. Then the task is to introduce in the market a radiopharmaceutical with this radioactive precursor and the imported lyophilized kit in order to increase the treatment to an important number of patients that, as a result, could be benefitted.
chloride solution for labeling. Then the task is to introduce in the market a radiopharmaceutical with this radioactive precursor and the imported lyophilized kit in order to increase the treatment to an important number of patients that, as a result, could be benefitted.
Key words: radiopharmaceuticals, skeleton, pain, metastases, phosphorus 32, yttrium 90, bone tissues.
INTRODUCCIÓN
Para el tratamiento del dolor por metástasis óseas se encuentran disponibles o en desarrollo radiofármacos basados en diferentes radionúclidos. A pesar de sus comprobados beneficios,esta modalidad terapéutica se considera subutilizada. El costo y la disponibilidad de los radiofármacos son factores condicionantes para hacerla sostenible al tener en cuenta el universo de pacientes a tratar, es decir, la prevalencia de la enfermedad, así como la valoración de los efectos secundarios. En el presente trabajo se examinan las posibilidades del Fosfato de sodio-[![]() ] y del EDTMP-[
] y del EDTMP-[![]() ] como opciones para el tratamiento en Cuba del dolor por metástasis óseas.
] como opciones para el tratamiento en Cuba del dolor por metástasis óseas.
Se estima que entre un 64 % y 80 % de los pacientes con tumores sólidos desarrollan enfermedad ósea metastásica (EOM) y son los tumores de mama, pulmón y próstata los que lo hacen con mayor frecuencia [1, 2]. Las metástasis óseas pueden dar lugar a compresión de la médula espinal o de las raíces nerviosas, a fracturas patológicas, a hipercalcemia y a dolor severo [3]. Los estudios de prevalencia de la EOM son, en realidad, escasos. En un trabajo se indica que 4 861 987 es el promedio anual de enfermos de cáncer en EEUU y que el 5,3 % desarrollan EOM [4], es decir, unos 257 685. Esta cifra se acerca a la de 279 679, indicada en un estudio posterior en ese país [5]. El dolor por metástasis óseas es, por otra parte, el síndrome doloroso más común en pacientes con cáncer. Se estima que hasta el 79 % de los pacientes con metástasis óseas experimentan dolor severo antes del tratamiento paliativo [1, 6]. Estadísticamente, entre el 60 % y el 90 % de los pacientes con cáncer avanzado han sufrido diferentes grados de dolor, de los cuales el 30 % han presentado dolor severo persistente [7]. Hay situaciones clínicas en las que las metástasis óseas transcurren sin dolor o son hallazgos de autopsia [3, 8]. El 25 % aproximadamente de los pacientes con cáncer de mama y lesiones óseas permanecen asintomáticos [9]. Como la población de EEUU es ~ 26 veces mayor que la de Cuba, a partir de los datos indicados, tendríamos como estimado más conservador de prevalencia de la EOM en Cuba ~ 260 000/26, es decir, unos 10 000 pacientes. Si consideramos que el 25 % aproximadamente transcurre sin dolor, la prevalencia del dolor por EOM sería de ~ 7 500 pacientes. Si tomamos solo la mitad, a los efectos de disponer de una cifra de referencia más consistente, habría que atender unos 3 750 pacientes por año. En EEUU se ha estimado que la atención a pacientes con EOM representa el 17 % de los costos médicos directos en el tratamiento del cáncer [4]. Por otra parte, en un estudio canadiense en el que se llama la atención sobre la importancia de los radiofármacos en el tratamiento de la EOM, se fundamenta el uso como terapia principal de EDTMP-[![]() ]. A un costo de 4 500 dólares por paciente, en el tratamiento de 755 pacientes se invertirían 3 397 500 USD, pero el sistema de salud ahorraría, teniendo en cuenta otros elementos de costo, 7 758 905 USD, con igual o mejores resultados medidos como alivio de dolor y calidad de vida [10].
]. A un costo de 4 500 dólares por paciente, en el tratamiento de 755 pacientes se invertirían 3 397 500 USD, pero el sistema de salud ahorraría, teniendo en cuenta otros elementos de costo, 7 758 905 USD, con igual o mejores resultados medidos como alivio de dolor y calidad de vida [10].
Es decir, el tratamiento del dolor por EOM es un problema de salud de elevado costo y el uso de radiofármacos pudiera favorecer la atención de un mayor número de pacientes a más bajo costo. Para ello es necesario disponer de opciones convenientes.
Radiofármacos en el manejo de la EOM
Existen estudios en los que se considera que los pacientes con metástasis óseas reciben inadecuado tratamiento de su dolor [7, 11]. El tratamiento es como regla paliativa, lo mismo en terapia sistémica (analgésicos, hormonas, quimioterapia, esteroides y bifosfonatos) que local (cirugía, bloqueo nervioso, radioterapia externa). Varios son los radiofármacos que han mostrado eficacia en aliviar el dolor óseo metastásico, por lo que se ha valorado que pudieran ser más utilizados [12, 13]. Al actuar de manera sistémica, la terapia con radiofármacos con afinidad por el hueso resulta adecuada para el tratamiento de la enfermedad diseminada. La toxicidad potencial de la administración sistémica se reduce por la relativa selectividad de los radiofármacos por los sitios de lesión, aunque todos los emisores β en uso y en desarrollo dan lugar a pancitopenia transitoria [14-16].
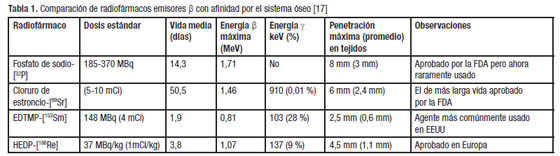
Los radiofármacos emisores β registrados (Tabla 1) son el Fosfato de sodio-[![]() ], raras veces usado en la actualidad; el Cloruro de estroncio-[
], raras veces usado en la actualidad; el Cloruro de estroncio-[![]() ]; el EDTMP-[
]; el EDTMP-[![]() ] (Lexidronam), el agente más comúnmente usado en EEUU y el HEDP-[
] (Lexidronam), el agente más comúnmente usado en EEUU y el HEDP-[![]() ], aprobado en Europa. En esta relación se reflejala tendencia a utilizar, entre los emisores β, los de menor energía para disminuir el daño radiacional [17]. Con relación a la eficacia y los costos se ha indicado que el
], aprobado en Europa. En esta relación se reflejala tendencia a utilizar, entre los emisores β, los de menor energía para disminuir el daño radiacional [17]. Con relación a la eficacia y los costos se ha indicado que el ![]() debiera ser el radionúclido de elección en el manejo del dolor en pacientes terminales, debido a su bajo costo, un 10 % menos que el
debiera ser el radionúclido de elección en el manejo del dolor en pacientes terminales, debido a su bajo costo, un 10 % menos que el ![]() y el
y el ![]() (390 USD vs 2 900 o 2 850 USD respectivamente), con un 74 % (
(390 USD vs 2 900 o 2 850 USD respectivamente), con un 74 % (![]() ), 80 % (
), 80 % (![]() ) y 77 % (
) y 77 % (![]() ) de alivio durante 10 semanas, respectivamente [18].
) de alivio durante 10 semanas, respectivamente [18].
El fosfato de sodio-[![]() ] como opción
] como opción
Una de las razones que explica la disminución en el uso del ![]() es su efecto sobre la médula ósea. Al examinar, sin embargo, la radiotoxicidad del
es su efecto sobre la médula ósea. Al examinar, sin embargo, la radiotoxicidad del ![]() en el tratamiento de las metástasis óseas aparece en la bibliografía el reporte de solo dos casos de complicaciones serias: uno, la muerte secundaria a pancitopenia y otro, una hemorragia cerebral secundaria a trombocitopenia [19]. Se ha considerado, además, que la frecuencia de pancitopenia en el tratamiento con
en el tratamiento de las metástasis óseas aparece en la bibliografía el reporte de solo dos casos de complicaciones serias: uno, la muerte secundaria a pancitopenia y otro, una hemorragia cerebral secundaria a trombocitopenia [19]. Se ha considerado, además, que la frecuencia de pancitopenia en el tratamiento con ![]() puede estar relacionada con el grado y extensión de la enfermedad que actúa en los huesos y en la reducida reserva medular, resultado de tratamientos previos. Asimismo, se afirmaque la pancitopenia es rara en inyección simple, incluso en múltiple hasta 444 MBq (12 mCi) de
puede estar relacionada con el grado y extensión de la enfermedad que actúa en los huesos y en la reducida reserva medular, resultado de tratamientos previos. Asimismo, se afirmaque la pancitopenia es rara en inyección simple, incluso en múltiple hasta 444 MBq (12 mCi) de ![]() [19]. La principal desventaja de la terapia con
[19]. La principal desventaja de la terapia con ![]() es la mielosupresión limitada por la dosis con pancitopenia reversible máxima a las 5-6 semanas, después de la administración. Sobre la base de estos efectos tóxicos en revisiones realizadas, en diferentes momentos, además de lo señalado arriba, se ha indicado que el
es la mielosupresión limitada por la dosis con pancitopenia reversible máxima a las 5-6 semanas, después de la administración. Sobre la base de estos efectos tóxicos en revisiones realizadas, en diferentes momentos, además de lo señalado arriba, se ha indicado que el ![]() no está más en uso o se abandona su empleo para el tratamiento de las metástasis óseas, al desarrollarse radiofármacos con otros radionúclidos [13,15].
no está más en uso o se abandona su empleo para el tratamiento de las metástasis óseas, al desarrollarse radiofármacos con otros radionúclidos [13,15].
La consideración de la radiotoxicidad del ![]() se basa en trabajos de Silberstein de la década de los 90 del siglo pasado [20, 21]. Este autor ha indicado, con relación a un grupo de radiofármacos de
se basa en trabajos de Silberstein de la década de los 90 del siglo pasado [20, 21]. Este autor ha indicado, con relación a un grupo de radiofármacos de ![]() ,
, ![]() ,
, ![]() y
y ![]() , que según su conocimiento, ninguno se ha mostrado más eficaz o significativamentemenos tóxico que cualquier otro en los estudios comparativos publicados. Llama la atención que teóricamente el Pentetato de
, que según su conocimiento, ninguno se ha mostrado más eficaz o significativamentemenos tóxico que cualquier otro en los estudios comparativos publicados. Llama la atención que teóricamente el Pentetato de ![]() debiera ser menos tóxico debido al pequeño recorrido de los electrones de conversión que emite [22]. En un trabajo en el que se evalúan los efectos secundarios de distintos radionúclidos sobre la médula ósea, a partir del término Factor de Ventaja Dosimétrica Relativa (FVDR), se asume que el valor del efecto del radioelemento más tóxico, el
debiera ser menos tóxico debido al pequeño recorrido de los electrones de conversión que emite [22]. En un trabajo en el que se evalúan los efectos secundarios de distintos radionúclidos sobre la médula ósea, a partir del término Factor de Ventaja Dosimétrica Relativa (FVDR), se asume que el valor del efecto del radioelemento más tóxico, el ![]() , es 1, y se obtienen para
, es 1, y se obtienen para ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() y
y ![]() valores de 1,1; 1,5; 2,4; 3,2; 5,1 y 6,5, respectivamente y en correspondencia con los valores promedio de sus energías β [23]. Se evidencia que el
valores de 1,1; 1,5; 2,4; 3,2; 5,1 y 6,5, respectivamente y en correspondencia con los valores promedio de sus energías β [23]. Se evidencia que el ![]() es más radiotóxico que otros radionúclidos, pero no que sea desechable como opción, sino que se prefieren otros, considerados de mejores características. El asunto se relaciona, entonces, con cuál es el universo de pacientes que pueden ser tratados y cuál radionúclido está al alcance de cada quien, desde el punto de vista de logística y costos.
es más radiotóxico que otros radionúclidos, pero no que sea desechable como opción, sino que se prefieren otros, considerados de mejores características. El asunto se relaciona, entonces, con cuál es el universo de pacientes que pueden ser tratados y cuál radionúclido está al alcance de cada quien, desde el punto de vista de logística y costos.
Aunque, como se ha señalado el ![]() es raramente usado en Norteamérica y Europa para paliación del dolor óseo, la significativa ventaja económica y la facilidad de la administración oral ha renovado el interés en este agente como el radiofármaco de elección en otros lugares del mundo [14, 15, 24]. En un estudio de varias instituciones del Organismo Internacional de Energía Atómica (OIEA) se comparan el
es raramente usado en Norteamérica y Europa para paliación del dolor óseo, la significativa ventaja económica y la facilidad de la administración oral ha renovado el interés en este agente como el radiofármaco de elección en otros lugares del mundo [14, 15, 24]. En un estudio de varias instituciones del Organismo Internacional de Energía Atómica (OIEA) se comparan el ![]() y el
y el ![]() en 93 pacientes: 68 hombres y 25 mujeres con edad promedio de 62 años. La eficaciade
en 93 pacientes: 68 hombres y 25 mujeres con edad promedio de 62 años. La eficaciade ![]() fue del 78 % y la del
fue del 78 % y la del ![]() del 60 %, aunque estas diferencias fueron estadísticamente no significativas. Para el
del 60 %, aunque estas diferencias fueron estadísticamente no significativas. Para el ![]() , en apariencia más tóxico, no se requirió tratamiento específico en ninguno de los dos grupos y se mostró tan seguro como el
, en apariencia más tóxico, no se requirió tratamiento específico en ninguno de los dos grupos y se mostró tan seguro como el ![]() en dosis hasta 450 MBq (12 mCi). Se concluye que por su disponibilidad general y bajo costo debe estimularse su uso más amplio, con el finde mejorar la calidad de vida y reducir los costos de la atención a pacientes con dolor óseo intratable debido a metástasis óseas [25]. En otro estudio en 62 pacientes con metástasis óseas extensivas se observó respuesta favorable en 55 % de 22 pacientes tratados con
en dosis hasta 450 MBq (12 mCi). Se concluye que por su disponibilidad general y bajo costo debe estimularse su uso más amplio, con el finde mejorar la calidad de vida y reducir los costos de la atención a pacientes con dolor óseo intratable debido a metástasis óseas [25]. En otro estudio en 62 pacientes con metástasis óseas extensivas se observó respuesta favorable en 55 % de 22 pacientes tratados con ![]() , 81 % en 22 pacientes tratados con
, 81 % en 22 pacientes tratados con ![]() y vitamina D y 9 % en 18 pacientes tratados solo con vitamina D. Basado en estos resultados se considera que el
y vitamina D y 9 % en 18 pacientes tratados solo con vitamina D. Basado en estos resultados se considera que el ![]() es un agente eficaz en el tratamiento del dolor provocado por metástasis óseas y que la vitamina D, como adyuvante, favorece de manera significativa su efecto paliativo [26].
es un agente eficaz en el tratamiento del dolor provocado por metástasis óseas y que la vitamina D, como adyuvante, favorece de manera significativa su efecto paliativo [26].
En Cuba la mayor experiencia se tiene en el uso del ![]() y se han reportado buenos resultados en un estudio con 50 pacientes, entre 1986-89, a los que se les administró 74 MBq (2 mCi) de Fosfato de sodio-[
y se han reportado buenos resultados en un estudio con 50 pacientes, entre 1986-89, a los que se les administró 74 MBq (2 mCi) de Fosfato de sodio-[![]() ]), en días alternos, hasta administrar 370 MBq (10 mCi). El 50 % de los pacientes mostró respuestas completas y los 46 %, parciales; 42 pacientes (84 %) refirieon desaparición del dolor y seis (12 %), alivio. No ocurrió depresión medular en ningún paciente [27]. En un trabajo más reciente [28] se reportó que fueron tratados con Fosfato de sodio-[
]), en días alternos, hasta administrar 370 MBq (10 mCi). El 50 % de los pacientes mostró respuestas completas y los 46 %, parciales; 42 pacientes (84 %) refirieon desaparición del dolor y seis (12 %), alivio. No ocurrió depresión medular en ningún paciente [27]. En un trabajo más reciente [28] se reportó que fueron tratados con Fosfato de sodio-[![]() ] 42 pacientes: 25 hombres y 17 mujeres, con tumores de próstata (25), mama (11), pulmón (tres) y otras localizaciones (tres). Veintinueve pacientes se mantuvieron sin dolor, nueve experimentaron gran mejoría, tres, ligeras mejorías y uno, sin cambio favorable. En relación con los efectos secundarios: 33 pacientes tuvieron una disminución del recuento hematológico dentro de límites normales, nueve pacientes sufrieron trombocitopenia y leucopenia ligeras. A seis pacientes se les realizó una segunda administración, también beneficiosa en sus efectos, aunque en menor grado [28].
] 42 pacientes: 25 hombres y 17 mujeres, con tumores de próstata (25), mama (11), pulmón (tres) y otras localizaciones (tres). Veintinueve pacientes se mantuvieron sin dolor, nueve experimentaron gran mejoría, tres, ligeras mejorías y uno, sin cambio favorable. En relación con los efectos secundarios: 33 pacientes tuvieron una disminución del recuento hematológico dentro de límites normales, nueve pacientes sufrieron trombocitopenia y leucopenia ligeras. A seis pacientes se les realizó una segunda administración, también beneficiosa en sus efectos, aunque en menor grado [28].
El Fosfato de sodio-[![]() ] ha sido la opción para Cuba en el tratamiento del dolor óseo metastásico debido a sus características físicas, menor costo relativo y posibilidades de adquisición, no obstante haber disminuido su uso y, por tanto, la disponibilidad del radionúclido en el mundo. Podría aun bajo estas circunstancias, utilizarse más, al tener en cuenta la prevalencia de ese síndrome y la experiencia internacional de uso por su eficacia y adecuada seguridad. Convendría extender más esa experiencia en nuestro medio, en beneficio de un mayor número de pacientes.
] ha sido la opción para Cuba en el tratamiento del dolor óseo metastásico debido a sus características físicas, menor costo relativo y posibilidades de adquisición, no obstante haber disminuido su uso y, por tanto, la disponibilidad del radionúclido en el mundo. Podría aun bajo estas circunstancias, utilizarse más, al tener en cuenta la prevalencia de ese síndrome y la experiencia internacional de uso por su eficacia y adecuada seguridad. Convendría extender más esa experiencia en nuestro medio, en beneficio de un mayor número de pacientes.
El ![]() como opción
como opción
El Centro de Isótopos ha puesto en marcha una línea de producción con posibilidad de hasta no menos de 37 GBq (1 Ci) de ![]() de alta calidad por semana [29]. Al obtenerse por separación electroquímica en un generador de radionúclidos, a partir del
de alta calidad por semana [29]. Al obtenerse por separación electroquímica en un generador de radionúclidos, a partir del ![]() producto de fisióncon período de semidesintegración de 28,8 años, hace que no se requiera importación de materia prima radiactiva, prácticamente por tiempo indefinido,es decir, que el radionúclido estaría disponible de manera sostenible.
producto de fisióncon período de semidesintegración de 28,8 años, hace que no se requiera importación de materia prima radiactiva, prácticamente por tiempo indefinido,es decir, que el radionúclido estaría disponible de manera sostenible.
Por el hecho de tener el ![]() una energía de emisión β mayor pudiera pensarse que debiera ser inclusive más radiotóxico que el
una energía de emisión β mayor pudiera pensarse que debiera ser inclusive más radiotóxico que el ![]() . En un trabajo teórico-experimental [30] que incluye el Citrato de itrio-[
. En un trabajo teórico-experimental [30] que incluye el Citrato de itrio-[![]() ] utilizado antes como radiofármaco en el tratamiento del dolor por metástasis óseas [31], se aprecia que el
] utilizado antes como radiofármaco en el tratamiento del dolor por metástasis óseas [31], se aprecia que el ![]() en forma de ortofosfato es más radiotóxico que el
en forma de ortofosfato es más radiotóxico que el ![]() en forma de citrato. Por otra parte, en exhaustivo estudio se ha probado la potencial eficacia del EDTMP-[
en forma de citrato. Por otra parte, en exhaustivo estudio se ha probado la potencial eficacia del EDTMP-[![]() ] en el tratamiento de la EOM y que tiene menor efecto sobre la médula ósea que el Citrato de itrio-[
] en el tratamiento de la EOM y que tiene menor efecto sobre la médula ósea que el Citrato de itrio-[![]() ] [32]. El radiofármaco de EDTMP con
] [32]. El radiofármaco de EDTMP con ![]() se comercializa en Europa por la firma IZOTOP de Hungría y se ha indicado un buen efecto de alivio de dolor en 191 pacientes, sin ningún efecto secundario severo y que a 24 pacientes se les realizaron de una a seis aplicaciones, lo que aumentó el tiempo de alivio con la repetición de tres a cinco meses como promedio. Dos de los pacientes de la serie estuvieron sin dolor dos años (con hasta seis aplicaciones). No se observó efecto adverso acumulativo con independencia del número de tratamientos [33]. El radiofármaco consiste en un liofilizadode EDTMP con el nombre de Multibone y Cloruro de itrio-[
se comercializa en Europa por la firma IZOTOP de Hungría y se ha indicado un buen efecto de alivio de dolor en 191 pacientes, sin ningún efecto secundario severo y que a 24 pacientes se les realizaron de una a seis aplicaciones, lo que aumentó el tiempo de alivio con la repetición de tres a cinco meses como promedio. Dos de los pacientes de la serie estuvieron sin dolor dos años (con hasta seis aplicaciones). No se observó efecto adverso acumulativo con independencia del número de tratamientos [33]. El radiofármaco consiste en un liofilizadode EDTMP con el nombre de Multibone y Cloruro de itrio-[![]() ]. En la actualidad Centis produce 250 mCi (9 250 MBq) quincenales de Cloruro de itrio-[
]. En la actualidad Centis produce 250 mCi (9 250 MBq) quincenales de Cloruro de itrio-[![]() ]. Se trata de introducir en el mercado cubano un producto con este precursor radiofarmacéutico, mediante el empleo del EDTMP liofilizado importado de Hungría. En el tratamiento de la EOM se utilizan entre 200 y 400 MBq/paciente [33]. De emplearse la última dosis podrían tratarse, a partir de la producción actual sin considerar las pérdidas por decaimiento, aproximadamente 20 pacientes. Si se tratan 10 pacientes por mes, alrededor de 100 por año, aún quedaría la mitad de la actividad para otras aplicaciones. Esa cifra de pacientes es en sí significativa y su incremento no dependería de la disponibilidad del radionúclido y del radiofármaco, sino de la extensión de esa aplicación. Centis continúa, además, el escalado, con la intención de incrementar la disponibilidad del Cloruro de itrio [
]. Se trata de introducir en el mercado cubano un producto con este precursor radiofarmacéutico, mediante el empleo del EDTMP liofilizado importado de Hungría. En el tratamiento de la EOM se utilizan entre 200 y 400 MBq/paciente [33]. De emplearse la última dosis podrían tratarse, a partir de la producción actual sin considerar las pérdidas por decaimiento, aproximadamente 20 pacientes. Si se tratan 10 pacientes por mes, alrededor de 100 por año, aún quedaría la mitad de la actividad para otras aplicaciones. Esa cifra de pacientes es en sí significativa y su incremento no dependería de la disponibilidad del radionúclido y del radiofármaco, sino de la extensión de esa aplicación. Centis continúa, además, el escalado, con la intención de incrementar la disponibilidad del Cloruro de itrio [![]() ] cada semana.
] cada semana.
CONCLUSIONES
El dolor óseo metastásico es un problema de sa-lud en nuestro país que, con un estimado conservador, puede afectar a 3750 pacientes por año. Radiofármacos de ![]() e
e ![]() han probado eficacia y seguridad en el tratamiento de esta enfermedad y resultan opciones viables en términos de costo-beneficios para atender un número mayor de pacientes que lo usual. En el primer caso, dado su bajo costo y relativa disponibilidad y en el segundo, por contarse con una instalación productiva eficaz del radionúclido.
han probado eficacia y seguridad en el tratamiento de esta enfermedad y resultan opciones viables en términos de costo-beneficios para atender un número mayor de pacientes que lo usual. En el primer caso, dado su bajo costo y relativa disponibilidad y en el segundo, por contarse con una instalación productiva eficaz del radionúclido.
REFERENCIAS BIBLIOGRÁFICAS
[1] MERCADANTE S. Malignant bone pain: pathophysiology and treatment. Pain. 1997; 69(1-2): 1-18.
[2] MUNDY GR. Metastasis to bone: causes, consequences and therapeutic opportunities. Nat. Rev. Cancer. 2002; 2(8): 584-593.
[3] International Atomic Energy Agency. Criteria for palliation of bone metastases-clinical applications. IAEA-TECDOC 1549. Vienna: IAEA, 2007. ISBN 92-0-104507-7.
[4] SCHULMAN KL, KOHLES J. Economic burden of metastatic bone disease in the US. Cancer. 2010; 109(11): 2334-2342.
[5] LI S, PENG Y, WEINHANDL ED, et. al. Estimated number of prevalent cases of metastatic bone disease in the US adult population. Clin Epidemiol. 2012; 4: 87-93.
[6] YU HH, TSAI YY, HOFFE SE. Overview of diagnosis and management of metastatic disease to bone. Cancer Control. 2012; 19(2): 84-91.
[7] ZHU XC, ZHANG JL, GE CT, et. al. Advances in cancer pain from bone metastasis. Drug Des Devel Ther. 2015; 18(9): 4239-4245.
[8] PANDIT-TASKAR N, BATRAKI M, DIVGI CR. Radiopharmaceutical therapy for palliation of bone pain from osseous metastases. J. Nucl. Med. 2004; 45(8): 1358-1365.
[9] IBRAHIM T, MERCATALI L, AMADORI D. A new emergency in oncology: bone metastases in breast cancer patients (review). Oncol Lett. 2013; 6(2): 306-310.
[10] TAYLOR DW. Economic and clinical net benefitsfrom the use of samarium Sm-153 lexidronam injection in the treatment of bone metastases. Intern J Tumor Therapy. 2013; 2(1): 10-17.
[11] KIROU-MAURO AM, HIRD A, WONG J, et. al. Has pain manaagement of painful bone metastases with an emphasis on radionuclide therapy. J. Natl Med Assoc. 2007; 99(7): 785-794.
[13] TOMBLYN M. The role of bone-seeking radionuclides in the palliative treatment of patients with painful osteoblastic skeletal metas-tases. Cancer Control. 2012; 19(2): 137-144.
[14] SILBERSTEIN EB. Teletherapy and radiopharmaceutical therapy of painful bone metastasis. Semin. Nucl. Med. 2005; 35(2): 152-158.
[15] PAUWELS EKJ, STOKKEL MP. Radiopharmaceuticals for bone lesions. Imaging and therapy in clinical practice. Q J Nucl. Med. 2001; 45(1): 18-26.
[16] LEWINGTON VJ. Bone-Seeking radionuclides for therapy. J. Nucl. Med. 2005; 46(suppl. 1): 38S-47S.
[17] GUPTA M, CHOUDHURY PS. Systemic radionuclide therapy for bone pain palliation in cancer patients. Cancer News. 2014, 8(2): 12-14. http://www.rgcirc.org/UserFiles/cancer-news-june-2014.pdf
[18] KRISHNAMURTHY G, KRISHNAMURTHY S. Radionuclides for metastatic bone pain palliation: a need for rational revaluation in the new millennium. J. Nucl. Med. 2000; 41(4): 688-691.
[19] SERAFINI AN. Therapy of Metastatic Bone Pain. J. Nucl. Med. 2001; 42(6): 895-906.
[20] SILBERSTEIN EB, ELGAZZAR AH, KAPILIVSKY A. Phosphorus-32 radiopharmaceuticals for the treatment of painful osseous metastases. Semin. Nucl. Med. 1992; 22(1): 17-27.
[21] SILBERSTEIN EB. The treatment of painful osseous metastases with 32P- labeled phosphates. Semin. Oncol. 1993; 20(3) suppl2: 10-21.
[22] SILBERSTEIN EB. Advances in our understanding of the treatment of painful bone metastases. J. Nucl. Med. 2000; 41(4): 655-657.
[23] BOUCHET LG, BOLCH WE, MURTY GS, et. al. Considerations of radiopharmaceuticals for palliation of bone pain from metastatic osseous lesions. J. Nucl. Med. 2000; 41(4): 682-687.
[24] SRIVASTAVA SC. Treatment of bone and join pain with electron emitting radiopharmaceuticals. Indian J. Nucl. Med. 2004; 19(3): 89-97.
[25] FETTICH J, PADHY A, NAIR N. Comparative clinical efficacy and safety of phosphorous-32 and Strontium-89 in the palliative treatment of metastatic bone pain: results of an IAEA coordinated research Project. World J. Nucl. Med. 2003; 2(3): 226-231.
[26] KHAN AU, KHAN SU, IQBAl M, KHAN A, SHAHID S. Metastatic bone pain palliation with P-32 in combination with vitamin D, Our preliminary experience. http://www.iaea.org/inis/collection/NCL-CollectionStore/_Public/43/005/43005480.pdf
[27] PORTILLA I, ALSINA S. de la C, OLIVA JP, et. al. P-32 en el tratamiento de las metástasis óseas por carcinoma prostático. Revista Cubana de Oncología. 2000; 16(1): 44-47.
[28] GARCÍA E, ALBERTI A, CRUZ J, MORIN J. Radiofármacos en el tratamiento del dolor por metástasis óseas. Nucleus. 2012; (52): 50-53.
[29] ALBERTI A, CRUZ A, MORIN J. Itrio 90 como radionúclido para terapia. Nucleus. 2012; (52): 62-67.
[30] GODDU SM, BISHAYEE A, BOUCHET LG, et. al. Marrow toxiciy of 33P-versus 32P-Orthophosphate: implications for therapy of bone pain and bone metastases. J. Nucl. Med. 2000; 41 (5): 941-951.
[31] MALJA S, SCHOMACKER K, MALJA E. Preparation of 90Y by the 90 Sr-90Y generator for medical purpose. J Radioanal Nucl Chemistry. 2000; 245(2): 403-406.
[32] RÖSCH F, HERZOG H, PLAG C, et. al. Radiation doses of yttrium-90 citrate and yttrium-90 EDTMP as determined via analogous yttrium-86 complexes and positron emission tomography. Eur. J. Nucl. Med. 1996; 23(8): 958-966.
[33] BALOGH I, GALLER Z, LANDHERR L. Do we really have to be cautious of repeating the Y-90-EDTMP therapy for bone pain palliation? J. Nucl. Med. 2013; 54 (suppl 2): 1405.
Recibido: 3 de junio de 2016
Aprobado: 27 de agosto de 2016