Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina General Integral
versión On-line ISSN 1561-3038
Rev Cubana Med Gen Integr v.13 n.5 Ciudad de La Habana sep.-oct. 1997
Actualidad
La dislipidemia en el paciente diabético. Parte II. Manejo de la dislipidemia en el paciente diabético
RESUMEN: La dislipidemia del paciente diabético tiene como primera condición la regulación de la glicemia y como primera opción terapéutica en caso de que no se restablezca el perfil lipídico normal, medida de control dietético y reducción del peso corporal si fuera necesario. Al iniciar la farmacoterapia, cuando fallen estas medidas, debe tomarse en consideración el nivel de los lípidos séricos y la presencia o no de macroangiopatía. La selección de los medicamentos que se deben utilizar debe ser cuidadosa a fin de no introducir reacciones colaterales particularmente adversas en estos pacientes.
Descriptores DeCS: HIPERLIPIDEMIA/quimioterapia; DIABETES MELLITUS/complicaciones; HIPERLIPIDEMIA/complicaciones; AGENTES ANTILIPIDEMICOS/uso terapéutico; AGENTES ANTILIPIDEMICOS/farmacología.
La Asociación Americana de Diabetes (ADA) ha recomendado estrategias no farmacológicas para tratar la dislipidemia y prevenir las complicaciones macrovasculares en los pacientes con diabetes mellitus. Tales estrategias incluyen: modificaciones de la dieta, reducción del peso corporal (si fuera necesario), ejercicio físico y control glicémico.1 Sin embargo, esta organización reconoce que el control de la glicemia en pocas ocasiones es suficiente para normalizar los niveles de lípidos en la mayoría de los pacientes diabéticos.1
Lineamientos generales
La aplicación de la farmacoterapia hipolipemiante en pacientes diabéticos ha sido objeto de diferentes publicaciones.2-7 Los pacientes diabéticos que no tengan otros factores de riesgo vascular y que mantengan cifras de lípidos normales deben chequear sus lípidos séricos anualmente.1-7
Si no hay evidencia de enfermedad macrovascular ni otros factores de riesgo, pero el paciente presenta valores de LDL 4,4 mmol/L, TG 4,4 mmol/L o HDL < 0,9 mmol/L, se refuerzan las medidas no farmacológicas ya mencionadas por un período de 6 meses. Si a pesar de estas medidas las cifras de LDL se mantienen 4 mmol/L y TG 4,4 mmol/L se recomiendan medidas farmacológicas con el objetivo de que el paciente alcance cifras de LDL < 3,2 mmol/L, TG < 2,2 mmol y HDL 0,9 mmol/L.1-7
Si el paciente diabético presenta además otro factor de riesgo no lipídico, aunque todavía sin evidencia de enfermedad macrovascular, se requiere el manejo del caso con medidas no farmacológicas. Así, una LDL 3,3 mmol/L y/o TG 2,2 mmol/L y/o HDL < 0,9 mmol/L será motivo suficiente para hacer esta indicación. Si al cabo de 6 meses no se logran cifras inferiores a estos valores es necesario indicar farmacoterapia hasta que el paciente alcance cifras de LDL y triglicéridos inferiores a las mencionadas y/o superiores de HDL.1-7
En el caso de que el paciente presente evidencia de macroangiopatía diabética bastan valores de LDL 2,5 mmol/L, TG 1,6 y HDL < 0,9 para iniciar tratamiento no farmacológico reforzado, pero en estos casos el chequeo del perfil lipídico debe realizarse entre 1 y 3 meses después. Si en ese tiempo el paciente no ha controlado sus lípidos de acuerdo con los niveles indicados debe indicarse farmacoterapia hipolipemiante.1-7
Debe tenerse en cuenta que aquellos pacientes con cifras de triglicéridos superiores a 11 mmol/L tienen riesgo elevado de pancreatitis y deben recibir de inmediato tratamiento con restricción de grasas por debajo del 10 % de las calorías de la dieta y la indicación de medicamentos hipolipemiantes que actúen específicamente sobre los triglicéridos.7
Terapia farmacológica de la dislipidemia asociada con la diabetes mellitus
Al indicar a un paciente diabético un fármaco hipolipemiante, este debe ser seleccionado cuidadosamente a fin de no contribuir con sus efectos adversos al empeoramiento del cuadro clínico-metabólico del paciente.
Las principales características de los agentes que se utilizan en la dislipidemia del diabético se resumen a continuación.
DERIVADOS DEL ÁCIDO FÍBRICO (CLOFIBRATO, BEZAFIBRATO, GEMFIBROZIL, CIPROFIBRATO, FENOFIBRATO Y OTROS)
Los derivados del ácido fíbrico reducen significativamente los triglicéridos y aumentan los niveles de HDL. Además, pueden reducir moderadamente los valores de colesterol total y el de LDL. Estos medicamentos incrementan la actividad de la LpL y disminuyen la producción hepática de VLDL.
Teniendo en cuenta que la hipertrigliceridemia se encuentra frecuentemente asociada con la diabetes, este tipo de medicamento ha sido evaluado en diversos ensayos para su aplicación en estos casos.8-10
El bezafibrato también muestra una eficiencia satisfactoria en los ensayos clínicos reportados en diabéticos,11 y muestra algunas ventajas al mejorar las propiedades reológicas de la sangre en estos casos. Sin embargo, se ha descrito que el bezafibrato puede incrementar las LDL-C en las dislipidemias con un fenotipo III según la clasificación de Friedewald.12
Aunque se consideran drogas seguras, los fibratos producen efectos adversos de distintos tipos, fundamentalmente gastrointestinales, así como erupciones, colelitiasis y en los casos de insuficiencia renal (una complicación que suele aparecer en los diabéticos), los fibratos pueden acumularse en sangre y producir una miositis potencialmente seria.13-15
INHIBIDORES DE LA HMG-CoA REDUCTASA
Los inhibidores de la reductasa de hidroximetil-glutaril-coenzima A disminuyen de forma efectiva la concentración de colesterol total y LDL, sin afectar el control de la glicemia y por tanto representan una buena opción para el tratamiento de la hipercolesterolemia asociada con la DMNID.
Estudios clínicos han demostrado que la pravastatina es capaz de reducir el colesterol total en 11 y 16 % en pacientes con DMNID en un período de 6 y 12 meses, respectivamente16 y muestran que la lovastatina redujo el colesterol en un 26 %.17
La sinvastatina redujo los niveles de colesterol total en 36 % al cabo de 52 semanas de tratamiento18 y la fluvastatina los redujo en 19,9 %.19.
Los efectos de los inhibidores de la HMG CoA reductasa en DMNID sobre los niveles de triglicéridos y HDL son modestos e inconstantes.
Se han realizado estudios a corto plazo de terapia combinada de lovastatina y gemfibrozil con el objetivo evidente de lograr una acción eficiente sobre los triglicéridos. En efecto, esta combinación ha logrado reducciones adicionales de colesterol y de los triglicéridos, pero debe utilizarse con extrema precaución debido al riesgo de miopatía severa, así como de posibles incrementos de la actividad sérica de la alanina amino transferasa, aspartato amino transferasa y fosfocreatinquinasa.20
ÁCIDO NICOTÍNICO
El ácido nicotínico limita la movilización de los ácidos grasos desde los tejidos periféricos hacia el hígado y reduce la producción hepática de VLDL. Ello reduce los niveles de triglicéridos y LDL en el plasma. Se ha sugerido que la niacina tiene un efecto estimulante de la actividad de LpL, por lo que se favorece el incremento de los niveles de HDL.21 Por estas razones el Programa Nacional de Educación del Colesterol (NCEP) había recomendado el ácido nicotínico como medicamento de primera línea en pacientes hipertrigliceridémicos.22 Sin embargo, los síntomas gastrointestinales que ocasiona pueden afectar la tolerabilidad en el paciente y esta droga está contraindicada en pacientes con úlcera péptica, gota y enfermedad hepática. Además, se ha demostrado que el ácido nicotínico empeora el control de la glicemia en el paciente diabético,21 por lo cual, la ADA no recomienda el ácido nicotínico como terapia de primera línea en el manejo de la dislipidemia del diabético.1
SECUESTRANTES DE ÁCIDOS BILIARES
Los secuestrantes de ácidos biliares o resinas, tales como la colestiramina o el colestipol, se unen a los ácidos biliares a nivel intestinal. De ese modo se impide el retorno de los ácidos biliares al hígado mediante la circulación enterohepática, y se incrementa la transformación de colesterol en ácidos biliares. El resultado final es una disminución de colesterol en el citoplasma del hepatocito, por lo que a su vez se incrementa la captación hepática de las LDL del suero.23
Sin embargo, teniendo en cuenta que las resinas tienden ha aumentar los niveles de triglicéridos, sobre todo en pacientes con hipertrigliceridemia marcada,24 y que uno de los efectos adversos característicos de las resinas es la constipación, su indicación en pacientes diabéticos, en particular con neuropatía autonómica gastrointestinal, incrementan la probabilidad de este efecto. Por todas estas razones, de acuerdo con las recomendaciones de la ADA, no se propone el uso de las resinas como terapia primaria en la DMNID.25-27
PROBUCOL
Es un agente hipolipemiante moderado con reconocido efecto antioxidante. Su mecanismo de acción es poco conocido, pero se plantea que al proteger la oxidación de las LDL-C se impide que el macrófago las fagocite, y favorece de este modo la captación por los receptores celulares específicos.28
Sus desventajas fundamentales son la disminución de los niveles de HDL-C que ocasiona (hasta un 25 %) y la prolongación del segmento QT del electrocardiograma.
Su principal ventaja clínica consiste en la reducción rápida de las lesiones xantomatosas en pacientes con hipercolesterolemia familiar,29 si bien su uso clínico está limitado en comparación con otras terapias, se mantiene vigente en función de sus propiedades antioxidantes. Sin embargo, una valoración de su uso en la dislipidemia del diabético no ha sido suficientemente elaborada.
POLICOSANOL (PPG-5)
El policosanol es un nuevo fármaco hipolipemiante consistente en una mezcla de alcoholes alifáticos primarios aislada y purificada de la cera de la caña de azúcar.
El policosanol reduce de manera efectiva el colesterol total y la LDL-C en modelos experimentales,30-32 voluntarios sanos33 y en pacientes con hipercolesterolemia tipo II.34-39
Los estudios preclínicos y clínicos realizados sustentan la extrema seguridad del producto administrado a corto y largo plazo.32-41 Un control piloto de vigilancia farmacológica realizada en más de 20 000 pacientes bajo tratamiento durante varios años confirma lo anterior. El policosanol inhibe la síntesis de colesterol en una etapa entre el acetato y el mevalonato e incrementa el proceso de captación, internalización y metabolización de las LDL-C mediante sus receptores, lo que disminuye sus niveles plasmáticos.42
El policosanol incrementa moderadamente la concentración de las HDL en la mayoría de los ensayos clínicos realizados, si bien en todas las ocasiones tales incrementos no han resultado significativos. Por otra parte, el tratamiento produce reducciones de los triglicéridos que sólo en algunos casos han alcanzado significación estadística.
El policosanol previene el desarrollo de lesiones ateromatosas en primates no humanos43 y en humanos.44-45 Por otro lado, estudios preclínicos y clínicos han demostrado que el policosanol es capaz de inhibir la agregación plaquetaria.46-47 Según parecen indicar resultados aún no publicados, este fármaco inhibe la formación de peróxidos lipídicos y de las LDL, así como reduce los niveles de tromboxano e incrementa los de prostaciclina,47 lo cual podría constituir la base de los efectos mencionados.
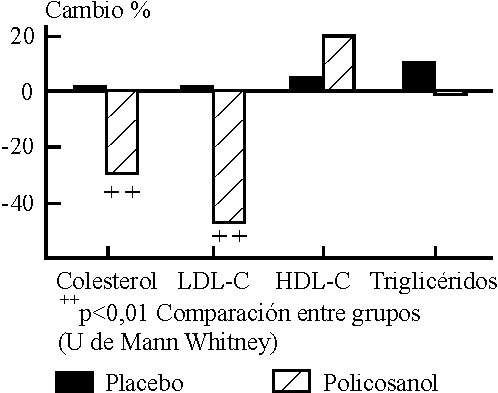
El efecto hipocolesterolemizante del policosanol sobre la dislipidemia asociada con la DMNID ha sido investigado especialmente en 2 ensayos clínicos a doble ciegas controlados con placebo. El colesterol total y la LDL-C disminuyeron en el primer ensayo 17,5 % y 21,8 %48 y en el segundo ensayo 29 y 44,4 %49 (figura) respectivamente. Aunque en ambos casos la eficacia resultó satisfactoria, en el segundo se apreció una mayor efectividad probablemente debido a un mejor y más prolongado control glicémico antes del inicio del período de tratamiento activo y durante éste. Además, estudios clínicos en los que se ha permitido la inclusión de pacientes con DMNID controlada han presentado resultados consistentes con estos datos.
FIGURA. Variaciones (%) del perfil lipídico en pacientes con DMNJD e hipercalesteralemia que recibieron tratamiento con policosanol (10 mg/día) durante 12 semanas.
Así, el perfil de acción del policosanol en virtud de la reducción de los niveles de colesterol total y LDL-C, su acción antiagregante plaquetaria y su efecto beneficioso sobre el desarrollo de lesiones unido a su excelente seguridad y tolerabilidad, en la cual se incluye el hecho de que no afecta el control glicémico de los pacientes con DMNID, indica que este tratamiento es una opción satisfactoria en el manejo de la dislipidemia asociada con la DMNID.
SUMMARY: Displipydemia of the diabetic patients has as a primary condiction the regulation of glycaemia and as o firts therapeutical choice the diet control and the reduction of body weight in case the normal lipidic prolife is nor reestablished. On beginning the pharmacotherapy, the level of the serum lipidis and the presence or not of macroangiopathy should be taken into o consideration if these measures fail. Drugs should be carefully selected so as not to introduce side effects particulary adverse for these patients.
Subject headings: HYPERLIPIDEMIA/drug therapy; DIABETES MELLITUS/complications; HYPERLIPIDEMIA/complications; ANTILIPIDEMIC AGENTS/therapeutic use; ANILIPIDEMIC AGENTS/pharmacology.
Referencias bibliográficas
- Kikuchi T, Onuma T, Shimura M, Tsutsui M, Boku A, Matsui J, Takebe K. Differente change in lipoprotein (a) levels from lipid levels of others lipoproteins with improved glycemic control in patients with NIDDM. Diabetic Care 1964; 9(17):1059-61, 1994.
- Dahlen GH, Slunga L, Lindblom B. Importance of Lp(a) lipoprotein and HLA genotipes in atheroesclerosis and diabetes. Clin Genet 1994; 1(46):46-51.
- American Diabetes Association. Consensus statement. Detection and management of lipid disorders in diabetes. Diabetes Care 1993; 1(16): 106-12.
- Hiratmtzu K, Bierman EI, Chait A. Metabolism of LDL from patients with diabetic hypertrigliceridemia by cultured human skin fibroblast. Diabetes 1995; 1(34):8-14.
- López-Virella MF, Klein RL, Lyons TJ, Stevenson HC, Witztum JL. Glycosilation of low density lipoproteins enhances cholesteryl ester synthesis in human monocytes derived macrophages. Diabetes 1988; 4(37):550-7.
- López-Virella MF, Colwell JA. Pharmacological treatment of lipid disorders in diabetes mellitus. Diabetes Metab Rev 1987;1(3):691-772.
- Garg A, Grundy SM. Management of dislypidemia in NIDDM. Diabetes Care 1990; 1(13):153-8.
- Betteride DJ. Management of hyperlipidemia in the diabetic patient. In: Mogensen CE, Standl E, eds. Pahrmacology of Diabetes. Berlin: Ed. de Gruytel, 1990;135-51.
- Gotto AM, Assmann G, Carmena R, Davignonb J, Fernández-Cruz A, Paoletti R, Management of Patients with Diabetes Mellitus SUMMARY CHART: Evaluation and treatment of lipid disorders in adults with diabetes mellitus. In: The ILIB Lipid Handbook for Clinical Practice 1995:132-9.
- Koshinen P, Manttari M, Manniten V, Coronary heart disease incidence in NIDDM patients in the Helsinky Heart Study. Diabetes Care 1992;820-7.
- Mikhailidis DP, Arthur S, Barradas MA, Dawdona P, Bezafibrato Retard in type II diabetic patients: Effect on hemeostasis and glucose homeostasis. J Cardiovas-Pharmacol 1990; 9(13):34-9.
- Goldberg R, La Belle P, Zupkis R, Ronca P. Comparison of the effect of lovastatin and gemfibrozil on lipids and glucose control in non-insulin-dependent diabetes mellitus Am J Cardiol 1990; 2(66):16B-21B.
- Vinik AI, Colwell JA, and the hiperperlipidemia in Diabetes Investigators. Effects of gemfibrozil on triglyceride levels in patients with NIDDM. Diabetes Care 1993;1(16):34-7.
- Kasaniemi Y, Grundy SM. Influence of gemfibrozil and clofibrate on metabolism of cholesterol and triglycerides in man. JAMA 1995; 4(253):2398-403.
- Levy RI, Blum C. What are the comparative risk for the bile acids sequestrants, HMG-CoA reductase inhibitors, nicotine acid, probucol and fibric acids derivatives? In: Morganroth J, Moore J, Moore EN eds. Risk/Benefit Analysis for the use and Approval of Thrombotic, Antiarrhitmic and Hypolipidemic agent. Boston: M.A. Kiever Academic Publishers 1989;215-23.
- Bridgeman JF, Rose SM, Thorp JM. Complication during clofibrate treatment of nephrotic syndrome hyperlipoproteinemia. Lancet 1972; 2(ii):506-9.
- Diabetes Control and Complications Trial Resarch Group. Effect of intensive treatment of diabetes on the development and progression of long term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 10(329), 1456-62.
- Yoshino G, Kasumi T, Iwai M, Maatsushito M, Matsuba K, Venoyan K, Iwatani I, Baba S. Tratamiento a largo plazo de la hipercolesterolemia en diabetes no insulino dependientes con pravastina. Atherosclerosis 1989; 1(75):67-72.
- Garg A, Scatt M, Grundy MD. Treatment of dislipidemia in non insuline diabetes mellitus with lovastatin. Am J Cardiol 1988; 5(62):443--93.
- Bach L, Wirth A, O'Brien RC Jerums G, Cooper ME Cholesterol lowering effect of simbastatin in patients with non-insulin dependent diabetes mellitus. Diab Nutr Metab 1991;3(4):123-8.
- Knopp RH. Efficacy and safety of fluvastatinin patients with non insuline-dependent diabetes mellitus and hyperlipemia. Am J Med 1993; 3(329):1456-62.
- Garg A, Grundy SM. Gemfibrozil alone and in combination with lovastatin for treatment of hypertrigliceridemia in NIDDM. Diabetes 1989; 1(38):365-74..
- Garg A, Grundy SM, Nicotinic acid as therapy for dislipidaemia in non-insulin-dependent diabetes mellitus. JAMA 1990; 3(264):723-6.
- The Expert Panel. Report of the National Cholesterol Education Program Expert Panel on Detection. Evaluation, and Treatment of High Blood Cholesterol in Adults. Arch Intern Med 1988; 1(148):36-69.
- The lipid research clinic program. The lipid research clinic and the coronary primary prevention trial results II The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA 1984;4(251):365-74.
- Crouse JR. Hypertriglyceridemia: a contraindication to the use of bile acid binding resins. Am J Med 1987;3(83):243-8.
- Parthasarathy S, Young SG, Witzum JL, Pittman RC. Steinberg D. Probucol inhibits oxidative modification of low density lipoproteins. J Clin Invest 1986; 6(77):641-4.
- Yamamoto A, Matsuzawa Y, Yoko-yama S, Funashashi T, Yamamura T, Kishino BI. Effect of probucol on xanthomata regression in familial hypercholesterolemia. Am J Cardiol 1986; 1(57):29H-35H.
- Arruzabala ML, Carbajal D, Más R, Illnait J, Laguna A, Castaño G. Efecto del policosanol sobre el perfil lipídico de conejos normocolesterolémicos. Arch Ven Farmacol Ter 1992; 2(11):80-6.
- Arruzabala ML, Carbajal D, Más R, Castaño G, Stolongo R, Mesa R. Efecto del Ateromixol (PPG) sobre los niveles de colesterol en perros Beagle. Rev CENIC Ciencias Biológicas 1991;1-2(22):72-3.
- Cruz Bustillo D, Mederos CM, Más R, Arruzabala ML, Barreto B, Martínez O. Efecto hipocolesterolémico del ateromixol (PPG) en el cerdo de ceba. Rev CENIC Ciencias Biológicas, 1991;1-2(22):62-3.
- Hernández F, Illnait J, Más R, Castaño G, Fernández L, González M, Cordovi N, Fernández J C. Effect of Ateromixol on serum lipids and lipoproteins in healthy voluteers. Curr Ther Res 1992;4(51):568-75.
- Castaño G, Más R, Nodarse M, Illnait J, Fernández L, Fernández JC. One year study of the efficacy and safety of policosanol (5 mg twice daily) in the treament of type II hypercholesterolemia. Curr Ther Res 1995; 3(56):-296-304.
- Aneiros E, Calderón R, Más R, Illnait J, Castaño G, Fernández L, Fernández JC. Effect of policosanol succesive dose increase on lipid profile and tolerability to treatment. Curr Ther Res 1993;2(54):304-12.
- Pons P, Más R, Illnait J, Fernández L, Rodríguez M, Robaina C, Fernández JC. Efficacy and safety of policosanol in patients with primary hypercholesterolemia. Curr Ther Res 1992;4(52):507-13.
- Castaño G, Más R, Nodarse M, Illnait J, Fernández L, Fernández JC. One year study of the efficacy and safety of policosanol (5 mg twice daily) in the treatment of type II hypercholesterolemia. Curr Ther Res 1995;3(56):296-304.
- Castaño G, Canetti M, Moreira M, Tula L, Más R, Illnait J, Fernández L, Fernández JC, Díaz E. Efficacy and tolerability of policosanol in elderly patients with type II hypercholesterolemia: a 12-month study. Curr Ther Res 1995;8(56):819-28.
- Canetti M, Morera M, Más R, Illnait J, Fernández L, Fernández JC, Díaz E, Castaño G. A two year study on the efficacy and tolerability of policosanol in patients with type II hypercholesterolemia. Int Clin Pharm Res 1995;4(25):159-65.
- Menéndez R, Fraga V, Sotolongo V, Amor AM, Del Río A, González RM, Jiménez S, Más R. Efecto de la administración oral de policosanol sobre el metabolismo lipídico de ratas normocolesterolémicas. Rev Mex Ciencias Farmacéuticas 1993;4(24):16-8.
- Fernández SL, Rendón A, de las Cajigas A, López M. Estudio genotóxico del Ateromixol (PPG), un nuevo hipolipemiante. Rev CENIC Ciencias Biológicas 1991;(1-2):22:98-101.
- Alemán CL, Más R, Rodeiro I, Noa M, Hernández C, Capote A, Menéndez R, González RM, Amos AM, Jiménez S. Toxicología aguda del ateromixol (PPG) en roedores. CENIC Ciencias Biológicas 1991;1-2(22):102-5.
- Rodríguez C, Mesa R, Más R, Noa M, Menéndez R, González RM, Amor AM, Fraga V, Sotolongo V, Laguna A. Effect of policosanol chronically administered in male monkeys (Macaca arctoides). Food and Chemical toxicology 1994;4(32):565-76.
- Batista J, Stusser R, Penichet M, Uguet E. Doppler-ultrasound pilot study of the effects of long-term policosanol therapy on carotid-vertebral atherosclerosis. Curr Ther Res 1995;9(56):906-14.
- Batista J, Stusser R, Sáez F, Pérez B. Effect of policosanol on hyperlipidemia and coronary heart disease in middle-aged patients. A 14-month pilot study. Int J Clin Pharmacol Ther (en prensa) 1996.
- Arruzabala ML, Carbajal D, Molina V, Valdés S, Más R, García M. Estudio farmacológico de la interacción entre el policosanol y la aspirina en animales de experimentación. Rev Iberoamericana de Trombosis y Hemostasia 1992;5(1):17-20.
- Arruzabala ML, Carbajal D, Más R, García M, Fraga V. Effects of policosanol on platelet aggregation in rats. Thrombosis Research 1962;1(69):321-7.
- Arruzabala ML, Carbajal D, Molina V, Valdés S, Más R. Effect of policosanol on cerebral ischemia in Mongolian gerbils: Rol of prostaciclin and thromboxane A2. Prostaglandins Leucotrienes and essential Fatty Acids 1993;6(49):695-7.
- Torres O, Illnait J, Más R, Fernández L, Fernández JC. treatment of hypercholesterolemia in non-insuline-dependent mellitus with policosanol. Diabetic Care 1995;(2)18:393-7.
- Crespo N, Álvarez R, Illnait J, Más R, Fernández L, Fernández JC. Effectiveness of policosanol on hypercholesterolemia associated to non-insulin-dependent diabetes mellitus. Curr Ther Res (en prensa).
Recibido: 22 de junio de 1996. Aprobado: 21 de julio de 1996.
Dr. José Illnait Pérez. CENIC. Ave 25 y 158, Cubanacán, Playa, Ciudad de La Habana, Cuba.
- Doctor en Ciencias. Especialista de II grado en Bioquímica Clínica e Investigador Auxiliar del Centro Nacional de Investigaciones Científicas, Ciudad de La Habana.