Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol v.18 n.2 Ciudad de la Habana jul.-dic. 2005
Instituto de Neurología y Neurocirugía
Neuropatía óptica isquémica
Dr. Alberto Omar González García,1 Dr. Carlos E. Mendoza Santiesteban2 Dra. Rosaralis Santiesteban Freixas3 y Dra. Martha Francisco Plasencia1
Resumen
Se realizó una revisión sobre distintos aspectos actualizados relacionados con la neuropatía óptica isquémica. Esta constituye una devastadora entidad que en muchos casos da al traste de manera permanente con la visión de los pacientes. Se divide en dos grandes grupos de acuerdo con el sitio donde ocurre (anterior o posterior) y un tanto así por la relación con su causa (arterítica o no arterítica). La neuropatía óptica isquémica se relaciona con un gran número de factores de riesgo como la hipertensión arterial, cardiopatía isquémica, apnea del sueño entre otras. Al constituir una enfermedad multifactorial su tratamiento se enmarca de una manera individualizada y el ánimo de cubrir todas las posibles causas haciendo principal énfasis en la terapia antioxidante.
Palabras clave: Neuropatía óptica isquémica; factores de riesgo; tratamiento: terapia antioxidante.
Concepto
La neuropatía óptica isquémica (NOI) representa un grupo de desórdenes isquémicos del nervio óptico (NO).1 Esta entidad constituye un infarto de la papila y más raramente de la porción posterior del nervio óptico no relacionado con procesos inflamatorios, desmielinización, infiltración o compresión tumoral, o congestión orbitaria difusa.2
Clasificación
La neuropatía óptica isquémica (NOI) mundialmente se clasifica en: anterior (NOIA) la cual se caracteriza por la tríada de un defecto pupilar aferente, un defecto del campo visual y un edema del disco óptico. En la neuropatía óptica isquémica posterior (NOIP), no suele haber edema del disco óptico.3
La NOIA a su vez se subclasifica en dos grandes grupos: arterítica (NOIA-A), asociada a arteritis (temporal) de células gigantes (ACG), y no arterítica (NOIA-NA).4
Epidemiología
Según estudios realizados, la NOI constituye la neuropatía óptica no glaucomatosa más frecuente en pacientes mayores de 50 años de edad.5
Aporte sanguíneo del nervio óptico
Aporte sanguíneo
La capa de fibras nerviosas de la retina se encuentra irrigada por ramas de la arteria central de la retina y en ocasiones, sobre todo en la región temporal del disco óptico, por la arteria ciliorretiniana (fig. 1). A nivel de la lámina coroidalis está abastecida por los ramos centrípetos de la coroides peripapilar, a cuyo nivel no se emiten ramas de la central de la retina.1
Fig. 1. Aporte sanguíneo al nervio óptico.
El suministro hemático de la región laminar está a cargo de las ramas centrípetas de las ciliares cortas posteriores, directamente o a través del llamado círculo o anillo de Zinn y Haler, aunque se plantea que el mismo no existe en la mayoría de los humanos o está incompleto. A este nivel no se emiten ramas de la central de la retina.1
Los 10 a 15 mm retrolaminar más cercanos al globo ocular son nutridos por los capilares que provienen de la arteria central de la retina, mientras el resto se nutre del plexo pial centrípeto que deriva de, las ciliares cortas posteriores, de ramos que regresan de la coroides peripapilar, ramos centrípetos de la arteria central de la retina y las anastomosis que coexisten con el sistema de carótida externa (meníngea media, temporal superficial y facial transversa).3
Patogénesis
Factores predisponentes
Dentro de esta categoría están todas aquellas entidades que de una manera u otra se asocian con la susceptibilidad del NO a los procesos isquémicos (tabla 1).
Tabla 1. Factores predisponentes sistémicos y locales
| Factores predisponentes sistémicos | Factores predisponentes locales |
| Hipertensión arterial | Disco óptico pequeño (crowded) |
| Diabetes mellitus | Edema marcado del nervio óptico |
| Accidente vascular encefálico | Drusen del nervio óptico |
| Enfermedad cardíaca isquémica | Hipertensión ocular |
| Desórdenes tiroideos | Anomalías congénitas |
| Arteriosclerosis | Localización de las zonas vasculares limítrofes Watershed con respecto al nervio óptico |
| Aterosclerosis | Todos aquellos factores sistémicos que actúan en los vasos nutrientes del nervio óptico |
| Enfermedad de la carótida interna | |
| Arteritis de células gigantes | |
| Vasculitis | |
| Migraña y otros desórdenes vasoespásticos | |
| Hemorragias sistémicas masivas | |
| Hiperhomocistinemia | |
| Apnea del sueño | |
| Drogas |
Clínica
Características clínicas
Edad Es bien cierto que la edad promedio en que tiene mayor incidencia la NOIA-NA es a los 60 años. Existe un 10 % de la población en que ocurre esta entidad con edades menores a 45 años.5 Por otro lado, la NOIA-A se presenta casi exclusivamente en pacientes con más de 55 años de edad.6
Sexo
Aunque de manera general no existen grandes diferencias en cuanto a la distribución de las NOIs por sexo, en sus estudios, Hayreh y otros han encontrado en las NOIA-NA un ligera prevalencia del sexo masculino, mientras que en la ACG se observó lo contrario.7
Momento del ictus
En muchas publicaciones se argumenta y existe el consenso de que la mayoría de los pacientes (73,3 %) refiere la pérdida visual en tempranas horas de la mañana o al despertar de una siesta.8 Estas horas de comienzo del evento también se describen en el NOIA6,9 Otro de los aspectos interesantes en el comportamiento de las NOIA-NA es su marcada incidencia en los meses de más alta temperatura.8
Psicofísica
La agudeza visual puede variar desde 20/20 (menos frecuente) hasta no percepción luminosa. Hay una disminución importante de la sensibilidad al contraste, así como de la visión del color.
Oftalmoscopía y biopmicroscopía
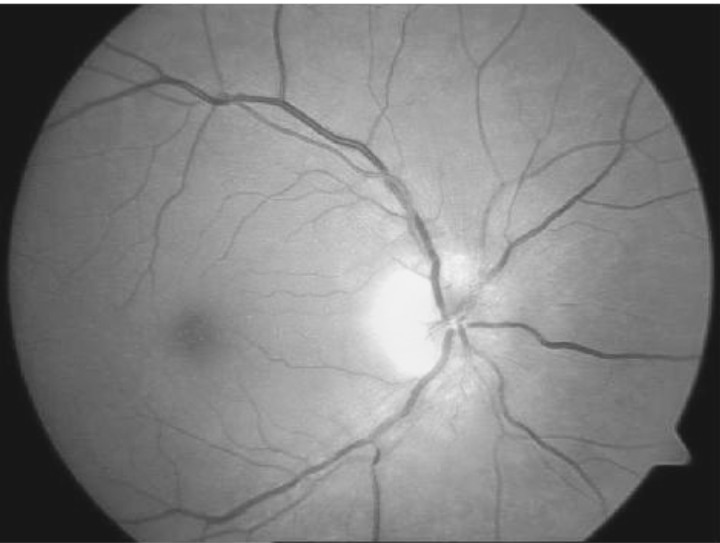
En los primeros días de producirse la NOI-NA se observa en el ojo afecto un disco óptico edematoso, el cual puede abarcar todo el disco o solo un sector del mismo, correspondiente al más afectado. Cuando es muy incipiente el examen, el edema no necesariamente es pálido. La palidez se instaura en la medida en que evoluciona el cuadro.1 A nivel de la capa de fibras nerviosas se constatan hemorragias en astilla de variable cuantía. Otro elemento encontrado puede ser el infarto de la capa de fibras nerviosas (exudados superficiales). Es común encontrar en período de estado una muy leve celularidad en el vítreo posterior. A las 2-3 semanas aún está presente el edema, pero se hace más evidente la palidez del disco (fig. 2). En un término de 2 a 3 meses el edema se reabsorbe y se hacen más visibles las líneas demarcatorias del edema, o pseudopliegues coroideos como también se les conoce. Existen algunos casos como en los pacientes diabéticos en que el edema puede demorar un tanto más de lo normal en reabsorberse.1
Fig. 2. Fotografía del nervio óptico del ojo derecho de una paciente femenina de 55 años de edad, con 2 semanas de evolución en la cual se muestra edema del disco y palidez de la región temporal.
Es muy importante señalar que el edema del disco en las NOI-NA en ocasiones es indistinguible de los producidos por otras entidades como las neuritis ópticas sobretodo en las virales, inmunológicas o posvaccinales y es entonces en que el detallado interrogatorio y los exámenes complementarios se hacen indispensables para el correcto diagnóstico diferencial.
Cuando se examina el ojo contralateral generalmente se encuentra un disco pequeño.10
Exámenes complementarios
Es indispensable la realización de todos aquellos complementarios que esclarezcan el estado sistémico del paciente en el orden de controlar todos los factores de riesgo.
Eritrosedimentación y proteína C reactiva
Cuando se encuentran cifras de eritrosedimentación elevadas en pacientes con NOI el diagnóstico de NOI-A se refuerza, sobretodo en pacientes con más de 60 años de edad. Algunos autores validan el anterior planteamiento pero en estudios recientes de larga data se han encontrado gran número de caso con eritrosedimentación normal y biopsia de arteria temporal positiva de arteritis de células gigantes (ACG), incluso las cifras de proteína C reactiva han resultado, por si sola, específica y aún más si se asocia con la eritrosedimentación elevada.11,12
La angiografía fluoresceínica
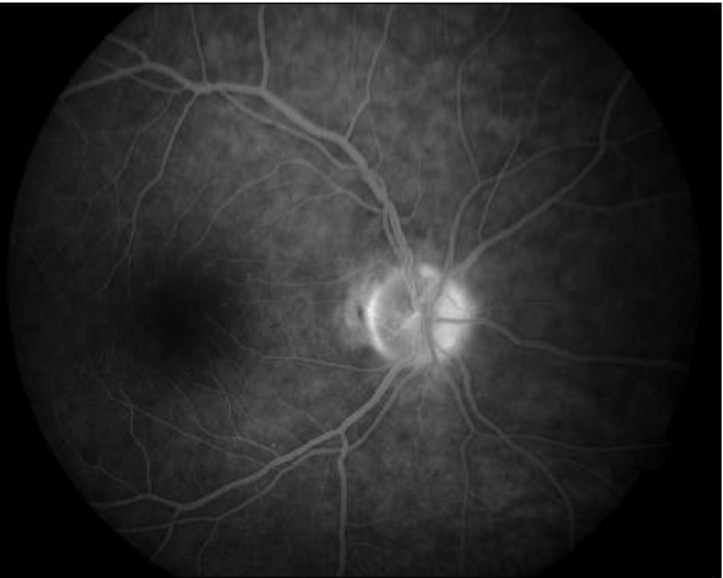
Resulta ser un elemento importante en el estudio de la circulación sanguínea del NO y la red coriocapilar peripapilar tanto en estado de salud o enfermedad, lo que demuestra la gran variabilidad interpersonal en la distribución del territorio de irrigación de las ciliares cortas posteriores en el NO y la región peripapilar, así como muestra las áreas de watershed en dichas estructuras. En los días iniciales del proceso isquémico es posible diferenciar la forma arterítica de la no arterítica de manera bastante confiable, si en el estudio angiográfico se observa un defecto de llenado de la red coriocapilar peripapilar, lo cual ocurre muy raramente en la NOIA-NA.1 En las NOI se observa un profuso escape de la fluoresceína en las áreas dañadas y edematosas13 (fig. 3). Incluso algunos autores le atribuyen a la angiografía fluoresceínica valor diferencial entre las formas arteríticas y no arteríticas.14
Fig. 3. Fotografía del nervio óptico del ojo derecho de la misma paciente con 3 semanas de evolución en la cual se muestra el defecto de llenado de fluorescencia en el sector temporal del disco correspondiente al territorio de la arteria ciliar corta posterior afectada.
Potenciales evocados visuales y electrorretinograma a patrón
Los potenciales evocados visuales más que diagnóstico tienen valor a la hora de evaluar la evolución de la enfermedad o los efectos de medicamentos utilizados. El electrorretinograma a patrón constituye un elemento de ayuda en el diagnóstico diferencial de la NOIA-NA, sobretodo con las neuritis ópticas en las cuales el registro de N95 no se ve tan afectado como en las primeras.15
Diagnóstico diferencial
Diagnóstico diferencial etiológico
Lo primero que se debe tener en cuenta ante el diagnóstico de NOI es su diferenciación entre su etiología arterítica o no arterítica. Existen algunos elementos1 (tabla 2) que aunque no son absolutos son una guía importante y útil.
Tabla 2. Guía de elementos para el diagnóstico diforme
| Neuropatía óptica isquémica | Arterítica | No arterítica |
| Edad | Mayores de 55 años | Cualquier edad (más común en adultos) |
| Sexo | Más común en mujeres | Más común en hombres |
| Agudeza visual | Pérdida masiva | Pérdida menos profunda |
| Claudicación a la masticación | Muy frecuentes | Poco frecuentes |
| Cefaleas en región temporal | Muy frecuentes | Poco frecuentes |
| Amaurosis fugax | Muy frecuentes | Poco frecuentes |
| Eritrosedimentación | Acelerada o normal | Normal o acelerada |
| Proteína C reactiva | Positiva | Negativa o positiva |
| Edema | Muy pálido | Pálido |
| Biopsia de arteria temporal | Positiva o negativa | Negativa |
| Atrofia posedema | Excavada | Plana |
| Angiografía fluoresceínica | Defecto de lleno de la trama coroidea peripapilar (más frecuentemente nasal) | No defecto o mínimo |
Manejo
Tratamiento médico: hasta la actualidad no existe ningún tratamiento eficaz capaz de revertir por completo el proceso de deterioro visual ocasionado por la isquemia aguda o crónica del NO. Si bien es cierto lo anterior, existen una serie de medidas que se pueden tomar en el orden de mejorar el estado visual tanto en lo que respecta a la agudeza visual como al campo visual.
Aunque los tópicos que se detallan a continuación, por si solo no han demostrado ser del todo útil en el tratamiento de las NOIs, el uso de los mismos en combinación y previa individualización de cada paciente aumenta la calidad visual de ellos.
Recordar que la NOI es una enfermedad multifactorial por lo que muy probablemente no existirá un medicamento o proceder quirúrgico que solucione por si solo tan catastrófico evento.
Aspirina: las propiedades beneficiosas del uso del ácido acetil salicílico (ASA) en las NOIA-NA resulta bastante controversial, sobretodo en evitar el infarto del NO contralateral. En sus estudios retrospectivos algunos autores han encontrado que la ASA reduce el riesgo de NOIA-NA en el segundo ojo,16 mientras que otros estudios prospectivos de larga data (7 años) lo refutan.17 Cada día es más fuerte la creencia de la multifactorialidad de las NOIs y que en su patogenia la aterosclerosis constituye un factor más. Aún así en la práctica diaria se encuentran pacientes con factores que evidentemente sugieren la causa tromboembólica. Son en estos casos en los que resulta de gran importancia el uso de ASA y otros medicamentos que protegen el sistema cardiovascular.
Brimonidina: la brimonidina tópica (tartrato) ha sido utilizada en varios estudios de experimentación en modelos animales resultando beneficiosa como agente neuroprotector de las células ganglionares, tanto en elevación de la presión intraocular (PIO) así como en la injuria directa del NO.18-20. A pesar del efecto protector en modelos animales, en los ensayos clínicos (abortados) el resultado ha sido negativo, es decir no se muestran diferencias estadísticamente significativas con el grupo control.20 Algunos autores postulan que: la brimonidina no alcanza en niveles apropiados el NO, no disminuye la PIO a niveles tan bajos como para mejorar la perfusión en el NO y que su acción neuroprotectora de las células ganglionares está a nivel de la retina y no en el NO1.
Vitaminas y ácido fólico: las vitaminas y los folatos constituyen un elemento esencial en el metabolismo celular y equilibrado funcionamiento del endotelio vascular,21,22 por lo que su prescripción en los pacientes con NOIA-NA pudiera constituir un pilar importante en la atenuación de la injuria y disfunción endotelial.4
Ozono: no existe referencia en la bibliografía acerca del uso del O3 en las NOIs, en nuestro centro se realizó un estudio en aras de determinar su efecto en dicha entidad y fue precisamente en los casos con daño al NO de causa vascular.23,24
Esteroides: la NOIA-A constituye una de las pocas y reales emergencias en la oftalmología.25 La falta de un tratamiento agresivo y oportuno constituye un riesgo inminente de pérdida visual masiva, incluso de ambos ojos. Ante la fuerte sospecha de ACG, no se debe esperar a realizar la biopsia de la arteria temporal homónima, en el transcurso de una semana no existirán variaciones que enmascaren el diagnóstico anatomopatológico. Incluso después de realizada la biopsia no debe esperarse el resultado y sólo ante un reporte negativo del patólogo se debe interrumpir la medicación.
Las terapéuticas quirúrgicas han sido desarrolladas, pero hasta ahora sin éxito probado.
Summary
Ischemic optic neuropathy
A review was made on the different aspects updated in relation to ischemic optic neuropathy. This is a devastating entity that in many cases causes a permanent damage to the patients' vision. It is divided into 2 large groups, according to the site where it occurs (anterior or posterior) and to the connection with its cause (arteritic or non-arteritic). Ischemic optic neuropathy is related to a great number of risk factors, such as arterial hypertension, ischemic heart disease and sleep apnea, among others. As it is a multifactorial disease, its treatment is individualized aimed at determining all the possible causes, making special emphasis on the antioxidant therapy.
Key words: Ischemic optic neuropathy, risk factors, treatment, antioxidant therapy.
Referencias bibliográficas
1. Hayreh SS. Ischaemic Optic Neuropathy. Indian J Ophthalmol 2000;48:171-94.
2. Glaser JS. Topical Diagnosis: Prechiasmal Visual Pathways. In: Duanes 2004.
3. Sedwick LA. Ischemic Optic Neuropathy. In: Kline LB (ed): Optic Nerve Disorders. San Francisco, American Academy of Ophthalmology, 1996, Pp. 75-89.
4. Weger M, Stanger O, Deutschmann H, Simon M, Renner W, Schmut O, Semmelrock J, Haas A. Hyperhomocyst(e)inaemia, but not MTHFR C677T mutation, as a risk factor for non-arteritic ischaemic optic neuropathy. Br J Ophthalmol 2001;85:803-6.
5. Hayreh SS. Joos KM, Podhajsky PA, Long CR. Systemic diseases associated with nonarteritic anterior ischemic optic neuropathy. Am J Ophthalmol 1994;118:766-80.
6. Hayreh SS, Podhajsky PA, Zimmerman B. Occult giant cell arteritis: Ocular manifestations. Am J Ophthalmol 1998;125:521-6.
7. Hayreh SS, Podhajsky PA, Zimmerman B. Ocular manifestations of giant cell arteritis. Am J Ophthalmol 1998;125:509-20.
8. Hayreh SS, Patricia A, Podhajsky PA, Zimmerman B. Nonarteritic anterior ischemic optic neuropathy - Time of onset of visual loss. Am J Ophthalmol 1997;124:641-7.
9. Woldemussie E, Ruiz G, Wijono M, et al. Neuroprotection of retinal ganglion cells by brimonidine in rats with laser-induced chronic ocular hypertension. Invest Ophthalmol Vis Sci 2001;42:2849-55.
10. Cox TA. Crowded optic discs and AION. Anterior ischemic optic neuropathy. Ophthalmology. 1999 Dec;106(12):2234-5.
11. Nagy V, Facsko A, Takacs L, Balazs E, Berta A, Balogh I, Edes I, Czuriga I, Pfliegler G. Activated protein C resistance in anterior ischaemic optic neuropathy. Acta Ophthalmol Scand. 2004;82(2):140-3.
12. Nagy V, Facsko A, Takacs L, Balazs E, Berta A, Balogh I, Edes I, Czuriga I, Pfliegler G. Activated protein C resistance in anterior ischaemic optic neuropathy. Acta Ophthalmol Scand. 2004;82(2):140-3.
13. Spraul CW, Amann J, Lang GE, Lang GK. Risk factors and clinical fluorescein angiography findings in anterior ischemic optic neuropathy. Ophthalmologe. 1996;93(4):354-60.
14. Valmaggia C, Speiser P, Bischoff P, Niederberger H. Indocyanine green versus fluorescein angiography in the differential diagnosis of arteritic and nonarteritic anterior ischemic optic neuropathy. Retina. 1999;19(2):131-4.
15. Froehlich J, Kaufman DI. Use of pattern electroretinography to differentiate acute optic neuritis from acute anterior ischemic optic neuropathy. Electroencephalogr Clin Neurophysiol. 1994;92(6):480-6.
16. Salomon O, Huna-Baron R, Steinberg DM, Kurtz S, Seligsohn U. Role of aspirin in reducing the frequency of second eye involvement in patients with non-arteritic anterior ischaemic optic neuropathy. Eye. 1999;13:357-9.
17. Beck RW, Hayreh SS, Podhajsky PA, Tan ES, Moke PS. Aspirin therapy in nonarteritic anterior ischemic optic neuropathy. Am J Ophthalmol. 1997;123(2):212-7.
18. Wheeler LA, Woldemussie E. Alpha-2 adrenergic receptor agonists are neuroprotective in experimental models of glaucoma. Eur J Ophthalmol 2001;11(suppl 2):S30-5.
19. Yoles E, Wheeler LA, Schwartz M. Alpha2-adrenoreceptor agonists are neuroprotective in a model of optic nerve degeneration. Invest Ophthalmol Vis Sci 1999;40:65-73.
20. Fazzone H E, Kupersmith M J, Leibmann J. Does topical brimonidine tartrate help NAION? Br J Ophthalmol 2003;87:1193-4.
21. Title LM, Cummings PM, Giddens K, et al. Effect of folic acid and antioxidant vitamins on endothelial dysfunction in patients with coronary artery disease. J Am Coll Cardiol 2000;36:758-65.
22. Woo KS, Chook P, Lolin YI, et al. Folic acid improves arterial endothelial dysfunction in adults with hyperhomocysteinemia. J Am Coll Cardiol 1999;34:2002-6.
23. Santiesteban R, Menéndez S y col. Ozonoterapia en la atrofia del nervio óptico. Procc. primer congreso nacional de Ozono. Cuba, 1988.
24. Chan CK, Paine M, Santiesteban y col. Ozone in optic nerve disfunction. Procceding of the XI ozone worl Congress. 1993, San Foco. USA.
25. O'Day J. Steroid management in giant cell arteritis. Br J Ophthalmol 2001;85:1061-4.
Recibido: 18 de agosto de 2005. Aprobado: 21 de octubre de 2005.
Dr. Alberto O. González García. Instituto de Neurología y Neurocirugía. Calle 29 No. 739 esquina a D, El Vedado, Ciudad de La Habana, Cuba.
1Especialista de I Grado en Oftalmología.
2Especialista de Neurofisiología. Diplomado en Neuroftalmología y Retina
3Doctora en Ciencias Médicas. Especialista de II Grado en Oftalmología. Investigadora Titular. Profesora Auxiliar y Consultante.