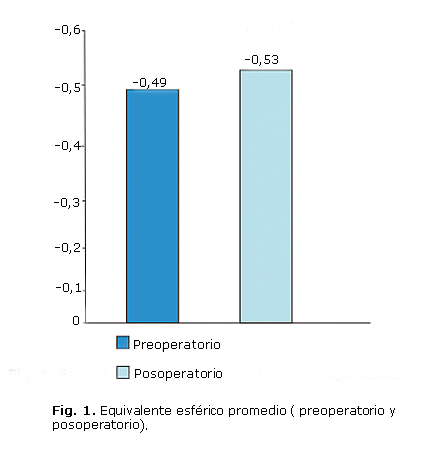Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol v.23 supl.1 Ciudad de la Habana 2010
INVESTIGACIONES
Resultados del cálculo del poder del lente intraocular mediante la fórmula de Haigis
Results of the intraocular lens power calculation through Haigis´ formula
Juan Raúl Hernández SilvaI; Alexander Pérez LlanesII; Leyda Elena Galá HerreraII; Meisy Ramos LópezIII; Zucel Veitía RovirosaIV; Carmen Padilla GonzálezV
IDoctor en Ciencias Médicas. Especialista de II Grado en Oftalmología. Profesor Titular. Investigador Auxiliar. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
IIEspecialista de I Grado en Oftalmología. Especialista en Medicina General Integral. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
IIIEspecialista de II Grado en Oftalmología. Profesor Auxiliar. Investigador Auxiliar. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
IVEspecialista de II Grado en Oftalmología. Profesor Auxiliar. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
VEspecialista de I Grado en Especialista en Bioestadística. Profesor Asistente. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
RESUMEN
OBJETIVO: Determinar la efectividad de la fórmula de Haigis en el cálculo del poder dióptrico del lente intraocular.
MÉTODOS: Se realizó un estudio descriptivo prospectivo, de pacientes operados de catarata mediante la técnica de Facoemulsificación en el Servicio de Microcirugía del Instituto Cubano de Oftalmología «Ramón Pando Ferrer» entre enero 2007 a enero 2008. Para el cálculo del poder del lente intraocular se empleó el IOL Máster y la fórmula de Haigis. La muestra de 101 pacientes, se seleccionó por el método aleatorio simple, de los cuales 28 fueron intervenidos en ambos ojos, para un total de 129 ojos.
RESULTADOS: El equivalente esférico preoperatorio y posoperatorio no tuvieron diferencias, sí existieron entre esfera esperada y la obtenida. La mayor diferencia entre la esfera esperada y la obtenida fue encontrada en los pacientes hipermétropes. El astigmatismo refractivo fue bajo. La longitud axil posoperatoria no se modificó y la mejor agudeza visual sin corrección y con corrección mejoró en más de cuatro líneas en la cartilla de Snellen
CONCLUSIÓN: Se demostró la efectividad de la fórmula de Haigis en el cálculo del poder del lente intraocular.
Palabras clave: Facoemulsificación, equivalente esférico, astigmatismo refractivo.
ABSTRACT
OBJECTIVE: To determine the effectiveness of Haigis´formula in the intraocular lens power calculation.
METHODS: A prospective and descriptive study was conducted in patients operated from cataract with phacoemulsification technique at the Microsurgery Service of "Ramón Pando Ferrer" Cuban Institute of Opththalmology from January 2007 to January 2008. The IOL Master and the Haigis´formula were used for the intraocular lens power calculation. The sample of 101 patients was selected by the simple random method, of whom 28 underwent surgery in both eyes, for a total number of 129 eyes.
RESULTS: The Pre- and the post-operative spherical equivalents did not have any differences; but the expected sphere and the real sphere did show differences. The biggest difference between the expected sphere and the real one was found in the hypermetropic patients. The refractive astigmatism was low. The postoperative axil length did not change and the best visual acuity without/ with Correction improved by more than four lines in the Snellen´s chart.
CONCLUSION: The effectiveness of Haigis´ formula was confirmed in the intraocular lens power calculation.
Key words: Phacoemulsification, spherical equivalent, refractive astigmatism.
INTRODUCCIÓN
De acuerdo con la Organización Mundial de la Salud (OMS), en 2002 había más de 161 millones de discapacitados visuales en el mundo, 124 millones de los cuales tenían muy baja visión y 37 millones eran ciegos, incluyendo a 1,4 millones menores de 15 años. Actualmente, la catarata senil sigue siendo el principal motivo de ceguera prevenible (38 %), seguida por otras causas también relacionadas con la edad, como el glaucoma (12,3 %), la degeneración macular (8,7 %) y la retinopatía diabética (4,8 %). La OMS calcula que la ceguera prevenible por estas patologías constituye el 75 % de todos los casos de ceguera en el mundo.1
Cuba, según las tasas estimadas por la OMS, debe tener alrededor de 55 900 ciegos. Entre las causas de ceguera encontradas fundamentalmente en el país se encuentra además de la catarata, el glaucoma crónico simple, la retinopatía diabética proliferativa y no proliferativa, además, del desprendimiento de retina y las hemorragias vítreas, lo que pudiera incrementarse dado que en estos momentos se cuenta con 28,8 % de población mayor de 45 años y un 13,7 % mayor de 65 años, con una tendencia al incremento, a causa de el aumento de la esperanza de vida que en el país alcanza los 74 años.2
Una técnica más reciente, llamada facoemulsificación, fue desarrollada en EE.UU. por Charles Kelman y se realizó por primera vez en un humano en 1967.3
En Cuba, en el centro de microcirugía ocular de nuestro instituto, se sistematiza a partir del año 2000 la realización de la facoemulsificación, allí se destacan las técnicas de prechop MICS del doctor Juan Raúl Hernández Silva, Multichop , SR Prechop del doctor Luis Curbelo , TECMICS del doctor Armando Capote y Chopping Inverso del doctor Gilberto Fernández.
En la actualidad el uso de las incisiones corneales mínimas, la mejora en los materiales y diseño de los lentes intraoculares (LIO), el desarrollo de los agentes viscoelásticos junto al avance de las técnicas y equipamientos, han convertido a la facoemulsificación en el método quirúrgico de elección de la mayoría de los cirujanos.4
Al principio todas las lentes implantadas eran de un valor estándar, pero los pacientes míopes quedaban hipocorregidos y los hipermétropes hipercorregidos. Para evitar este problema, se empezaron a desarrollar fórmulas biométricas basadas en la longitud axial (ALX) y en la queratometría.
Hay dos tipos de fórmulas: teóricas (aplican la geometría óptica a un ojo esquemático, sin considerar el análisis de las medidas clínicas del paciente) y empíricas o de regresión (analizan los resultados de la refracción posoperatoria de múltiples intervenciones y los relaciona con la longitud axial y la queratometría).5
Tanto las fórmulas teóricas como las empíricas son válidas para calcular el poder dióptrico de la LIO, sin que se hayan encontrado diferencias significativas entre ellas.6
Las fórmulas para el cálculo de los LIO también fueron evolucionando, surgieron fórmulas de primera, segunda, y tercera generación hasta las más recientes llamadas por algunos autores de cuarta generación, entre estas últimas se encuentra la de Haigis, aportada por el doctor Wolfang Haigis.7
Se trata una de las más recientes fórmulas teóricas, la cual es desarrollada para incrementar la exactitud del cálculo del poder de las lentes intraoculares. Esta utiliza tres constantes para fijar la posición y la forma de la curva del poder de predicción.
El correcto cálculo del poder del LIO es fundamental en el resultado final de la cirugía, de nada servirá una correcta técnica quirúrgica si el lente es mal calculado, por lo que es necesario la exacta medición de los distintos parámetros pues pequeños e insignificantes errores al calcular el poder del LIO pueden producir importantes errores en los resultados posoperatorios.8
En las últimas décadas se han desarrollado las técnicas quirúrgicas, las lentes intraoculares, las fórmulas biométricas, el instrumental y paralelamente a esto los equipos relacionados con la cirugía y el cálculo de la potencia de la lente intraocular.
Durante la década de los 90 se desarrolló un biómetro nuevo no invasivo basado en el principio de biometría óptica con interferometría parcialmente coherente (PCI): la tomografía de coherencia óptica (IOL Máster).9 Permite la medición a la vez de la longitud axial , curvatura corneal y la profundidad de la cámara anterior; así como el cálculo de la potencia de la lente intraocular en tan sólo unos segundos, todo esto con el uso de una técnica de no contacto y un único equipo.10
Tras la llegada a Cuba de dicha tecnología, en nuestro instituto comenzó a utilizarse en el 2005, en el que tradicionalmente se había estado empleando solamente el método convencional acústico para el cálculo de la LIO, el cual precisa del uso del queratómetro y del biómetro ultrasónico para obtener los valores de la ALX y la queratometría (K), cuyos datos son procesados en un software específico destinado a calcular la LIO que se implantará durante el acto quirúrgico, atendiendo a la refracción que desea obtener el cirujano en el paciente, según la fórmula biométrica en dependencia de la ALX del ojo y con el cual aún se evidencian pacientes cuyos resultados refractivos en ocasiones distan de los esperados.10
El IOL Máster usa la biometría óptica de coherencia para medir la longitud axial del ojo humano. La biometría óptica de coherencia es de no contacto por naturaleza y se basa en los principios de la interferometria de laser con luz parcialmente coherente, a menudo llamada interferometría de coherencia parcial.
La biometría acústica ultrasónica mide la longitud axial como la distancia entre la córnea y la membrana limitante interna (MLI) de la retina porque las ondas sonoras se reflejan en esta membrana retiniana. La biometría óptica de coherencia con el IOL Máster mide la longitud axial como la distancia entre la cornea y el epitelio pigmentario de la retina.11
El IOL Máster es más preciso alcanzando las 10 micras de tolerancia, mientras que el ultrasonido está alrededor de las 100 micras, debido a la más corta longitud de onda de la luz con respecto al sonido, permitiendo una mejor resolución. Además de la imprecisión de la biometría acústica hay otras desventajas como ser un procedimiento poco cómodo para el paciente, requiriendo anestesia tópica. La abrasión corneal y la transmisión de agentes infecciosos por ser un método de contacto.11
La biometría óptica de coherencia también tiene sus inconvenientes, pues además de su elevado costo, no mide espesor del cristalino, tampoco es útil en las opacidades de los medios (leucomas corneales, cataratas densas o nigras, hipermaduras o subcapsulares posteriores, hemorragias vítreas), así como en casos de dificultades de fijación de la luz, patologías de retina, cansancio o poca colaboración del paciente.
Con estas limitaciones, las medidas pueden no ser posibles con el IOL Máster en aproximadamente de un 5 % a un 10 % de los pacientes.12
El IOL Máster calcula múltiples opciones de implantes de lentes usando las conocidas fórmulas para el cálculo de la potencia de la lente tanto empíricas o de regresión (SRK II), como teóricas (SRK/T, Hoffer Q, Holladay 2 y Haigis).12
Los estudios han comparado la eficiencia de estos nuevos modelos de fórmulas en varios grupos de longitudes axiles, para ello se han divido los ojos en base a sus longitudes axiales:
-Para longitudes axiales menores de 22 mm las fórmulas recomendadas son la Holladay 2 y Hoffer Q modificada.
- Para longitud axial entre 22 y 24,5 mm se prefieren Holladay 1 y la fórmula promedio (media de las tres fórmulas Hoffer, Holladay y SRK/T).
- En mayores de 24,5 mm se utilizan (Holladay 1 y SRK/T).
La fórmula de Haigis sin embargo es efectiva en todos los rangos de longitudes axiales.13
Las medidas preoperatorias con el Zeiss IOL Máster tienen muchas ventajas en comparación con las técnicas convencionales de biometría ultrasónica con el ecógrafo en modo A y la queratometría. Nos permite mayor precisión, facilidad de uso, y seguridad del paciente además, consigue aumentar la eficiencia de la práctica y mayor fluidez en la línea preoperatoria.
A pesar de las ventajas que nos ofrecen el IOL Máster y la fórmula de Haigis en el cálculo del lente, aún no es usada con mucha frecuencia por nuestros cirujanos, por lo que nos proponemos en nuestro estudio demostrar su eficacia.
MÉTODOS
Se realizó un estudio observacional descriptivo longitudinal prospectivo, de los pacientes operados de catarata mediante la técnica de Facoemulsificación (Prechop) en el Servicio de Microcirugía del ICO «Ramón Pando Ferrer» en el período comprendido entre enero de 2007 a enero de 2008 que para el cálculo del poder del lente se empleó el IOL Máster y la fórmula de Haigis.
El universo de estudio estuvo conformado por todos los pacientes con diagnóstico de catarata que recibieron tratamiento quirúrgico por técnica de extracción extracapsular del cristalino (EECC) mediante Facoemulsificación (FACO) por técnica de Faco Chop, realizada por dos cirujanos de nuestro instituto, durante el período de estudio, que cumplieron además con los criterios de inclusión, con implante del Henan universal IOL en el saco capsular.
La muestra se seleccionó por el método aleatorio simple. Para el cálculo del tamaño de muestra se utilizó el programa Stalcal, con un error estimable del 1 % y una incidencia estimada de errores para el cálculo de LIO por IOL Máster del 5 %. El resultado final es una muestra 101 pacientes, de los cuales 28 fueron intervenidos en ambos ojos, para un total de 129 ojos.
Los criterios de inclusión incluyeron diagnóstico de catarata, pacientes cubanos mayores de 18 años de edad y voluntariedad del paciente a participar en el estudio.
Los criterios de exclusión fueron catarata secundaria o asociada a trauma de cualquier tipo, presencia de patología ocular asociada que afecte al cálculo del poder del LIO o los resultados refractivos postoperatorios como pueden ser: cirugía ocular previa de cualquier tipo, afecciones de las cubiertas oculares como degeneraciones y tumores conjuntivales, simbléfaron, distrofias y degeneraciones corneales, alteraciones del segmento anterior de cualquier tipo, glaucoma, patología retino-vítrea, patología orbitaria y ojo único, así como presencia de patología sistémica grave o no controlada.
Como criterios de salida se tuvieron en cuenta, presencia de complicaciones transoperatorias o posoperatorias, posición del LIO fuera del saco capsular y pacientes que decidieron no seguir la investigación por razones personales u otro motivo.
Fueron estudiadas las siguientes variables: edad, sexo, equivalente esférico preoperatorio y posoperatorio, esfera promedio, cilindro refractivo, mejor agudeza visual corregida y sin corrección así como longitud axil.
Para practicar la técnica quirúrgica de Facoemulsificación , se realizó dilatación pupilar con fenilefrina 10 % 1 gota cada 5 minutos por 20 minutos, limpieza del área quirúrgica con Yodo Povidona al 10 % (Imefa, Cuba), anestesia tópica con colirio anestésico Clorhidrato de Tetracaína (Imefa, Cuba), colocación de los campos quirúrgicos y Blefaróstato; además dos Paracentesis de 1 mm con querátomo de diamante (Janach ME 105) a 90 grados una de otra, anestesia intracameral con Lidocaína 2% sin preservo (Imefa, Cuba), formación de cámara anterior con viscoelástico, realización de la incisión principal de 3,0 mm tunelizada, autosellante, con querátomo trapezoidal de diamante a través de córnea clara temporal o en el meridiano mas curvo de ser requerido. Capsulorrexis de 5,5 a 6 mm con pinza de Utrata, Hidrodisección e Hidrodelaminación con cánula, Movilización del núcleo en el saco y realización de Facoemulsificación (FACO) por técnica de Pre Chop. La máquina de Facoemulsificación utilizada fue Pulsar 2 Minimal Stress de la firma italiana OPTIKON, con bomba peristáltica, punta de titanio de 20 Gauge y 30 grados de bisel, los parámetros facodinámicos se modificaron según la experiencia de los cirujanos.
Se realizó anamnesis y examen oftalmológico completo e integral que incluyó: toma de la mejor agudeza visual sin corrección (MAVSC) y con corrección (MAVCC), examen en lámpara de hendidura, topografía corneal, (queratometría, longitud axial y amplitud de la cámara anterior) en el IOL Máster así como el cálculo del poder del lente mediante la fórmula de Haigis.
La constante a utilizar fue de 118,4, para colocarse dentro del saco capsular según el LIO utilizado, que en todos los casos fue el Henan Universal IOL de fabricación china, compuesto de polímeros flexibles de acrílico.
De la base de datos del Centro de Microcirugía Ocular se tomaron MAVSC y MAVCC, equivalente esférico esperado, queratometría y biometría preoperatoria.
Se les realizó el seguimiento posoperatorio correspondiente con consultas a las 24 horas de operado, una semana, al mes y a los tres meses de operados, en esta última se tomaron mejor agudeza visual alcanzada con y sin corrección, equivalente esférico final, se les repitió queratometría y biometría en el IOL Máster. Se determinó la posición efectiva del LIO (PEL) realizando la biomicroscopia ultrasónica (BMU) con el uso del Hi Scan, modo B de alta resolución y se usó un transductor de 35-50 MHz.
Con los datos obtenidos se confeccionó una base de datos. Los resultados se resumieron en tablas y figuras y se expresaron en frecuencias absolutas, relativas y medias.
El análisis estadístico se realizó por la Prueba T- Student para comparar medias de datos pareados y el análisis de varianza (ANOVA de 1 vía) para las comparaciones múltiples de medias, con pruebas a Posteriori de Scheffé en el caso de encontrar diferencias significativas en las comparaciones. En todos los casos se consideró un nivel de confiabilidad del 95 %.
Durante toda la investigación se respetaron las normas éticas de confidencialidad de la información y se obtuvo el consentimiento de los gestores de la información para la utilización de los datos.
RESULTADOS
Se incluyeron en el estudio un total de 101 pacientes, de los cuales 28 fueron intervenidos en los dos ojos, para un total de 129 ojos. La edad promedio fue de 66,3 años con una DS de ± 10. Con respecto a la distribución por sexo se observó un predominio discreto del sexo masculino que no puede considerarse como significativo (tabla).
Al evaluar los resultados refractivos encontramos que no se observan diferencias estadísticamente significativas, como se refleja en la figura 1, entre el equivalente esférico preoperatorio promedio y el equivalente esférico posoperatorio promedio (p*= 0,7343).
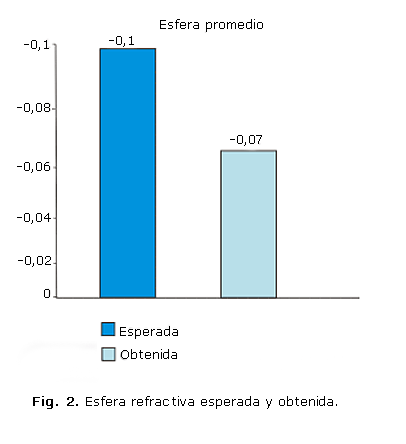
Existió diferencias estadísticamente significativas en la variación de las esferas refractivas esperada promedio y la esfera refractiva obtenida promedio, (p*= 0,0006). Clínicamente es una diferencia menor de 0,50 D (figura 2), lo cual nos muestra buenos resultados.
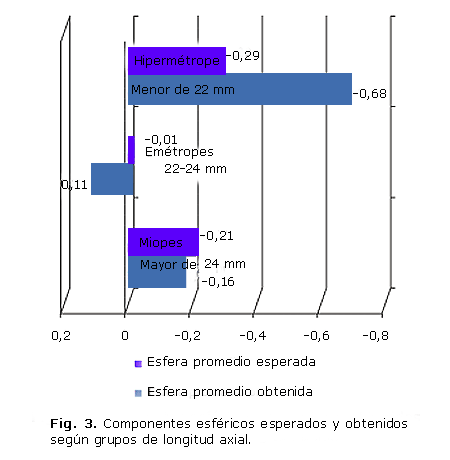
Si comparamos los resultados de la esfera obtenida y esperada de los pacientes tomando en consideración las longitudes axiales (figura 3), podemos observar que para los tres grupos considerados, la esfera esperada se acerca a la emetropía; por el contrario la esfera obtenida, mostró diferencias significativas (p= 0,001) para las longitudes axiales más pequeñas (pacientes hipermétropes),el valor promedio de la esfera fue de -0,68, mientras que para ojos miopes y emétropes este valor fue de -0,16 y 0,11 respectivamente.
Estas diferencias resultan estadísticamente significativa en las pruebas a posteriori de ANOVA (p= 0,001 y p= 0,007 respectivamente).
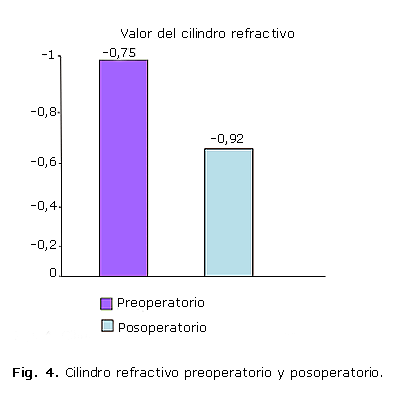
En la figura 4 se muestran las diferencias entre los valores de los cilindros refractivos preoperatorio y posoperatorio, aunque esta no es mayor a 1 D, razón por la que se considera de poca importancia clínica.
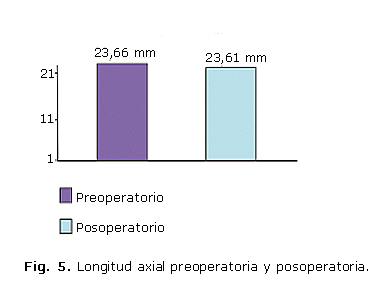
La longitud axial preoperatoria y posoperatoria no se modificó como se muestra en la figura 5.
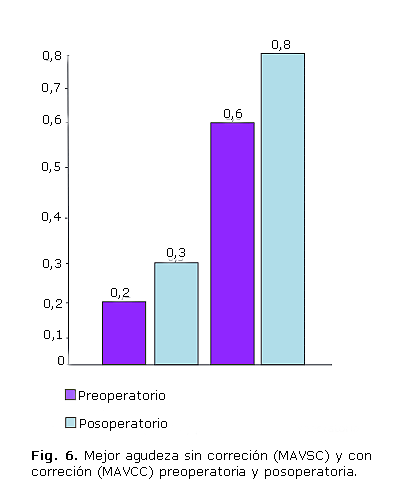
Finalmente si evaluamos los resultados visuales alcanzados al comparar la MAVSC preoperatoria y posoperatoria, observamos una ganancia de 4 líneas de visión, según la cartilla u optotipo de Snellen. Al considerarse la MAVCC, existió una ganancia de 5 líneas de visión, lo cual nos permite apreciar que existen entre ambas variables analizadas una diferencia estadísticamente significativa en los valores preoperatorios y posoperatorios (figura 6).
DISCUSIÓN
La catarata senil constituye en la actualidad la primera causa de ceguera prevenible en el mundo y también en nuestro país. Los resultados obtenidos en nuestro estudio coinciden con muchos autores que plantean que esta entidad es más frecuente en adultos mayores de 60 años y constituye la primera causa de ceguera en este grupo de edades; en cuanto al sexo, no existen diferencias.14,15
El estado refractivo alcanzado en nuestros pacientes después de 3 meses de la operación, fueron similares a los obtenidos en un estudio realizado por Luis Morfinn en el año 2008, donde se incluyeron 88 ojos y aplicaron las fórmulas para el cálculo del LIO según la longitud axial utilizando SRK II para longitudes axiales entre 22 mm y 23,9 mm, SRK-T en longitudes axiales mayor o igual a 24 mm y Holladay II si longitudes axiales menores o iguales que 21,9 mm. En este estudio se obtuvo un equivalente esférico promedio de -0,71 D.16
Al analizar el equivalente esférico esperado antes de la cirugía y el equivalente esférico real tras la cirugía no se encontró diferencias estadísticamente significativas, esto demuestra que el cálculo del valor del LIO fue adecuado, así como la posición efectiva del LIO ubicados en el saco capsular diagnosticado por BMU, eliminando una posible fuente de error para una sorpresa refractiva post operatoria, aunque en ambos casos sabemos que en el preoperatorio el equivalente esférico esta modificado de su valor real por el defecto refractivo de base del paciente así como por la miopía de índice que aparece en los pacientes portadores de cataratas. Finalmente el valor obtenido es cercano a la emetropía como se previó en el cálculo preoperatorio, se considera como norma de trabajo de nuestro centro, cuando no existe en el ojo contralateral alguna condición refractiva o quirúrgica que deba considerarse.
De modo general, al analizar los valores de la esfera esperada y la esfera obtenida, observamos diferencias estadísticamente significativas entre ambas, pues la esfera obtenida se acercó más a los valores de la emetropía que lo esperado, por lo que podemos concluir de modo general que funcionó adecuadamente el cálculo del LIO con esta fórmula.
Durante los últimos decenios ha mejorado el cálculo del poder del lente intraocular. Hace solo 10 años se consideraban buenos resultados ± 1 D de diferencia de la refracción deseada. Actualmente se esperan resultados menores a 0,50 D como los obtenidos en nuestro estudio.17
Al individualizar los resultados y agrupar los pacientes según su longitud axial para ser más exquisitos en el análisis, se apreció que en los pacientes hipermétropes fue donde mayor diferencia existió entre la esfera esperada y la esfera obtenida, pero aún así se mantuvo en el rango de la emetropía.
Muchos autores plantean que en ojos pequeños e hipermétropes es mayor la dificultad para el cálculo de poder del lente intraocular, mientras que en los pacientes con longitudes axiales extremas, es impredecible e inexacto el cálculo del lente intraocular.18
La posición efectiva del lente en estos ojos cortos es crítica, por lo tanto será impredecible el cálculo del lente y las probabilidades de error refractivo serán mayores, (error refractivo de 2,33 versus 0,79 en ojos normales); por lo que algunos autores sugieren el uso de la fórmula de Haigis para los ojos hipermétropes.19
También se obtuvo buenos resultados refractivos al analizar el componente cilíndrico de la refracción. Estos resultados coinciden con la bibliografía consultada, que plantea que con las actuales técnicas quirúrgicas de pequeña incisión, particularmente la Facoemulsificación, el grado de astigmatismo inducido debe ser mínimo. Varios autores refieren que el 70 % de los pacientes operados de catarata por esta técnica tendrán menos de 1 D de astigmatismo, se espera que al menos esta cantidad de pacientes obtengan la refracción deseada. Otro 20 % de los pacientes entre 1 y 2 D y pueden requerir la adición de cirugía para el astigmatismo y el 10 % de los pacientes restantes tendrán un astigmatismo mayor de 2 D.20
El componente cilíndrico de la refracción no es un factor que demuestre o sea predictivo del correcto cálculo del poder del lente, pero sí un factor a tener en cuenta en los resultados ópticos finales del paciente. Durante la evaluación preope ratoria personalizada, se incluyó en todos los casos la realización de una topografía corneal para comparar el eje refractivo y topográfico, para ubicar la vía de acceso al globo ocular, según el meridiano más curvo, de manera que se trate de mejorar en los pacientes el astigmatismo y no empeorarlo.
Si observamos los resultados de las biometrías preoperatorias y posoperatorias, que se conoce es la causa más común de defectos refractivos posoperatorios (medición biométrica imprecisa), podemos afirmar que en nuestro estudio no existió variación en las biometrías preoperatorias y posoperatorias.
No hay duda de que cuando se seleccionan bien y se realizan adecuadamente los modernos métodos de interferometría de coherencia parcial (ahora conocida como biometría de coherencia óptica), se nos ofrece la mejor forma de lograr el resultado refractivo deseado. Al realizar una correcta biometría, se elimina así otra posible causa de sorpresa refractiva. Un error de 1 mm induce un error del poder del lente intraocular de 2,5 Dioptrías.10,19
Por su parte Mendicute, en su serie de 1998, concluyó que 73,68 % de errores refractivos, se debían a errores en la longitud axial.7
Otros autores también plantean que el 68 % de los casos con sorpresas refractivas se deben a errores en la longitud axial, 22 % al uso de una fórmula no apropiada y 10 % a errores en las lecturas queratométricas.9
Los resultados de la agudeza visual final entre 4 y 12 semanas después de la cirugía son resultados comparables con un estudio realizado en nuestro instituto en el 2003 de 597 casos, por el doctor Hernández Silva y otros, donde la MAVCC posoperatoria recogida resultó aproximadamente(0,8).21
Estudios similares refieren que la MAVC alcanzada fue de 20/40 (0,5),22 resultados muy parecidos a los obtenidos en nuestra investigación.
CONCLUSIONES
La fórmula de Haigis permite una mayor exactitud en el cálculo del LIO. Esto posibilitó valores visuales finales más aproximados a los esperados. Todo contribuyó a una mejoría en más de cuatro líneas.
REFERENCIAS BIBLIOGRÁFICAS
1. OMS.Vision2020 The Right to Sight.Ginebra: OMS; 2001.
2. Hernández Silva Juan R, Padilla González Carmen M, Ramos López Meisy, Ríos Cazo Reinaldo, Río Torres Marcelino. Resultados del Programa Nacional de Prevención de Ceguera por Catarata. Cuba 2000-2003. Rev Cubana Oftalmol. 2004; 17(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762004000200001&lng=es&nrm=iso&tlng=es
3. Cristobal JA, Ascaso FJ. Historia de la cirugía de catarata. En: Centurion V.El libro del Cristalino de las Américas. Brasil: Livraria Santos; 2007:25 35.
4. Alemañy Martorell J, Villar Valdez R. Reseña histórica de la Oftalmología. La Habana: Ciencias Médicas; 2003.
5. Binkhorst CD. Dioptric power of the lens implant. Ophthalmologica. 1975;171(4-5):278-80.
6. Hussain M. Durrani J. Comparison of intraocular lens power calculation using the Binkhorst and SRK formulae: a clinical study. J Pak Med Assoc. 1995;45(2):38-40.
7. Ascaso FJ, Castillo JM, Cristobal JA, Mínguez E, Palomar A. A comparative study of eight intraocular lens calculation formulas. Ophthalmologica. 1991;203(3):148-53.
8. Naeser K. The vergence-based, empirically modified intraocular lens equation. Eur J Implant Refract Surg. 1991;3:201-6.
9. Rose LT, Moshegov CN. Comparison of the Zeiss IOLMaster and applanation A-scan ultrasound: biometry for intraocular lens calculation. Clinical Experimental Ophthalmology. 2006;31(2):121-4
10.Haigis W, Lege B, Miller N, Schneider B. Comparison of immersion ultrasound biometry and partial coherence interferometry for intraocular lens calculation according to Haigis. Graefes Arch Clin Exp Ophthalmol. 2000; 238(9):765-73.
11. Olsen T. Sources of error in IOL power calculations. J Cataract Refract Surg. 1992;18(2):125-9.
12.Rajan MS, Keilhorn I, Bell JA. Partial coherence laser interferometry vs conventional ultrasound biometry in intraocular lens power calculations. Eye. 2002; 16(5):552-6.
13. Boyd S, Dodick J, Lincoln L, Freitas MD. Nuevas Técnicas en la cirugía de catarata. Panamá: Highlights of ophalmology; 2005.
14. Kanski JJ, Menon J. Oftalmología Clinica. 5ed. España: Elsevier ; 2005.
15. Spalton D, Koch D. The constant evolution of cataract surgery. Br Med J. 2000;44:123-47
16.Ruiz Morfin I, Bustos Cepeda M, Díaz Jiménez JO. Estado refractivo en pacientes sometidos a facoemulsificación de cataratas con situaciones especiales. Cir Ciruj. 2008;76(1):5-12.
17. Donoso R, Mura JJ, Lopez M. Emmetropization at cataract surgery. Looking for the best IOL power calculation formula according to the eye length. Arch Soc Esp Oftalmol. 2003;78(9):477-80.
18.Hoffer KJ. Clinical results using the Holladay 2 intraocular lens power formula. J Cataract Refractive Surg. 2000;26(8):12337.
19. Soler FL, Pascual SJ. Fuentes de error en queratometria y biometría. En: Centurion V. El libro del Cristalino de las Américas. Brasil: Livraria Santos; 2007. p.95-111.
20. Lu LN. Cálculo del poder del LIO en casos estándar y complejos. En: Boyds S. Nuevas técnicas en cirugía de catarata. Panamá: Highlights of Ofthalmology; 2005. p.29-53.
21. Hernández Silva, Juan R, Río T orres M, Ramos López, M. Personalización de las fórmulas de calculo de la lente intraocular.Rev. Cubana Oftalmol. 2004;17(2).
22. Kumar J. IOL Calculations: When, How and Which?. Preliminary Considerations and varios IOL Power Calculation Formulas. En: Garg A, Lin JT. Mastering the techniques of IOL Power Calculations. 2da ed. New Delhi: Haypee brothers; 2008.
Recibido: 14 de noviembre de 2010
Aprobado: 22 de noviembre de 2010
Dr. C. Juan Raúl Hernández Silva. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: jrhs@infomed.sld.cu