Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol v.23 supl.1 Ciudad de la Habana 2010
REVISIONES
Estrategias de prevención de la opacidad de la cápsula posterior
Strategies for the prevention of the posterior capsule opacification
Iván Hernández LópezI; Juan Raúl Hernández SilvaII; Yadira Castro GonzálezIII; Ailén Garcés FernándezI; Zucell Veitía RovirosaIV; Eneida Pérez CandelariaIV
IEspecialista de I Grado en Oftalmología. Especialista de I Grado en Medicina General Integral. Aspirante a investigador. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
IIDoctor en Ciencias Médicas. Especialista de II Grado en Oftalmología. Profesor Asistente. Investigador Auxiliar. Instituto Cubano de Oftalmología.»Ramón Pando Ferrer». La Habana, Cuba.
IIIEspecialista de I Grado en Oftalmología. Instituto Cubano de Oftalmología.»Ramón Pando Ferrer». La Habana, Cuba.
IVEspecialista de II Grado en Oftalmología. Profesora Auxiliar. Investigador agregado. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». La Habana, Cuba.
RESUMEN
La opacidad de la cápsula posterior es actualmente el aspecto más importante en la cirugía de catarata de los tiempos modernos. Sigue siendo la complicación posoperatoria tardía más frecuente tras la cirugía de catarata asociada con disminución de la agudeza visual, deterioro de la sensibilidad al contraste y problemas de deslumbramiento que conllevan importantes repercusiones sociales, médicas y económicas. La capsulotomía láser aunque es un proceder efectivo para el tratamiento de esta complicación dista mucho de ser el método ideal puesto que se puede asociar a múltiples complicaciones. Debido a esto las investigaciones recientemente han dirigido su atención a estrategias de prevención de la opacidad de la cápsula posterior. Estas incluyen el diseño de los lentes intraoculares, técnicas quirúrgicas modificadas y/o mejoradas, implantes adicionales, empleo de fármacos y agentes citotóxicos así como el uso de nuevas tecnologías. La terapia génica, entre las novedosas intervenciones en estudio, parece ser una estrategia prometedora en este campo. No existe hasta ahora un método único que evite de modo definitivo la aparición de la opacidad capsular. El oftalmólogo debe usar la combinación de todos aquellos métodos que están a su alcance y han demostrada probada efectividad en la reducción de la opacidad de la cápsula posterior. Obtener excelentes resultados visuales a largo plazo es el objetivo de la cirugía moderna de la catarata así como abrir el camino a intervenciones quirúrgicas novedosas para el tratamiento de la presbicia en pacientes mayores de 40 años. Para lograrlo resulta fundamental impedir que la cápsula posterior se opacifique, aún más con el uso de lentes multifocales y acomodativos, que son más vulnerables a la opacidad que los lentes monofocales. Es por ello que nos atrevemos a decir que el mayor salto en la cirugía de la catarata moderna aún está por dar: la erradicación definitiva de la opacidad del saco capsular.
Palabras clave: Opacidad de cápsula posterior, cirugía de catarata, lentes intraoculares.
ABSTRACT
The posterior capsule opacification (PCO) is the most important aspect in the cataract surgery nowadays. It continues being the more frequent late postoperative complication after cataract surgery associated with decrease of the visual acuity and other visual problems that lead to important social, economical and medical impacts. The laser capsulotomy is an effective procedure for the treatment of this complication but it is far from being the ideal method since it can be associated to considerable complications. This is the reason why several research studies recently have directed their attention to PCO-preventing strategies such as the design of intraocular lenses, modified and/or improved surgical techniques, additional implants, use of cytotoxic agents and drugs as well as new technologies. The gene therapy, among the novel interventions in study, seems to be a promising strategy in this field. Up to the present, there is not a unique method that avoids in a definitive way the development of the capsular opacification. The ophthalmologists should use the combination of all these methods available which have demonstrated a proved effectiveness in the reduction of PCO. Attaining long-term excellent visual result is the main purpose of the modern cataract surgery as well as paving the road towards novel surgical interventions for the treatment of presbyopia in patients older than 40 years. In order to achieve that goal, it is essential to avoid the opacification of the posterior capsule, even more with the use of multifocal and accommodative lenses that are more vulnerable to the opacity than the monofocal lenses. Therefore, we may dare to say that the biggest breakthrough in the modern cataract surgery is still awaiting: the definitive eradication of posterior capsule opacification.
Key words: Posterior capsule opacity, cataract surgery, intraocular lenses.
INTRODUCCIÓN
La extracción extracapsular de la catarata (EECC) con implante de lente intraocular es la técnica quirúrgica preferida para el tratamiento de catarata en la actualidad. En ella, a diferencia de la extracción intracapsular de la catarata (EICC), se extrae del ojo únicamente el cristalino opacificado dejando la cápsula posterior intacta. Esta estructura constituye una barrera anatómica entre los segmentos anterior y posterior del ojo, que se cree reduce el riesgo de complicaciones en el segmento posterior después de la cirugía (como el edema macular cistoideo y el desprendimiento de retina). Sin embargo, dejar la cápsula intacta puede dar lugar a complicaciones a largo plazo, principalmente la opacificación de la cápsula posterior.1
La opacificación de la cápsula posterior (OCP) es actualmente el aspecto más importante en la cirugía de catarata de los tiempos modernos. Sigue siendo la complicación posoperatoria tardía más frecuente tras la cirugía de catarata asociada con disminución de la agudeza visual, deterioro de la sensibilidad al contraste y problemas de deslumbramiento que conllevan importantes repercusiones sociales, médicas y económicas. Su incidencia en la actualidad se encuentra entre 0,7-47,6 % en los primeros cinco años de la cirugía, según un metanálisis de 90 estudios publicados. Que el rango de variación reportado sea tan amplio probablemente responda a diferentes criterios de selección de la muestra, edad, técnica quirúrgica, tipo de lente intraocular (LIO) y sistemas de evaluación de la opacidad.2
Clínicamente, exceptuando las opacidades dependientes de la fibrosis exudativa por inflamación, impregnación hemática y/o permanencia de restos corticales, la OCP relacionada intrínsecamente con la cápsula se subdivide en dos tipos: regenerativa y fibrótica. La OCP regenerativa es mucho más frecuente y es resultado de la migración de las células epiteliales cristalinianas (LEC: Lens epitelial cells) a lo largo de la cápsula posterior hasta la región retrolental formando agregados celulares conocidos como perlas de Elsching. En la OCP fibrótica las células epiteliales residuales del cristalino experimentan la transformación a miofibroblastos, lo que ocasiona fibrosis y contracción de la bolsa capsular.1 Esta trasformación fibroproliferativa es inducida por la liberación de mediadores inflamatorios y citoquinas, particularmente el transforming growth beta factor (TGF-â) contenidos en una matrix extracelular secretada por los propios agregados celulares.3,4
El diagnóstico de la OCP se realiza mediante la lámpara de hendidura. No obstante, la evaluación biomicroscópica de la extensión y severidad de la opacidad es subjetiva y esta sujeta a amplia variación entre un observador y otro. Para obtener resultados confiables y comparables entre los múltiples estudios que sobre la prevención de la opacidad capsular se realizan, se hace sumamente necesaria la evaluación objetiva y cuantificación estandarizada del grado de OCP. Múltiples sistemas han surgido en años recientes que persiguen este objetivo mediante el análisis de imágenes en retroiluminación, así como de tomogramas tomados con la cámara rotatoria Scheimpflug del Pentacam. Sin embargo, no ha habido aún consenso en cuanto al método estandarizado universal a utilizar.5
Actualmente el tratamiento de la opacidad de la cápsula posterior se basa en la realización de una abertura en la cápsula posterior con un láser granate de neodimio: itrio aluminio (Nd:YAG), o rara vez por capsulotomía quirúrgica.6 Aunque es un proceder efectivo, la capsulotomía láser dista mucho de ser el método ideal puesto que se puede asociar a múltiples complicaciones como el daño de la óptica del LIO, elevación transitoria de la presión intraocular, edema macular cistoide y desprendimiento de retina entre otras, además del incremento de los costes para el sistema asistencial de salud y la falta de disponibilidad del tratamiento en muchos países subdesarrollados.2
Debido a esto las investigaciones recientemente han dirigido su atención a estrategias de prevención de la OCP. Estas incluyen el diseño de los lentes intraoculares, técnicas quirúrgicas modificadas y/o mejoradas, implantes adicionales como los anillos de tensión capsular, el empleo de fármacos y agentes citotóxicos así como el uso de nuevas tecnologías como el Aqualase y el Facoláser de Dodick.7-38
Cada día surgen nuevos estudios en cuanto a prevención de la opacidad capsular, por eso el objetivo de esta revisión es dar una mirada actualizada a las más recientes investigaciones, entre la inmensa cantidad de trabajos publicados, sobre las intervenciones que se realizan hasta hoy para reducir la incidencia de la OCP como medio para conseguir de forma definitiva la transparencia del saco capsular.
DESARROLLO
El conocimiento de los mecanismos etiopatogénicos involucrados en el desarrollo de la opacidad de la cápsula posterior tras la cirugía de catarata han permitido concluir que para prevenir la aparición de esta complicación se necesita: bloquear la migración de las células epiteliales cristalinianas residuales, impedir la proliferación y/o transformación fibroblástica de las LECs o eliminarlas completamente del saco capsular.
Las intervenciones para lograrlo se dividen a su vez en seis categorías principales:
1. Diseño de los lentes intraoculares
Los dos factores principales relacionados con el diseño del lente intraocular que influyen en la reducción de la incidencia de la OCP son la biocompatibilidad del material del LIO y su geometria.1
La biocompatibilidad de la lente intraocular en relación con el saco capsular se define basándose en la propiedad que tiene el material con el que está confeccionado para inhibir la estimulación de la proliferación de las células epiteliales cristalinianas y por tanto de influir en el desarrollo de la opacidad de la cápsula posterior.7
Los materiales ópticos de la lente intraocular varían desde el polimetilmetacrilato (PMMA), el material hidrofílico de acrílico con alto contenido de agua, al material hidrofóbico de acrílico con bajo contenido de agua, hasta el material hidrofóbico de silicona. Estos materiales difieren en sus propiedades físicas y químicas pero hasta la fecha, no está claro el efecto del material de los LIO en la OCP.1 Se conoce que las superficies hidrofílicas proporcionan una matrix óptima para la adhesión y migración celular aunque no hay reportes de si la propiedad hidrofílica o hidrofóbica del lente influye en la transformación morfológica de las LEC responsables de la opacificación capsular.3
Varios estudios han investigado el efecto de algunas sustancias para modificar las propiedades de la superficie de los lentes intraoculares. Se observó que los LIO tratados con heparina disminuían la adhesión de las LEC a la superficie de la óptica del lente pero no fue demostrado que influyera significativamente en la disminución de la OCP. No obstante, en un estudio más reciente realizado con cultivos de células epiteliales cristalinianas de ganado bovino que fue publicado en el 2006 se modificó la superficie de LIO de PMMA, silicona y acrílico hidrofóbico tratándolos con plasma gaseoso y comprobaron que en las superficies no tratadas las LEC tenían una morfología fibrótica mientras que en las superficies tratadas con el plasma las células mantenían su morfología epitelial normal. A su vez, las superficie de los lentes tratados incrementaba significativamente sus propiedades hidrofílicas aumentando significativamente también la adherencia de las LEC a los implantes en comparación con los no tratados.3 Este trabajo demostró que el fenotipo y capacidad de adhesión de las LEC está influenciado por las propiedades del material de la lente intraocular.
Asimismo, un metanálisis de varios estudios publicado en el 2008 mostró tasas de OCP significativamente mayores en los LIO de hidrogel (acrílico hidrofílico) que en otros materiales ópticos de la LIO (acrílico hidrofóbico, silicona).1 No se evidencian diferencias significativas entre otros materiales ópticos de la LIO (PMMA, acrílico hidrofóbico, silicona).1,7-11
En 1998, O. Nishi y otros demostraron el efecto del diseño del borde truncado de los lentes intraoculares en la disminución de la OCP. En su estudio experimental con animales evaluó el desarrollo de opacidad capsular utilizando lentes de acrílico hidrofóbico (AcrySof) de borde truncado comparados con lentes de PMMA con borde redondo. Tres semanas después de la cirugía Nishi reveló que la migración de las LEC parecía ser inhibida por un doblez agudo de la cápsula alrededor del borde truncado mientras en los lentes de borde redondo las LEC migraron libremente al centro de la cápsula posterior.12
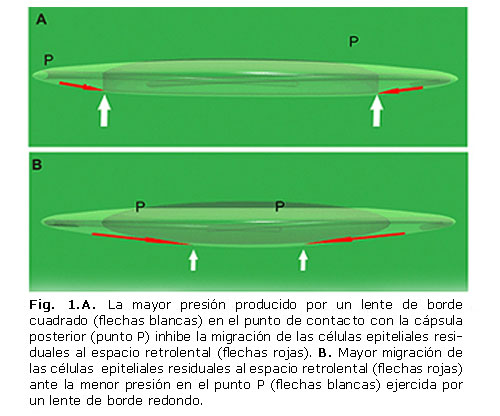
Boyce y otros en el 2002 demostraron, matemáticamente, que una lente intraocular de borde cuadrado ejerce dos veces más presión sobre la cápsula posterior en el punto de contacto entre esta y la esquina del borde de la óptica (punto p).13 Esta presión aumentada puede producir un bloqueo físico a la migración de las células epiteliales y por consiguiente explicar la menor incidencia de OCP observada con la utilización de LIO con este tipo de diseño del borde óptico cuadrado o truncado en comparación con los de borde redondo (figura 1).14
La inmensa mayoría de los estudios realizados posteriormente ha demostrado una incidencia significativamente menor de OCP en los LIO de borde agudo que en los LIO de borde romo del mismo material óptico. Asimismo, los estudios que han comparado bordes ópticos agudos y romos (independientemente del material óptico), también han hallado una diferencia clara entre los dos diseños de bordes de la LIO, no solo en la puntuación de OCP o en las tasas de capsulotomía Nd.Yag láser, sino también en la agudeza visual a distancia mejor corregida.1
Algunas investigaciones mencionan otras propiedades del diseño geométrico del LIO que pueden influir en la prevención de la OCP. Entre ellas se plantea que la angulación de las hápticas contribuye al máximo contacto entre la capsula posterior y el lente que unida a las propiedades bioadhesivas de su superficie permitiría conformar una estructura sellada que incluye el saco capsular, las LECs dispuestas en forma de una monocapa (distribución fisiológica que mantiene la transparencia normal) y el LIO (Teoría del Sandwich). Este sellado impediría que las citoquinas y el transforming growth beta factor (TGF-â) tomaran contacto con las LECs evitando su transformación fibroblástica.15 La comparación entre LIOs de una pieza versus de tres piezas no han mostrado diferencias significativas en la tasa de capsulotomías con Nd.yag láser.1 Es importante señalar que para aprovechar las ventajas del diseño del LIO es imprescindible que este quede bien centrado y totalmente dentro del saco capsular para facilitar el contacto del implante con la cápsula posterior, puesto que una lente con una o ambas hápticas fuera del saco capsular tiene menos posibilidades de producir un efecto de barrera2 (figura 2). Ha sido desarrollado además, un lente intraocular que cuenta con un surco periférico que rodea la óptica especialmente diseñado para la técnica quirúrgica «bag-in-the-lens» que ha demostrado reducir la opacificación de la cápsula posterior16 (Ver Modificaciones de las técnicas quirúrgicas).
2. Modificaciones de las técnicas quirúrgicas
Las modificaciones quirúrgicas incluyen fundamentalmente el pulido del saco capsular y el control del tamaño de la capsulorrexis. Existen otras además como la capsulotomía posterior primaria, las técnicas del «bag-in-the-lens» y «Posterior Optic Buttonholing»
El pulido manual o automatizado del saco capsular va dirigido a minimizar el número de LEC residuales tras la facoemulsificación del cristalino. Cabría esperar que al reducir la presencia de estas células que son la causa directa del origen de la opacificación disminuya la incidencia de opacidad capsular. Efectivamente, Sacu y otros en un estudio de 2004 reportaron tasas significativamente mayores de OCP fibrótica en los ojos no pulidos.16 En otro estudio del mismo autor, sin embargo, no se obtuvieron iguales resultados.17 Además, Boltz en 2006 y Menapace en 2007 observaron que la OCP regenerativa no mostró diferencias entre los ojos pulidos y no pulidos.18, 19 Por tanto, es importante señalar que más que eliminar la capa de células epiteliales anteriores, debemos eliminar principalmente las células E de la zona ecuatorial, cualquiera que sea el método utilizado para el pulido capsular.
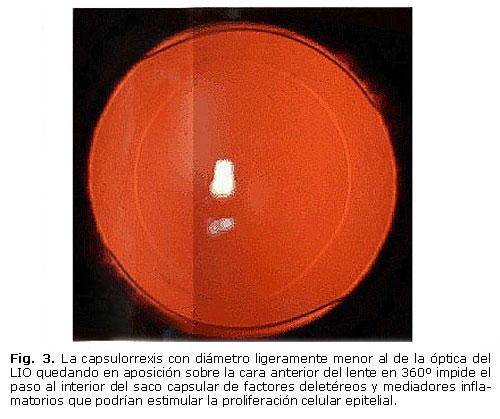
Algunos estudios han señalado que el control del tamaño de la capsulotomía circular continua o capsulorrexis constituye un factor adicional importante para prevenir la OCP siempre y cuando se logre que su diámetro sea ligeramente menor al de la óptica del LIO quedando en aposición sobre la cara anterior del lente en 360º. 11, 20 Se plantea que la estrecha unión LIO-casulorrexis impide el paso al interior del saco capsular de factores deletéreos y mediadores inflamatorios que podrán estimular la proliferación celular epitelial (figura 3).20
La capsulotomía posterior primaria consiste en realizar la abertura central de la cápsula posterior durante el acto quirúrgico y es una maniobra comúnmente realizada en la cirugía de catarata en edad pediátrica. Este proceder quirúrgico persigue como objetivo que las LEC no tengan asiento para la migración y proliferación a nivel del eje visual. Desafortunadamente este paso por sí solo no previene el desarrollo de opacidad central puesto que las células epiteliales cristalinianas tienen la capacidad de proliferar sobre la superficie de la hialoides e incluso en la superficie posterior del LIO21 Para resolver este problema Gimbel ya desde 1997 publicó una técnica realizada por él en casos pediátricos consistente en atrapar la óptica del lente intraocular por detrás de la capsulorrexis posterior. Esta técnica impide que las LEC puedan alcanzar el espacio retrolental y es demostró ser efectiva para prevenir la aparición de la OCP en niños.22
El «bag-in-the-lens» constituye en sí una nueva técnica quirúrgica. Necesita un lente intraocular especialmente diseñado que cuenta con un surco que rodea la periferia de la óptica en el cual se inserta la cápsula posterior. Leysen y otros demostraron al utilizarla la erradicación de la OCP en el 100 % de los casos incluidos, dentro de los que se hallaban pacientes pediátricos y con uveítis.15 Tassignon y otros en 2009 demostraron una baja incidencia de desprendimiento de retina con el empleo de esta técnica.21
No obstante, la reticencia de los cirujanos a crear una brecha en la barrera entre el segmento anterior y posterior que supone la cápsula posterior intacta y principalmente la necesidad de un lente específico, probablemente sean las causas que han determinado que esta técnica no se haya generalizado.
Recientemente, Menapace publicó una técnica que toma como base lo descrito por Gimbel en niños. La denominó «Posterior Optic Buttonholing» que en español sería Abotonado óptico posterior y se basa en realizar el atrapamiento de la óptica del LIO en la capsulorrexis posterior previamente realizada. Este autor obtuvo buenos resultados en cuanto a prevención de la OCP en una serie de 1000 casos y la recomienda para su uso rutinario en adultos. Tiene la ventaja de que puede realizarse con el uso del instrumental quirúrgico habitual y los lentes convencionales.23
3. Implantes adicionales
Los anillos de tensión capsular (Capsular Tension Ring: CTR) son dispositivos adicionales que se implantan en la bolsa capsular antes de la colocación del LIO y pueden contribuir a reducir la OCP. El mecanismo de acción principal que se les atribuye para prevenir la OCP es el efecto de barrera que logran mediante la tensión tangencial en 360º que producen sobre la cápsula posterior. Esto incrementa la presión sobre el punto P y potencia el bloqueo mecánico del borde posterior de la óptica del LIO sobre la migración de las LEC. Este efecto no es el único pues se plantea que facilitan la adhesión del complejo LIO-cápsula, previenen la descentración del implante y la deformación de los lentes plegables, disminuyen los pliegues de la cápsula posterior, facilitan el pulido de la cápsula anterior y la eliminación del viscoelástico del espacio retrolental, así como que podrían destruir las células epiteliales por un mecanismo de compresión directa sobre el ecuador del saco capsular. Diversos estudios han confirmado su relación con la disminución de la opacificación de la cápsula posterior.24, 25
A pesar de su eficacia demostrada para la reducción significativa de la OCP, no logran eliminarla totalmente. Este efecto limitado y el costo adicional de la cirugía han dificultado que se generalice su uso.2
4. Intervenciones farmacológicas
Las intervenciones farmacológicas durante o después de la cirugía con el objetivo de interrumpir o inhibir la regeneración de las células epiteliales cristalinianas vienen siendo estudiadas hace unos años. Se han usado sustancias intrasaculares directamente o a través de implantes impregnados con el fármaco así como medicamentos tópicos y orales. A continuación se comentan algunas de ellas:
Antimetabolitos
Actinomycina D, metrotrexate, daunomicina, 5-fluoracilo, colchicina, doxorubicina, arabinósido de citosina, mitomicina y siramesine son fármacos que tienen probado efecto citotóxico sobre las LEC pero así mismo pueden ser letales para el endotelio corneal. La daunomicina es el único de los antimetabolitos que ha sido probado en humanos con este objetivo pero no se han reportado nuevos estudios sobre su uso.2
Inmunotoxinas
La MDX-Ra es la única inmunotoxina ensayada en la cirugía de catarata en humanos in vivo. Clark en 1998 y luego Meacock en el 2000 hallaron una reducción significativa en la incidencia de la OCP así como buena tolerancia para su uso intraocular.26,27 Otras inmunotoxinas probadas in vitro o animales han sido reportadas como potenciales agentes reductores de la OCP, entre ellos el factor de necrosis epitelial lenticular, el 4137X-ricin A inmunoconjugado, la cafeína, inhibidores de la aldosa reductasa28, bacteriolin (este asociado con terapia fotodinámica),29 etc. Se necesitan nuevos estudios para demostrar su efectividad y seguridad in vivo en humanos.
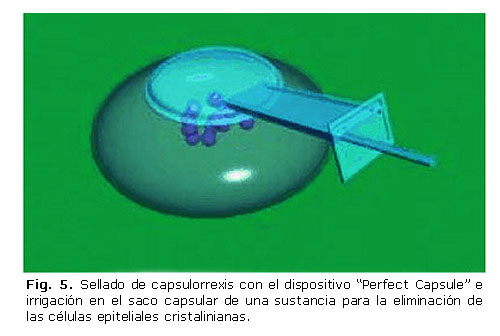
Para posibilitar el uso de los fármacos antes mencionados y evitar el daño endotelial al imposibilitar la salida de la sustancia citotóxica fuera del saco capsular fue diseñado el dispositivo de irrigación sellada conocido como Cápsula Perfecta que permite sellar el saco capsular a nivel de la capsulorrexis mediante un anillo de succión unido a una jeringa (figuras 4 y 5).20,30
Antinflamatorios
Un ensayo en un modelo ex vivo demostró que fármacos como el rofecoxib y el celecoxib, que previenen la transición epitelial-mesenquimal (EMT: epithelial-mesenchymal transition) de las LEC mediante la inhibición la cicloxigenasa-2 (COX-2), resultaron eficaces para la prevención de la OCP.31 En 1997 un estudio reportó la inhibición de la proliferación de las LEC con el uso de diclofenaco en combinación con ciclosporina A.32 Sin embargo, se han realizado posteriormente estudios con varios antinflamatorios como indometacina, dediclofenaco, dexametasona, betametasona, Ketorolac y no se han encontrado diferencias significativas en la prevención de la OCP entre ellos y el uso de placebos.1
Trypan blue
En abril de 2010 se publica un estudio realizado en el Departamento de Oftalmología de la Universidad de São Paulo, Brasil en el que concluyen que el Trypan blue causa la muerte de las LEC por un mecanismo de autofagia y apoptosis. Esto apoya la hipótesis de que la tinción con Trypan blue al 0,1 % podría contribuir a la reducción de la incidencia de la OCP tras una cirugía de catarata.33
5. Aplicación de nuevas tecnologías
Aqualase es una nueva tecnología de remoción del cristalino que usa pulsos de solución salina originados en la punta de la pieza de mano que son capaces de hidrolizar el cristalino. Debido al diseño de esta punta hecha de un polímero suavemente redondeado y que no usa ultrasonido surgió la hipótesis de una mejor y más segura eliminación de las LECs a nivel del ecuador en 360º resultando en un pulido capsular casi total que evitaría la opacificación de la cápsula posterior.34 No obstante, un estudio publicado en 2009 que evaluó la eficacia del Aqualase y el Neosonix en la prevención de la OCP durante tres años concluyó que ninguno de estos dos métodos eran capaces de prevenir la progresión natural de la opacidad capsular.35 Se necesitan futuros estudios para avalar su utilidad en la prevención de la opacificación de la cápsula posterior.
Cleanbagjet es novedosa técnica que se vale de una nueva punta de faco redondeada y altamente pulida (Punta de Radio Dewey) la cual permite utilizar bajos niveles de energía ultrasónica para el pulido seguro de la cápsula posterior.36 Se encuentra en estudio su utilidad para reducir la incidencia de la opacificación de la cápsula posterior.
Fotolisis láser (facoláser) fue técnica creada primeramente por el doctor Jack Dodick (Dodick Nd:YAG Laser Photolysis system) para la emulsificación del cristalino no resultó mejor en este sentido que la emulsificación ultrasónica convencional y no se generalizó su uso. En 2007 se publica un estudio realizado en ojos enucleados de cerdo donde se observó que este sistema de fotolisis láser produjo la ablación total de las LEC en el modelo de extracción de catarata in situ lo que sugería la posibilidad de que este sistema pudiera prevenir la aparición de la OCP in vivo.37
La pieza de mano láser cuenta con una punta de 1-1,5 mm que es insertada a través de paracentesis o por la incisión principal para eliminar las células epiteliales de la región nasal y temporal de la cápsula posterior. Las células son aniquiladas por la onda de choque creada por el láser y no con el rayo propiamente. El procedimiento añade solo cinco minutos al tiempo total de la cirugía que bien vale la pena al prevenir la necesidad de una segunda intervención para tratar la opacificación de la cápsula posterior.38
En abril de 2010 se publican los resultados preliminares de un estudio realizado en pacientes humanos con un seguimiento de 3 años que confirman la ablación de las LEC en las zonas tratadas.39 Actualmente se está llevando a cabo un estudio multicéntrico en cinco centros de Europa que ayudará definir la utilidad de esta técnica en la reducción de la opacificación de la cápsula posterior.38
6. Terapia génica
Ya desde 1992 se realizaron estudios en el campo de la genética con planteamientos elegantes y revolucionarios consistentes en la regeneración por neo-síntesis del cristalino a partir de las células epiteliales cristalinianas residuales o usando factores de crecimiento, evitando la diferenciación de las LEC en células fibroblásticas que resultan en OCP.40,41 No obstante, hasta el presente estas estrategias han sido difíciles de lograr.
Estrategias alternativas han surgido entonces para prevenir la OCP mediante la introducción de genes citotóxicos en las LEC para matarlas selectivamente preservando los tejidos oculares circundantes. El acercamiento más ampliamente estudiado en este sentido ha sido la estrategia del «suicidio genético» mediante el uso de genes inductores de apoptosis.42 La apoptosis, o muerte celular programada, es un proceso fisiológico esencial para el mantenimiento de la homeostasis en el organismo que con la terapia génica puede ser desencadenada por la expresión de diferentes genes con fines terapéuticos.43
Un estudio del 2006 identificó varias moléculas que inducen apoptosis de las LEC in vitro, ex vivo, así como in vivo para prevenir la PCO en un modelo experimental con conejos.43 No obstante, para que tenga utilidad terapéutica los efectos de esta expresión transgénica deben estar dirigidos exclusivamente a las LEC. El taponamiento de la capsulorrexis y sellado del saco capsular con el uso de visco elásticos, tapones de silicona o el dispositivo de irrigación sellada cápsula perfecta son métodos que pueden lograr la especificidad requerida de la acción transgénica. Actualmente se estudian métodos no quirúrgicos para la transferencia génica selectiva a las LEC mediante el uso de promotores específicos de células cristalinianas.43
En resumen, aunque la manipulación genética es una poderosa manera de inducir apoptosis celular en modelos experimentales de OCP se necesitan futuros estudios antes que estas estrategias puedan ser usadas en humanos.
CONCLUSIONES
Hemos expuesto las principales intervenciones cuyos efectos en la prevención de la OCP se investigan hasta el presente. No existe hasta ahora un método único que evite de modo definitivo la aparición de la opacidad capsular. El oftalmólogo debe usar la combinación de todos aquellos métodos que están a su alcance y han demostrada probada efectividad en la reducción de la OCP hasta hoy, fundamentalmente los relacionados con el tipo de lente intraocular a implantar y las modificaciones de la técnica quirúrgica. La comunidad oftalmológica mundial se mantiene expectante acerca de los resultados de nuevos ensayos clínicos, experimentales y multicéntricos que están actualmente en curso. La terapia génica, entre las novedosas intervenciones en estudio, parece ser una estrategia prometedora en este campo.
Obtener excelentes resultados visuales a largo plazo es el objetivo de la cirugía moderna de la catarata así como abrir el camino a intervenciones quirúrgicas novedosas para el tratamiento de la presbicia en pacientes mayores de 40 años. Para lograrlo resulta fundamental impedir que la cápsula posterior se opacifique, aún más con el uso de lentes multifocales y acomodativos, que son más vulnerables a la opacidad que los lentes monofocales. Es por ello que nos atrevemos a decir que el mayor salto en la cirugía de la catarata moderna aún está por dar: la erradicación definitiva de la opacidad del saco capsular.
REFERENCIAS BIBLIOGRÁFICAS
1. Findl O, Buehl W, Bauer P, Sycha T. Intervenciones para la prevención de la opacificación de la cápsula posterior. La Biblioteca Cochrane Plus. 2008:2 Disponible en: http://www.bibliotecacochrane.com/pdf/CD003738.pdf
2. Hernández López I, Castro González Y, Trujillo Fonseca K, Cepero Hernández L, Miranda Hernández I. Opacidad de la cápsula posterior. En: Rio Torres M. Oftalmología. Criterios y tendencias actuales. La Habana: Ciencias Médicas; 2009. p. 307-17.
3. Yuen C, Williams R, Batterbury M, Grierson I. Modification of the surface properties of a lens material to influence posterior capsular opacification. Clinical and Experimental Ophthalmology. 2006;34(6):568-74.
4. Wormstone IM, Tamiya S, Anderson I. TGF-â2-induced matrix modification and cell transdifferentiation in the human lens capsular bag. Invest Ophthalmol Vis Sci. 2002;43:23018.
5. Aslam TM, Dhillon B, Werghi N, Taguri A, Wadood A. Systems of analysis of posterior capsule opacification. Br J Ophthalmol. 2002 October;86(10):11816.
6. American Academy of Ophthalmology. Parte XI. Cap 9: Complications of cataract surgery. En su: Lens and cataract. USA: American Academy of Ophthalmology; 2008. p. 182-186. (Basic and Clinical Science Course; 11).
7. Amon M. Biocompatibility of intraocular lenses. J. Cataract Refract Surg. 2001;27(2):178-9.
8. Þemaitienë R, Jaðinskas V, Barzdþiukas V, Auffarth GU. Prevention of posterior capsule opacification using different intraocular lenses (results of one-year clinical study). Medicina (Kaunas). 2004;40(8):721-30.
9. Flores Gaitán A, Morales Gómez ME, Matiz H, Garzón M. Opacidad de la cápsula posterior después de facoemulsificación. Evaluación de varios tipos de lentes intraoculares. Rev Mex Oftalmol. 2005 Mayo-Junio;79(3):159-62.
10. Katayama Y, Kobayakawa S, Yanagawa H, Tochikubo T. The relationship between the adhesion characteristics of acrylic intraocular lens materials and posterior capsule opacification. Ophthalmic. Res. 2007;39:276-81.
11. Buehl W, Findl O. Advances in optic designs to reduce PCO. En: Garg A, Fine H, editors. Mastering the techniques of advance phaco surgery. New Delhi:Jaypee Brothers Medical Publishers; 2008. p.408-13.
12. Nishi O, Nishi K, Sakanishi K. Inhibition of migrating lens epithelial cells at the capsular bend created by the rectangular optic edge of a posterior chamber intraocular lens. Ophthalmic Surgery Lasers. 1998;29(7):587-94.
13. Boyce JF, Bhermi GS, Spalton DJ, El-Osta AR. Mathematical modeling of the forces between an intraocular lens and the capsule. J Cataract Refract Surg. 2002;28(10):1853-9.
14. Werner L, Apple DJ, Zurres KP. Postoperative proliferation of posterior and equatorial lens epithelial cells. En: Buratto L, Osher RH, Masket S. Cataract surgery in complicated cases. USA: Slack Incorporated; 2000. p.399-415.
15. Leysen I, Coeckelbergh T, Gobin L, Smet H, Daniel Y, De Groot V, et al. Cumulative neodimiun: Yag laser rates after bag-in-the-lens and lens-in-the-bag intraocular lens implantation: comparative study. J Cataract Refract Surg. 2006;32(12):2085-90.
16. Sacu S, Menapace R, Wirtitsch M, Buehl W, Rainer G, Findl O. Effect of anterior capsule polishing on fibrotic capsule opacification: Three-year results. J Cataract Refract Surg. 2004;30(11):2322-7.
17. Sacu S, Menapace R, Findl O, Georgopoulos M, Buehl W, Kriechbaum K, et al. Influence of optic edge design and anterior capsule polishing on posterior capsule fibrosis. J Cataract Refract Surg. 2004;30(3):658-62
18. Bolz M, Menapace R, Findl O, Sacu S, Buehl W, Wirtitsch M, et al. Effect of anterior capsule polishing on the posterior capsule opacification-inhibiting properties of a sharp-edged, 3-piece, silicone intraocular lens. Three- and 5-year results of a randomized trial. J Cataract Refract Surg. 2006;32(9):1513-20.
19. Menapace R, Wirtitsch M, Findl O, Buehl W, Kriechbaum K, Sacu S. Effect of anterior capsule polishing on posterior capsule opacification and neodimium:YAG capsulotomy rates: Three-year randomized trial. J Cataract Refract Surg. 2005;31(11):2067-75.
20. Suresh KP, Apple DJ, McAvoy J, Maloof AJ, Milverton EJ. Posterior capsule opacification (After cataract): Surgical and implant related factors for prevention. En: Jitendar PV. Matering the Arts of Bimanual microincision Phaco (Phaconit/MICS). New Delhi: Jaypee; 2005. p.396-420.
21. Tassignon MJ, Van Looveren J. Bag-in-the-lens IOL implantation and pseudophakic retinal detachment. En: Garg A, Alió JL. Mastering phaco chop techniques. New Delhi: Jaypee; 2009. p. 213-5
22. Gimbel HV. Posterior continuous curvilinear capsulorhexis and optic capture of the intraocular lens to prevent secondary opacification in pediatric cataract surgery. J Cataract Refract Surg. 1997;23(Suppl 1):652-6.
23. Menapace R. Eradication of after-cataract by posterior capsulorhexis and optic buttonholing combined with anterior capsule polishing: A report of 1000 cases. En: Garg A, Fine H. Mastering the techniques of advanced phaco surgery. New Delhi: Jaypee; 2008. p. 394-401.
24. Hehn F. Update on capsular tension ring implantation to prevent PCO. 2da ed. Advance in ophthalmology; 2004.
25. Hara T, Hara T, Hara T. Preventing Posterior Capsular Opacification With an Endocapsular Equator Ring in a Young Human Eye. Arch Ophthalmol. 2007;125(4):483-6.
26. Clark DS, Emery JM, Munsell MF. Inhibition of posterior capsule opacification with an immunotoxin specific for lens epithelial cells: 24 month clinical results. J Cataract Refract Surg. 1998;24(12):1614-20.
27. Meacock WR, Spalton DJ, Hollick EJ, Boyce JF, Barman S, Sanguinetti G. Double-masked prospective ocular safety study of a lens epithelial cell antibody to prevent posterior capsule opacification. J Cataract Refract Surg. 2000;26(5):716-21.
28. Yaday UCS, Ighani-Hosseinabad F, VanKuijk FJGM, Srivastava SK, Ramana KV. Prevention of Posterior Capsular Opacification through Aldose Reductase Inhibition. Inv Ophthalmol Vis Sci. 2009;50(2):7529.
29. Tenten Y, Schuitmaker HJ, Wolf A, Willekens B, Vrensen GF, Tassignon MJ. The effect of photodynamic therapy with bacteriochlorin a on lens epithelial cells in a capsular bag model. Exp Eye Res. 2001 Jan;72 (1):41-8.
30. Rabsilber TM, Limberger IJ, Reuland AJ, Holzer MP, Auffarth GU. Long-term results of sealed capsule irrigation using distilled water to prevent posterior capsule opacification: a prospective clinical randomised trial. Br J Ophthalmol. 2007;91(7):9125
31. Chandler HL, Barden CA, Lu P, Kusewitt DF, Colitz CMH. Prevention of posterior capsular opacification through cyclooxygenase-2 inhibition. Mol Vis. 2007 Apr 30;13:677-91. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17563718
32. Cortina P, Gómez-Lechón MJ, Navea A, Menezo JL, Terencio MC, Diaz-Llopis M. Diclofenac sodium and cyclosporin A inhibit human lens epithelial cell proliferation in culture. Graefes Arch Clin Exp Ophthalmol. 1997 Mar;235(3):180-5.
33. Portes ALF<, Almeida AC, Allodi S, Monteiro MLR,Miguel NCO . Trypan blue staining for capsulorhexis: Ultrastructural effect on lens epithelial cells and capsules. J Cataract Refract Surg. 2010 Apr;36(4):582-7.
34. Mackool RJ. Aqualase: a new technology for cataract extraction. Curr Opin Ophthalmol. 2004;15(1):40-3.
35. Nekolová J, Jirásková N, Pozlerová J, Rozsíval P. Three-year follow-up of posterior capsule opacification after AquaLase and NeoSoniX phacoemulsification. Am J Ophthalmol. 2009;148(3):390-5.
36. Dewey S. Ultrasonic Polishing of the posterior capsule with the Dewey Radius Tip. Techniques in Ophthalmology. 2006;4(4):139-48.
37. Pollhammer M, Meiller R, Rummelt C, Thyzel R, Cursiefen C, Kruse FE. In situ ablation of lens epithelial cells in porcine eyes with the laser photolysis system. J Cataract Refract Surg. 2007;33(4):697-701.
38. Henderson BA. New cataract instruments boost safety and visual, refractive outcomes. Ocular Surgery News U.S. 2009 Nov 25.
39. Wehner W, Warning GO, Walker R, Thyzel R. Capsular Cleaning to Remove Lens Epithelial Cells Results of Nd:YAG laser photolysis at 3 years are promising. Cataract and Refractive Surgery Today (Europe). 2010;3. Disponible: http://bmctoday.net/crstodayeurope/pdfs/euro0310_feature_waring.pdf
40. Gwon AE, Jones RL, Gruber LJ, Mantras C. Lens regeneration in juvenile and adult rabbits measured by image analysis. Invest Ophthalmol Vis Sci. 1992;33:227983.
41. Gwon A, Gruber L, Mantras C, Cunanan C. Lens regeneration in New Zealand albino rabbits after endocapsular cataract extraction. Invest Ophthalmol Vis Sci. 1993;34:21249.
42. Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, et al. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Human Gene Therapy. 1999;10(14):236572.
43. Malecaze F, Decha A, Serre B, Penary M, Duboue M, Berg D, et al. Prevention of posterior capsule opacification by the induction of therapeutic apoptosis of residual lens cells. Gene Therapy. 2006;13:4408.
Recibido: 19 de noviembre de 2010
Aprobado: 28 de noviembre de 2010
Dr. Iván Hernández López. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: ivan.hdez@infomed.sld.cu