Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176
Rev Cubana Oftalmol vol.25 supl.1 Ciudad de la Habana 2012
REVISIONES
Consideraciones generales en el hipema secundario a trauma ocular a globo ocular cerrado
General considerations about hyphema secondary to ocular trauma and closed globe injure
Dra. Liamet Fernández Argones,I Dr. José Guillermo Martínez Urbay,II Dra. Diana Teresa Rodríguez González,I Dr. Ibraín Piloto Díaz,I Dra. Yuderkys Díaz Águila,I Dr. Germán Antonio Álvarez CisnerosI
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Hospital Universitario "Arnaldo Milián Castro". Villa Clara, Cuba.
RESUMEN
El hipema, consecuencia común del trauma ocular, es considerado una emergencia diagnóstica y terapéutica por las lesiones oculares que determinan su aparición y las complicaciones que puede originar. Sin embargo, su tratamiento continúa siendo un desafío donde aún no existe un consenso unánime. En esta investigación se profundiza en cuestiones que han resultado polémicas como la hospitalización, uso de midriáticos, parches oculares, fibrinolíticos, esteroides sistémicos, inhibidores del ácido aminocaproico, cirugía precoz, entre otros.
Palabras clave: hipema, trauma ocular, hipertensión ocular.
ABSTRACT
Hyphema, common consequence of the ocular trauma, is considered a diagnostic and therapeutic emergency due to the ocular lesions that determine their appearance and the complications that may occur. However, the treatment of hyphema continues being a challenge since unanimous consent does not exist yet. This study intended to delve into questions that are controversial as the hospitalization, the use of midriatic drops use, ocular patches, systemic steroids, aminocaproic acid inhibitors, the early surgery, among others.
Key words: hyphema, ocular trauma, ocular hypertension.
INTRODUCCION
El hipema, término más correcto que hifema, según el Diccionario Terminológico de Ciencias Médicas, proviene de hipo, forma prefija del griego hypó que indica situación inferior y haima que significa sangre. Se designa así a la hemorragia en la parte anterior e inferior del globo ocular.1
Es consecuencia común del trauma ocular y considerado una emergencia diagnóstica y terapéutica por las lesiones oculares que determinan su aparición y las complicaciones a las que puede dar lugar. Otras causas son el trauma quirúrgico (durante la cirugía o después de esta), y el hipema espontáneo asociado a enfermedades sistémicas que cursan con alteraciones vasculares y/o de la coagulación, al uso de sustancias que alteran la función plaquetaria o la trombina (aspirina, etanol, entre otras), o a la presencia de neovasos sanguíneos en el segmento anterior ocular.2
Se realizó esta investigación para lograr una actualización en el manejo del hipema traumático y profundizar en algunas cuestiones que han resultado polémicas.
DESARROLLO
Epidemiología
Se ha descrito con mayor frecuencia en niños, jóvenes y personas en edad laboral, así como en el sexo masculino a razón de 3/1 con respecto al femenino. Los accidentes deportivos y las riñas son causas frecuentes. En niños se debe valorar la posibilidad de abuso infantil.2
En un estudio realizado en Cuba por Labrada3 el hipema representó 62 % de los ingresos hospitalarios oftalmológicos en edad pediátrica. En mayores de 15 años de edad, el hipema total estuvo presente en 7 % de los casos que necesitaron cirugía filtrante para el control de la hipertensión ocular asociada al trauma, según Miqueli y otros.4
Fisiopatología del hipema traumático
En el trauma ocular contuso la compresión anteroposterior conduce a una expansión ecuatorial del globo ocular. Esto daña los pequeños vasos sanguíneos del iris y cuerpo ciliar, especialmente los del círculo arterial mayor del iris, y produce sangrado en la cámara anterior (CA). Puede ocurrir también por lesión de la raíz del iris, espolón escleral o músculos como el esfínter y el dilatador del iris.2
Clasificación
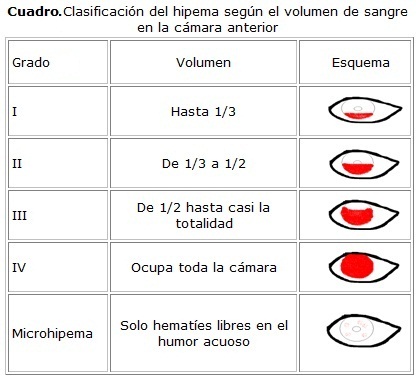
Varias son las clasificaciones propuestas para describir el tamaño del hipema. Por ejemplo, al interpretar la altura de la columna hemática en milímetros (12 mm es igual a hipema total), en porciento de ocupación de la CA (0 no presencia de sangre y 100 % hipema total) o al utilizar las horas del reloj para esta descripción. El hipema total se conoce como "hipema en bola 8", hace referencia a la similitud con la bola negra del juego de billar. El color oscuro se debe a la desoxigenación de la hemoglobina.
El modo de clasificar más difundido utiliza la gradación que se representa en el cuadro. Algunos autores hacen distinción entre los términos microhipema como suspensión de células sanguíneas en la CA e hipema cuando la sangre forma un nivel.5,6
Interrogatorio en el paciente con hipema
Se debe indagar y registrar cuidadosamente en la historia clínica los datos referentes al tipo de trauma, momento en que ocurrió y las características de la aparición de los síntomas. Los más frecuentes suelen ser dolor ocular, que se incrementa en presencia de luz y disminución inmediata de la agudeza visual (AV) de grado variable. En ocasiones, puede acompañarse de manifestaciones generales como náuseas, vómitos y se ha reportado somnolencia y letargo sobre todo en niños;7 aunque el mecanismo para la aparición de este síntoma no está totalmente esclarecido.
Es importante verificar el consumo de fibrinolíticos o anticoagulantes. También revisar los antecedentes de enfermedades sistémicas como anemia de células falciformes, leucemia, hemofilia o xantogranuloma juvenil, que pueden cursar con alteraciones en la coagulación.
Los hábitos tóxicos son importantes. El abuso de alcohol puede asociarse a hepatopatía severa con trastornos de la coagulación.
En el paciente que ha recibido tratamiento quirúrgico previo al trauma, se hace necesario revisar detenidamente el informe operatorio. Esto permitirá conocer la fecha de cirugía, tipo de intervención realizada, complicaciones transquirúrgicas y otros datos de interés.
Examen oftalmológico en estos pacientes
La agudeza visual mejor corregida se ha considerado un factor influyente en el pronóstico visual del paciente. Según González y otros8 un descenso inicial a menos de 20/200 es un factor de mal pronóstico, justificado por la cuantía del hipema y las posibles lesiones en el polo posterior. Sin embargo, se ha reconocido que la AV puede decaer de manera súbita hasta percepción de luz, en ausencia de afección importante en el segmento posterior.
La biomicroscopia del segmento anterior en lámpara de hendidura evalúa la cuantía del hipema y la presencia de daños como laceraciones y edema corneal. Los desgarros a nivel del esfínter iridiano, iridodiálisis, ciclodiálisis, midriasis, catarata, entre otras lesiones secundarias al trauma, se descartan cuando lo permita la transparencia de los medios. Es necesario explorar aquellos signos que apuntan hacia ruptura del globo ocular y/o fractura orbitaria, en cuyo caso se tomará la conducta apropiada.
Preferentemente se realiza tonometría de Goldman o de contorno dinámico de Pascal. Si se sospecha una lesión abierta, la presión intraocular (PIO) puede estimarse mediante la maniobra de palpación bidigital y comparación con el tono del otro ojo.9
El examen de fondo de ojo se realiza al arribo del paciente al cuerpo de guardia. Una valoración general puede obtenerse antes que la opacidad del acuoso y/o vítreo lo impida. Un segundo examen, bajo midriasis y sin realizar maniobras de depresión escleral, permitirá obtener más detalles sobre la existencia de hemorragia vítrea, desprendimiento de retina o cualquier otra lesión retiniana de etiología traumática. Estas están presentes en un elevado número de casos y usualmente no son sospechadas por la mayor parte de los oftalmólogos.9
La gonioscopia se trata de no realizar en los primeros 15 días para evitar el resangrado. Si fuese necesario (por ejemplo en la hipertensión ocular incontrolable), se utiliza la lente de Zeiss con maniobras gentiles. Este examen generalmente se difiere hasta el mes posterior a la resolución del hipema y busca fundamentalmente, el receso angular traumático.9
Medios diagnósticos utilizados
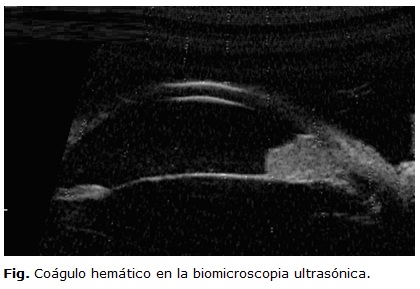
La biomicroscopia ultrasónica permite evaluar el estado del cristalino y las estructuras del segmento anterior ocular en presencia de opacidad de medios. Se indica ante la sospecha de rotura de la cápsula lenticular, luxación o subluxación del cristalino, alteraciones angulares, cuerpos extraños y otras anomalías no visibles en la lámpara de hendidura (figura). Permite explorar alteraciones en la cámara posterior, cuerpo ciliar y retina periférica.10
La tomografía de coherencia óptica de segmento anterior y las imágenes de Scheimpflug (Pentacam), presentan el inconveniente de no atravesar los medios opacos. Por esto su utilidad en el hipema se encuentra limitada.10
El ultrasonido ocular de segmento posterior precisa la existencia de desprendimiento de retina u otras alteraciones asociadas. Es fundamental cuando la opacidad de medios impide la fundoscopia.9
Se indican exámenes de laboratorio como hemograma y estudio de la coagulación. La electroforesis de hemoglobina y la prueba de Huck se reservan para sospechosos de enfermedad de células falciformes (personas de piel no blanca), retardo en la resolución del hipema y resangrado.2,11 Se recomienda en estos casos, descartar enfermedades como hemofilia A o déficit de factor VIII, hemofilia C o déficit de factor XI, déficit de vitamina K, entre otras. Si se planea comenzar la terapia antifibrinolítica se requiere el estudio de la función hepática y renal.2
Complicaciones relacionadas con el hipema
- Resangrado o hemorragia secundaria: Es la más frecuente, ocurre por lo general entre el 3er. o 5to. día, quizás asociada a lisis y retracción del coágulo. La incidencia es variable, entre 0 y 38 % según los diferentes autores.2,12-15
- Hipertensión ocular: Su incidencia es de hasta 14 % tras el cuadro inicial y de 25 a 67 % después de una hemorragia recurrente.12 La elevación inicial de la PIO se debe a la obstrucción trabecular ocasionada por los hematíes y células inflamatorias, edema trabecular postraumático y/o bloqueo pupilar ocasionado por coágulo sanguíneo. Entre el 2do. y 5to. día se recupera la PIO e incluso puede presentarse hipotonía por la reducción de la producción de humor acuoso debido al trauma del cuerpo ciliar. Entre el 5to. y 6to. día se recobra la producción de acuoso y el tono ocular puede aumentar por encima de los valores basales. Estos valores se retoman entre el 4to. y 18vo. día luego de reabsorberse la sangre y restituirse la función de la malla trabecular, en los casos donde no se asocien otras complicaciones.2,9
La presencia de hipema con hipertensión ocular fue considerada por Sihota y otros16 como uno de los factores precoces predictivos del desarrollo de glaucoma postrauma a globo ocular cerrado. En los hipemas que ocupan más del 75 % de la CA, el daño directo irreparable del ángulo camerular y/o las sinequias anteriores extensas provocadas por la organización del coágulo, condicionan la aparición de glaucoma que no responde a tratamiento médico.2,12
- La asociación con hemovítreo puede dar lugar al glaucoma de células fantasmas. La presión intraocular se mantiene elevada de 2 semanas a 3 meses y se requiere de tratamiento quirúrgico con mayor frecuencia.2
- Impregnación hemática de la córnea: Mediante biomicroscopia del segmento anterior en lámpara de hendidura, con haz de luz fino y máxima magnificación, se reconoce el cambio de coloración del endotelio corneal a un tono que puede ir del amarillo al cobrizo. El principal factor de riesgo para su aparición es el hipema total mantenido por más de 6 días asociado a una PIO mayor de 25 mmHg. La tinción endotelial puede aclararse luego de varios meses y generalmente va de la periferia al centro, sentido inverso al proceso de impregnación.2,9
- Atrofia óptica: Puede deberse al trauma inicial. Secundaria al hipema se presenta asociada a una PIO mayor de 50 mmHg por 5 días o PIO mayor de 35 mmHg por 7 días.2 En sicklémicos o portadores puede presentarse con menores cifras de presión intraocular.17
- Obstrucción de la arteria central de la retina: Se ha reportado como consecuencia de hipema en pacientes con rasgos sicklémicos.17
- Ambliopía: Especial cuidado se aconseja en menores de 6 años de edad. En estos se ha descrito una mayor incidencia de resangrado, que aumenta el riesgo de hematocórnea y ambliopía. El tratamiento con parches oculares puede favorecer su aparición. 2
Tratamiento médico
La estrategia va dirigida a evitar el resangrado, controlar la hipertensión y/o la inflamación intraocular, y prevenir la tinción hemática de la córnea.
¿Ingreso hospitalario? Se requiere en pacientes con riesgo elevado. Se consideran a aquellos poco cooperadores con el tratamiento, sicklémicos o con rasgo de la enfermedad, hipema que ocupe más de 1/3 de la CA, AV inicial menor de 20/200 y resangrado.2,18,19 Se recomienda en menores de 18 años, aunque Rocha y otros13 obtuvieron resultados favorables en niños tratados de forma ambulatoria.
Se aconseja descanso durante el tiempo de peligro de resangrado que es máximo entre el 3er. y 5to. día, a pesar de que el reposo estricto no ha mostrado ser más beneficioso que la actividad ligera.5,13,20 La posición en decúbito supino con inclinación de 30º permite que la sangre se coleccione en la porción inferior de la CA, esto mejora la AV, permite clasificar el hipema y visualizar el segmento posterior. 2
Una vez que el hipema desaparezca, se restringirá la actividad física intensa durante las 2 semanas siguientes. La sedación solo se utilizará en pacientes aprehensivos.2
¿Dieta blanda? No se requiere dieta especial.5 Se evitará las ingestas que puedan desencadenar vómitos. La constipación debe tratarse con el uso de laxantes.8
¿Parches oculares? Solo se utilizan en presencia de lesiones corneales de importancia. Puede utilizarse un escudo protector transparente, de esta forma se previene la ambliopía en niños y se garantiza que el paciente pueda percatarse de variaciones en la AV si ocurre resangrado.5
¿Dilatar la pupila? Se ha considerado que pudiera agravar el daño del esfínter pupilar e incrementar el riesgo de resangrado.14,21 Sin embargo, la mayoría de los autores5,12,22 recomienda el uso de atropina 1 % (1 a 2 gotas/día) con el objetivo de reducir el dolor al bloquear el espasmo ciliar, limitar los movimientos del iris, evitar la formación de sinequias posteriores y facilitar la exploración del segmento posterior.
¿Con qué medicamentos controlar la hipertensión ocular secundaria? Se aconseja tratar la PIO mayor de 30 mmHg y en los pacientes sicklémicos o portadores, por encima de 24 mmHg.5,9 Otros autores refieren que inician el tratamiento con una PIO mayor de 22 mmHg.2 Se deben administrar betabloqueadores tópicos, de preferencia timolol 0,5 % (1 gota cada 12 h), si no existe contraindicación. De ser necesario, se asocian alfa-adrenérgicos como la brimonidina, o inhibidores tópicos de la anhidrasa carbónica como la dorzolamida. La acetazolamida vía oral (1 tableta de 1 a 4 veces al día) y el manitol vía endovenosa (250cc al 20 %, a dosis de 1 a 2 g por kg de peso), pueden utilizarse en casos severos. Se aconseja evitar los medicamentos prostaglandínicos y mióticos porque pueden actuar potenciando la inflamación ocular.
¿Cuándo usar los antifibrinolíticos? Los agentes antifibrinolíticos estabilizan el coágulo en los vasos sanguíneos. Se ha demostrado su efectividad en la prevención del resangrado, tanto en ensayos clínicos controlados, aleatorios y a doble ciegas como en estudios farmacológicos básicos.20,23-27
El ácido aminocaproico se inicia en los 3 primeros días de evolución a dosis de 50mg/kg cada 4 h durante 5 días, sin exceder los 30 g al día. Está contraindicado en la coagulación intravascular activa, embarazo y patologías cardíacas, hepáticas y renales. Entre sus efectos indeseables se encuentran los trastornos gastrointestinales, mareos, cefalea y fatiga. La presencia de dificultad respiratoria o al tragar, sudoración excesiva, entre otros, pueden indicar la suspensión del tratamiento.5
El ácido tranexámico, otro de los antifibrinolíticos orales, se usa a dosis de 25 mg/kg cada 8 h por 6 días.2 Uusilato y otros20 observaron en su estudio de 340 casos, que previene el resangrado aún cuando no se indica reposo estricto. Rahmani y otros23 obtuvieron mayor efectividad en la prevención del resangrado que con los esteroides sistémicos.
Se ha desarrollado la formulación tópica en gel del ácido aminocaproico, esta previene los efectos sistémicos. Pieramici y otros28 reportaron que es un medicamento seguro y efectivo en prevenir el resangrado (8 % del grupo tratado, 30 % del grupo placebo). Sin embargo, Karkhaneh y otros29 en un ensayo aleatorio a doble ciegas, no observaron diferencias significativas en el resangrado y sí en el tiempo de absorción del coágulo, que fue mayor en el grupo tratado.
¿Y los fibrinolíticos? Los agentes fibrinolíticos, como el factor activador tisular del plasminógeno, pueden acelerar la lisis del coágulo.11 Se utilizan una vez recuperado el endotelio vascular dañado, de lo contrario pueden favorecer el resangrado.30 Lambrou y otros31 en un modelo experimental en conejos observaron hipemas totales que se aclararon en 24 horas, mientras el grupo control demoró 14 días. Karaman y otros11 obtuvieron excelentes resultados en un paciente portador de rasgo sicklémico que desarrolló hipema e hipertensión ocular severa incontrolable.
Aún no se precisa el tiempo óptimo para iniciar el uso de los fibrinolíticos. Se prefiere en aquellos hipemas que fallan en reabsorberse espontáneamente y la PIO se hace incontrolable.2
¿Es conveniente el uso de antinflamatorios tópicos y sistémicos? Se contraindican los no esteroideos, así como los antiagregantes plaquetarios para evitar el resangrado.12
Los esteroides tópicos, como la prednisolona, se utilizan cada 4 h en ausencia de lesión epitelial corneal y se incrementa la dosis en casos severos. Su modo de acción en la prevención del resangrado no ha sido esclarecido. Pudiese estar relacionado con el efecto antinflamatorio en los vasos dañados.2,5 Algunos autores consideran usarlo desde el inicio (prednisona vía oral a dosis de 0,75 a 1 mg/kg).12,19 Otros como Thangaraj en Barbados14 y Beiran en Israel,15 no justifican la terapia sistémica y sus efectos adversos para prevenir el resangrado al considerar una incidencia variable de este, el desconocimiento de factores predictivos para su ocurrencia y la ausencia de relación significativa entre resangrado y AV final en sus estudios.
Tratamiento quirúrgico
La mayoría de los hipemas resuelven con tratamiento médico. La cirugía se hace necesaria para prevenir secuelas oculares graves en situaciones como: impregnación hemática de la córnea, hipema mayor del 50 % de la CA por 8 a 9 días (peligro de formación de sinequias anteriores periféricas), hipema total o mayor del 75 % de la CA por más de 6 días asociado a PIO mayor de 25 mmHg (peligro de tinción hemática de la córnea) y PIO mayor de 50 mmHg por más de 4 días (peligro de atrofia óptica).2
La hipertensión ocular importante requiere de manitol y acetazolamida en el preoperatorio. Una de las opciones quirúrgicas es el lavado de la cámara anterior. Se remueve fácilmente la sangre líquida, mediante irrigación, a través de una o dos paracentesis, en una de las cuales se coloca un mantenedor de CA conectado a un frasco de solución salina balanceada. De esta forma se minimizan las fluctuaciones transoperatorias de la PIO y se conserva la profundidad de la cámara anterior. Todo este proceder reduce el riesgo de resangrado y daño iatrogénico sobre el cristalino, iris y endotelio corneal.32 Los coágulos se extraen con la utilización de viscoelástico, o con un instrumento de vitrectomía con baja aspiración. Al culminar la cirugía se reforma la CA con burbuja de aire para prevenir el resangrado.
La iridotomía láser o la iridectomía periférica (si no se dispone de equipo YAG láser o la transparencia de los medios no lo permite), pueden realizarse para romper el bloqueo pupilar por coágulo hemático o seclusión pupilar.
En algunos casos se requiere la cirugía filtrante. En el hipema total que persiste hasta el 4to. día, evita el resangrado y la posibilidad de atrofia óptica. El uso de antimetabolitos se justifica por el antecedente del trauma que predispone a la inflamación.2
Consideraciones en pacientes con sicklemia o rasgos sicklémicos
¿Qué conducta seguir si el paciente es sicklémico o portador de rasgo sicklémico? En los hematíes del paciente portador coexisten la hemoglobina A y la S, ésta última en tan pequeña cantidad que en condiciones de tensión normal de oxígeno, no experimentan cambios. En condiciones adversas, estos hematíes pueden sufrir el fenómeno drepanocítico.11,33 Se ha estudiado que de los fluidos corporales el humor acuoso es el más nocivo, por lo que en este medio se desencadena y mantiene el fenómeno drepanocítico. Los hematíes semilunares, al ser rígidos, no atraviesan la malla trabecular. El hipema persiste por mucho más tiempo, la hipertensión ocular se hace rebelde al tratamiento, la hipoperfusión y la hipoxia empeoran el cuadro falciforme y como resultado final, puede desarrollarse obstrucción de la arteria central de la retina o daño del nervio óptico con cifras de PIO no tan elevadas.11
Lai y otros6 no encontraron diferencias significativas de resangrado entre niños portadores de la enfermedad y normales, pero sí en el desarrollo de hipertensión ocular que fue más frecuente en el primer grupo (p=0,06). Papaconstantinou y otros9 reportaron mayor frecuencia de estas dos complicaciones en sicklémicos y portadores.
El profesor Goldberg17 ha propuesto la "regla 24 por 24" para el tratamiento del hipema en estos casos. Esta consiste en practicar paracentesis inmediata y lavado de cámara anterior si se mantiene la PIO por encima de 24 mmHg durante 24 horas.
Los hipotensores alfa-adrenérgicos, como la brimonidina, pueden desencadenar alteraciones vasculares del iris (por vasoconstricción) y los inhibidores de la anhidrasa carbónica, como la dorzolamida, un cuadro falciforme por reducción del pH de la cámara anterior.2 Ambos grupos farmacológicos deben ser evitados.
Pronóstico y seguimiento
El pronóstico visual siempre es reservado. Estará en relación con factores dentro de los que se destacan la AV inicial, grado de hipema, resangrado, tiempo de reabsorción del coágulo, nivel de hipertensión ocular, aparición de impregnación hemática de la córnea, lesiones traumáticas asociadas en el segmento anterior y posterior, y el tratamiento recibido. Las complicaciones ensombrecen el pronóstico visual del paciente.2,8,9 Generalmente el microhipema y el hipema grado I, que se reabsorben en la primera semana, evolucionan favorablemente.34 Estos pacientes tienen un elevado riesgo de desarrollar glaucoma a largo plazo. Por esto se sugiere una evaluación anual de por vida.
CONCLUSIONES
El manejo del hipema traumático continúa siendo un desafío donde aún no existe consenso unánime. Esto quedó evidenciado en una encuesta realizada por Kelly y otros.35 La conducta a seguir depende en gran medida de la magnitud del trauma, grado de hipema, enfermedades sistémicas asociadas y complicaciones que acontezcan. La polémica persiste referente al riesgo o beneficio de la medicación sistémica en la profilaxis del resangrado y el tiempo óptimo para la cirugía en casos complicados.
REFERENCIAS BIBLIOGRÁFICAS
1. Colectivo de autores. Diccionario terminológico de ciencias médicas. 10ma. Ed. España: Salvat editores; 1972.
2. Sheppard JD Jr. Hyphema. E medicine; 2012. Disponible en: http://emedicine.medscape.com/article/1190165-overview
3. Labrada YH, Flores A, González L. Traumatología ocular en niños. Rev Cubana Oftalmol. 2003 [citado 20 de agosto de 2012];16(2). Disponible en: http://bvs.sld.cu/revistas/oft/vol16_2_03/oft04203.htm
4. Miqueli M, Ortiz E. Traumas oculares y glaucoma. Rev Cubana Oftalmol. 2003 [citado 20 de agosto de 2012];16(2). Disponible en: http://bvs.sld.cu/revistas/oft/vol16_2_03/oft03203.htm
5. Irak-Dersu I. Glaucoma, Hyphema: Treatment & Medication. E medicine; 2012. Disponible en: http://emedicine.medscape.com/article/1206635-treatment
6. Lai JC, Fekrat S, Barrón Y, Goldberg MF. Traumatic hyphema in children. Risk factors for complications. Arch Ophthalmol. 2001;119(1):64-70.
7. Jara E, Colom G, Santiesteban R. Traumatismos oculares. En: Colectivo de autores. Pediatría Tomo III. La Habana: Editorial Ciencias Médicas; 2007. p. 1344-51.
8. González IX, Villavicencio A, Campos LE. Escala pronóstica para agudeza visual en hipema traumático. Rev Mex Oftalmol. 2007;81(6):301-6.
9. Papaconstantinou D, Georgalas I, Kourtis N, Karmiris E, Koutsandrea C. Contemporary aspects in the prognosis of traumatic hyphemas. Clin Ophthalmol. 2009;3:287-90.
10. Wolffsohn JS, Davies LN. Advances in anterior segment imaging. Curr Opin Ophthalmol. 2007;18(1):32-8.
11. Karaman K, Culie S, Erceg I. Treatment of post-traumatic trabecular Mashwork thrombosis and secondary glaucoma with intracameral tissue plasminogen activator in previously unrecognized sickle cell anemia. Coll. Antropol. 2005;29(1):123-6.
12. Walton W, Von Hagen S, Grigorian R, Zarbin M. Management of traumatic hyphema. Surv Ophthalmol. 2002;47(4):297-334.
13. Rocha KM, Nogueira E, Melo LA Jr, Simeren N. Outpatient management of traumatic hyphema in children: Prospective evaluation. J AAPOS. 2004;8(4):357-61.
14. Thangaraj MA. Treatment of traumatic hyphema. West Indian Med. 1995;44(2):43-4.
15. Beiran I, Talmon T, Miller B. Characteristics and functional outcome of traumatic hyphema without routine administration of epsilon-aminocaproic acid. Isr Med Assoc J. 2002;4(11):1009-10.
16. Sihota R, Kumar S, Gupta V, Dada T, Kashyap S, Insan R, et al. Early predictors of traumatic glaucoma after closed globe injury: trabecular pigmentation, widened angle recess, and higher baseline intraocular pressure. Arch Ophthalmol. 2008;126(7):921-6.
17. Grove N. Optic atrophy secondary to sickle cell hyphema is avoidable. Ophthalmology Times. 2008;33(17):1-66.
18. Luksza L, Homziuk M, Nowakowska-Klimek M, Glasner L, Iwaszkiewicz-Bilikiewicz B. Traumatic hyphema caused by eye injuries. Klin Oczna. 2005;107(4-6):250-4.
19. Romano PE, Phillips PJ. Traumatic hyphema: a critical review of the scientifically catastrophic history of steroid treatment therefore; and a report of 24 additional cases with no rebleeding after treatment with the Yasuna systemic steroid, no touch PLUS protocol. Binocul Vis Strabismus Q. 2000;15(2):187-96.
20. Uusilato R, Ranta L. Management of traumatic hyphema in children. An analysis of 340 cases. Arch Ophthalmol. 1988;106(9):1207-9.
21. Vaughan DG, Asbury T. Vaughan & Asbury's General Ophthalmology. 17th. Ed. USA:Mcgraw-Hill; 2008.
22. Crouch ER Jr. Traumatic hyphema. J Pediatr Ophthalmol Strabismus. 1986;23(2):95-7.
23. Rahmani B, Jahadi HR. Comparison of tranexamic acid and prednisolone in the treatment of traumatic hyphema. A randomized clinical trial. Ophthalmology. 1999;6(2):375-9.
24. Crouch E, Norfolk VA. Systemic Steroids: An alternative to systemic aminocaproic acid to prevent rebleeding in traumatic hyphema-reply. Arch Ophthalmol. 1987;105(5):611.
25. Fourman S, Kutner B. Comments on continued clinical research on systemic aminocaproic acid for traumatic hyphema-reply. Arch Ophthalmol. 1987;105(5):612.
26. Romano PE. Systemic Steroids: An alternative to systemic aminocaproic acid to prevent rebleeding in traumatic hyphema. Arch Ophthalmol. 1987;105(5):610.
27. Romano PE. Comments on continued clinical research on systemic aminocaproic acid for traumatic hyphema. Arch Ophthalmol. 1987;105(5):611-2.
28. Pieramici DJ, Goldberg MF, Melia M, Fekrat S. A phase III, multicenter, randomized, placebo-controlled clinical trial of topical aminocaproic acid (Caprogel) in the management of traumatic hyphema. Ophthalmology. 2003;110(11):2106-12.
29. Karkhaneh R, Naeen M, Chams H. Topical amiriocaproic acid to prevent rebleeding in cases of traumatic hyphema. Eur J Ophthalmol. 2003;13(11):57-61.
30. Williams DF, Han DP. Rebleeding in experimental traumatic hyphema treated with intraocular tissue plasminogen activator. Arch Ophthalmol. 1990;108(2):264-6.
31. Lambrou FH, Snyder RW, Williams GA. Use of tissue plasminogen activator in experimental hyphema. Arch Ophthalmol. 1987;105(7):995-7.
32. Yu T, Dahan E, Yin ZQ, Levitz LM. Use of an anterior chamber maintainer in the surgical management of traumatic hyphaemas. Clin Experiment Ophthalmol. 2008;36(3):206-8.
33. Tapia JL. Infarto esplénico por anemia falciforme relacionado con la altura. Rev Venez Cir. 2006;59(2):60-5.
34. Recchia FM, Saluja RK, Hammel K, Jeffers JB. Outpatient management of traumatic microhyphema. Ophthalmology. 2002;109(8):1465-70.
35. Kelly JL, Blomquist PH. Management of traumatic hyphema in Texas. Tex Med. 2002;98(4):56-61.
Recibido: 8 de marzo de 2012.
Aprobado: 8 de abril de 2012.
Dra. Liamet Fernández Argones. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: lianetfa@infomed.sld.cu