Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176
Rev Cubana Oftalmol vol.27 no.1 Ciudad de la Habana ene.-mar. 2014
INVESTIGACIÓN
Fotocoagulación panretinal y bevacizumab intravítreo en el tratamiento de la retinopatía diabética proliferativa activa
Panretinal photocoagulation and intravitreal bevacizumab in the treatment of active proliferative diabetic retinopathy
Dra. Arianna Hernández Pérez, Dr. Oslay Mijail Tirado Martínez
Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
RESUMEN
Objetivo: evaluar el efecto de la fotocoagulación panretinal e inyección intravítrea de bevacizumab sobre las áreas de neovascularización en pacientes con retinopatía diabética proliferativa activa.
Métodos: estudio experimental en 80 ojos de 62 pacientes con retinopatía diabética proliferativa con características de alto riesgo, a quienes se les asignó aleatoriamente fotocoagulación panretinal (Grupo L) o fotocoagulación panretinal con bevacizumab intravítreo (Grupo L + B). Variables: edad, sexo, color de la piel, tipo de diabetes mellitus, tiempo de evolución, tipo de tratamiento, área de difusión de fluoresceína y regresión de neovascularización retinal y/o del disco óptico. Se realizó un seguimiento de 9 meses.
Resultados: en la evaluación inicial el área media de difusión fue de 8,95 mm2 en el grupo L y de 10,08 mm2 en el grupo L + B (p = 0,347), que se modificó a 6,40 mm2 y 3,91 mm2 (p = 0,012) al mes; 3,15 mm2 y 1,02 mm2 (p = 0,002) a los tres meses; 2,45 mm2 y 0,58 mm2 (p = 0,001) a los seis meses; 2,18 mm2 y 0,46 mm2 (p = 0,001) a los nueve meses, respectivamente. El análisis de las diferencias absolutas de los promedios mostró una reducción significativa de las áreas de difusión a favor del tratamiento combinado en comparación con el momento inicial.
Conclusiones: en pacientes con retinopatía diabética proliferativa activa el bevacizumab intravítreo combinado con fotocoagulación panretinal produjo regresión dramática de la neovascularización, permaneciendo estable desde el tercer mes al noveno.
Palabras clave: retinopatía diabética, neovascularización patológica, inhibidores de la angiogénesis, bevacizumab, fotocoagulación.
ABSTRACT
Objective: to evaluate the effect of panretinal photocoagulation and intravitreal injection of bevacizumab on neovascularization areas of patients with active proliferative diabetic retinopathy.
Methods: experimental study conducted in 80 eyes from 62 patients with proliferative diabetic retinopathy with high risk characteristics. These patients were randomly assigned to panretinal photocoagulation group (group L) or to the panretinal photocoagulation plus intravitreal bevacizumab group (group L + B). The studied variables were age, sex, race, type of diabetes mellitus, illness duration, type of treatment, fluorescein distribution area and retinal/optical disc neovascularization regression area. They were followed-up for 9 months.
Results: in the initial evaluation, the average diffusion area was 8,95 mm2 in group L and 10,08 mm2 in group L + B (p = 0,347), which changed to 6,40 mm2 and 3,91 mm2 (p = 0,012) respectively, after one month; 3,15 mm2 and 1,02 mm2 (p = 0,002) three months later, 2,45 mm2 and 0,58 mm2 (p = 0,001) after six months and 2,18 mm2 and 0,46 mm2 (p = 0,001) after nine months, respectively. The analysis of absolute differences of averages showed a significant reduction in the distribution areas of fluorescein that favored the combined therapy.
Conclusions: in patients with active proliferative diabetic retinopathy, intravitreal bevacizumab combined with panretinal photocoagulation bring about dramatic regression of neovascularization, which remained stable from the third to the ninth month.
Key words: diabetic retinopathy, pathologic neovascularization, angiogenesis inhibitors, bevacizumab, photocoagulation.
INTRODUCCIÓN
La retinopatía diabética proliferativa (RDP) constituye la primera causa de ceguera en personas entre 20 y 74 años de edad.1 Se estima una prevalencia de un 28,5 % de retinopatía diabética en los Estados Unidos de América en diabéticos mayores de 40 años de edad. Aproximadamente el 1,5 % de los adultos con diabetes mellitus (DM) tienen RDP.2
En Cuba, la DM se comporta de manera similar, con una prevalencia de retinopatía diabética (RD) que oscila entre el 20 % y 40 % según estudios realizados en áreas de salud de diversas localidades del país. La ceguera por esta afección puede aparecer en el 35 % de los pacientes que la padecen a pesar de que se trabaja arduamente en su prevención.3
La isquemia retinal constituye un estímulo para la formación de vasos nuevos, regulado por el factor de crecimiento vascular endotelial (VEGF).4,5 El VEGF-A es el más común y muchas veces se conoce en general como VEGF; tiene seis isoformas y puede inducir angiogénesis, aumento de la permeabilidad vascular, linfangiogénesis, estimular la proliferación y migración de células endoteliales y su organización tubular.5
La terapia antiangiogénica ha demostrado ser eficaz en enfermedades oculares con neovascularización retinal, coroidea, edema macular, glaucoma neovascular, neuropatía y retinopatía por radiación, melanomas asociados a neovascularización, metástasis coroideas y tumores vasoproliferativos, entre otros.6-11
El bevacizumab (Avastin) es un anticuerpo monoclonal humanizado que actúa sobre todas las isoformas del VEGF-A humano y penetra todas las capas de la retina a pesar de su alto peso molecular.4,9,12
Las inyecciones de bevacizumab causan reducción en la expresión del VEGF y la densidad vascular en pacientes con RDP activa.13,14 La interleukina 6 puede mediar los cambios inflamatorios en el periodo agudo después de la inyección, lo cual demuestra su papel como mediador agudo para los cambios inflamatorios en condiciones de hipoxia patológica.15
Una sola inyección no es suficiente para inducir un bloqueo completo del VEGF y regresión de la neovascularización patológica.14 Varios estudios han demostrado la utilidad del Avastin en la regresión de la neovascularización del iris, retina y del disco óptico.10,16-23 Sin embargo, esta regresión no es permanente.11
Por otra parte, la fotocoagulación panretinal (FPR) ha sido el tratamiento de elección de la RDP para lograr la desaparición de los vasos de nueva formación24 y puede prevenir la pérdida visual severa en un 50 a 60 %.25 Alrededor del 60 % de los pacientes con RDP responden a la fotocoagulación con láser en un periodo de 3 meses.26 Sin embargo, una sustancial regresión de los neovasos puede tomar varias semanas después de completada la fotocoagulación y en más de un tercio de los casos los neovasos continúan creciendo a pesar del tratamiento inicial con láser.24 En estos casos la hemorragia vítrea puede inducir una pérdida visual. El edema macular diabético puede aumentar después de la FPR y causar disminución transitoria o permanente de la agudeza visual.25,27,28
Las limitaciones halladas en ambos tratamientos por separado (FPR e inyección intravítrea de Bevacizumab) han motivado a la búsqueda de un método de más rápida acción y a la vez duradero, para reducir el riesgo de daño permanente.
Nos propusimos como objetivo evaluar el efecto sobre las áreas de neovascularización de la FPR unida a la inyección intravítrea de bevacizumab en pacientes con RDP activa.
MÉTODOS
Se realizó un estudio experimental con dos grupos de tratamiento con universo de 80 ojos de 62 pacientes con RDP activa, atendidos consecutivamente en el Servicio de Vítreorretina del Instituto Cubano de Oftalmología "Ramón Pando Ferrer", de La Habana. La recogida de datos y los tratamientos fueron impuestos entre los meses de febrero de 2010 a febrero de 2012, con un seguimiento de nueve meses.
Se conformaron dos grupos de 40 ojos cada uno, distribuidos aleatoriamente mediante el generador de números aleatorios del software libre OpenEpi versión 2.3 (mayo de 2009), a los cuales se les realizó FPR unida a una inyección intravítrea de bevacizumab (Grupo L + B o grupo de estudio) o solamente FPR (Grupo L o grupo control).
Los criterios de inclusión fueron: pacientes con RDP con características de alto riesgo (CAAR) [neovascularización del disco (NVD) mayor que en la fotografía estándar 10a del Early Treatment Diabetic Retinopathy Study (ETDRS), NVD mayor o igual a 0,250,33 diámetro de disco; neovascularización más hemorragia vítrea o prerretinal; neovascularización extrapapilar mayor o igual a ½ diámetro de disco con hemorragia vítrea o prerretinal.29 Pacientes sin tratamiento intravítreo previo o con láser en el ojo en estudio.
Se excluyeron los pacientes con RDP sin CAAR o avanzada. Historia de tratamiento con láser o vitrectomía en el ojo en estudio. Opacidad de medios que impidieran el examen del fondo de ojo. Pacientes con tracción vítreorretinal comprobada por ultrasonido ocular. Antecedentes de infarto agudo de miocardio o accidente vascular encefálico. Historia de cirugía mayor previa con menos de seis meses o planificada en el transcurso del mes próximo a la inyección. DM o hipertensión arterial descompensadas. Coagulopatías o uso de anticoagulantes. Contraindicación para el uso endovenoso de Fluoresceína Sódica. Contraindicación para el uso de bevacizumab.
A cada paciente con criterios de inclusión se le solicitó consentimiento informado por escrito para participar en el estudio después de haber sido informado sobre este. El Comité de Ética de la Investigación del Instituto Cubano de Oftalmología "Ramón Pando Ferrer" aprobó la ejecución de este estudio, que se adhirió a la Declaración de Helsinki.
Como variable principal de salida se utilizó el área de difusión de fluoresceína, expresada en milímetros cuadrados (mm2) y evaluada mediante angiografía fluoresceínica (AGF).
Además se estudió la edad, sexo, color de la piel, tipo de DM, tiempo de evolución y tipo de tratamiento, área de difusión de fluoresceína, regresión de la neovascularización retinal y/o del disco óptico, definiéndose esta última de la siguiente manera:
- Sin regresión: área de difusión de fluoresceína en fases tardías de la AGF igual o mayor a la evaluación anterior.
- Regresión parcial: disminución parcial del área de difusión de fluoresceína en fases tardías de la AGF.
- Regresión completa: ausencia de difusión.
Se realizó el examen oftalmológico del segmento anterior (sin dilatar) y del segmento posterior (dilatado con Tropicamida al 2 %), con el uso del oftalmoscopio indirecto Heine Omega 180 (Heine Optotechnik, Herrsching, Alemania), con lente asférica de 20 dioptrías, lámpara de hendidura SL 130 (Carl Zeiss, Meditec AG, Jena, Alemania) con lente de contacto Goldmann y de no contacto de 90 dioptrías para realizar biomicroscopía de polo posterior.
A cada ojo incluido en el estudio le fue asignada de manera aleatoria FPR solamente (Grupo L) o FPR con Avastin (Genentech, San Francisco, California) intravítreo (Grupo L + B). En todos los casos se administró láser verde con el equipo Visulas 532s (Carl Zeiss, Meditec AG, Jena, Alemania) con lente de contacto Goldmann en tres sesiones (semana 1, 2 y 3) de 600 spots cada una, 200 µm de tamaño, con una duración de 0,2 segundos e intensidad entre 200 y 500 mW hasta lograr una quemadura blanco-grisácea. Los pacientes del Grupo L + B recibieron al final de la primera semana, 1,25 mg/0,05 mL de avastin mediante inyección intravítrea a 3,5 o 4 mm del limbo esclerocorneal en temporal inferior, usando aguja No. 26, previa asepsia y antisepsia, uso de ciprofloxacino (colirio al 0,3 %; Laboratorio Farmacéutico "Julio Trigo", Cuba) a la dosis de una gota cada tres horas desde tres días antes del procedimiento y hasta siete días posteriores a este.
En el examen inicial se realizó ultrasonido ocular para descartar tracción vítreorretinal que contraindicara el uso del medicamento antiangiogénico. Se realizaron retinografías a color y libre de rojo (FF-450) y angiografía fluoresceínica antes de recibir tratamiento alguno, al mes, tres, seis y nueve meses de concluido el tratamiento. Los angiogramas fueron tomados usando el HRA-2 (Heidelberg Engineering, Dossenheim, Alemania) con 55º de amplitud de campo. Para evaluar la regresión de neovasos se midió en mm2 el área total de difusión de la neovascularización en fases tardías de la AGF usando las herramientas del software del HRA-2.
Todos los exámenes oftalmológicos fueron realizados por el mismo especialista (AHP), así como el tratamiento con láser y la inyección intravítrea. La AGF y las retinografías fueron realizadas por el mismo técnico.
La información se descargó y se procesó en una base de datos mediante el software SPSS versión 15.0 (SPSS Inc., Chicago, IL, USA) con un nivel de significación de 5 % (p < 0,05).
Las variables demográficas de los pacientes con los dos ojos incluidos en diferentes grupos de tratamiento se incluyeron en el grupo correspondiente al tratamiento de su ojo derecho para evitar información duplicada.
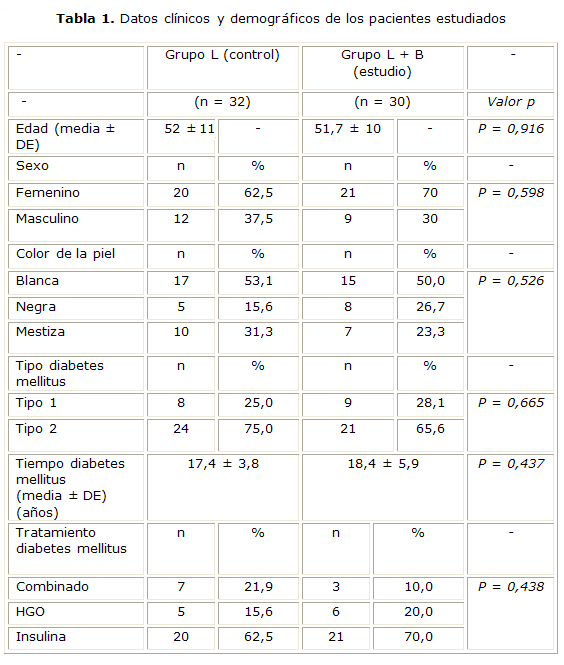
Se utilizaron estadígrafos descriptivos para resumir datos clínicos y demográficos de interés. Se empleó el test t-Student para comparar las medias de edad entre ambos grupos y el tiempo de evolución de la DM, así como el test Chi cuadrado de Pearson para evaluar la relación entre color de la piel, sexo, tipo de DM y tipo de tratamiento para la DM con el grupo de tratamiento estudiado.
Para determinar la eficacia del tratamiento láser combinado con bevacizumab con respecto al láser solo, se utilizaron las diferencias absolutas de las medias de las áreas de difusión por intervalos de análisis.
RESULTADOS
No se encontraron diferencias significativas entre ambos grupos al analizar las variables demográficas y aquellas relacionadas con la enfermedad de base, ni en cuanto a tipos de tratamiento para la DM (tabla 1). En ambos grupos predominaron los pacientes del sexo femenino (62,5 y 70 %), la DM tipo 2 (75 y 65,6 %) y el tratamiento con insulina (62,5 y 70 %, respectivamente). Los 62 pacientes tenían más de 15 años de evolución de la DM con una media de 17,4 años en el grupo L y de 18,4 años en el grupo L + B (p = 0,437).
En la evaluación inicial el área media de difusión fue de 8,95 mm2 en el grupo L y de 10,08 mm2 en el grupo L + B (p= 0,347), modificado a 6,40 mm2 y 3,91 mm2 (p = 0,012) al mes; 3,15 mm2 y 1,02 mm2 (p = 0,002) a los tres meses; 2,45 mm2 y 0,58 mm2 (p = 0,001) a los seis meses; 2,18 mm2 y 0,46 mm2 (p = 0,001) a los nueve meses, respectivamente (tabla 2).
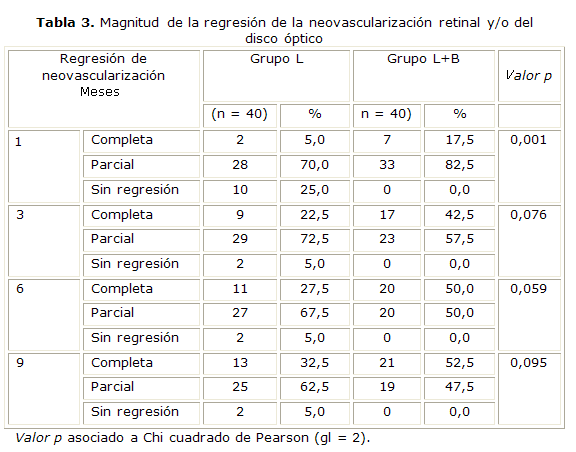
Hubo regresión completa de la neovascularización retinal y/o del disco óptico tras la FPR (grupo L) en el 5 % de los pacientes al mes de la terapia, en 22,5 % a los tres meses, en 27,5 % a los seis meses y en 32,5 % a los nueve meses. En el Grupo L + B hubo más pacientes con regresión completa tanto al mes de tratamiento como a los tres, seis y nueve meses (17,5, 42,5, 50 y 52,5 %, respectivamente) y no hubo pacientes sin regresión de la neovascularización según la AGF en este grupo (tabla 3).
El análisis de las diferencias absolutas de los promedios de las áreas de difusión (tabla 4) mostró una reducción marcada de las áreas de difusión a favor del tratamiento combinado en el transcurso del primer mes de evolución (intervalo 10). Esta relación se mantuvo al comparar los angiogramas del tercer mes con los pretratamientos (intervalo 3 - 0), así como los del sexto y noveno mes de seguimiento con los iniciales (intervalo 6 - 0 y 9 - 0). Sin embargo, no hubo diferencias significativas entre ambos grupos cuando se comparó con el momento de observación que precedía. No se registraron efectos adversos ni complicaciones inherentes al contraste ni al antiangiogénico.
DISCUSIÓN
Los niveles de VEGF en vítreo y plasma se incrementan marcadamente en pacientes con RDP y decrecen significativamente tras una inyección intravítrea de bevacizumab. El efecto de la droga puede durar desde 4,4 ± 2,2 días hasta 34,8 ± 33,7 días después de la inyección.30
Algunos autores31 han evaluado el efecto de repetidas inyecciones de bevacizumab en pacientes con RDP activa a pesar de la FPR, y han concluido que este tratamiento permite una reducción significativa de los neovasos por un periodo de 2,9 meses como promedio, y que es necesario reinyectar a partir del tercer mes a aquellos pacientes con neovasos persistentes.
Sin embargo, otros avalan que el punto principal para evaluar la efectividad del tratamiento anti-VEGF es la persistencia del efecto del tratamiento al menos por seis meses después de la inyección.32
El bevacizumab aislado o combinado con FPR ha demostrado gran potencial en el tratamiento de diferentes enfermedades oculares que cursan con neovascularización, incluida la RDP.6,8,10,16-18,33,34
La inyección intravítrea de bevacizumab en pacientes con RDP puede ser usada para aclarar hemorragias vítreas, como adyuvante al tratamiento con láser e incluso previo a la vitrectomía en casos con gran actividad neovascular.35,36
Diversos investigadores8,9,16,22,23,37 han estudiado dos grupos de pacientes con condiciones similares a las de nuestro estudio,y han reportado un significativo porcentaje de reducción completa de la difusión tras el tratamiento intravítreo de bevacizumab, lo cual coincide con los resultados obtenidos en nuestra investigación.
Mirshahi y otros19 estudiaron 80 ojos de 40 pacientes con RDP y encontraron que el tratamiento combinado de FPR + Avastin mostró una respuesta más efectiva a las seis semanas de seguimiento por AGF (87,5 % de regresión) que aquellos que recibieron solo láser (25 % de regresión), con recurrencia de la RDP a las 16 semanas cuya causa se debate entre el término del efecto del antiangiogénico o por la persistencia del efecto angiogénico (p.e.: niveles elevados de hemoglobina glicosilada).
Tonello y otros20 estudiaron 30 ojos de 22 pacientes y hallaron que la terapia combinada indujo mayor regresión de la neovascularización en comparación con la FPR aislada en pacientes con RDP de alto riesgo hasta 16 semanas de seguimiento (p = 0,001). Al igual que nosotros, estos investigadores no encuentran diferencias significativas entre ambos grupos con respecto a la edad, sexo, duración, tipo de diabetes y a la agudeza visual mejor corregida. Sin embargo, reportan con mayor frecuencia la aparición de hemorragia subconjuntival (47 %) y sensación de cuerpo extraño (13,5 %) en los pacientes que recibieron la inyección intravítrea.
En contraste, Minella y otros21 reportan regresión en la neovascularización y aclaramiento de la hemorragia vítrea al mes del tratamiento con bevacizumab (p = 0,01) en una serie de 10 pacientes (15 ojos), y muestran un promedio de área de neovasos antes del tratamiento de 10,15 mm2 (DE ± 12,28), que se redujo a 1,15 mm2 (DE ± 1,78) al mes (p = 0,01) y a 1,07 mm2 a los 2 meses (p = 0,05). Señalan los mismos resultados positivos sin la aparición de complicaciones con mantenimiento del efecto a los tres meses y tendencia a la estabilidad de este a los 9 meses.
Erdol y otros36 estudiaron 33 ojos de 24 pacientes con RDP y neovascularización retinal persistente a pesar del tratamiento con láser. Reportaron la resolución completa de la neovascularización después de una dosis de bevacizumab intravítreo en el 78,8 % de los casos al mes, en el 63,6 % a los tres meses, y en el 45,4 % a los seis meses del tratamiento.
López y otros38 evaluaron la eficacia de la triamcinolona y el bevacizumab asociados a la FPR en 60 ojos de 45 pacientes. A los 6 meses de seguimiento encontraron una regresión de la neovascularización de un 27,5 % en el grupo de FPR, mientras que la combinación de láser con inyección intravítrea de triamcinolona y láser con bevacizumab indujo regresión significativamente mayor (74,4 y 76,8 % respectivamente).
Wu y otros39 siguieron durante un año 1 310 ojos inyectados con bevacizumab y confirmaron la seguridad de la droga con escasos efectos adversos locales y sistémicos, lo cual coincide con nuestros resultados.
En sentido general, los resultados de nuestro estudio y el tamaño muestral coinciden con lo planteado por la mayoría de los autores internacionales.8,10,16-23,31,33-39 Esta investigación constituye el primer estudio de este tipo en Cuba.
La mayor limitación del tratamiento anti-VEGF es la recurrencia de la neovascularización en un periodo de dos semanas a tres meses después de la inyección. Pero su combinación con láser en la RDP es beneficiosa, ya que permite una reducción inicial dramática de la neovascularización bajo el efecto del bevacizumab, lo cual se potencia y prolonga en el tiempo por el efecto del láser.
Este tratamiento combinado constituye una alternativa más para los pacientes con RDP y nos sitúa en mejores condiciones para prevenir la ceguera por RD; por tanto, también todas las alteraciones biológicas, psicológicas y sociales que se derivan de esta e incapacitan al paciente.
En conclusión, el uso del bevacizumab intravítreo como coadyuvante del tratamiento con láser está asociado a una mayor y más temprana regresión de la neovascularización activa comparado con los pacientes que reciben solamente FPR en el tratamiento de la RDP con CAAR. También se observa una estabilidad en la regresión de la neovascularización en un período de seguimiento de nueve meses. Se recomienda la ejecución de futuras investigaciones para evaluar el efecto de este tratamiento a mayor plazo.
REFERENCIAS BIBLIOGRÁFICAS
1. Pareja Ríos A, Serrano García MA, Marrero Saavedra MD, et al. Guías de práctica clínica de la SERV: manejo de las complicaciones oculares de la diabetes. Retinopatía diabética y edema macular. Arch Soc Esp Oftalmol. 2009;84(9):429-50.
2. Zhang X, Saaddine JB, Chou CF, Cotch MF, Cheng YJ, Geiss LS, et al. Prevalence of diabetic retinopathy in the United States. JAMA. 2010;304(6):649-56.
3. Crespo N, Padilla JC, González R, Crespo N, Rodríguez M, Hernández JD. Prevalencia de la retinopatía diabética en pacientes del nivel primario de salud. Rev Cubana Med Gen Integr. 2004;20(2):111.
4. Abdallah W, Fawzi AA. Anti-VEGF therapy in proliferative diabetic retinopathy. Int Ophthalmol Clin. 2009;49(2):95-107.
5. Carmeliet P. Mechanisms of angiogenesis and arteriogenesis. Nat Med. 2000;6:389-95.
6. Gunther JB, Altaweel MM. Bevacizumab (Avastin) for the Treatment of Ocular Disease. Surv Ophthalmol. 2009;54:372-400.
7. Adamis AP, Altaweel M, Bressler NM. Macugen Diabetic Retinopathy Study Group. Changes in retinal neovascularization after pegaptanib (Macugen) therapy in diabetic individuals. Ophthalmology 2006;113:238.
8. Jorge R, Costa RA, Calucci D, Cintra LP, Scott IU. Intravitreal bevacizumab (Avastin) for persistent new vessels in diabetic retinopathy (IBEPE study). Retina. 2006;26(9):1006-13.
9. Avery RL, Pearlman J, Pieramici DJ. Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy. Ophthalmology. 2006;113(10):16-95.
10. Avery RL. Regression of retinal and iris neovascularization after intravitreal bevacizumab (Avastin) treatment. Retina. 2006;26:352-4.
11. Wu L. Bevacizumab Intravítreo (Avastin®). En: Retinopatía Diabética: Resultados del Grupo Panamericano de Estudio Colaborativo de Retina (PACORES). Vision Pan-America. The Pan-American Journal of Ophthalmology. 2012;11(3):709.
12. Shahr J, Avery RL, Heilweil G, Barak A, Zemel E, Lewis GP, et al. Electrophysiologic and retinal penetration studies following intravitreal injection of bevacizumab (Avastin). Retina. 2006;26:262-9.
13. Han XX, Guo CM, Li Y, Hui YN. Effects of bevacizumab on the neovascular membrane of proliferative diabetic retinopathy: reduction of endothelial cells and expressions of VEGF and HIF-1a. Mol Vis. 2012;18:19.
14. Chung EJ, Kang SJ, Koo JS, Choi YJ, Grossniklaus HE, Koh HJ.Effect of intravitreal bevacizumab on vascular endothelial growth factor expression in patients with proliferative diabetic retinopathy. Yonsei Med J. 2011;52(1):151-7.
15. Jeon S, Lee WK. Intravitreal bevacizumab increases intraocular interleukin-6 levels at 1 day after injection in patients with proliferative diabetic retinopathy. Cytokine. 2012;60(2):535-9.
16. Shin YW, Lee YJ, Lee BR, Cho HY. Effects of an Intravitreal Bevacizumab Injection Combined With Panretinal Photocoagulation on High-Risk Proliferative Diabetic Retinopathy. Korean J Ophthalmol. 2009;23:266-72.
17. Isaacs TW, Barry C. Rapid resolution of severe disc new vessels in proliferative diabetic retinopathy following a single intravitreal injection of bevacizumab (Avastin). Clin Experiment Ophthalmol. 2006;34(8):802-3.
18. Bakri SJ, Donaldson MJ, Link TP. Rapid regression of disc neovascularization in a patient with proliferative diabetic retinopathy following adjunctive intravitreal bevacizumab. Eye. 2006;20(12):1474-5.
19. Mirshahi A, Roohipoor R, Lashay A, Mohammadi SF, Abdoallahi A, Faghihi H. Bevacizumab-augmented retinal laser photocoagulation in proliferative diabetic retinopathy: A randomized double-masked clinical trial. Eur J Ophthalmol. 2008;18(2):263-9.
20. Tonello M, Costa RA, Almeida FP, Barbosa JC, Scott IU, Jorge R. Panretinal photocoagulation versus PRP plus intravitreal bevacizumab for high-risk proliferative diabetic retinopathy (IBeHi study). Acta Ophthalmol. 2008;86(4):385-9.
21. Minnella AM, Savastano CM, Ziccardi L, Scupola A, Falsini B, et al. Intravitreal bevacizumab (Avastin) in proliferative diabetic retinopathy. Acta Ophthalmol. 2008;86(6):683-7.
22. Arévalo JF, Wu L, Sánchez JG, Maia M, Saravia MJ, Fernández CF, et al. Intravitreal bevacizumab (Avastin) for proliferative diabetic retinopathy: 6-months follow-up. Eye. 2009;23(1):117-23.
23. Mason JO, Nixon PA, White MF. Intravitreal injection of bevacizumab (Avastin) as adjunctive treatment of proliferative diabetic retinopathy. Am J Ophthalmol. 2006;142(4):685-8.
24. Randomized comparison of krypton vs. argon scatter photocoagulation for diabetic disc neovascularization: the Intravitreal bevacizumab (Avastin) for proliferative diabetic retinopathy krypton argon regression neovascularization study report number 1. Ophthalmology. 1993;100:1655-64.
25. Early Treatment Diabetic Retinopathy Study Research Group. Fundus photographic risk factors for progression of diabetic retinopathy. ETDRS report number 12. Ophthalmology. 1991;98:823-33.
26. Vander JF, Duker JS, Benson WE, Brown GC, McNamara JA, Rosenstein RB. Long term stability and visual outcome after favorable initial response of proliferative diabetic retinopathy to panretinal photocoagulation. Ophthalmology. 1991;98(10):157-59.
27. Shimura M, Yasuda K, Nakazawa T, Kano T, Ohta S, Tamai M. Quantifying alterations of macular thickness before and after panretinal photocoagulation in patients with severe diabetic retinopathy and good vision. Ophthalmology. 2003;110:2386-94.
28. Brucker AJ, Qin H, Antoszyk AN, Beck RW, Bressler NM, Browning DJ, et al. Observational study of the development of diabetic macular edema following panretinal (scatter) photocoagulation given in 1 or 4 sittings. Arch Ophthalmol. 2009;127(2):132-40.
29. Grading diabetic retinopathy from stereoscopic color fundus photographs- an extension of the modified Airlie House classification. ETDRS Report No. 10. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991;98(5 Suppl):786-806.
30. Ma Y, Zhang Y, Zhao T, Jiang YR. Vascular Endothelial Growth Factor in Plasma and Vitreous Fluid of Patients with Proliferative Diabetic Retinopathy Patients after Intravitreal Injection of Bevacizumab. Am J Ophthalmol. 2012;153(2):307-313.
31. Schmidinger G, Maar N, Bolz M, Scholda C, Schmidt-Erfurth U. Repeated intravitreal bevacizumab (Avastin) treatment of persistent new vessels in proliferative diabetic retinopathy after complete panretinal photocoagulation. Acta Ophthalmol. 2011;89:76-81.
32. Tremolada G, Del Turco C, Lattanzio R, Maestroni S, Maestroni A, Bandello F, et al. The Role of Angiogenesis in the Development of Proliferative Diabetic Retinopathy: Impact of Intravitreal Anti-VEGF Treatment. Exp Diabetes Res. 2012.
33. Cho WB, Moon JW, Kim HC. Intravitreal triamcinolone and bevacizumab as adjunctive treatments to panretinal photocoagulation in diabetic retinopathy. Br J Ophthalmol. 2010;94(7):858-63.
34. Cho WB, Oh SB, Moon JW, Kim HC. Panretinal photocoagulation combined with intravitreal bevacizumab in high-risk proliferative diabetic retinopathy. Retina. 2009;29(4):516-22.
35. Arévalo JF, Sánchez JG, Lasave AF, Wu L, Maia M, Bonafonte S, et al. Intravitreal Bevacizumab (Avastin) for Diabetic Retinopathy: The 2010 GLADAOF Lecture. J Ophthalmol [Internet]. 2011 [citado 26 de diciembre de 2013]. Disponible en: http://dx.doi.org/10.1155/2011/584238
36. Erdol H, Turk A, Akyol N, Imamoglu HI. The results of intravitreal bevacizumab injections for persistent neovascularizations in proliferative diabetic retinopathy after photocoagulation therapy. Retina. 2010;30(4):570-7.
37. Moradian S, Ahmadieh H, Malihi M, Soheilian M, Dehghan MH, Azarmina M. Intravitreal bevacizumab in active progressive proliferative diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol. 2008;246(12):1699-705.
38. López-López F, Gómez-Ulla F, Rodríguez-Cid MJ, Arias L. Triamcinolone and Bevacizumab as Adjunctive Therapies to Panretinal Photocoagulation for Proliferative Diabetic Retinopathy. ISRN Ophthalmology. 2012:267-643.
39. Wu L, Martínez Castellanos MA, Quiroz-Mercado H, Arévalo JF, Berrocal MH, Farah ME, et al. Twelve-month safety of intravitreal injections of bevacizumab (Avastin): results of the Pan-American Collaborative Retina Study Group (PACORES). Graefes Arch Clin Exp Ophthalmol. 2008;246(1):81-7.
Recibido: 12 de octubre de 2013.
Aprobado: 20 de octubre de 2013.
Dra. Arianna Hernández Pérez. Instituto Cubano de Oftalmología «Ramón Pando Ferrer». Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: ariannahdez@yahoo.es