Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol vol.28 no.1 Ciudad de la Habana ene.-mar. 2015
INVESTIGACIÓN
Inyección intravítrea de bevacizumab vs. acetato de triamcinolona en el edema macular secundario a oclusión de rama venosa retiniana
Intravitreal bevacizumab vs. triamcinolone acetonide injection to treat macular edema secondary to branch retinal vein occlusion
Dra. Caridad Chiang Rodríguez,I Dr. Raúl Rúa Martínez,I Dr. Silvio Llanes Domínguez,II Dra. Yusimik Toledo González,III Dra. Suzel Lapido Polanco,I Dr. Waldemar Baldoquín RodríguezIV
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Hospital Clínico Quirúrgico "General Calixto García". La Habana, Cuba.
III Policlínico Docente "Eduardo Díaz Ortega". La Habana, Cuba.
IV Servicios Médicos de Cuba. La Habana, Cuba.
RESUMEN
Objetivo: comparar los resultados del tratamiento intravítreo de bevacizumab y de acetato de triamcinolona en el edema macular secundario ante la oclusión de rama venosa retiniana.
Métodos: estudio prospectivo, intervencional, aleatorio y comparativo realizado en 34 pacientes. El grupo 1 (16 pacientes) con inyección intravítrea de acetato de triamcinolona y el grupo 2 (18 pacientes) con inyección de bevacizumab hasta completar 3 dosis en cada grupo, seguida la tercera dosis de grid macular. La dosis inicial fue a los 3 meses de la afección, y la evaluación final a los 12 meses. Se evaluó la agudeza visual mejor corregida (Snellen), grosor macular y complicaciones.
Resultados: en el grupo 1 la mejor agudeza visual con corrección evolucionó de 0,29 (0,05-0,5) a 0,64 (0,05-1,0); en el grupo 2 de 0,24 (0,05-0,5) a 0,66 (0,11,0). El grosor macular en el grupo 1, de 551,3 (346-967) micras, mejoró a 204,06 (112-449) micras; en el grupo 2, de 546,2 (283-1020) micras, hasta un grosor retinal foveal de 181,05 (112-312) micras. Como complicaciones, en el grupo 1 hubo un incremento de la tensión ocular en el 25,0 % de los pacientes y una progresión de catarata en el 12,5 %.
Conclusiones: el tratamiento de inyección intravítrea de bevacizumab en el edema macular secundario a oclusiones venosas de rama retiniana muestra mejor resultado que el de acetato de triamcinolona. También son menores las complicaciones asociadas al bevacizumab.
Palabras clave: anti- VEGF, retina, bevacizumab, avastin, triamcinolona.
ABSTRACT
Objective: to compare the results of the intravitreal treatment with bevacizumab and with triamcinolone acetonide in the macular edema secondary to branch retinal vein occlusion.
Methods: a prospective, interventional, random and comparative study was carried out in 34 patients. The first group (16 patients) received intravitreal triamcinolone acetonide injection whereas the second group (18 patients) had bevacizumab injection up to completing three doses in each group, followed by a third dose of macular grid. The initial dose was applied three months after the occurrence of edema and the final evaluation was made 12 months afterwards. Best corrected visual acuity (Snellen's chart), the macular thickness and complications were assessed.
Results: in the first group, the best corrected visual acuity increased from 0,29 (0,05-05) to 0,64 (0,05-1,0) whereas in the second group it went from 0,24 (0,05-05) to 0,66 (0,1-1,0).The macular thickness of 551,3 (346-967) microns of the first group improved when reaching 204,06 (112-449) microns and that of the second group went from 546,2 (283-1020) microns to 181,05 (112-312) microns. As to the complications, 25 % of patients of the first group experienced eye hypertension, and 12,5 % of patients in the same group had cataract progression.
Conclusions: intravitreal bevacizumab injection treatment of the macular edema secondary to branch retinal vein occlusion was better than that based on triamcinolone acetonide injection. The complications associated to bevacizumab treatment were fewer.
Key words: anti-VEGF, retina, bevacizumab, avastin, triamcinolone.
INTRODUCCIÓN
La obstrucción venosa retinal (OVR) constituye la segunda causa más frecuente de enfermedad vascular retinal, después de la retinopatía diabética. Ocupa un lugar significativo como causa de pérdida visual, secundaria principalmente al edema macular desencadenado por el fenómeno vascular.1-4
Estudios poblacionales recientes han reportado un promedio de 16,4 millones de personas afectadas con OVR a nivel mundial; de ellas, el 1,6 % son mayores de 40 años, con una prevalencia de obstrucción venosa de rama retinal (OVRR) de 4,42 x 1 000 personas (3,65-5,19) contra el 0,80 x 1 000 personas (0,61-0,99) con obstrucción de vena central de la retina (OVCR); es decir, 13,9 con OVRR contra 2,5 millones de OVCR.5-9
En 1877 Leber reportó el primer caso de OVRR. Se subdivide en su forma isquémica y no isquémica. En el 95 % de los casos la oclusión ocurre en un cruce arteriovenoso y en el 66 % este cruce se ubica en el cuadrante temporal superior.10 Al analizar su patogénesis, debemos mencionar los mecanismos primarios que desencadenan este fenómeno obstructivo:6,11-13
I. Compresión de la vena en el cruce arteriovenoso (reportada desde 1928 por Koyanagi): Arteria y vena comparten una vaina adventicia común.
IV. Cuadro inflamatorio (alteración de la regulación de VEGF).
A pesar de que su historia natural evoluciona hacia un 50-60 % de pacientes con resolución espontánea y agudeza visual de 20/40 o más, debemos tener en cuenta ese otro 40-50 % desencadenante de mal pronóstico visual, propiciado fundamentalmente por el edema macular (EM) secundario a la enfermedad obstructiva vascular, presente en un 60 % de los casos, y por las hemorragias vítreas secundarias a neovascularización en un 25 %. En dependencia del sitio y grado de oclusión vascular, de la integridad de la perfusión arteriolar en el sector afectado y la eficiencia del desarrollo de circulación colateral, será mayor o menor el daño de la hipoxia retinal, con su consecuente cascada de fenómenos vasculares, que van a propiciar el desarrollo y progresión del EM vasogénico en la OVRR.11
Como modalidad de tratamiento para la resolución del EM secundario a las OVRR, la terapia con grid macular ha sido por décadas el tratamiento de elección,4,6,8,11-14 pero por los efectos secundarios que pueden aparecer luego de dicho proceder terapéutico, por primera vez, después de 1990, las modalidades de tratamiento para el EM secundario a las OVRR se han expandido, y han evaluado los beneficios y resultados alentadores para su recuperación anatómica y funcional de otras modalidades terapéuticas.11,14-16 Entre estas modalidades terapéuticas se encuentran:
- La inyección intravítrea de esteroides (SCORE).17- Los implantes liberadores de agentes esteroideos activos (Ozurdex, Allergan, Inc. Aprobado por la FDA en junio del 2009, para el tratamiento del edema macular secundario a la OVRR u OVCR).18,19
- El rol de los anti-VEGF (BRVO/CRUISE/RAVE.7,20-22
De lo anterior se desprende que, hasta el momento, para el tratamiento del edema macular secundario a las OVRR, la terapia de primera línea continúa siendo la fotocoagulación grid macular, y de segunda línea la terapia medicamentosa con esteroides y/o antiangiogénicos (anti-VEGF). La FDA aprobó la combinación de estrategias de terapia para dicha complicación vascular.11,15 Las combinaciones terapéuticas aprobadas son:
- Inmediata inyección de una o varias dosis de ranibizumab, seguidas de grid macular, cuando se aclaran las hemorragias.
- Inyección del implante de dexametazona seguida de grid macular.
- Combinación de inyección de anti-VEF e implante de dexametazona con/sin grid macular.
Múltiples son los estudios que han evaluado de forma comparativa las diferentes modalidades terapéuticas para identificar cuál provoca una evidente mejoría de la agudeza visual y del grosor retinal foveal (GRF), y que su beneficio y eficacia sea estadísticamente significativo. Entre ellos se encuentran los subdivididos en 2 subgrupos, uno que evidencia mejoría en las diferentes modalidades evaluadas, IVA vs. acetato de triamcinolona (IVTA) vs. intravítrea de bevacizumab (IVA) + IVTA; pero solo estadísticamente significativo en el grupo de IVA.5,23,24) Otro grupo de investigaciones demuestra una evidente mejoría, estadísticamente significativa, tanto de la mejor agudeza visual corregida (MAVC) como del grosor retinal foveal, pero solamente del grupo de IVA.25-31 Todos coinciden en el corto período de efectividad y en la alta recurrencia y necesidad de retratamientos.
Se realiza el estudio para comparar los resultados del tratamiento intravítreo de acetato de triamcinolona vs. bevacizumab en el edema macular secundario a oclusión de rama venosa retiniana en nuestros pacientes. Se evaluó la recuperación funcional del paciente, la recuperación anatómica de la afección macular y se identificó la aparición de efectos adversos y las complicaciones.
MÉTODOS
Estudio prospectivo, intervencional, comparativo, que incluyó inicialmente a n= 40 pacientes con edema macular secundario a OVRR, a quienes se les ofreció ser incluidos de forma aleatoria en dos diferentes subgrupos de modalidad terapéutica (IVTA vs. IVA). Los pacientes fueron seleccionados en Cuerpo de Guardia y en la consulta especializada de Retina Vítreo del Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Los criterios de inclusión consistían en el deseo manifiesto del paciente de participar en el estudio, la historia confirmada de OVRR (clínica, OCT y/o AGF), tiempo de un año o menos de iniciado los síntomas, edad de 18 años o más y tensión ocular inferior a 21 mmHg. Los de exclusión fueron patología retiniana concomitante que comprometiera la visión del paciente, patología ocular que impidiera la visualización del fondo de ojo y como consecuencia un diagnóstico temprano de la patología en estudio, tratamiento con esteroides orales menor de 4 meses, tratamiento previo con intravítrea de acetato de triamcinolona, tratamiento previo con subtenoneana de esteroides menor de 6 meses, tratamiento previo de grid macular, vitrectomía pars plana previa, panfotocoagulación menor de 4 meses, tratamiento con Nd yag láser menor de dos meses, pacientes cuya condición física y/o mental imposibilitara la correcta y completa evaluación.
Se evaluaron en una primera consulta de diagnóstico la mejor agudeza visual corregida (MAVC) con cartilla de Snellen, la tensión ocular (TO) con tonómetro de aplanación de la TOPCON, el examen de anexos oculares, el segmento anterior y medio en lámpara de hendidura, la exploración del fondo de ojo con lente de no contacto de segmento posterior de +78 dp y el oftalmoscopio indirecto. Además, se les realizó tomografía de coherencia óptica (OCT-TOPCON). Se citaron para la semana 12 de iniciado el evento vascular para, tras similar examen oftalmológico, además de la angiografía fluoresceínica (AGF), evaluar las características del EM, el grado de perfusión de los capilares retinales (fundamentalmente foveales) y decidir el proceder para el EM.
La terapia se les realizó a todos en la Unidad Quirúrgica, previa asepsia y antisepsia según protocolo de intravítreas, dosis de 4 mg-0,1 cc de IVTA vs. dosis de 1,25 mg-0,1 cc de IVA, con dosis de antibioticoterapia ocular a partir de las 3 h del tratamiento, cada 3 h y durante 7 días. Todos fueron evaluados en las primeras 24 h: estado del segmento anterior y la presión ocular. Se citaron cada 4 semanas y se les repitió examen inicial. Si no había mejoría evidente del cuadro oftalmológico o regresión de este pasadas 6 semanas de la terapia anterior, se aplicó retratamiento en caso de caída de la MAVC con un incremento del GRF a más de 250 micras, en correspondencia con la presencia del fluido intra-retinal o sub-retinal. Así se colocó un segundo y tercer retratamiento, de ser necesarios, combinada la 3ra. dosis con fotocoagulación grid macular a la semana de la última dosis. En los casos en los que existió una regresión importante de las variables estudiadas (fundamentalmente la MAVC) se decidió repetir AGF para evaluar perfusión capilar/isquemia retinal. El total de los pacientes fueron evaluados durante 12 meses de seguimiento.
RESULTADOS
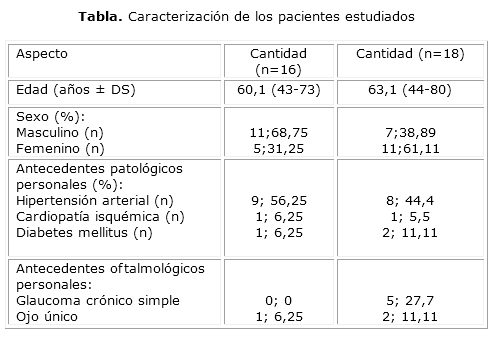
Fueron incluidos un total de 34 ojos de 34 pacientes, subdivididos en 2 subgrupos: subgrupo 1 (IVTA) y subgrupo 2 (IVA) con EM secundario a OVRR. El principal período de tiempo de inicio del tratamiento, desde el comienzo de los síntomas, fue de 3,3 (3-6) meses en el grupo IVTA y de 4,1 (3-10) meses en el de IVA (tabla).
En el grupo de IVTA: 8/16 requirieron una dosis única de IVTA (50 %); 5/16 con dos dosis (31,25 %) y 3/16 con 3 dosis (18,75 %) + fotocoagulación grid macular. El promedio de IVTA por ojo fue de 1,6. En el grupo de IVA: 7/18 requirieron una dosis única de IVA (38,88 %); 6/18 con 2 (33,33 %) y 5/18 con 3 (27,77 %) + fotocoagulación grid macular. El promedio de IVA por ojo fue de 1,8.
En el grupo de IVTA la MAVC inicial fue de 0,29 (0,05-0,5), con una mejoría evidente de 0,64 (0,05-1,0) a los 12 meses de seguimiento (p< 0,005), una ganancia de 15 letras o más en un 62,5 % de los pacientes a los 6 y 12 meses de seguimiento. Un promedio de 14,06 y 16,25 letras ganadas a los 6 y 12 meses, respectivamente. Hubo pérdidas de más de 15 letras de visión en 2 pacientes en todo el período, para un 12,5 %. La MAVC inicial en el grupo de IVA fue de 0,24 (0,05-0,5) con un incremento a 0,66 (0,1-1,0) a los 12 meses (p< 0,005), una ganancia de 15 letras o más en 66,66 % de los pacientes a los 6 y de 77,77 % a los 12 meses, con un promedio de 20 y 22,2 letras ganadas a los 6 y 12 meses, respectivamente. No hubo pérdidas de más de 15 letras de visión en todo el período (Fig.).
En el grupo de IVTA el GRF inicial medido por OCT fue de 551,3 (346-967) micras hasta un GRF de 204,06 (112-449) micras, a los 12 meses de seguimiento. Se presentó una reducción de 200 micras o más en un 75 y 81,25 % de los pacientes a los 6 y 12 meses respectivamente, con un incremento de 200 micras o más en un paciente, que representa el 6,25 %. En el grupo de IVA el GRF inicial medido por OCT fue de 546,2 (283-1020) micras hasta un GRF de 181,05 (112-312) micras, al final. Reducción de 200 micras o más en 94,4 y 88,8 % de los pacientes a los 6 y 12 meses respectivamente. No existió un incremento de 200 micras o más en ningún paciente.
Hubo complicaciones asociadas al tratamiento. En el grupo de triamcinolona: 4 pacientes evolucionaron con hipertensión ocular (25 %), 2 con progresión de catarata (12,5 %) y 3 con edema macular (18,7 %). En el avastin, 5 pacientes evolucionaron con edema macular (27,7 %).
DISCUSIÓN
El edema macular es una causa frecuente de disminución de la agudeza visual en OVRR, resultado del aumento de la presión hidrostática y del incremento de la permeabilidad vascular derivada de la producción de mediadores químicos por parte de la retina isquémica. Dentro de estos mediadores se destaca el Vascular Endothelial Growth Factor (VEGF), proteína relacionada con la angiogénesis, la vasodilatación y el aumento de la permeabilidad vascular.32
A pesar de los variados tratamientos y múltiples series de casos estudiados hasta el momento, el tratamiento de fotocoagulación standard con grid macular ha logrado una destacada disminución del edema macular y estabilización de la agudeza visual en la mayoría de los pacientes, aunque limitada, pues solo es eficaz en el edema macular no isquémico y puede asociarse con variadas complicaciones como la fibrosis submacular, el deterioro de la sensibilidad del campo visual, el agrandamiento del spot del láser y la neovascularización coroidea.33
Estas limitaciones adversas de la terapia con fotocoagulación grid macular han llevado a la búsqueda de nuevas opciones terapéuticas. Desde la década de 1990 las modalidades de tratamiento para el EM secundario a las OVRR no habían recibido tal impacto de revisión y evaluación como lo ha sido desde el 2009, en que variados estudios han demostrado la utilidad de las terapias farmacológicas: inyección intravítrea de triamcinolona acetónida y agentes anti factor del crecimiento vascular endotelial (anti-VEGF) como bevacizumab y ranibizumab.4,6,8,34
La FDA ha aprobado la combinación de estrategias de terapia en la OVRR: inmediata inyección de una o varias dosis de ranibizumab seguidas de grid macular, cuando se aclaran las hemorragias; inyección del implante de dexametazona seguida de grid macular y combinación de inyección de anti-VEF e implante de dexametazona con o sin grid macular.11,15
Los corticosteroides tienen propiedades antiangiogénicas, antiedematosas, neuroprotectoras, antinflamatorias, reguladoras del estrés oxidativo y de la apoptosis.26,35 El uso de esteroides intraoculares (intravítreas o implantes biodegradables) altera en un 5 % la expresión de los genes retinales, alrededor de una semana postratamiento, con dosis de TA de 1 mg/mL o de dexametazona implante de 0,1mg/mL; pero determinados genes son los únicos que modifican sus efectos reguladores sobre la inflamación, la angiogénesis, la apoptosis, la neuroprotección o la vía del estrés oxidativo. Estas vías de expresión génica son afectadas extensamente después que los esteroides son metabolizados intraocularmente, con lo que se logra quizás un balance de la homeostasis tisular.36,37
Su utilidad en el tratamiento del edema macular secundario a OVRR fue investigado en el estudio Standard Care vs. Corticosteroid for Retinal Occlusion Study (Score Bravo), donde se comparan 3 grupos de pacientes: inyecciones intravítreas mensuales de 1 mg, 4 mg y placebo. A los 12 meses no se presentaron diferencias estadísticamente significativas entre los tres grupos en cuanto a la recuperación anatómica y funcional, y los tres tratamientos fueron mejores que la evolución natural de la enfermedad. Se destacó que el tratamiento standard continúa siendo la fotocoagulación grid macular, que posee un mejor perfil de seguridad y que con dosis de IVTA de 4 mg se presentaron más efectos adversos (catarata e hipertensión ocular).17,38,39
Más recientemente se ha utilizado con éxito la terapia intravítrea anti-VEGF con anticuerpos monoclonales como el bevacizumab (Avastin®), o fragmentos Fab de anticuerpos como el ranibizumab (Lucentis®), agentes que poseen una actividad similar en cuanto a inhibición del VEGF. El estudio Ranibizumab for the treatment of macular edema following Branch Retinal Vein Occlusion (BRAVO) compara el ranibizumab en dosis de 0,3 mg y 0,5 mg vs. placebo. Los grupos con ranibizumab lograron mejorías de la agudeza visual desde el séptimo día y una mejoría de la agudeza visual de tres líneas o más, a los primeros 6 meses, en un 55,2 y 61,1 % respectivamente, versus un 28,8 % en el grupo de tratamiento placebo.40 La IVA se usó por primera vez por Pai y otros como tratamiento para el edema macular relacionado a OVRR.41
La utilización de fármacos, como el acetato de triamcinolona y el bevacizumab, abren una nueva línea terapéutica en enfermedades que presentaban un tratamiento tradicional poco satisfactorio, como el edema macular secundario a OVRR. Nuestros resultados ponen en evidencia los efectos beneficiosos del tratamiento con estos medicamentos, donde se obtiene una mejoría de la agudeza visual y una disminución del grosor macular medido por OCT durante un seguimiento de 12 semanas.
Cekic, Jin y otros mostraron una reducción significativa del grosor macular (p= 0,02, p= 0,02) y mejoría de la agudeza visual (p= 0,02, p= 0,02) un mes después de la inyección intravítrea de triamcinolona y bevacizumab respectivamente. A los 6 meses fue significativa la reducción del grosor macular en ambos grupos; pero solo hubo mejoría significativa de la agudeza visual en el grupo de IVA (p= 0,01), que no coincidió con nuestro estudio, donde se obtuvo una disminución significativa del grosor macular en los dos grupos de tratamiento (p< 0,005), así como de la MAVC en ambos grupos (p< 0,005), que se mantuvo a las 24 y 52 semanas de seguimiento.23,42
Chen y otros hallaron una mejoría significativa del grosor macular en los dos grupos (p< 0,05) a las 4, 8 y 12 semanas después del tratamiento, mientras que la agudeza visual mejoró significativamente en el grupo de IVTA hasta las 8 semanas, y de IVA hasta las 12 semanas. Al comparar los dos grupos no encontraron diferencias significativas en cuanto al grosor macular y la MAVC alcanzados (p> 0,05).27
Al comparar dichos resultados con los nuestros, pudimos observar mejores valores de agudeza visual y grosor retinal foveal en el primer tratamiento a las 12 semanas en el grupo de IVTA. Estos hallazgos se modificaron para el segundo y tercer retratamiento, a partir de las 18 y 24 semanas, con mejoría significativa para el grupo de IVA. En relación con el porcentaje de letras ganadas, en el grupo de IVTA hubo una ganancia de 15 letras o más en el 62,5 % de los pacientes a los 6 y 12 meses de seguimiento. Con respecto a la ganancia, de 15 letras o más en el 66,66 % de los pacientes a los 6 meses, y de 77,77 % a los 12 meses de seguimiento en el grupo de IVA. Aunque en ambos grupos fue significativa la mejoría de las variables estudiadas (MAVC y GRF), los resultados fueron más alentadores con la terapia antiangiogénica con bevacizumab, medido esto por el porcentaje de pacientes que ganaron más de 15 letras de visión y el número de letras ganadas, con menores complicaciones.
Cheng y otros reportaron en su investigación que en el grupo de IVTA la MAVC mejoró significativamente (p< 0,001) durante el período de seguimiento comparado con la inicial, en el que 11 ojos (68,75 %) mostraron una mejoría de dos o más líneas de Snellen. En el grupo de IVA, la MAVC también mejoró significativamente (p< 0,001). En este caso, 12 ojos (92,31 %) mostraron mejoría de la agudeza visual y 1 ojo (7,69 %) permanecía igual durante el período de estudio; 9 ojos (69,23 %) mostraron una mejoría por lo menos de dos o más líneas de Snellen. Sin embargo, la comparación entre los dos grupos con respecto al cambio en la AV no mostró diferencias estadísticamente significativas (p= 0,083). El examen de OCT en el grupo de IVTA demostró la mejoría clínica en el edema macular (p< 0,001) posoperatorio. El grosor macular antes del tratamiento fue de 533,63 ± 163,75; y el último grosor medido fue de 254,00 ± 80,06. En el grupo de IVA, el grosor macular también medido por OCT mostró una disminución significante (p< 0,001). El grosor macular antes del tratamiento fue de 538,85 ± 189,80; y el último grosor medido fue de 222,00 ± 36,38. Sin embargo, los cambios en el grosor macular no se diferenciaron significativamente entre estos dos tratamientos (p= 0,570).31
Los recientes estudios clínicos y experimentales no han mostrado evidencias de toxicidad de la retina por IVTA o IVA. El riesgo de elevación de la presión intraocular (HTO) a corto plazo es la complicación más común reportada por la IVTA. Chen reportó 8 ojos (32 %) con HTO después de la inyección de acetato de triamcinolona. También este autor y otros reportaron 3 pacientes (18,75 %) en el grupo de ITA con HTO posoperatoriamente, quienes fueron controlados con agentes antiglaucomatosos tópicos.31 Después de una inyección intravítrea de anti-VEGF puede aparecer HTO que puede requerir terapia; pero esta se hace persistente cuando las inyecciones son múltiples.43
Se ha informado que los efectos de intravítrea de acetato de triamcinolona o bevacizumab pueden ser temporales y podrían relacionarse con la vida media de los medicamentos en el ojo. Yepremyan y otros demostraron que 8 de 12 ojos con OVRR presentaron recurrencia del edema macular en un promedio de 5,5 meses después de IVTA, e indicaron que su efecto terapéutico persistió durante 5,5 meses.44 La recaída del edema macular a un promedio de 12 semanas después de la IVA también fue demostrado por Jaissle.45 Otros estudios han planteado períodos similares que van desde 2 a 3 meses de recurrencia del edema macular después de la IVA.46 Según los resultados anteriores, coincidiendo con el presente estudio, la IVTA parece persistir mucho más tiempo que la IVA, ya que permite una inhibición más prolongada del VEGF y reduce el número de retratamientos. Otra superioridad del acetato de triamcinolona es su costo relativamente bajo comparado con el bevacizumab.
En nuestra investigación recogimos mayor número de complicaciones en el grupo de IVTA: 2 pacientes con progresión de la catarata que requirieron cirugía; 3 con hipertensión ocular controladas con terapia medicamentosa y 3 con MER. En el grupo de IVA, 5 evolucionaron con MER. Debemos señalar que se detectaron un total de 6 pacientes con maculopatía isquémica por angiografía fluoresceínica, que —aunque presentaron una relativa mejoría de las variables evaluadas— no presentaron ganancia visual de más de 15 letras en correspondencia con los resultados anatómicos favorables que presentaron. Esto se correspondió con las investigaciones revisadas.47-49 Las inyecciones intravítreas de anti-VEGF, de esteroides o de su combinación, previas a la terapia del grid macular, favorece la aplicación de la fotocoagulación; la precisión de los impactos es más eficaz y se requiere de menos intensidad en su aplicación.11 El tratamiento de grid macular continúa siendo la terapia de elección para el EM secundario a las OVRR; pero se ha demostrado en múltiples investigaciones que se es más agresivo combinándolo con esteroides y anti-VEGF.14,39,50En conclusión el tratamiento de inyección intravítrea de bevacizumab en el edema macular secundario a oclusiones venosas de rama retiniana resultó mejor que el de acetato de triamcinolona. También fueron menores las complicaciones asociadas al bevacizumab.
1. Scott IV. Macular edema associated with retinal vein occlusion. Retina Today. 2010:54-5.
2. Rogers SL, McIntosh RL, et al. Natural history of branch retinal vein occlusion: Evidence–based systematic review. Ophthalmology. 2010;117(6):1094-101.
3. Chan A, Leung LS. Critical appraisal of the clinical utility of the dexamethasone intravitreal implant (Ozurdex) for the treatment of macular edema related to branch retinal vein occlusion or central retinal vein occlusion. Clin Ophthalmol. 2011;5:1043-9.
4. Shak GK. Treatment of Retinal Vein Occlusion. Individualized therapy is crucial to good patient outcomes. Retina Today [revista en Internet]. 2012 [cited 2012 abril 23];(3). Available in: http://www.bmctoday.net/retinatoday/2012/03/article.asp?f=treatment-of retinal-vein-occlusion
5. Rogers S, Mepid RL. The prevalence of retinal vein occlusion pooled data from population studies from the United States, Europe, Asia and Australia. Ophthalmology. 2010;117(2):313-9.
6. Haller JA, Brown DM. Evaluating and Integrating New Evidence in the Treatment of RVO. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];(10)Suppl. 1. Available in: http://www.bmctoday.net/retinatoday/2010/10/supplement/article.asp?f=e valuating-and -integrating-new-evidence-in-the-treatment-of-rvo
7. Brown DM. New Directions in RVO Treatment. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];(4) Suppl. 1. Available in: http://www.bmctoday.net/retinatoday/2010 /04/supplement/article.asp?f=new-directions-in-rvo-treatment
8. Ho AC, Ip MS. An Evidence-based Approach for RVO: Corticosteroids, Implants and Anti- VEGF Therapies. Retina Today [revista en Internet]. 2011 [cited 2012 abril 23];(6). Available in: http://www.bmctoday.net/retinatoday/2011/06/supplement/article.asp?f=a n-evidence -based-approach-for-rvocorticosteroids-implants-and-anti-vegftherapies
9. Schutze C, Schmidt-Erfurt U. Imaging for BRVO and CRVO. Retina Today [revista en Internet]. 2011 [cited 2012 abril 23];(6). Available in: http://www.bmctoday.net/retinatoday/2011/06/article.asp?f=imaging-forbrvo-and-crvo
10. Rehak J, Rehak M. Branch retinal vein occlusion: pathogenesis, visual prognosis and treatment modalities. Cur Eye Res. 2008;33(2):111-31.
11. Hariprasad SM. Combination therapy for RVO. Retina Today. 2010:67-76.
12. Boyer DS. The pathophysiology of macular edema. Retina Today [revista en Internet]. 2011 [cited 2012 abril 23];9(Suppl. 1). Available in: http://www.bmctoday.net/retinatoday /2011/09/supplement/article.asp?f=the-pathophysiology-of-macular-edema
13. Hidetaka N. Vitreous inflammatory factors and serous macular detachment in branch retinal vein occlusion. Retina. 2012;32:86-91.
14. Cousins SW, Boyer DS. New and Emerging Treatment Paradigms for Macular Edema in Retinal Vein Occlusions and Diabetic Retinopathy. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];10. Available in: http://www.bmctoday.net/retinatoday/2010/10/supplement/article.asp?f=evaluating-and-integrating-new-evidence-in-thetreatment-of-rvo
15. Holekamp NM, Ip MS. Point Counteroint Early vs Late Pharmacologic Therapy for RVO. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];(8). Available in: http://www.bmctoday.net/retinatoday/2010/08/article.asp?f=pointcounterpointearly-vs-late-pharmacologic-therapy-for-rvo
16. Herrero-Vanrell R, Cardillo JA, Kuppermann BD. Clinical applications of the sustained-release dexamethasone implant for treatment of macular edema. Clin Ophthalmol. 2011;5:139-46.
17. Scott IV, Vanveldhuisen PC. Baseline predictors of visual acuity and retinal thickness outcomes in patients with retinal vein occlusion: standard care versus Corticosteroid for retinal vein occlusion. Study Report 10. Ophthalmology. 2011;118(2):345-52.
18. Haller JA, Bandello F. Randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema du to retinal vein occlusion. Ophthalmology. 2010;117(6):1134-46.
19. Haller JA, Bandello F. Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion, twelve-month study results. Ophthalmology. 2011;118(12):2453-60.
20. Campochiaro PA, Heier JS. Ranibizumab for macular edema following Branch retinal vein occlusion: six month primary end point results of a phase III study. Ophthalmology. 2010;117(6):1102-12.
21. Brown DM. Clinical Implications of the BRVO and CRUISE Trials. Retina Today. 2010:38-40.
22. Kitchens J. Baseline predictors of the number of ranibizumab retreatment injections in the BRAVO study during months. Chicago: poster presented at: American Academy of Ophthalmology Annual Meeting; October 16-19, 2010.
23. Cekic O. A comparison of three different intravitreal treatment modalities of macular edema due to branch retinal vein occlusion. Curr Eye Res. 2010;35(10):925-9.
24. Guthoff R. Comparison of bevacizumab and triamcinolone for treatment of macular edema secondary to branch retinal vein occlusion in a pair-matched analysis. Ophthalmologica. 2010;224(5):319-24.
25. Byun YJ. Intravitreal triamcinolone acetonide versus bevacizumab therapy for macular edema associated with branch retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2010;248(7):63-71.
26. Yasushi S. Early change of central macular Thickness after intravitreous triamcinolone or bevacizumab in diabetic macular edema or retinal vein occlusion. Retina. 2011;31:290-7.
27. Chen CH. Treatment of branch retinal vein occlusion induced macular edema in treatment-naive cases with a single intravitreal triamcinolone or bevacizumab injection. Chang Gung Med J. 2010;33(4):424-35.
28. Kelkar AS. Comparison of single injection of intravitreal triamcinolone versus single injection of intravitreal bevacizumab in macular edema secondary to branch retinal vein occlusion with regard to chances in best correct visual acuity and central macular thickness in the short term. Ind J Ophthalmol. 2009;57(3):243-44.
29. Kim JY. Comparison between intravitreal bevacizumab and triamcinolone for macular edema secondary to branch retinal vein occlusion. Kor J Ophthalmol. 2009;23(4):259-65.
30. Hou J. Intravitral bevacizumab versus triamcinolone acetonide for macular edema due to branch retinal vein occlusion: a matched study. Chin Med J. 2009;122(22):2695-9.
31. Chen KC. Intravitreal triamcinolone acetonide vs. bevacizumab for treatment of macular edema secondary to branch retinal vein occlusion. Eye. 2009;23:2023-33.
32. Lutz HA, Martínez RP. Oclusiones venosas retinales. Rev Méd Clínica Las Condes. 2010;21(6)961-5.
33. Battaglia Parodi M, Saviano S, Ravalico G. Grid laser treatment in macular branch retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 1999;237:1024-7.
34. Gallemare RP, Wallsh J. Management of retinal vein occlusion: what the clinical trials tell us. Retina Today. 2013:64-67.
35. Wu L, Evans T. Brach Retinal Vein Occlusion: Treatment and Medication. MEDSCAPE Articles; Feb 19, 2010.
36. Morse LS, Modjjtahedi S. Use of Intravitreal Steroids in the Clinic. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];(6)Suppl. 1. Available in: http://www.bmctoday.net/retinatoday/2010/06/supplement/article.asp?f=u se-of-intravitreal-steroids-in-the-clinic
37. Oakley RH, Cidlowski JA. Evolving Science: The Pharmacology of Steroids. Retina Today [revista en Internet]. 2010 [cited 2012 abril 23];(5)Suppl. 1. Available in: http://www.bmctoday.net/retinatoday/2010/06/supplement/
38. The SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular edema secondary to branch retinal vein occlusion: the Standard Care vs. Corticosteroid for Retinal Vein Occlusion (SCORE) Study Report 6. Arch Ophthalmol. 2009;127(9):1115-28.
39. Benson WB. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular edema secondary to branch retinal vein occlusion. Evidence-Based Ophthalmology. 2010;11(1):22-3.
40. Campochiaro PA, Hafiz G, Shah SM, Nguyen QD, Ying H, Do DV, et al. Ranibizumab for macular edema due to retinal vein occlusions: implication of VEGF as a critical stimulator. Mol Ther. 2008;16(4):791-9.
41. Pai SA, Shetty R, Vijayan PB, Venkatasubramaniam G, Yadav NK, Shetty BK, et al. Clinical, anatomic, and electrophysiologic evaluation following intravitreal bevacizumab for macular edema in retinal vein occlusion. Am J Ophthalmol. 2007;143(4):601-6.
42. Kim JY, Park SP. Comparison Between Intravitreal Bevacizumab and Triamcinolone for Macular Edema Secondary to Branch Retinal Vein Occlusion. Korean J Ophthalmol. 2009;23(4):259-65.
43. Adelman RA, Zheng Q, Mayer HR. Persistent ocular hypertension following intravitreal bevacizumab and ranibizumab injections. J Ocul Pharmacol Ther. 2010 Feb;26(1):105-10.
44. Yepremyan M, Wertz FD, Tivnan T, Eversman L, Marx JL. Early treatment of cystoid macular edema secondary to branch retinal vein occlusion with intravitreal triamcinolone acetonide. Ophthalmic Surg Lasers Imag. 2005;36(1):30-6.
45. Jaissle GB, Leitritz M, Gelisken F, Ziemssen F, Bartz-Schmidt KU, Szurman P. Oneyear results after intravitreal bevacizumab therapy for macular edema secondary to branch retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2009;247(1):27-33.
46. Rabena MD, Pieramici DJ, Castellarin AA, Nasir MA, Avery RL. Intravitreal bevacizumab (Avastin) in the treatment of macular edema secondary to branch retinal vein occlusion. Retina. 2007;27(4):419-25.
47. Hayreh SS. Hemicentral retinal vein occlusion: Natural history of visual outcome. Retina. 2012;32(1):68-76.
48. Noma H. Influence of ischemia on visual function in patients with branch retinal vein occlusion and macular edema. Clin Ophthalmol. 2011;5:679-85.
49. Jaulim A, Badia A. Branch retinal vein occlusion: epidemiology, pathogenesis, risk factors, clinical features, diagnosis and complications. An Update of the Literature. Retina; 2013;13(5):901-10.
50. Shukla D, Behera UC. Serous macular detachment as a predictor of resolution of macular edema with intravitreal triamcinolone injection. Ophthalmic Surg Lasers Imaging. 2009;40:115-9.
Recibido: 2 de diciembre de 2014.
Aprobado: 3 de enero de 2015.
Dra. Caridad Chiang Rodríguez. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: chiang@infomed.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons