INTRODUCCIÓN
A pesar de las diferentes técnicas quirúrgicas utilizadas para la cirugía de glaucomas pediátricos, hay un porcentaje de estos niños que no logran el éxito quirúrgico y serán ciegos legales para toda la vida, con las implicaciones económicas, sociales y psicológicas que eso provoca a los pacientes y familiares.
Una opción en el manejo de este tipo de pacientes son los dispositivos de drenaje de glaucoma (DDG), que generalmente se utilizan en glaucomas refractarios a tratamientos convencionales, pero que en estos momentos muchos autores lo utilizan también como técnica quirúrgica de primera elección en el tratamiento de pacientes con alto riesgo de fracaso quirúrgico, con las estrategias más convencionales de manejo de estos.
En el Instituto Cubano de Oftalmología “Ramón Pando Ferrer” se atienden varios niños con glaucoma pediátrico refractario, quienes pueden beneficiarse de este proceder, el cual se realiza por primera vez en la población pediátrica en el país, por lo que nos propusimos en este estudio determinar los resultados del implante dispositivo de glaucoma de Ahmed en pacientes con glaucoma pediátrico refractario.
MÉTODOS
Se realizó un estudio longitudinal, prospectivo, de una serie de casos con glaucoma pediátrico refractario, quienes acudieron a la consulta del Servicio de Oftalmología Pediátrica del Instituto Cubano de Oftalmología “Ramón Pando Ferrer” en el periodo comprendido entre enero de 2011 a enero de 2016, y cumplían con los criterios de selección para el implante de válvula de Ahmed.
Los criterios de inclusión consistieron en una, dos o más cirugías filtrantes, con o sin antimetabolito; ojos con cicatrices conjuntivales graves; pacientes portadores de lente de contacto necesario para la rehabilitación visual; glaucoma uveítico; glaucoma asociado a afaquia o pseudofaquia; glaucoma secundario a queratoplastia penetrante; pacientes con aniridia y glaucoma después de una disrupción traumática del segmento anterior. Se excluyeron del estudio los pacientes con implante valvular previo. Se incluyeron todos los casos que cumplieron con los criterios de selección hasta el final del período señalado previamente, lo que quedó constituido por 17 ojos de 15 pacientes.
Las variables estudiadas fueron: edad por grupo (de 1-4 años, de 5-11 años y de 12 a 18 años); sexo; agudeza visual mejor corregida pre y posoperatoria; tipo de glaucoma; número de cirugías previas; tipo de cirugía de glaucoma; tipo de otras cirugías oculares; localización del implante; presión intraocular pre y posoperatoria; éxito completo; éxito calificado; falla; número de medicamentos posoperatorios; supervivencia con éxito completo y éxito calificado; complicaciones y reintervenciones. Para determinar el éxito o la falla del procedimiento se establecieron los siguientes criterios:
Éxito completo: Presión intraocular ≥ 6 o ≤ 21 mmHg, sin medicamentos, preservando la agudeza visual inicial y sin necesidad de reintervención quirúrgica. En la fase hipertensiva de la válvula (6 primeros meses después de la cirugía) fueron aceptadas presiones hasta 28 mmHg.1,2
Éxito calificado: Presión intraocular ≥ 6 o ≤ 21 mmHg con el uso de medicamentos anti-glaucoma, preservando la agudeza visual inicial y sin necesidad de reintervención quirúrgica. En la fase hipertensiva de la válvula (6 primeros meses después de la cirugía) fueron aceptadas presiones hasta 28 mmHg más tratamiento antihipertensivo tópico (hasta tres colirios).1,2,3
Falla (evento final para estudio, análisis de supervivencia): Presión intraocular > 21 mmHg (dos tomas consecutivas) con medicamentos (una vez adicionados hasta tres colirios) o pérdida completa de la visión o requerimiento de cirugía de glaucoma adicional o pérdida del ojo o presencia de complicaciones graves, como Ptisis bulbi; hipotonía crónica (dos visitas consecutivas), desprendimiento de retina y endoftalmitis. En el período de la fase hipertensiva de la válvula se consideró falla cuando las presiones sobrepasaron los 28 mmHg con 3 colirios (con medicamentos).1,2
La cirugía siempre fue realizada por un mismo cirujano y a todos los pacientes se les implantó válvula de Ahmed modelo S2 o FP7, según la disponibilidad hospitalaria. Se escogió el sitio de implantación de la válvula de acuerdo con el estado de cicatrización de la conjuntiva y la localización de cirugías previas. Se optó, siempre que fue posible, por los cuadrantes superiores, en especial, el cuadrante temporal superior. En los casos donde no fue posible la utilización de este cuadrante tras las cirugías previas a las que había sido sometido el paciente, se empleó el cuadrante nasal superior o los inferiores, siempre en ese orden.
Se utilizó sutura de tracción 6/0 ácido poliglicólico con aguja espatulada un cuarto de ciclo a través de la mitad del espesor corneal en la zona yuxtalímbica. Posteriormente se realizó colgajo conjuntival base fórnix. La conjuntiva y Tenon se decolaron conjuntamente hasta que se visualizó el área quirúrgica (± 90º, con incisiones relajantes radiales). Los músculos rectos se localizaron en dependencia del cuadrante donde se colocaría el DDG y se comprobó la función valvular con la introducción de una cánula 26-G en el orificio distal del tubo de drenaje, para irrigar 1 mL de solución salina balanceada en el mecanismo valvular.
La fijación se realizó mediante sutura de nylon 10,0 o sutura no reabsorbible, como prolene 6,0 (según la disponibilidad hospitalaria), pasándola a través de los orificios del implante sin emplear la aguja. En el caso de existir vasos epiesclerales prominentes se cauterizó la zona destinada a las suturas. Se fijó el cuerpo valvular a 10 mm del limbo, excepto en los cuadrantes nasales, donde no es prudente superar los 8 mm por una posible compresión del nervio óptico.
De preferencia, se talló un colgajo escleral de 4 mm de ancho por 6 mm de largo y mitad de espesor escleral, a nivel del limbo. Otra opción, que se utilizó fundamentalmente en casos de grave adelgazamiento escleral en ojos buftálmicos poli-intervenidos, fue no realizar colgajo escleral y cubrir el tubo con esclera donante de 1 x 1 cm. Se recortó el tubo para que penetrara en la cámara anterior entre 2 y 3 mm, formando un bisel, ángulo de 30°, que facilitara su inserción y que apuntara hacia el endotelio corneal.
En relación con la penetración en la cámara anterior, a fin de evitar la descompresión brusca se realizó paracentesis previa y se inyectó viscoelástico en la cámara anterior. Luego, se levantó el colgajo escleral, se posicionó la punta de la aguja 23-G e inmediatamente anterior a la unión esclerolimbar se puncionó el limbo, siguiendo un trayecto paralelo al iris, con lentitud, y controlando visualmente, en la medida de lo posible, el avance de la aguja. Seguidamente se introdujo el tubo en la cámara anterior. La inserción vía límbica, mediante paracentesis directa, se realizó en casos de grave adelgazamiento escleral, donde el recubrimiento del tubo es con tejido donante.
Para la sutura del colgajo escleral se emplearon dos puntos de nylon 10,0 en las esquinas posteriores del colgajo escleral. El colgajo conjuntival se cerró con sutura continua, generalmente ácido poliglicólico, doble aguja espatulada, un cuarto de ciclo, 8,0.
El ojo fue ocluido, previa instilación de colirio de antibiótico (ciprofloxacino 0,3 %) y midriático ciclopléjico (atropina 1 %). Se le indicó al padre o tutor desocluir a las 4 horas e iniciar tratamiento con antibiótico, esteroides y midriático ciclopléjico en colirio. A los 15 días se suspendieron el colirio antibiótico y el midriático ciclopléjico, y se disminuyó progresivamente el colirio de esteroides a lo largo del primer mes. Se realizó el seguimiento con la siguiente frecuencia: 24 h, 7 días, 2 meses, 6 meses, 12 meses, 18 meses, 24 meses, y hasta los 36 meses de implantada la válvula.
Para el procesamiento de la información, se creó una base de datos automatizada en Excel 2007. Los datos primarios se procesaron con el programa informático para análisis estadístico SPSS para Window, versión 21. Las variables cualitativas se describieron estadísticamente mediante frecuencias absolutas y cifras porcentuales, mientras que para la descripción del comportamiento de las variables cuantitativas se utilizó la media y la mediana como medidas de tendencia central, y la desviación estándar (DE) y el rango intercuartílico (RI) como medidas de dispersión. La mediana y el RI se utilizaron cuando los datos no se distribuían normalmente.
Para la comparación de frecuencias observadas, de varias categorías de una variable politómica, se empleó la Prueba de Chi cuadrado. La investigación de la asociación entre variables cualitativas nominales y cualitativas ordinales se realizó con la prueba tau de Kendall. En el caso de dos variables nominales de dos categorías se utilizó la prueba de probabilidad exacta de Fisher. Para la comparación de variables cuantitativas independientes, que no seguían una distribución normal, se empleó la prueba no-paramétrica U de Mann- Whitney. Cuando la variable tenía una distribución normal y se deseaba comparar las medias en función de una variable cualitativa dicotómica se empleó la prueba de t de Student. Para determinar la probabilidad de ocurrencia de un evento, en un intervalo de tiempo dado, se empleó el análisis de supervivencia por el método de Kaplan- Meyer. Para la comparación de dos curvas de supervivencia se utilizó la prueba no paramétrica de long-rank. El análisis para saber si la variable se distribuía normalmente se realizó mediante la prueba de Shapiro-Wilk y para evaluar la homogeneidad de las varianzas se utilizó la prueba de Levene. En todos los casos se utilizó un nivel de significación de 0,05 y una confiabilidad del 95 %.
Los procedimientos del análisis estadístico anterior se sustentaron en tablas y gráficos. El estudio se realizó conforme a los principios éticos para la investigación médica en humanos establecidos en la Declaración de Helsinki, enmendada por la 59ª Asamblea General, Seúl, Corea, octubre de 2008, y acogidos por Cuba, además del consentimiento del padre o tutor de participar en la investigación.
RESULTADOS
La mediana de edad de los pacientes estudiados fue 4,0 años (RI: 3,0-11,0); predominó el grupo de edades entre 1-4 años (47,9 %), aunque de modo no significativo (p= 0,113). Los pacientes varones fueron mayoría, quienes representaron el 58,8 % de la muestra. La mayoría de los pacientes presentaban glaucoma congénito primario (52,9 %). Dentro de los glaucomas secundarios (47,1 %), el más frecuente fue el glaucoma pseudofáquico (23,5 %), seguido del glaucoma afáquico (11,8 %) y del uveítico (11,8 %). La media de la presión intraocular (PIO) preoperatoria fue de 37,3 mmHg y la posoperatoria de 19,4 mmHg (p= 0,000).
La mediana del número de cirugías en los pacientes estudiados fue de 2,0 (RI: 2,0-2,0). El tipo de cirugía de glaucoma realizada previamente con más frecuencia fue la trabeculectomía (47,0 %) y de los otros tipos, la extracción de catarata (47,0 %). La localización del DDG más frecuente fue la temporal superior en el 47,0 % de los pacientes y el modelo de dispositivo de glaucoma de Ahmed más usado fue el S2.
En todos los casos los valores de la PIO posoperatoria fueron menores, significativamente, que la PIO preoperatoria (p= 0,000). El menor porcentaje de caída de la PIO fue del 41,8 %, a los 18 meses y el mayor fue a la semana de la operación (79,1 %), como muestra la figura 1.
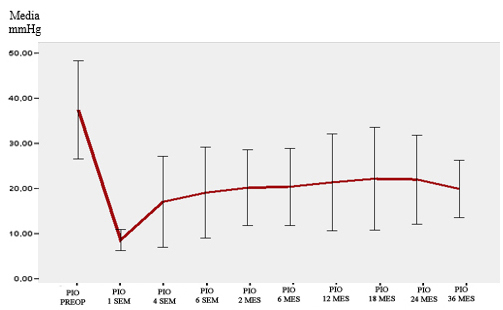 P= 0,000.Barra de error: ± 2 desviación estándar
P= 0,000.Barra de error: ± 2 desviación estándarFig. 1 - Presión intraocular media preoperatoria y posoperatoria en los pacientes estudiados.
Los glaucomas primarios y secundarios no se diferenciaron de modo significativo en cuanto a la PIO preoperatoria (35,4 ± 4,7 mmHg vs. 39,4 ± 6,0 mmHg respectivamente; p= 0,151). Tampoco hubo diferencias significativas en el posoperatorio (Fig. 2), en el que se obtuvo a los 36 meses PIO de 19,2 mmHg y 19,6 mmHg respectivamente; p= 0,807).
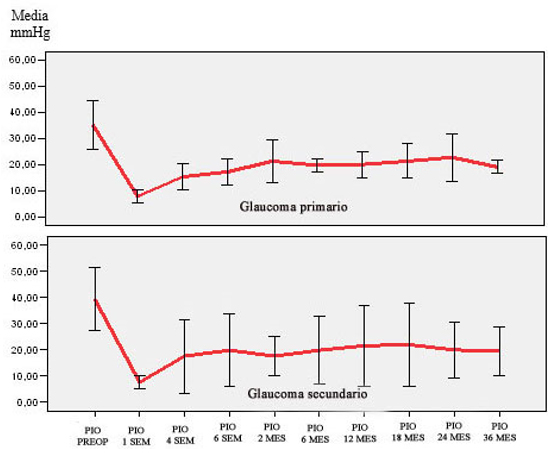 Glaucoma primario: p= 0,151.Glaucoma secundario: P= 0,087.Barra de error: ± 2 desviación estándar
Glaucoma primario: p= 0,151.Glaucoma secundario: P= 0,087.Barra de error: ± 2 desviación estándarFig. 2 Presión intraocular preoperatoria y posoperatoria, según tipo de glaucoma.
La agudeza visual en el posoperatorio de tres años no se modificó respecto a la preoperatoria (p= 0,125). Se mantuvo sin variación en el 73,3 % de los casos, mientras el 26,7 % mostró mejoría. La probabilidad acumulativa de éxito completo en un período de tres años (36 meses) fue de 94,1 % (± 5,7) en el primer mes y medio (6 semanas); 94,1 % (± 5,7) a los 6 meses; 70,6 % (± 11,1) a los 12 meses; 58,8 % (± 11,9) a los 18 meses y del 47,1 % (± 12,1) a los 24 meses, valor que se mantuvo hasta los 36 meses (Fig. 3). El número de fallas fue 9 (52,9 %) y hubo éxito completo en 8 ojos (47,1 %).
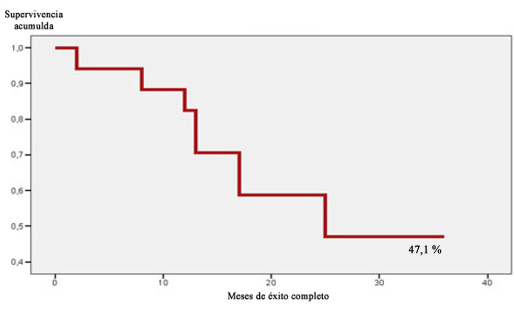
Fig. 3 - Función de supervivencia de éxito completo a los tres años en el grupo de pacientes estudiados.
La figura 4 compara el comportamiento de la supervivencia del éxito completo según el tipo de glaucoma. En los glaucomas secundarios, la caída de la proporción de pacientes con éxito completo fue de 87,5 % (± 11,7) al mes y medio del implante; disminuyó al 50 % (± 17,7) a los 12 meses y se mantuvo igual hasta el final del período de seguimiento (36 meses); es decir, al final de la evaluación el 50 % de los pacientes con glaucomas secundarios tenía un éxito completo con el implante del dispositivo de glaucoma de Ahmed (DGA). En el caso de los pacientes con glaucoma primario, la curva de supervivencia del éxito completo comenzó a caer a partir de los 12 meses, y alcanzó el valor más bajo a los 24 meses (44,4 % ± 16,6), valor que se mantuvo hasta el cierre del período de seguimiento. Las diferencias encontradas no fueron estadísticamente significativas (p= 0,717).
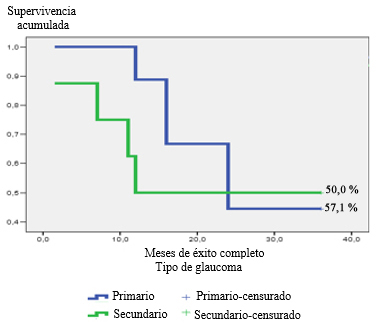
Fig. 4 - Función de supervivencia de éxito completo a los tres años en el grupo de pacientes estudiados según el tipo de glaucoma.
La probabilidad acumulada para el éxito calificado disminuyó en el tiempo, la cual fue de 94,1 % (± 5,7) a los 12 meses; 88,2 % (± 7,8) a los 16 meses; 82,4 % (± 9,2) a los 17 meses y de 76,5 % (± 10,3) a los 24 meses, porcentaje que se mantuvo hasta los 36 meses. Un total de 4 casos presentaron fallas en el periodo estudiado (Fig. 5).
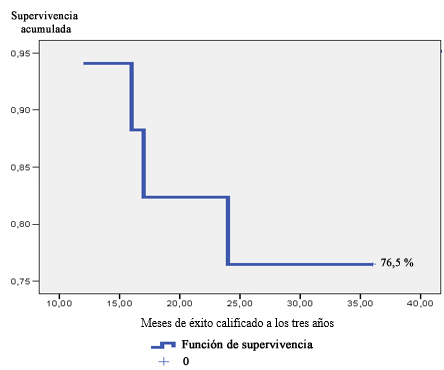
Fig. 5 - Función de supervivencia de éxito calificado a los tres años en el grupo de pacientes estudiados.
De los 17 ojos operados, 5 presentaron complicaciones (29,4 %); en 2 de ellos se trataron de complicaciones tempranas (11,8 %) y en 3 tardías (17,6 %). Las complicaciones tempranas fueron: desprendimiento coroideo y retracción conjuntival; mientras que las tardías fueron: retracción del tubo, exposición del tubo y megabula. Todas ellas ocurrieron de forma unilateral, lo que representó un 5,9 %, en cada caso.
Cuatro pacientes requirieron ser reintervenidos (23,5 %). A dos de ellos se les colocó una segunda válvula (11,8 %); a otro un expansor del tubo (5,9 %) y en el cuarto paciente fue necesario realizar una ciclofotocoagulación (5,9 %).
DISCUSIÓN
Según los estudios de Dallas y Minessota, el glaucoma pediátrico se ve con mayor frecuencia en niños varones. La edad predominante en el glaucoma primario es mucho menor que en los glaucoma secundarios. El glaucoma primario más frecuente es el congénito primario. En el estudio de Minessota (basado en población), el glaucoma más frecuente fue el glaucoma adquirido, y con esto explican el predominio de los varones, por la frecuencia del glaucoma traumático.4,5,6) Lo anterior no coincide con los resultados del presente estudio donde hubo frecuencia similar, pero con predominio de los glaucomas congénitos primarios.
En el estudio de Dallas, basado en el registro de 239 niños con glaucoma y 376 ojos analizados, se observó que el 19 % de los niños presentaban un glaucoma congénito primario, el 4 % un glaucoma juvenil y el 45 % un glaucoma secundario. De los glaucomas secundarios, el traumatismo y la afaquia poscirugía eran las principales causas. En el presente estudio, entre los glaucomas secundarios predominaron los pseudofáquicos. Las mayores incidencias de glaucoma para pacientes afáquicos, y por extensión pseudofáquicos, corresponden a la realización de la cirugía de catarata en etapas muy tempranas de la vida en ojos pequeños y con diámetro corneal menor de 10 mm; presencia de otras anomalías oculares; algunos tipos morfológicos de cataratas congénitas (completas, nucleares, persistencia de la vasculatura fetal), restos corticales, proteínas y partículas del lente retenidas e historia de cirugías secundarias.4,5,6,7
Las tasas de éxito en el control de la PIO con los DDG oscilan entre un 50-95 %, en dependencia de los criterios de éxito utilizados, los tipos de implantes y el período de seguimiento.8,9,10 Muchos pacientes requieren del uso de medicamentos como adyuvantes después de la cirugía. Sin embargo, a pesar de los criterios de control de la PIO empleados, sí se ha visto que el éxito disminuye en el curso de largos períodos de seguimiento. Beck y otros11 han reportado una tasa de éxito del 87 % al año y una caída al 53 % a los 6 años. Estos resultados difieren del presente estudio porque al año el éxito completo fue de 58,8 % y a los tres años de 47,1 %; mientras el éxito calificado fue de 94,1 % al año y de 76,5 % a los tres años, pero evidencia que el éxito disminuye con los años.
En la investigación de Dave y otros,12 en la cual estos autores estudian 11 ojos de 8 pacientes con glaucoma congénito primario tratados con válvula de Ahmed, reportan una caída de la PIO de 28 ± 5,7 mmHg (preoperatoria) a 13,6 ± 3,4 mmHg (p< 0,0001), en el último seguimiento (media de seguimiento 17,9 ± 9,3 meses (rango: 6,2-35,4)).
Huang y otros,3 en su estudio en ojos de pacientes con glaucoma congénito primario avanzado en los cuales habían fallado las cirugías previas, reportan supervivencias de éxito (para el presente trabajo éxito calificado) de 85,7, 71,4 y 71,4 % a los 6, 12 y 18 meses, respectivamente. Comparando sus resultados con los reportados en esta investigación (100, 88,9 y 66,7 %, respectivamente) en igual período de tiempo, fueron más bajas en el primer año, pero un poco más altas a los 18 meses.
En el estudio de Autrata y otros,13 en el cual reportan los resultados del uso de DDG en niños con glaucoma refractario, por un largo período de seguimiento, ellos demuestran también una caída significativa de la PIO de 33,6 mmHg preoperatoria a 17,1 mmHg después de un tiempo promedio de seguimiento de 7,1 años. La tasa de éxito fue de: 91,45 (± 3,6) al año; 82,7 % (± 4,8) a los dos años; 76,5 % (± 5,6) a los tres años; 71,4 % (± 7,2) a los cuatro años y 65,3 (± 9,7) a los seis años. Ellos no encuentran diferencias en la supervivencia de éxito calificado entre los pacientes con glaucoma primario y glaucoma secundario.
En relación con la agudeza visual mejor corregida, se observó en el presente estudio que no se modificó en la mayoría de los pacientes, aunque cuatro de ellos experimentaron, incluso, una mejoría de esta. Dos de estos pacientes presentaban un glaucoma primario y dos un glaucoma secundario, y tenían edades por debajo de los 11 años. Como se trata de pacientes con períodos relativamente largos de daño del nervio óptico y con otras alteraciones oculares, se justifica que se mantengan estables durante el período evaluado en relación con la agudeza visual mejor corregida preoperatoria. Sin embargo, se ha señalado que son pocos los estudios que están dirigidos al análisis del comportamiento de la agudeza visual en pacientes con glaucoma congénito primario. Una razón que se plantea para explicar esto, es que los pacientes tienen poca edad y se hace difícil el seguimiento de la progresión de la agudeza visual. Además, los pacientes que han tenido operaciones exitosas, no siempre alcanzan el mismo nivel de mejoría en la agudeza visual. Es por eso que el estatus de la agudeza visual no se incluye en los índices usados para la evaluación de la tasa de éxito en el glaucoma de la infancia; pero cuando se incluye, el criterio es que se mantenga estable o no disminuya por debajo de determinado valor. En un reporte de Hill y otros,14 estos autores comparan dos opciones de tratamientos en niños y en el grupo tratado con AGV, donde el 12 % experimentó una caída de la agudeza visual mejor corregida. Ellos explican la disminución de la agudeza visual a partir del desarrollo de una catarata secundaria a la operación de glaucoma.2,15
Se analizaron las complicaciones presentadas en los ojos operados en este estudio y se observó una frecuencia de casi el 30 %. Las complicaciones tardías fueron las más frecuentes. Un paciente presentó desprendimiento coroideo como complicación temprana, el cual se asocia con la disminución de la PIO. Diferentes investigaciones han demostrado que existen varios tipos de factores de riesgo que se asocian con este tipo de complicaciones, como son la inflamación posoperatoria, la dilatación de los vasos coroideos y la salida del plasma. Se ha observado, además, que pueden ser tomadas una serie de medidas preventivas, como son la inyección de viscoelástico en la cámara anterior, la ligadura del tubo y el trasplante de esclera heterogéneo, aunque ninguna de estas medidas es lo suficientemente efectiva.16,17,18
El paciente que presentó el desprendimiento coroideo en el presente estudio tenía 6 años al momento de la operación y tenía un diagnóstico previo de un glaucoma congénito. Se le habían realizado previamente dos trabeculotomía-trabeculectomía y se resolvió el cuadro clínico con tratamiento médico, en el que no fue necesario el drenaje.
Dave y otros (12 estudiaron 11 ojos de 8 pacientes, y uno de ellos desarrolló una inflamación de la cámara anterior con desprendimiento coroideo en la primera semana después de la operación, que también resolvió con medicamentos. Djodeyre y otros9 refieren la presencia de desprendimiento coroideo en el 17 % de los ojos estudiados por ellos.
Zarallo19 reporta una incidencia en su estudio de desprendimiento coroideo de un 20,4 %, el cual es autolimitado y sin necesidad de realizar cirugía. En la serie estudiada por él, esto fue más frecuente en pacientes con glaucoma secundario, en particular asociados con el síndrome de Sturger-Weber.
La otra complicación temprana reportada en el presente estudio fue la retracción conjuntival, que al igual que la anterior apareció en el transcurso del primer mes después de la operación. Por lo general, se trata de un tipo de complicación no reportada en los trabajos analizados.20,21,22 Las complicaciones tardías reportadas en el presente estudio fueron la retracción del tubo, la exposición del tubo y la megabula. En el caso de la exposición del tubo valvular, esto respondió a un traumatismo que el niño sufrió y que provocó este cuadro en un paciente que hasta ese momento había evolucionado bien.
En las series publicadas, estas complicaciones relacionadas con el tubo, y en particular con la migración del tubo, son de las complicaciones más frecuentes, las cuales pueden alcanzar una frecuencia hasta del 35 %. Esto puede relacionarse con frecuentes traumatismos y, entre otras razones, con el frotamiento ocular en estos pacientes, lo que aumenta el trauma mecánico infringido al dispositivo implantado, que favorece su movimiento y la alteración de su posición inicial. Por otra parte, el propio crecimiento del globo ocular produce una rotación del tubo hacia adelante, y lo acerca al endotelio. Por último, la contracción de la cápsula fibrosa perivalvular puede alterar la posición del tubo hasta retraerlo de la cámara anterior o hacerlo contactar con otras estructuras. Algunas de estas razones puede explicar por qué este tipo de complicación es más frecuente en los niños que en los adultos.14,19,23,24)
Huang y otros3 estudiaron los resultados de la implantación de la DGA en 14 ojos de pacientes con un glaucoma congénito avanzado, en los cuales las cirugías anteriores habían fallado en el control de la PIO, con una mediana de seguimiento de 18 meses. Se encontró que el 28,6 % presentó complicaciones como endoftalmitis, erosión del tubo, desprendimiento de retina, desprendimiento coroideo y hemorragia supracoroidea tardía. Las complicaciones referidas por este grupo son más graves que las reportadas en el presente trabajo. Se concuerda con lo planteado por Djodeyre y otros (9 en que el éxito del implante de la DGA en pacientes pediátricos está altamente correlacionada con la experiencia del cirujano.
Con el presente estudio se logró demostrar la efectividad del implante dispositivo de glaucoma de Ahmed en el control de la presión intraocular, la cual tuvo una caída de la media al final del período de seguimiento (3 años) de casi el 50 % en esta serie de pacientes, y la supervivencia de éxito calificado fue superior al 70 %.














