Introducción
La diabetes mellitus (DM) se define como una enfermedad crónica que ocurre cuando el páncreas no produce suficiente insulina, o cuando el cuerpo no puede utilizar eficazmente la insulina producida. Constituye un gran problema de salud pública global y a su vez una de las enfermedades sistémicas más frecuentes en el mundo, con una prevalencia en incremento. Se informó de que la diabetes afectó 366 millones de personas en todo el mundo en el año 2011 y se estima que se afectarán 555 y 640 millones para los años 2030 y 2040 respectivamente.1) Esta enfermedad se asocia con una mortalidad prematura en países de todas las latitudes, dada por sus complicaciones macrovasculares como la enfermedad cardiovascular, y las complicaciones microvasculares, donde figuran la nefropatía que conduce a fallo renal, la neuropatía diabética y la retinopatía diabética con un elevado potencial de ceguera.2
La retinopatía diabética es la principal causa de ceguera en personas entre 25 y 74 años de edad en los Estados Unidos, lo que representa alrededor de 8 000 nuevos casos de ceguera cada año.3 Del mismo modo, otras enfermedades oculares, como la catarata y el edema macular, también se desarrollan como resultado de la hiperglucemia crónica en el 28-60 %, lo que también puede tributar a una discapacidad visual o a la ceguera. Mientras que las complicaciones retinales de la diabetes son ampliamente reconocidas por oftalmólogos, sus efectos sobre la córnea, la conjuntiva y las glándulas lagrimales son poco estudiados.2,4) Sin embargo, resultados de investigaciones clínicas plantean que hasta el 73,6 % de los pacientes diabéticos tipo 2 sufren de complicaciones corneales o de la superficie ocular per se.5 Con el propósito de brindar información actualizada sobre la influencia de la diabetes en la superficie ocular, se realizó una revisión de la bibliografía reciente disponible en idiomas español e inglés, a la que se pudo acceder, disponible en textos completos y resúmenes en algunas bases de datos como PubMed, Ebsco, Google Académico, Scielo, entre otras. Además, se consultaron novedosos artículos en prestigiosas revistas especializadas.
Diabetes mellitus y la superficie ocular
Manifestaciones corneales en la diabetes mellitus
El epitelio corneal desempeña un papel importante como sistema de defensa de la superficie ocular al proporcionar una barrera física e inmunológica a los agentes orgánicos e inorgánicos externos. La inervación de la córnea se deriva de la división oftálmica del nervio trigémino. Proporciona un gran número de receptores sensoriales, tales como las fibras mielínicas A y amielínicas C en un total aproximado de 7 000 terminaciones nerviosas libres epiteliales por milímetro cuadrado, los cuales son 300-600 veces mayor que la de la piel, lo que le confiere la propiedad de ser la estructura más densamente inervada en los seres humanos. Sus fibras nerviosas juegan un importante papel neurotrófico en el desarrollo de una superficie corneal sana.6)
Las alteraciones en las córneas diabéticas observadas clínicamente incluyen aumento de su grosor, defectos epiteliales, fragilidad epitelial y erosiones recurrentes, úlceras, edema, queratitis punteada superficial, reparación tardía e incompleta de la herida, cambios endoteliales y neuropatía dada por una menor sensibilidad corneal. La neuropatía corneal diabética, la autofluorescencia corneal (posiblemente por la acumulación de productos finales de glicación avanzada), y la fragilidad epitelial se incrementan en pacientes con retinopatía diabética. Al igual que la retina diabética, la córnea en diabéticos también se ve afectada por la dislipidemia, con un mayor contenido de esfingosinas y ceramidas.3) La figura 1 brinda información que avala, desde el punto de vista etiopatogénico, lo antes descrito.
 Tomada de: Shih KC, Lam KS, Tong L. A systematic review on the impact of diabetes mellitus on the ocular surface. Nutr Diabetes. 2017;7(3):e251.
Tomada de: Shih KC, Lam KS, Tong L. A systematic review on the impact of diabetes mellitus on the ocular surface. Nutr Diabetes. 2017;7(3):e251.Fig. 1 Etiopatogenia de las principales alteraciones corneales en la diabetes mellitus.
La hiperglicemia y la formación de productos finales de glicación avanzada tienen efectos distintos en diferentes partes de la córnea, lo que resulta en tres tipos principales de disfunción tisular con efectos fisiológicos que se pueden medir:
La glucosa en sangre elevada promueve la liberación de IGFBP3, que -a su vez- inhibe competitivamente IGF-1, mientras que TGFb3, EGFR, CNTF se suprimen en estados hiperglucémico. Como resultado final se obtiene una reducción en la proliferación de células epiteliales y un aumento de la apoptosis; ambos afectan la cicatrización de las heridas epiteliales.7,9
El daño neuronal es un defecto clave en la DM. La hiperglucemia prolongada resulta en la acumulación de productos finales de glicación avanzada, que promueve la inflamación y el estrés oxidativo.7,10 El factor de crecimiento nervioso y los esfingolípidos son claves para la salud neuronal y la formación de mielina; sin embargo, su producción se inhibe en estados hiperglucémicos.7 La hiperglucemia prolongada también resulta en pérdida de células endoteliales y deterioro en la función de la bomba. Aparte de estos procesos, la hinchazón del estroma corneal (la mayor parte de la córnea) puede responder a la pérdida de la barrera epitelial, la reticulación del colágeno del estroma y la pérdida de la bomba endotelial. La inervación sensorial de la córnea es un determinante importante de la salud epitelial y de la capacidad de curación. Esto puede estar mediado por la secreción de la sustancia P, por los nervios y la unión al receptor neuroquinina-1 en las células epiteliales.7)
Los cambios morfológicos en los nervios sensoriales corneales, asociados con la hiperglucemia prolongada, se han caracterizado bien en varios tejidos con pérdida en las terminaciones nerviosas y aumento de la tortuosidad de los haces de fibra restantes. Los daños en las neuronas sensoriales influyen directamente en la integridad del epitelio, el estroma y el endotelio; ralentiza o detiene la mitosis y provoca una regeneración de tejido reducida. Eventualmente, la presencia de daño del nervio periférico puede dar lugar a degeneración epitelial a medida que las células epiteliales se hinchan, pierden microvellosidades, y generan láminas basales anormales que resultan en erosiones corneales recurrentes, queratitis y defectos epiteliales persistentes, por la disminución de la sensibilidad corneal.11 Se plantea que la cicatrización y la reepitelización de las heridas suprimidas comúnmente, asociadas con la diabetes, se deben a la débil adherencia entre el epitelio y la membrana basal subyacente, lo que determina un mayor riesgo de desarrollar ulceración corneal.12,13 Estos cambios pueden conducir a la ceguera, lo que subraya la importancia de tener en cuenta el impacto de DM en la superficie ocular.
A diferencia de otras áreas del cuerpo, los nervios de la córnea se pueden visualizar fácilmente en el estroma corneal anterior transparente mediante técnicas de imagen modernas en escenarios clínicos sin procedimientos de biopsia invasivos. Esencialmente, estos hallazgos in vivo han sido confirmados por estudios cadavéricos.14
Aportes de la microscopia confocal
La microscopia confocal es una prueba diagnóstica rápida, no invasiva y fiable, que permite identificar una neuropatía diabética subclínica mediante la visualización directa de los cambios sutiles de los nervios corneales en vivo. Es posible evaluar la densidad y la longitud de sus fibras, sus ramas y su tortuosidad, principalmente en el plexo nervioso subbasal, donde acontecen los cambios neurales más relevantes relacionados con la diabetes, más que en los nervios estromales (Fig. 2).14,15,16
 Tomada de: Bussan KA, Robertson DM. Contact lens wear and the diabetic corneal epithelium: A happy or disastrous marriage? J Diab Complicat. 2019;33(1):75-83.
Tomada de: Bussan KA, Robertson DM. Contact lens wear and the diabetic corneal epithelium: A happy or disastrous marriage? J Diab Complicat. 2019;33(1):75-83.Fig. 2 MicroscopIa confocal in vivo que confirma los cambios en el plexo nervioso subbasal en diabetes. A): Imagen del plexo nervioso subbasal en un paciente diabético tipo 2. B): se observa el plexo nervioso subbasal en un paciente control, no diabético. Barra escala: 100 μm.
Algunos autores coinciden en que existe un sector inferonasal en córnea periférica, donde el plexo nervioso subbasal adquiere un patrón único en espiral a favor de las manecillas del reloj, al que le denominan “área en espiral”. Por sus características, sugieren que puede ser el punto de referencia más confiable para la evaluación longitudinal e intervencionista del plexo nervioso subbasal corneal en pacientes diabéticos portadores de neuropatía periférica (Fig. 3).17
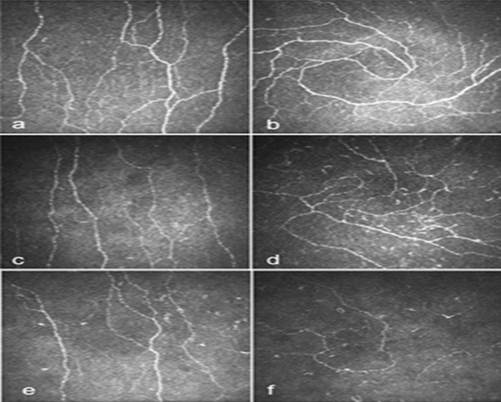 Tomada de: Kalteniece A, Ferdousi M, Petropoulos I, et al. Greater corneal nerve loss at the inferior whorl is related to the presence of diabetic neuropathy and painful diabetic neuropathy. Scientific Reports. 2018;(8):3283.
Tomada de: Kalteniece A, Ferdousi M, Petropoulos I, et al. Greater corneal nerve loss at the inferior whorl is related to the presence of diabetic neuropathy and painful diabetic neuropathy. Scientific Reports. 2018;(8):3283.Fig. 3 Imágenes de la microscopia confocal in vivo del centro corneal y la córnea periférica a nivel del área espiral. (a y b): paciente control. (c y d): paciente diabético sin neuropatía. (e y f): paciente diabético con neuropatía.
Cambios en nervios corneales como ventana de la retinopatía y neuropatía diabética
Numerosos estudios recientes reportan estrecha asociación entre la neuropatía periférica, la retinopatía diabética y la neuropatía corneal, y atribuyen a este último un importante valor predictivo para la enfermedad sistémica. En este sentido, consideran que los cambios en las células de la córnea y las fibras nerviosas predicen el desarrollo de la retinopatía diabética; las alteraciones del plexo nervioso subbasal corneal progresan en paralelo con la retinopatía diabética; y la neuropatía periférica, y los cambios en las fibras nerviosas de la córnea se pueden detectar previamente a la neuropatía diabética periférica en otras partes del cuerpo, por la alta densidad de las fibras nerviosas en la córnea.18,19,20) Por tanto, así como el examen de la retina puede ser una ventana a los cambios vasculares sistémicos en individuos diabéticos, la visualización de los nervios de la córnea también puede brindar un pronóstico a los cambios neuropáticos sistémicos periféricos.
Compromiso de la conjuntiva
Las alteraciones de la conjuntiva son comunes en pacientes diabéticos y generalmente incluyen alteraciones microvasculares, en parte similares a las de la retina, específicamente la pérdida de capilares, la dilatación macrovascular, la desigual distribución de vasos y un bajo número de células caliciformes.21
Algunos autores coinciden en que la conjuntiva diabética con ojo seco muestra un aumento de las citoquinas proinflamatorias. La flora conjuntival parece ser anormal, ya que se ha demostrado un porcentaje significativamente mayor de cultivos positivos que los pacientes no diabéticos. El patrón de cepas bacterianas predominantes (principalmente Staphylococcus) también difiere de los sujetos de control con bacterias Gram-negativas y son más comunes.22
Síndrome de ojo seco
En particular, los pacientes diabéticos se quejan a menudo de síntomas de ojo seco, incluyendo sequedad, ardor, enrojecimiento, dolor, irritación ocular y ojos fácilmente fatigados. El Taller Internacional sobre Ojo Seco, realizado en el año 2017, clasificó la diabetes como un factor de riesgo para el ojo seco acuoso-deficiente. Este subtipo es causado generalmente por la falta de producción de lágrimas; sin embargo, el ojo seco evaporativo, que responde entre otras causas a la disfunción de las glándulas de meibomio, es el subtipo más frecuente en pacientes diabéticos.23 Durante el curso de la diabetes, el daño microvascular a la glándula lagrimal por hiperglucemia, la disminución de la inervación lagrimal como resultado de la neuropatía autonómica, la reducción del apoyo trófico al tejido lagrimal y la reducción del reflejo de lagrimeo por deterioro de la sensibilidad corneal, son factores que contribuyen al estado alterado de la película lagrimal. Se reconoce que las características clínicas del ojo seco, tanto acuo-deficiente como ojo seco evaporativo, están presentes en los pacientes a medida que la enfermedad progresa.24 Atendiendo a que la presencia de ojo seco guarda una estrecha relación con el daño al epitelio corneal, la identificación oportuna de este, unido a los síntomas del ojo seco, además del examen de retina, sería un elemento clave a tener en cuenta en el examen de la superficie ocular en pacientes diabéticos.
Oportunidades terapéuticas en el manejo de la superficie ocular diabética
El control sistémico en la diabetes es la piedra angular del tratamiento en cualquier complicación diabética. El control estricto de la glucosa en sangre, preferiblemente en colaboración con el endocrinólogo, puede prevenir la progresión de la epiteliopatía corneal y la neuropatía. Muy prometedores enfoques terapéuticos desde el punto de vista sistémico han sido propuestos en los últimos años para el manejo y el control de las alteraciones de la superficie ocular, incluyendo la terapia con Resolvin-D1, los suplementos dietéticos ricos en betacarotenos, los suplementos como el KIOM-19 compuesto por extractos de plantas con propiedades medicinales, la terapia con células madre, etcétera. Sin embargo, aún se encuentran en estudio en modelos animales.7
El objetivo del tratamiento tópico en la queratopatía diabética es mantener una superficie ocular lisa y lubricada con un epitelio intacto y una respuesta de parpadeo adecuada. Esto minimiza la distorsión visual y favorece el confort. El tratamiento exacto prescrito depende de la gravedad del problema y de las estructuras específicas involucradas. Un enfoque escalonado hacia el tratamiento es útil con el fin de detener subsecuentes daños, fomentar la reepitelización, prevenir la infección y mantener una lubricación adecuada de la superficie ocular.6) En revisiones recientes se ha descrito cómo terapias con lubricantes, antibióticos, suero autólogo y agentes antiinflamatorios, así como algunos dispositivos como lentes de contacto terapéuticos, juegan un papel importante en el manejo y el control de las alteraciones de la superficie ocular en pacientes con DM.1) Los lubricantes artificiales tópicos son útiles para el mantenimiento de la superficie ocular sana y la transparencia del eje visual. Los medicamentos antinflamatorios tópicos, como los AINE, los esteroides y la ciclosporina A, también son útiles para aliviar la inflamación de la superficie ocular y animar la reepitelización. Los lentes de contacto blandos con fines terapéuticos pueden ser útiles para una superficie ocular irregular, erosión corneal recurrente y defectos epiteliales persistentes.25) El suero autólogo es teóricamente beneficioso para la facilitación de la cicatrización de heridas corneales y la regeneración nerviosa, ya que tiene altas cantidades de factores de crecimiento. Estudios basados en evidencias han demostrado que el suero autólogo tópico acelera la curación epitelial corneal después de la vitrectomía en pacientes con DM. También se sugiere que la aplicación tópica de suero del cordón umbilical y el plasma derivado de plaquetas sería eficaz para facilitar la regeneración del nervio corneal y la curación epitelial. En condiciones más graves, tales como úlceras neurotróficas, son aplicables opciones quirúrgicas para inducir el cierre de párpados, incluyendo la inyección de toxina botulínica y tarsorrafia.1
La diabetes mellitus tiene un impacto adverso en la integridad de la superficie ocular, sensibilidad corneal, regeneración epitelial corneal y producción de lágrimas. La gravedad de la neuropatía corneal diabética se correlaciona con la neuropatía diabética periférica a otros niveles del organismo. La neuropatía diabética sutil en la córnea precede a menudo a la retinopatía y a la neuropatía de otras partes del cuerpo. Por lo tanto, el examen del plexo nervioso corneal mediante la tomografía confocal in vivo constituye un biomarcador tan importante como la evaluación de la retina en pacientes con neuropatías diabéticas. Aunque se han introducido novedosos medicamentos eficaces para el tratamiento y la prevención de trastornos del segmento anterior asociados a la diabetes, todavía quedan varios en el curso de las investigaciones en modelos animales. Un futuro próspero en el manejo de la diabetes depende del aumento de la conciencia de su importancia en la superficie ocular. El mejor dominio de la superficie ocular es esencial para el manejo óptimo de la enfermedad.














