Introducción
El glaucoma congénito primario (GCP) constituye la forma más común de glaucoma infantil. Exige un diagnóstico precoz y un tratamiento quirúrgico relativamente urgente al poder ocasionar graves secuelas morfológicas y funcionales. Se reserva el término para situaciones en las que existe un defecto anatómico del ángulo camerular por anomalías aisladas del desarrollo ocular y que dificultan la salida del humor acuoso.1
En un pasado, la goniotomía fue la operación de primera elección. Posteriormente se han propuesto otras alternativas quirúrgicas como los implantes valvulares, la trabeculotomía ab externo, la trabeculectomía convencional o la trabéculo-trabeculectomía combinada (TTC), también denominada trabeculotomía-trabeculectomía. Esta técnica fue descrita para el GCP en el año 1979 por Nicolás Belmonte.2 Varios autores han publicado resultados satisfactorios con este procedimiento,3-8 incluso con la incorporación de implantes esclerales o la utilización de antimetabolitos.
La TTC es difícil de evaluar en las sociedades occidentales por su infrecuente uso y la baja incidencia de GCP (1:10 000 recién nacidos). De hecho, la efectividad de esta técnica se ha analizado en escasas publicaciones y la mayoría de los estudios se han realizado en poblaciones árabes donde la incidencia de GCP es mayor a causa de la alta consanguinidad (1:2 500 recién nacidos).9
Caso clínico
Se presenta un paciente de un año de edad, árabe, de nacionalidad argelina, a quien se le diagnosticó GCP con cuadro clínico clásico, no asociado a secundarismo, y se identificó consanguinidad en tercera generación. El tratamiento tópico hasta el momento de la cirugía se encontraba en dosis máxima terapéutica y con tensiones oculares (TO) de 40 mmHg como promedio en ambos ojos. Se decidió realizar cirugía incisional TTC en ambos ojos, con previa exploración gonioscópica, tonométrica, paquimétrica y fondoscópica bajo anestesia general. Dicho examen físico minucioso confirmó el diagnóstico, y las cirugías transcurrieron sin complicaciones en ambos ojos. Se evaluó el seguimiento posoperatorio con resultados satisfactorios, incluyendo la evaluación a los 12 meses, evidenciados por la mejoría de la agudeza visual, la transparencia corneal, la normalización de los valores de TO en rango normal y la filtración adecuada de la cirugía, con formación de bula de filtración apropiada. Al año de operado existían TO de 12 mmg sin tratamiento médico; mejor agudeza visual corregida (MAVC) 0,8 ojo derecho (OD) y 1,0 ojo izquierdo (OI); longitud axial de 23,4 mm (OD) y 23,7 mm (OI); diámetros corneales de 11,5 mm (OD) y 12 mm (OI); relación copa disco (RCD) 0,4 (OD) y 0,3 (OI).
De esta forma, se realiza por primera ocasión una TTC en la República Democrática y Popular de Argelia, ya que no se recogen datos bibliográficos de haberse realizado este tipo de cirugía en los centros oftalmológicos cubanos o en otra institución médica de la nación.
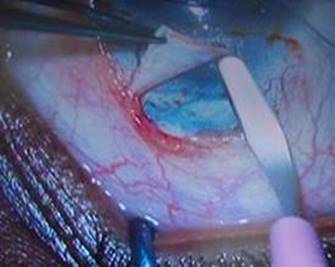
La técnica quirúrgica se realiza bajo anestesia general. Se inicia la intervención colocando suturas de tracción corneal (Vicril 5.0, aguja espatulada, 3/8 ciclo) en horas 2 y 10. De esta forma, se facilita la exposición de la conjuntiva superior. Se decola delicadamente un colgajo conjuntival con base en fórnix posicionado en el limbo superior (de hora 2 a hora 10) y se realiza hemostasia quirúrgica con electrocauterio (Fig. 1).
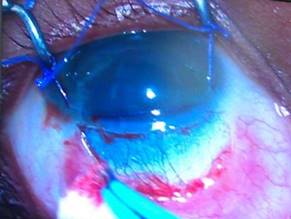
Fig. 1 Procedimiento quirúrgico con suturas de tracción corneal (Vicril 5.0, aguja espatulada, 3/8 ciclo) en horas 2 y 10.
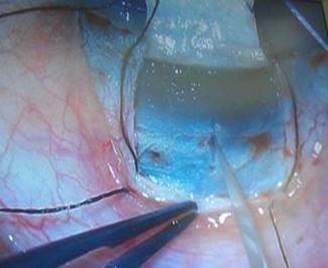
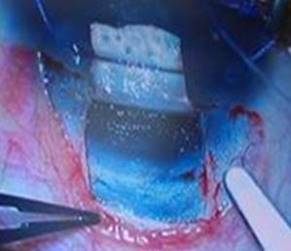
Se marca y se diseca un colgajo escleral rectangular con centro en hora 12, de un tamaño aproximado de 4 x 4 mm (Fig. 2) profundizando hasta la mitad o dos tercios del espesor escleral (Fig. 3). Posterior a este paso se puede incluir el uso de inhibidores fibroblásticos o antimetabolitos como la mitomicina C (MMC), el 5 fluorouracilo (5Flo), el Beta-aminopropionitrilo o la D-penicilamina.

Fig. 2 Se marca y se diseca un colgajo escleral rectangular con centro en hora 12, de un tamaño aproximado de 4 x 4 mm.
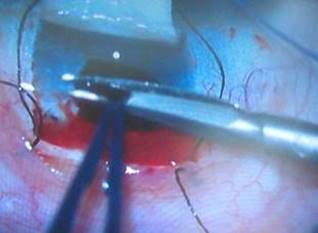
A continuación se sugiere la realización de una paracentesis para descompresionar el interior ocular y además para tener control del volumen de líquido intracameral. De esta forma y usando una alta magnificación, en la esclera subyacente, se realiza cuidadosamente una incisión radial rasgando con la porción roma de un cuchillete (Fig. 4). La incisión se efectúa en la zona de transición entre la córnea azul (banda trabecular) y el tejido escleral donde teóricamente se encuentra localizado el canal de Schlemm (Fig. 5).

Fig. 5 La incisión se efectúa en la zona de transición entre la córnea azul (banda trabecular) y el tejido escleral donde se encuentra localizado el canal de Schlemm.
En ocasiones puede ser difícil detectar el canal de Schlemm debido a un anormal alargamiento anatómico del limbo y a una esclera excesivamente adelgazada en ojos buftálmicos. El canal es identificado al observar un reflujo de humor acuoso desde la incisión, ocasionalmente mezclado con sangre. Por otro lado, se sugieren dos pasos. El primero es la colocación de suturas previas (Seda 8.0 V), las cuales serían las suturas de cierre final del tapete escleral, como medida de prevención para un cierre rápido en caso de complicaciones o para facilitar la colocación de estas frente a la hipotonía ocular transquirúrgica que ocurrirá en los siguientes pasos (Fig. 6). Segundo, la sujeción gentil del tapete escleral mediante la sutura colocada en un inicio por el Vicril 5.0 para la tracción ocular. De esta forma no se maltrata el colgajo escleral con pinzas de sujeción.
Luego el trabeculótomo doble, derecho o izquierdo (Sonda de Harms), es insertado en la incisión y se comprueba su avance en la luz del canal sin resistencia (Fig. 7). A continuación, se rota de forma controlada hacia la cámara anterior, atravesando, de esta forma, la cara interna del canal de Schlemm y se rompe la malla trabecular y el tejido embrionario del ángulo evitando lesionar otras estructuras intraoculares (Fig. 8). De manera similar se introduce el trabeculótomo por el otro extremo de la incisión y se realiza la misma maniobra intraocular. De esta forma, queda seccionada la pared interna del canal de Schlemm en una extensión de unos 120º.
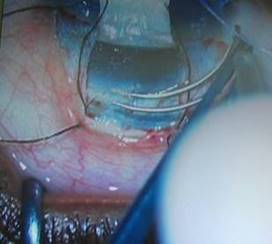
Fig. 7 El trabeculótomo doble, derecho o izquierdo (Sonda de Harms), es insertado en la incisión y se comprueba su avance en la luz del canal sin resistencia.
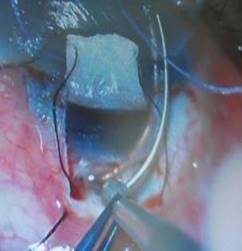
Fig. 8 Se rompe la malla trabecular y el tejido embrionario del ángulo evitando lesionar otras estructuras intraoculares.
Posteriormente se realiza la trabeculectomía en el lecho córneo-escleral, donde se escinde una pequeña pieza de tejido de aproximadamente 2 x 2 mm tomando la malla trabecular y una porción del canal de Schlemm de esa área. Se efectúa una iridectomía periférica comunicando ambas cámaras del segmento anterior ocular (Fig. 9).
Finalmente se sutura el tapete escleral con las suturas previamente colocadas, se explora su filtración evitando que sea excesiva y se inyecta en cámara anterior una bula de aire evitando así la hipotonía e hiperfiltración. El cierre conjuntival se realiza con suturas reabsorbibles alejadas del flap (horas 2 y 10) evitando Seidel o la exposición de las incisiones radiales del flap escleral (Fig. 10).
El tratamiento posoperatorio estará dirigido a la prescripción de colirios antibióticos, esteroide y ciclopléjicos por un mes, en dependencia de la mejoría clínica o de la aparición de complicaciones posquirúrgicas.
Discusión
Desde hace siete décadas, la cirugía fue considerada como el único tratamiento eficaz para el GCP. La goniotomía ab interno fue la técnica preferida por muchos cirujanos en aquella época, siempre y cuando la córnea fuera lo suficientemente transparente como para permitir una adecuada visualización del ángulo camerular.10,11 No obstante, era necesario repetir dicho procedimiento tras el fracaso de la primera intervención, luego de varios eventos que pudieran justificarlo: el abundante hiphema transquirúrgico, la inmadurez de la malla trabecular o del canal de Schlemm y la no sección del canal de Schlemm.12,13
Por su parte, la TTC crea dos vías de salida del humor acuoso: la primera es la trabeculotomía, la cual secciona el espesor total de la malla trabecular y proporciona una comunicación entre la cámara anterior y el canal de Schlemm; y la segunda es la habitual trabeculectomía, que permite crear una fístula suplementaria y facilita el drenaje desde la cámara anterior al espacio subconjuntival.4,6 Esta doble vía de salida justificaría, al menos parcialmente, la alta incidencia de éxito en el control de la PIO con un único procedimiento.6,7Campos y otros, en un estudio valorativo sobre los resultados quirúrgicos a largo plazo de la TCC, llegaron a las conclusiones de que como cirugía primaria ofrece una alta eficacia a largo plazo en el control de la presión intraocular sin tratamiento farmacológico; muestra mínimas complicaciones quirúrgicas y una baja incidencia de reintervenciones.14 Sin embargo, consideramos que puede tener ciertos inconvenientes, como la dificultad técnica de disecar el colgajo escleral lamelar en ojos muy adelgazados por el buftalmos, la localización exacta del canal de Schlemm para introducir el trabeculótomo en casos de megalocórnea extrema con marcada alteración del área límbica y la ruptura excesiva canal de Schlemm o de la malla trabecular al realizar el abordaje externo prácticamente “a ciegas”, cual también pudiera dañar el endotelio corneal.
Aun cuando la identificación del canal de Schlemm o su canalización con el trabeculótomo no se haya realizado de forma precisa, la trabeculectomía suplementaria proporciona una vía adicional para la salida del humor acuoso que disminuye la PIO a través de un mecanismo de filtración. Por otro lado, si también fracasaran los mecanismos hipotensores de la trabeculectomía, se limitarían las áreas para una futura intervención al no respetarse la conjuntiva perilímbica.
En esta situación estimamos conveniente el uso de implantes valvulares. De hecho, en la actualidad existen autores que consideran los implantes valvulares como la primera elección quirúrgica en el glaucoma pediátrico15 y otros que los dejan como segunda opción para los refractarios y en glaucomas de alto riesgo de falla como primera opción quirúrgica. El dispositivo más utilizado en el momento actual en la mayoría de los países por ser el más seguro es el ya conocido dispositivo de drenaje de tubo largo y valvulado de Ahmed.16
Por otra parte, valorando el uso de las nuevas generaciones quirúrgicas en glaucoma, las cuales logran el objetivo filtrante mediante un mínimo daño al tejido ocular, la cirugía microincisional de glaucoma (micro-invasive glaucoma surgery - MIGS)16,17,18,19 ha comenzado a utilizarse con éxito, aunque muchas excluyen al glaucoma congénito. La excepción ha sido la endoprótesis de gel AqueSys Xen®,20,21 específicamente el AqueSys XEN-45®, no así sus antecesores XEN-140 y XEN-63.19,20,21 La FDA aprobó en noviembre del año 2016 el AqueSys XEN‐45® para pacientes con glaucoma refractario que fracasaron en el tratamiento quirúrgico previo o en pacientes con glaucoma primario de ángulo abierto (GPAA), el glaucoma pseudoexfoliativo (GPEX) o el glaucoma pigmentario con ángulos abiertos que no responden al tratamiento médico máximo tolerado.22 De igual forma, se ha explorado en el glaucoma congénito y se ha llegado a buenos resultados, como los publicados por Smith y otros, en Jornal of Glaucoma en abril del año 2020, quienes exponen un buen control tensional con el AqueSys XEN‐45® sin uso de terapéutica médica en 6 y 24 meses de seguimiento.23
No obstante, existe otra gama de factores para el uso de estos dispositivos, pues dependen de la accesibilidad que tenga el paciente a ellos y el tipo de glaucoma según la anatomía ocular, sobre todo del ángulo iridocorneal. Al igual que en otros estudios realizados en nuestro centro, coincidimos en la elección de la trabéculo-trabeculectomía como procedimiento quirúrgico inicial,24 dada la no existencia de dispositivos de drenaje y el diagnóstico oportuno de GCP II. Según Miqueli y otros, las complicaciones transoperatorias con esta variante quirúrgica son mínimas, tales como hiphemas o hipotalamias, resueltas en pocos días bajo tratamiento médico y, a su vez, es de gran efectividad si el canal de Schlemm se encuentra permeable, pues permite la salida del humor acuoso por un doble mecanismo de acción: elimina el obstáculo a nivel del trabéculo y el canal de Schlemm, y corta el tejido anómalo del ángulo (filtración interna), además de permitir una vía de filtración externa al espacio subconjuntival25 por medio de la trabeculectomía, en caso de no estar permeable el Schlemm;24 lo que coincide con las descripciones de Mullaney y otros4 y Mandal y otros.6
Finalmente consideramos, que la trabéculo-trabeculectomía combinada es un proceder quirúrgico efectivo, predecible, no caro y suficientemente seguro en manos de un personal calificado, para poder aceptarse como primera opción en el tratamiento quirúrgico del glaucoma congénito primario.