Introducción
La catarata es la principal causa de ceguera a nivel mundial y la segunda de discapacidad visual moderada o severa; en este último caso, solo superada por los errores refractivos. Se ha estimado que en el año 2020 estarían ciegos por la presencia de catarata 13,4 millones de personas y por defectos visuales moderados o severos 57,1 millones.1)
La cirugía es el único tratamiento efectivo para esta dolencia. Se trata de un proceder seguro, que produce un cambio significativo en la función visual, no logrado con otras cirugías oftalmológicas. Después de las vacunas, se considera que la cirugía de catarata es la estrategia de tratamiento con mayor costo-efectividad.2,3) Como consecuencia del envejecimiento poblacional y el desarrollo que ha tenido este tipo de cirugía, así como el éxito alcanzado, su realización tiende a aumentar, y al mismo tiempo disminuye la edad de los pacientes que la requieren; tal es así, que en algunos países se ha convertido en la cirugía electiva más común.4,5,6
La técnica más empleada en la operación de catarata en la actualidad es la facoemulsificación del cristalino. En estas cirugías, idealmente después de la extracción del cristalino opacificado, le sigue la colocación de una lente intraocular (LIO), todo esto acoplado en un solo proceder. Lo óptimo es que el implante secundario de la LIO se realice en el saco capsular del cristalino y en su defecto en el sulcus ciliar. Al colocar la LIO en la cápsula se logra un buen centrado con respecto al eje pupilar y una mayor estabilidad, al ser soportada por las zónulas del cristalino. Este emplazamiento aumenta, además, la probabilidad de una cirugía exitosa y de resultados refractivos óptimos, al situar la lente más cerca del punto nodal del cristalino, hecho que proporciona una mayor resolución de la imagen. Esta posición mantiene también el material foráneo de la LIO distante de la cámara anterior (CA), lo que previene las complicaciones que involucran el endotelio y el ángulo de la CA.7,8,9,10)
Sin embargo, no siempre se puede colocar la LIO en el saco capsular, ya que el daño directo total o parcial de la cápsula o el debilitamiento de la suspensión zonular limita su colocación en el sulcus ciliar. El daño directo de la cápsula puede ser consecuencia de la propia cirugía de catarata. Si bien la cirugía de catarata es un proceder seguro, se reporta que el desgarro de la cápsula posterior durante la facoemulsificación es una complicación, observada entre el 0,7 y el 16 % de los casos.11
La prevalencia de un inadecuado soporte capsular es mayor de lo que inicialmente se pensaba. En primer lugar, se observa en los pacientes con un traumatismo ocular abierto, quienes presentan un riesgo mayor de daño de la cápsula y del iris.
La corrección de la afaquia en estos pacientes sin soporte capsular, de acuerdo con el momento en que se realiza el implante, puede ser primaria (en un mismo tiempo quirúrgico) o secundaria (en un segundo tiempo). El cirujano puede enfrentarse a tres posibles situaciones: 1) la LIO puede ser reposicionada, ya sea por una luxación, una subluxación o una ruptura del saco capsular durante la operación; 2) la LIO que se tenía no puede ser reposicionada y debe ser cambiada; 3) el paciente está afáquico y requiere un implante secundario.10)
La LIO en pacientes en quienes esta no puede ser implantada ni en el saco, ni en el sulcus, puede implantarse en la CA o en la cámara posterior (CP) mediante diferentes técnicas. En la CA existen las opciones de implante de LIO con asas flexibles abiertas con apoyo en ángulo, y de LIO de sujeción iridiana (iris claw). En la CP las opciones serían LIO fijada a esclera, LIO de fijación iridiana (iris claw) y LIO suturada a iris.10,12
En el año 1972, JanWorstet y otros13desarrollaron un nuevo tipo de LIO, una lente biconvexa de PMMA de sujeción iridiana, para la corrección de la afaquia. El diseño de esta LIO se ha modificado hasta nuestros días, y hoy se conoce como Artisan.14 Este tipo de lente tiene la ventaja de que, al fijarse a la porción móvil del iris, el anclaje de los hápticos se realiza en el estroma del iris, con lo que se evitan los problemas relacionados con la rotación de las lentes, las alteraciones mecánicas de la malla trabecular y la comprensión del iris. Además, permite que el ángulo camerular permanezca libre, no afecta las estructuras angulares ni la vascularización fisiológica. Facilita también un mejor centrado de la lente en el área pupilar al centrarse en la pupila, lo cual constituye una gran ventaja en los ojos con pupilas descentradas, algo que es frecuente en este tipo de pacientes y, por tanto, el resultado es mucho más predecible que con otras lentes de CA, como las de apoyo angular y las fijadas a sulcus.15,16,17,18,19
Varios estudios sustentan la baja frecuencia de complicaciones transoperatorias y posoperatorias, así como la obtención de resultados visuales favorables. Son lentes fáciles de remover y de reemplazar; el tiempo quirúrgico para la implantación es menor comparado con el de otras lentes, y la curva de aprendizaje de la técnica es corta. En la primera década del presente siglo varios autores han reportado, además, la implantación secundaria retropupilar de este tipo de lente en pacientes con afaquia, con buenos resultados visuales. En la actualidad es el tipo de LIO más empleada cuando existe ausencia de soporte capsular.20,21,22,23,24
A pesar de la complejidad de la técnica, del mayor tiempo quirúrgico, y de la necesidad de una mayor curva de aprendizaje, la técnica de fijación de LIO plegable de CP suturado a iris ofrece resultados superiores en cuanto a la función visual, que el implante de la LIO rígido de CA con apoyo angular. Con esta investigación nos propusimos comparar los resultados refractivos del implante secundario de lentes intraoculares rígidos de la cámara anterior con apoyo angular y de lentes intraoculares plegables de la cámara posterior suturados a iris.
Métodos
Se realizó un estudio cuasi experimental con control no equivalente (cohorte histórica). Se estudiaron 50 pacientes (50 ojos) con afaquia e inadecuado soporte capsular después de la cirugía de catarata, a quienes se les realizó implante secundario de LIO con dos técnicas diferentes, LIO en CA con apoyo angular (25 ojos) y LIO plegable de CP suturado a iris (25 ojos). Todas las cirugías fueron realizadas en el período comprendido entre enero 2017 y enero 2019, en el Instituto Cubano de Oftalmología (ICO).
Se crearon dos grupos (A y B) de 25 ojos cada uno (50 pacientes). El Grupo A se conformó a partir de pacientes que habían sido tratados con implante de LIO de CA con apoyo angular, extraídos de la base de datos del Centro de Microcirugía Ocular, porque cumplían los criterios de selección. Este quedó conformado por ojos tratados con LIO plegable de CP suturado a iris, reclutados de forma prospectiva. La unidad de análisis fue el ojo en todos los casos, excepto cuando se analizó la calidad de vida relacionada con la función visual. Las variables analizadas fueron:
Mejor agudeza visual: capacidad de reconocer dos puntos separados en el espacio. Está determinado por la separación angular de dichos puntos y por la distancia a la que son reconocidos como separados).
Mejor agudeza visual sin corrección (MAVSC): determinada sin lentes (sin espejuelos).
Mejor agudeza visual con corrección (MAVCC): determinada con lentes (con espejuelos).
Equivalente esférico: suma algebraica de la esfera más la mitad del cilindro refractivo).
Esfera esperada (EE): esfera que se espera obtener tras la cirugía, según la potencia óptica de la lente intraocular propuesta por las fórmulas de cálculo y la esfera preoperatoria.
Esfera obtenida (EO): esfera posoperatoria al año de la cirugía.
∆EE: diferencia entre la esfera obtenida (EO) y la esfera esperada (EE).
Predictibilidad del componente esférico 1,00 D: proporción de ojos con una ∆EE estricta de ± 1,0.
Análisis vectorial (Surgically induce Astigmatism - SIA): El astigmatismo inducido por la cirugía fue determinado por el método de Alpins. Para esto se utilizó el programa VECTrAK. Vector Calculator, versión 2.4.6 de la firma ASSORT.
Los datos primarios se procesaron con el programa informático para análisis estadístico SPSS para Window, versión 21. Las variables cualitativas se describieron en frecuencias absolutas y cifras porcentuales, mientras que para la descripción de los valores de las variables cuantitativas se utilizaron la media y la mediana, como medidas de tendencia central; y la desviación estándar (DE) y el rango intercuartílico (RI), como medidas de dispersión.
Para determinar la asociación de variables cualitativas se empleó la prueba de chi cuadrado o la prueba de Fisher en el caso de las tablas de 2 X 2, con frecuencias esperadas menores de 5. Para la comparación de variables cuantitativas que no siguieron una distribución normal o cualitativas ordinales, se empleó la prueba no-paramétrica, U de Mann- Whitney (dos grupos). Durante la investigación se cumplieron los principios éticos, partiendo de la aplicación de los principios de la Bioética.
Resultados
Durante la investigación fueron estudiados 50 ojos correspondientes a 50 pacientes con afaquia e inadecuado soporte capsular, quienes fueron divididos en dos grupos de acuerdo con el tipo de implante recibido: grupo A (LIO rígido de CA con apoyo angular) y grupo B (LIO plegable suturado a iris). Cuando se realizó un análisis de la edad por categorías se observó que en ambos grupos predominaron los pacientes con 60 años o más. Estos constituían el 76,0 % en el grupo A y el 80,0 % en el grupo B (p= 0,733). En el 60,0 % de los pacientes del grupo A, el ojo tratado fue el derecho, mientras que en el grupo B el ojo tratado con mayor frecuencia fue el izquierdo (56,0 %).
Al comparar los valores de la mejor agudeza visual sin y con corrección antes y después de la operación al año, puede observarse que en ambos grupos se produjo una mejora significativa de la mejor agudeza visual sin y con corrección (p< 0,05). El 96,0 % de los pacientes del grupo B presentaron MAVCC de 0,5 o más, lo que contrastó con el 60,0 % observado en el grupo A (Fig. 1). Solo 4 pacientes pertenecientes al grupo A presentaron mala visión (MAVCC < 0,1) (Fig. 2).

Fig. 1- Distribución de los pacientes según la presencia de buena visión y el grupo de tratamiento quirúrgico.
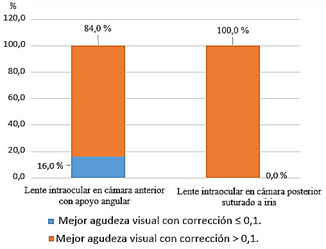
Fig. 2- Distribución de los pacientes según la presencia de mala visión y el grupo de tratamiento quirúrgico.
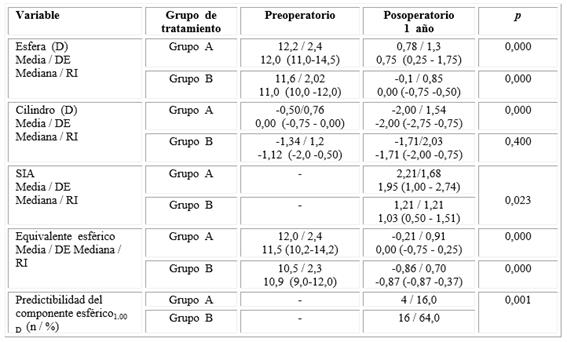
Cuando se analizaron los valores de la esfera, pudo observarse que en el grupo A se produjo una disminución significativa del valor de la media de esta, ya que pasó de 12,2 ± 12,4 dioptrías (D) antes de la cirugía a 0,78 ± 1,25 D poscirugía. El grupo B pasó de valores muy positivos (11,1 ± 2,02 D) a un valor negativo muy cercano al ideal (-0,1 ± 0,85 D). En el Grupo A se produjo un incremento significativo de la desviación del cilindro después de la cirugía, ya que pasó de -0,50 ± 0,76 a -2,00 ± 1,54 (p= 0,014), lo que contrasta con la menor modificación que se produjo en el grupo B (-1,34 ± 1,2 D a -1,71 ± 2,03 D, p= 0,400). Cuando se analizó el grado de variación del cilindro (ΔC) vimos que la variación fue más marcada en el grupo A con respecto a la observada en el Grupo B (-1,54 ± 1,73 vs. -0,43/1,55 D, p= 0,030). En el equivalente esférico en ambos grupos hubo una tendencia significativa a la emetropía (p= 0,000) en el análisis de la predictibilidad refractiva, para un rango estricto de 1,00 D. Esta solo se observó en el 16,0 % de los pacientes del grupo A y en el 64,0 % de los pacientes del grupo B (p= 0,001) (Tabla).
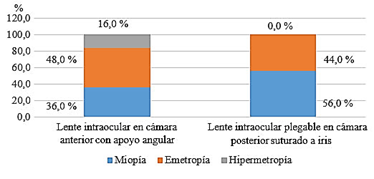
En relación con los resultados refractivos obtenidos según el grupo de tratamiento, en el grupo A predominaron los pacientes que quedaron emétropes, y le siguieron los pacientes miopes. En el grupo B, por el contrario, predominaron los pacientes miopes y, a diferencia del grupo anterior, ningún paciente quedó hipermétrope (p= 0,068) (Fig. 3).
Discusión
Los pacientes estudiados se encontraban en un rango de edades entre la adultez media y la tercera edad, con un predominio de estos últimos en ambos grupos de estudio. Se trata de pacientes afáquicos después de una cirugía de catarata, y si bien una causa pueden ser las cataratas traumáticas, la cual pudiera explicar la presencia de pacientes en la década de los cuarenta, las cataratas más frecuentes son las seniles, lo que justificaría el predominio de pacientes de 60 años o más.25
Por otra parte, cuando la diferencia de edades no fue significativa, el valor de la mediana de edad fue superior en los pacientes del grupo A. Donaldson y otros26) señalan que el LIO de la CA con apoyo angular es reservada para ser usada en pacientes ancianos y en los que no cooperen con otra técnica por requerir un mayor tiempo quirúrgico, como sucede en el grupo B.
En ambos grupos se observó un predominio de pacientes del sexo masculino. Esto pudiera explicarse por el hecho de que la cirugía de catarata es más frecuente en los pacientes del sexo masculino.27
Para el análisis de los resultados visuales con cada técnica se tuvieron en cuenta variables como la MAVSC, la MAVCC, buena visión [porcentaje de pacientes con una MAVCC de 20/40 (0,5) o más], mala visión [porcentaje de pacientes con una MAVCC de 20/200 (0,1) o menos], y la refracción (esfera, cilindro, equivalente esférico, predictibilidad del componente esférico en un rango estricto de ± 1,00 D y resultado refractivo). Puede observarse que en ambas técnicas se logra una mejoría significativa de la MAVSC. En el caso del grupo A (LIO rígido en CA) se produce como promedio una mejoría de 8 líneas en la cartilla de Snellen, mientras que en el grupo B esta mejoría es de 14 líneas si se analizan los valores de la media preoperatoria y posoperatoria. Algo similar ocurre en el caso de la MAVCC. Según los valores de la media, en el grupo A se produce una mejoría de una línea, mientras que en el grupo B es de dos líneas. Cuando se compararon los resultados obtenidos en este estudio con los de otros autores, el porcentaje de pacientes con buena visión [MAVC de 20/40 (0,5) o más] del grupo A se quedó por debajo de los reportados por Bayramlar y otros28 (76,5 %, 16/22 pacientes); Ellerton y otros29 (75 %, 60/81 pacientes) y Drolsum y Haaskjold30 (77 %, 17/22 pacientes) en pacientes donde se implantó LIO rígido de CA flexible de asas abiertas con apoyo angular, después de la cirugía de catarata.
Drolsum y Haaskjold30 también reportaron un 3,7 % de pacientes con mala visión (3/22) muy por debajo del encontrado en el presente estudio. Sin embargo, el porcentaje de pacientes con buena visión fue bastante similar al reportado por Hykinet y otros31 (60 %, 6/10 casos) en pacientes con cirugía de catarata complicada (extracción extracapsular de la catarata) y que fueron seguidos por un período de 24-42 meses.
En el caso del Grupo B, el porcentaje de pacientes con buena visión fue muy superior a los reportados por Hoh y otros,32) quienes estudiaron 6 pacientes afáquicos después de la catarata no complicada, y reportaron el 67 % (4 pacientes); por el contrario, el 17 % de mala visión (1 paciente) reportado por ellos fue muy superior al hallado en nuestra investigación (0,0 %). El porcentaje de buena visión obtenido en este trabajo también fue superior al observado por Navia-Arayet y otros,33 quienes reportaron el 65 %, mientras que ningún paciente presentó una visión de 20/200 (0,1) o peor, al igual que en el presente estudio.
Al analizar los resultados de la refracción se puede observar que en el caso del componente esférico el valor de la mediana disminuyó en ambos grupos. Este alcanzó un 0,00 D en el Grupo B y en el A se situó por debajo de 1,00 D, lo que pone en evidencia la mejoría en el componente esférico en estos pacientes. Por el contrario, los valores del cilindro se distanciaron negativamente del valor 0,00 D después de la cirugía. Este distanciamiento fue significativo en el grupo A, no así en el grupo B.
Para el análisis del astigmatismo inducido por la cirugía, existen dos métodos básicos: uno es la sustracción de los cilindros, antes y después de la intervención, que si bien este valor es importante en término de resultados visuales (fórmula de cálculo del equivalente esférico), no brinda información acerca de los efectos de la cirugía en la córnea. El otro método es el análisis vectorial (SIA).
En el presente estudio la SIA fue analizada de acuerdo con el método de Alpins.34 Este método usa vectores para el análisis del astigmatismo corneal inducido por las cirugías de catarata y las cirugías refractivas. El astigmatismo, con la potencia del cilindro y el eje, se describe mejor con vectores matemáticos, porque un vector permite combinar la magnitud y la dirección en una sola expresión matemática.34 Se puede inferir -a partir del resultado observado- que el astigmatismo inducido por la cirugía es significativamente superior en el grupo A. Esto puede ser explicado a partir de lo reportado en las cirugías de catarata. Se han identificado varios factores relacionados con la cirugía que se asocian con el astigmatismo después de la cirugía. Estos factores pueden ser extrapolados a las cirugías de implante secundario de la LIO. Entre ellos se encuentran la incisión (tamaño, localización, y arquitectura); la sutura (técnica, material, tensión); la presión intraocular; la inclinación de la lente; la cicatrización de la herida; la dehiscencia de la sutura; etcétera.
Se ha encontrado que incisiones < 3,5 mm inducen por lo general menos de 0,50 D de astigmatismo, mientras que si son mayores inducen mayor astigmatismo. En relación con la localización de la incisión, las incisiones temporales inducen menos astigmatismo. La localización de la sutura, el largo y la tensión son asociadas también. Suturas radiales inducen más cilindro en el meridiano en que se encuentran situadas y las suturas largas y apretadas inducen más astigmatismo en ese meridiano. La incisión utilizada en la implantación de la LIO suturada a iris es un 50 % menor a la utilizada en la LIO de la CA, hecho que puede explicar la mayor inducción de astigmatismo, por esta última. En varios estudios que comparan la inducción del astigmatismo de la LIO suturada a iris con respecto a otras técnicas se ha observado que esta induce menos astigmatismo, aunque la diferencia no ha sido estadísticamente significativa.35 Esto también es reportados en estudios donde se analizan los resultados de la técnica de manera individual.36 Debe tenerse en cuenta que el astigmatismo inducido por la cirugía también puede ser otro factor que explique los resultados de la MAVSC después de la cirugía en ambos grupos de pacientes. La predictibilidad del componente esférico fue superior en el grupo B, y esto puede estar relacionado con la forma en que se calcula la potencia de la LIO a implantar. En el grupo B este cálculo pudiera ser más específico al emplear la tabla de reconversión. En él se analizó el equivalente esférico y se observó que los valores de la mediana posoperatoria tienden a la miopía. Esto es marcado en el segundo grupo, donde más de la mitad de los pacientes quedan miopes después de la cirugía.
La LIO plegable de la cámara posterior suturada a iris muestra ser eficaz; induce, además, menos astigmatismo y es mejor en la predictibilidad de la esfera en un rango estricto de ± 1,00 D.