Introducción
La prevalencia de la catarata tiende a aumentar a la par del envejecimiento poblacional.1) El único tratamiento efectivo hasta el momento es la cirugía; por tanto, la tendencia actual es que la necesidad de estas intervenciones debe seguir en aumento, debido al crecimiento de la población mundial y a su envejecimiento.2,3
Los resultados refractivos de la cirugía de catarata han mejorado con el paso del tiempo como resultado del perfeccionamiento de la técnica, y por el hecho de contar con datos biométricos más precisos, así como con nuevas fórmulas para el cálculo del poder de la lente intraocular (LIO).4,5,6) Por otra parte, la corrección con láser de los trastornos refractivos se ha convertido en un tratamiento popular en la población y son varios los que solicitan este tipo de cirugía: la queractectomía fotorrefractiva (PRK); la queratomileusis in situ con láser (LASIK); la queratectomía subepitelial asistida por láser (LASEK) y la epi-LASIK, técnica muy similar a la LASEK.7,8
Muchos de los pacientes tratados con estas cirugías, así como con queratotomía radial (QR) desarrollan con el paso del tiempo cataratas y requieren entonces de una cirugía con implante de una LIO. En la actualidad, el cálculo preciso del poder dióptrico de la LIO es esencial en el logro de resultados óptimos con la cirugía de catarata. Olsen9 resume de manera concreta con tres razones su importancia. Este autor señala, en primer lugar, que el uso de pequeñas incisiones, y con esto la disminución de la necesidad de suturas, ha reducido el astigmatismo inducido por la cirugía. En segundo lugar, destaca el desarrollo de las LIO esféricas y multifocales de varios diseños y, por último, resalta la introducción de la interferometría de coherencia parcial (IOL Master, Carl- Zeiss Meditec, Jena, Germany), la cual ha permitido la medición de la longitud axial del ojo (LA) y la queratometría (K) con mayor precisión, así como de otras mensuraciones con una máxima disminución de las variaciones interobservador.9,10,11
La posición efectiva de la LIO (ELP, por sus siglas en inglés) es la única medida que no puede determinarse en el preoperatorio y, por tanto, debe estimarse a partir de la fórmula. Además, es importante señalar el papel de las constantes que brindan información acerca de las características físicas de cada modelo de LIO e influyen en el comportamiento refractivo.9) Las fórmulas deberán predecir, a partir de las mediciones que se realizan, la potencia de la LIO y su posición en el globo ocular. Se identifican 5 generaciones de acuerdo con el número de factores necesarios para predecir este parámetro. Las más utilizadas en la actualidad son las de tercera, cuarta y quinta generación, que utilizan dos o más parámetros oculares para estimar la posición efectiva de la lente intraocular.12,13
La cirugía refractiva (láser e incisional) altera la curvatura corneal e introduce un error en ambos aspectos, dígase la medición del poder refractivo de la córnea y la predicción de la ELP. Ambos tipos de error provocan una subestimación del poder de la LIO en ojos en los que se corrigió la miopía y una sobreestimación de la LIO en ojos en los que se corrigió la hipermetropía.12,14) La cirugía láser modifica la curvatura anterior de la córnea, pero deja intacta la curvatura posterior, por lo que altera la relación normal existente entre ambas curvaturas. Los queratómetros y los topógrafos que se utilizan para determinar el poder de la córnea miden el radio de la curvatura anterior y no miden la posterior; por tanto, para el cálculo del poder óptico se usa el índice de refracción estándar (1,3375). Estas fórmulas toman el índice queratométrico, como normalmente ocurre, pero este no es válido en los pacientes con antecedentes de cirugía refractiva.12,14,15
Otro error cometido en el cálculo por las fórmulas tradicionales es del instrumento. Este error está relacionado con la asunción hecha por muchos instrumentos, los cuales extrapolan la medición de la curvatura de la córnea central a partir de mediciones paracentrales, que no genera problemas en la córnea normal, no operada, pero después de la ablación en un paciente miope estos instrumentos pueden medir una curvatura corneal más empinada que la que hay en realidad en el área central.15,16
El tercer error está relacionado con el hecho de que las fórmulas de tercera generación utilizan el poder de la córnea y la LA para predecir la ELP. Con la K estándar y una fórmula de tercera generación, sin realizar ajustes, en los pacientes operados de miopía, se va a generar una sobreestimación del poder de la córnea central y un resultado posoperatorio hipermetrópico después de la cirugía de catarata. En los pacientes operados de hipermetropía se va a presentar una subestimación del poder de la córnea central que conduce a una sobreestimación del poder del lente y a un resultado miópico después de la cirugía de catarata. Para resolver este aspecto, Jaime Aramberri desarrolló el método Doble-K, y el cálculo de la Kpost se realiza con el método de la historia clínica. Este error no se produce en algunas fórmulas, como en la de Haigis, la cual no estima la ELP a partir del poder corneal.15,17
Savini y Hoffer15 identifican un cuarto error: el cambio en la esfericidad de la córnea inducido por la cirugía ablativa corneal, donde la magnitud del error será mayor en los pacientes operados de miopía. Este parámetro juega un papel importante en el cálculo del poder de la LIO y, por tanto, sería lógico esperar que lo sea, aún más después de la cirugía láser.14) En el caso de la QR, esta aplana ambas curvaturas en una zona óptica central pequeña, pero sobre todo la curvatura posterior; por tanto, el índice queratométrico tampoco es válido en estos pacientes, y como consecuencia la K estándar tiende a sobreestimar el poder de la córnea. Esta córnea, además, tiene con frecuencia un astigmatismo irregular como consecuencia de las incisiones asimétricas, y puede haber un aplanamiento central después de la cirugía de catarata, como resultado del edema corneal.14,15
En la actualidad existen métodos para obtener el verdadero poder de la córnea después de la cirugía refractiva. Algunos de estos métodos son válidos solo para los tratados con cirugía refractiva con láser; otros solo para QR, y otros son útiles para ambas estrategias quirúrgicas. Otra opción es la medición del poder neto de la córnea. Para esto se han empleado instrumentos que pueden medir directamente las curvaturas corneales anterior y posterior. Tal es el caso del Orbscan, la tomografía de coherencia óptica (OCT) y el Pentacam.15,18,19,20,21,22,23
A partir de los problemas con la cirugía refractiva, durante los últimos 17 años, se han desarrollado más de 30 fórmulas y/o métodos para el cálculo del poder de la LIO. Algunas de ellas son útiles después de ambos tipos de procedimientos quirúrgicos (cirugía refractiva láser y QR).15,24) La fórmula matemática detrás del método de Barrett True-K no se ha publicado. Se sabe que el índice queratométrico es modificado y que utiliza las fórmulas Barrett Universal II, y que la Doble K se utiliza en los pacientes con antecedentes de cirugía refractiva y en ojos de cualquier tamaño. Varios estudios avalan la obtención de resultados refractivos precisos y se considera en la actualidad una de las mejores opciones en pacientes con antecedentes de cirugía refractiva.25,26,27,28,29,30,31,32,33
Esta fórmula se encuentra disponible en el equipo Pentacam AXL adquirido por la institución (único en el país). Este tomógrafo de alta resolución tiene múltiples prestaciones; entre ellas, la del cálculo de la LIO con gran variedad de fórmulas. La versión con que contamos en el centro (AXL) solo tiene incorporadas las fórmulas estándar (SRK/T, Holladay 1, Hoffer Q, Haigis y Barrett Universal II), y solo para las córneas tratadas, la fórmula Barrett True-K. En la actualidad ya existen pacientes que después de esos procedimientos requieren cirugía de catarata, lo que implica complicaciones dadas por el cálculo del poder de la LIO y el alto nivel de exigencia de estos con este tipo de cirugía. Es por eso que con esta investigación nos propusimos determinar los resultados refractivos en pacientes operados de catarata con cirugía refractiva corneal, según el cálculo del poder dióptrico de la lente intraocular con la fórmula Barrett True K.
Métodos
Se realizó un estudio pre-experimental del tipo antes y después a 31 ojos (18 pacientes) atendidos en el Centro de Microcirugía Ocular del Instituto Cubano de Oftalmología “Ramón Pando Ferrer”, quienes tenían antecedentes de cirugía refractiva corneal y diagnóstico de catarata con criterio quirúrgico, en el periodo comprendido entre mayo del año 2018 y diciembre de 2019. La determinación del poder dióptrico de la córnea, la biometría para la obtención de la longitud axial y la selección de la fórmula Barrett True K para el cálculo del poder de la lente intraocular a implantar se realizó con el topógrafo OCULUS Pentacam AXL (pentacámara rotatoria de Scheimpflug), (Oculus, Wetzlar, Alemania) con el programa IOL Calculator.
Todas las cirugías de catarata (facoemulsificación) fueron realizadas por un mismo cirujano y los pacientes se siguieron por un periodo de 3 meses. Las principales variables de salida fueron la proporción de pacientes que logran agudeza visual sin corrección (AVSC) igual o mejor a 20/20, AVSC posoperatoria igual o mejor a 20/40, y la proporción de ojos que caen dentro de ±0,5 dioptrías o ±1 dioptría de la corrección refractiva intentada.
Cuando se efectuó la presente investigación no existió en la institución la disponibilidad de lentes intraoculares de medias dioptrías; por tanto, no siempre fue posible la elección de la LIO precisa para una esfera posoperatoria idealmente planificada en el rango de la emetropía, y se decidió seleccionar media dioptría por encima del valor calculado en tales casos.
Los datos analizados fueron recogidos a partir de las historias clínicas (HC) de los pacientes, así como los informes operatorios y los resultados de los exámenes diagnósticos, los cuales fueron realizados según el protocolo establecido en el centro. Los datos primarios se procesaron con el programa informático para el análisis estadístico SPSS para Windows, versión 21.
El análisis descriptivo de las variables cualitativas se realizó mediante frecuencias absolutas y cifras porcentuales, mientras que para la descripción del comportamiento de las variables cuantitativas se utilizaron la media y la mediana, como medidas de tendencia central, y la desviación estándar (DE) y el rango intercuartílico (RI), como medidas de dispersión.
En el análisis inferencial se utilizaron tanto pruebas paramétricas como no paramétricas. Cuando se trató de una variable de más de dos categorías se utilizó la prueba de chi cuadrado; para la comparación de variables cuantitativas que no siguieron una distribución normal o cualitativas ordinales se empleó la prueba no-paramétrica de Kruskal-Wallis (más de dos grupos); si eran dos grupos se utilizó la prueba U de Mann Whitney. Cuando se trató de 2 muestras pareadas evaluadas en el momento preoperatorio y a los 3 meses se empleó la prueba de los rangos con signos de Wilcoxon. En todos los casos se utilizó un nivel de significación de 0,05.
El procedimiento se realizó bajo estricto cumplimiento de los principios éticos, partiendo de la aplicación de los principios de la Bioética, y según las normas de la investigación
científica vigente emanadas de la Declaración de Helsinki.
Resultados
En la tabla 1 aparecen las características demográficas de los pacientes incluidos en el presente estudio.
Tabla 1 Características demográficas
NP: No procede, DE: desviación estándar, RI: rango intercuartílico, *Prueba binomial, Mín: mínimo, Máx: máximo.
Fuente: Historia clínica.
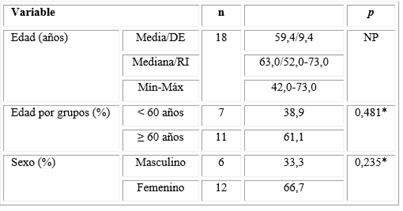
Puede apreciarse que la media de edad de los pacientes analizados correspondió a la de un adulto medio (59,4 años, DE: 9,4 años). El paciente con menos edad tenía 42,0 años y el de mayor edad 73,0 años. Más del 50 % de los pacientes presentaba 60 años o más y pertenecía al sexo femenino (61,1 % y 66,7 %), aunque las diferencias encontradas en la distribución de los pacientes por edad y por sexo no fueron significativas desde el punto de vista estadístico.
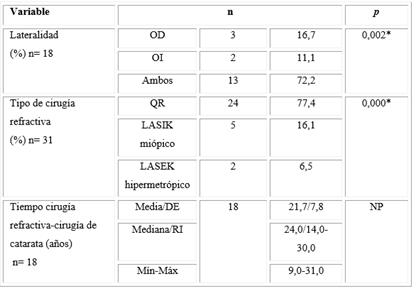
En la tabla 2 se muestra la información referente a los antecedentes de la cirugía refractiva. Puede observarse que en un porcentaje mayoritario de los pacientes fueron analizados ambos ojos (72,2 %) y se les había realizado una QR (77,4 %). Solo el 16,1 % fue tratado con LASIK y el 6,5 % con LASEK.
El valor de la mediana del tiempo mediado entre la cirugía refractiva y la cirugía de catarata fue de 24,0 años (RI: 14,0-30,0 años), el menor tiempo reportado fue de 9 años y el mayor de 31,0 años.
Tabla 2 Antecedentes de cirugía refractiva en los pacientes estudiados
OD: Ojo derecho, OI: ojo izquierdo, QR: Queratotomía radial, LASIK: Queratomileusis in situ con láser, LASEK: Queratectomía subepitelial asistida por láser, DE: desviación estándar, RI: Rango intercuartílico, NP: No procede, Mín: mínimo, Máx: máximo. *Prueba de chi cuadrado.
Fuente: Historia clínica.
En la tabla 3 se analizan los cambios en la función visual después de la cirugía de catarata. Puede observarse que el valor de la mediana de la AVSC precirugía es muy bajo en relación con el obtenido después de la cirugía de catarata (0,12, RI: 0,09-0,25 vs. 0,60, RI: 0,50-0,80, p= 0,000). Algo similar ocurrió con la AVMC pre- y posoperatoria, se produjo una mejoría importante después de la cirugía. El valor de la mediana de la AVMC posoperatoria fue de 0,90 (RI: 0,80-1,00), lo que contrasta con los valores preoperatorios (0,40, RI: 0,26-0,80).
Cuando se analizó el comportamiento de la variable esfera, se observó que de los valores muy negativos que superaban la unidad antes de la cirugía (-3,25 D, RI: -5,19-0,69 D), esta alcanzó valores cercanos a 0 (-0,50 D, RI: -1,00 − -0,25 D) después de la cirugía, siendo la diferencia estadísticamente significativa (p= 0,006). Con la cirugía disminuyó el astigmatismo, el cual pasó de -1,50 D (RI: -2,18 − -0,81 D) a -1,00 D (RI: -1,50 − -0,50 D), p= 0,001. El equivalente esférico precirugía fue de -4,05 D (RI: -6,12 − -1,56 D) y mejoró después de la cirugía (-1,00/-1,25 − -0,50).
Tabla 3 Cambios en la agudeza visual y la refracción después de cirugía de Catarata
| Variable | Preoperatorio | Posoperatorio | ||
|---|---|---|---|---|
| AVSC | Media/DE | 0,17/0,10 | 0,66/0,18 | 0,000 |
| Mediana/RI | 0,12/0,09-0,25 | 0,60/0,50-0,80 | ||
| AVMC | Media/DE | 0,48/0,33 | 0,89/0,12 | 0,000 |
| Mediana/RI | 0,40/0,26-0,80 | 0,90/0,80-1,00 | ||
| Esfera (D) | Media/DE | -3,11/4,9 | -0,45/0,62 | 0,006 |
| Mediana/RI | -3,25/-5,19-0,69 | -0,50/-1,00 ˗ -0,25 | ||
| Cilindro (D) | Media/DE | -1,69/1,2 | -1,10/0,63 | 0,001 |
| Mediana/RI | -1,50/-2,18 ˗ -0,81 | -1,00/-1,50 ˗ -0,50 | ||
| Equivalente esférico (D) | Media/DE | -3,75/4,9 | -0,88/0,56 | 0,003 |
| Mediana/RI | -4,05/-6,12 ˗ -1,56 | -1,00/-1,25 ˗ -0,50 | ||
DE: Desviación estándar, RI: Rango intercuartílico, D: Dioptrías, *Prueba de los rangos con signos de Wilcoxon.
Fuente: Historia clínica
En la tabla 4 se analizan los indicadores de resultado de una cirugía de catarata. Puede observarse que solo el 9,7 % de los pacientes analizados logró una visión 20/20 y el 90,3 % logró una visión de 20/40 o más. En el 35,5 % se logró un equivalente esférico de ±0,50 de la emetropía y el 64,5 % de los casos estudiados tenía un equivalente esférico pososperatorio de ±1,0 D de la emetropía. El 71,0 % de los pacientes estudiados quedaron miopes y el 29,0 % restante quedó emétrope.
Tabla 4 Comportamiento de los indicadores de la función visual y resultados de la refracción

Fuente: Historia clínica.
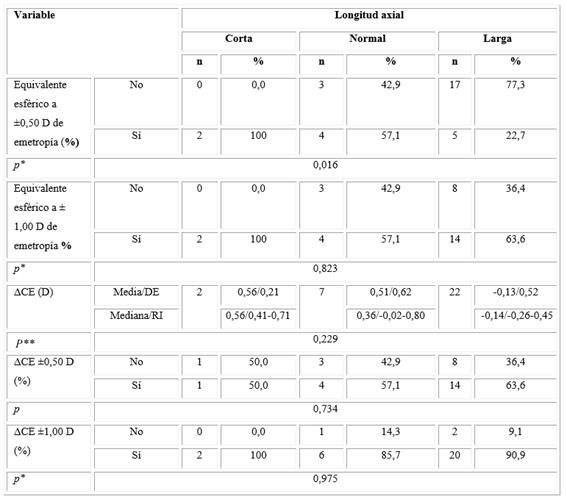
Cuando se analizó el porcentaje de pacientes con un equivalente esférico a ±0,50 de la emetropía según la LA, se observó que el 100 % de los ojos con una LA corta presentó un equivalente esférico de ±0,50; en los ojos normales este porcentaje fue de 57,1 % y del 22,7 % cuando el ojo fue largo. Hubo una tendencia a la disminución y la diferencia encontrada fue estadísticamente significativa (p= 0,016). Un análisis similar se realizó para el equivalente esférico a ±1,00 de la emetropía y no se observó la tendencia a la disminución en la medida en que el ojo era más grande (100; 57,1 y 63,6 %).
En el análisis de la diferencia entre el componente esférico esperado y el obtenido (ΔCE) se observó que la diferencia tendió a ser más pequeña en la medida en que el tamaño del ojo aumentó, aunque la diferencia no fue significativa desde el punto de vista estadístico (p= 0,229). El porcentaje de pacientes con un ΔCE ±0,50 D fue ligeramente superior en la medida en que aumentó el tamaño del ojo (50,0 %; 57,1 %; 63,6 %), pero no se pudo descartar que las diferencias encontradas se debieran al azar (p= 0,734). Esta tendencia no se observó cuando se analizó el ΔCE ±1,00 D (100 %; 85,7 %; 90,9 %) (Tabla 5).
Discusión
La operación de catarata después de la cirugía refractiva es complicada, por las imprecisiones en las estimaciones del poder de la LIO y por las altas expectativas del paciente. En el presente estudio se analizaron los resultados de un grupo de pacientes con antecedentes de cirugía refractiva, en su mayoría con QR, que ahora requirieron operación de catarata. Se trató de pacientes adultos mayores, en su mayoría, aunque hubo un porcentaje superior al tercio del grupo analizado, que presentó menos de 60 años.
En el estudio realizado por Wang y otros30 la media de edad fue de 63 años (DE: 7 años); el paciente de menor edad tenía 46 años y el de mayor de 79 años. En otro estudio liderado por la misma investigadora el valor de la media de edad para los grupos estudiados por ellos osciló entre 64,5 años (DE: 7,1 años) y 68,6 años (DE: 4,6 años) y el rango de edades estaba entre 45 y 80 años. Este predominio de adultos mayores ocurre porque se trata de cataratas relacionadas con la edad en pacientes con antecedentes de cirugía refractiva; de ahí que el promedio de edades en estos estudios sea similar.34 Existió un predominio de los pacientes del sexo femenino, característica observada en la mayoría de los otros estudios revisados.27,35,36)
Estos pacientes tienen como antecedente haberse realizado una cirugía refractiva. Según el estudio realizado por Kuo y otros,37 con el objetivo de identificar las características de los pacientes que solicitan este tipo de cirugía, los investigadores reportaron que este procedimiento lo buscan sobre todo los pacientes jóvenes y las mujeres. Este fenómeno puede ser explicado en parte por la mayor prevalencia de miopía en las féminas, y el deseo estético en ellas. El hecho de que sean más las mujeres las que buscan este tipo de cirugía puede ser una razón que explique el mayor predominio en el estudio.
Predominaron los ojos en los cuales se realizó la QR, que fue el primer tipo de cirugía refractiva que se realizó en el país. Solo después del año 2004 es que se contó con la tecnología del láser excímero; de ahí que los pacientes con antecedentes de habérsele realizado cirugía refractiva con láser estén menos representados.38) El tiempo promedio se corresponde con el inicio de este tipo de cirugía y tendió a ser menor en los ojos operados con LASIK y LASEK, resultado no mostrado.
Urrutia Breton y otros39 estudiaron 18 ojos de 13 pacientes que habían sido tratados previamente con QR y LASIK, realizadas entre los años 1984 y 2001, y a los que se les realizó cirugía de catarata entre 1999 y 2004. Ellos reportaron un promedio de tiempo entre ambas cirugías de 11,61 ± -5,21 años (rango de 2 a 20 años). Esto es importante, sobre todo para la QR, por las características de su estabilización.
Con la cirugía de catarata se obtuvo una mejoría significativa de la AVSC, de la AVMC, de los componentes de la refracción (esfera, cilindro) y del equivalente esférico. Pero cuando se analizan los resultados globales y se comparan con los estándares propuestos por el Colegio Real de Oftalmólogos británicos, estos valores se quedan muy por debajo. Por ejemplo, en los individuos sin comorbilidades la proporción de estos con una AVSC de 20/20 debe ser del 27,3 %, y en el presente trabajo este porcentaje está por debajo del 10 %. El porcentaje de pacientes con 20/40 debe ser de 80,9 % o más, y en el presente estudio se logra un porcentaje superior.40
Cuando analizan el promedio de ojos con un equivalente esférico a ±1,00 D de emetropía, ellos proponen que el 85 % debe entrar en esta categoría, y en el presente estudio este porcentaje alcanza el 64,5 %. Algo similar ocurre cuando se trata del equivalente esférico a ±0,50 D de emetropía. Ellos plantean que el grupo de pacientes en esta categoría debe ser del 55 % y aquí se obtiene un valor inferior.41 Estas diferencias pueden ser explicadas en gran parte porque la mayoría de los pacientes presentaban antecedentes de cirugía refractiva incisional, nivel en que este tipo de cirugía compromete el cálculo de la LIO por los errores que puede potenciar, es decir, por las propias características de la técnica quirúrgica utilizada, en particular la QR, realizada en la mayoría de los pacientes analizados en el presente estudio.
En los trabajos revisados de pacientes con antecedentes de cirugía refractiva que fueron sometidos posteriormente a cirugía de catarata se mantuvo esta tendencia. El mayor porcentaje de estos se encontraban con un equivalente esférico (EE) a ±1,00 D, y el menor en ±0,50 D. Savini y Hoffer15 realizaron un estudio a varios ojos operados de cirugía refractiva corneal miópica con diferentes métodos para el cálculo de la LIO, y mostraron un error predictivo del 60 al 70 % dentro de ±0,50 D. Por otra parte, Cho y otros29 evaluaron 80 ojos operados de miopía y utilizaron el poder refractivo corneal total (TCRP) en la zona de 4 mm por Scheimpflug, que es medido por el método Ray Tracing para calcular el poder refractivo total, con buenos resultados (60 y 90 % de ojos dentro de ±0,50 D y ±1,00 D de refracción deseada respectivamente).
Rosen y otros35 calcularon el poder de la LIO en pacientes con cirugía refractiva comparando 8 fórmulas; entre ellas, analizaron 64 ojos con cirugía fotoablativa calculado con la fórmula Barrett True K, y reportaron el 80 % con un EE a ± 1,00 D y de 75 % dentro de un EE a ±0,50 D. Wang y otros30 estudiaron 104 ojos de 80 pacientes quienes tuvieron LASIK/PRK miópico previo y cirugía de catarata con implante de LIO, y compararon el cálculo de LIO obtenido por la fórmula del tomógrafo de coherencia óptica (OCT) y la Barrett True K con los métodos del calculador de la Sociedad Americana de Catarata y Cirugía Refractiva (ASCRS), por sus siglas en inglés.
Con el OCT, True K no histórica, Wang-Koch-Maloney, Shammas, Haigis-L y el promedio de estas 5 fórmulas, el porcentaje de ojos dentro de ±0,50 D de error de predicción refractivo fue de 68,3; 58,7; 50,0; 52,9; 55,8 y 67,3, respectivamente, y el porcentaje de ojos dentro de ±1,00 D fueron 92,3; 90,4; 869; 88,5; 90,4 y 94,2 %, respectivamente. Concluyeron en su estudio que tanto el OCT como la True-K son fórmulas que prometen y el calculador online ha sido actualizado para incluirlas.
A pesar de tratarse de pacientes miópicos en su gran mayoría, estos tendieron a quedar miopes y no hipermétropes, como cabría esperar, dados los errores en el cálculo de la LIO asociados con este tipo de cirugías. Esto también está dado porque el cirujano, al determinar el resultado de la esfera a obtener, realiza los cálculos para que el paciente vaya a la miopía y no a la hipermetropía (comunicación personal). Además, al elegir la LIO a implantar y por la no disponibilidad en la institución de lentes con medias dioptrías, se escogió 0,5 D por encima de la ideal, lo que conlleva un error ligeramente miópico posoperatorio. Este tipo de error es más tolerable con los trastornos acomodativos que se observan con el envejecimiento.42)
En el presente estudio se observó que la frecuencia de pacientes con equivalente esférico a ±0,50 D de emetropía, disminuía en la medida que aumentaba la LA y esta diferencia era significativa. No sucedía así cuando se trataba del equivalente esférico a ±1,00 D de emetropía. Cuando se observa el comportamiento de la diferencia del componente esférico (error detectado entre lo esperado y lo observado), se observa que, en la medida en que aumenta, disminuye la mediana del error, lo que sugiere que lo observado previamente con el equivalente esférico no se debe a la fórmula empleada para realizar el cálculo de la LIO; todo lo contrario, esta parece funcionar mejor en los ojos grandes, según lo que puede inferirse de estos resultados. Por tanto, los problemas encontrados con el equivalente parecen estar más vinculados con el cilindro, problemas que no fueron resueltos completamente con la cirugía de catarata, en la cual se produjo una mejoría significativa, pero la mediana del valor se mantenía alrededor de 1 D.
La mayoría de los pacientes habían sido tratados con QR y las córneas de estos tienden a ser irregulares con múltiples zonas empinadas o aplanadas (astigmatismo irregular). Otros aspectos importantes en ellos son la variación diaria de la refracción, la reapertura de las incisiones y el correspondiente edema, la inestabilidad corneal y la regresión de la miopía.43) Todo esto pudiera explicar los resultados encontrados en relación con la agudeza visual y el equivalente esférico. Por otra parte, la fórmula de Barrett True K parece funcionar mejor en los pacientes con una mayor LA. Para la Barrett Universal II se ha reportado que tiene mejores resultados que otras fórmulas en los pacientes miópicos y esta fórmula forma parte del origen de la fórmula True-K.44)
La fórmula Barrett True-K resulta útil para el cálculo de la lente intraocular en pacientes operados de catarata y cirugía refractiva corneal previa, al existir una mejoría en la agudeza visual con y sin corrección, así como de las variables refractivas pre- y posoperatorias.