Introducción
El ojo humano es un instrumento óptico simple, pero extremadamente robusto.1 Se compone de solo dos lentes positivas: la córnea y el cristalino, que producen imágenes reales en la retina e inician el proceso visual. Cuando se compara con los sistemas ópticos artificiales, a menudo formados por muchas más lentes, el ojo es simple pero está muy bien adaptado a los requisitos del sistema visual.2
Los sistemas de imágenes para el diagnóstico y la evaluación del segmento anterior del ojo constituyen una herramienta fundamental para el oftalmólogo. Hasta hace poco, el uso de estas técnicas proporcionaba fundamentalmente información cualitativa sobre ciertas enfermedades; sin embargo, el desarrollo de nuevas técnicas de cuantificación abre una Nueva Era de evaluación y tratamiento basado en imagen. La obtención de medidas estructurales y geométricas precisas en el ojo permite el desarrollo de modelos individualizados para cada paciente, lo cual posibilita incrementar la predictibilidad de diversos procedimientos.3
La medición precisa de la longitud axial (ALX: por sus siglas en inglés), la queratometría (K) y la profundidad de la cámara anterior (ACD: por sus siglas en inglés) son indispensables para calcular el poder del lente intraocular (LIO).4 Se ha reportado que el 54 % de los errores en el cálculo responde a mediciones incorrectas de la ALX.5
Hasta hace poco, la interferometría de coherencia parcial fue la técnica de biometría más usada, ya que obtenía mediciones más exactas que la ultrasonografía.6,7 Sin embargo, esta tecnología presentaba dificultades en los pacientes con cataratas maduras o cataratas subcapsulares posteriores, por lo que surgieron nuevas tecnologías de biometría, como la tomografía de coherencia óptica de fuente de barrido (OCT-SS, por sus siglas en inglés), con mayor longitud de onda y mejores resultados.6,8,9
La tomografía de coherencia óptica (OCT: por sus siglas en inglés) es una técnica no invasiva y de no contacto que provee imágenes de alta calidad y análisis de tejidos oculares.10 En el año 1994, Izatt y otros presentaron el primer estudio de imágenes con OCT de la córnea y el segmento anterior.11
La tomografía es una técnica donde hay una fusión de una serie de imágenes transversales para permitir una reconstrucción tridimensional generada por computadora. La tomografía de segmento anterior permite no solamente la visualización de la superficie corneal anterior, sino también de la superficie corneal posterior; de la cámara anterior; del grosor corneal y de porciones del ángulo del ojo y del cristalino. Las mediciones, como la profundidad de la cámara anterior, el grosor corneal y la densidad del lente, son ejemplos de mediciones disponibles con la tomografía de segmento anterior que no se podían efectuar con dispositivos más antiguos, ya que simplemente medían la superficie corneal anterior.12
Posteriormente se agregó topografía con discos de Plácido a los dispositivos de OCT comerciales para generar mejores mapas corneales.13,14) En la actualidad, el OCT de segmento anterior se ha convertido en una herramienta crucial en la práctica clínica.15 La OCT se puede dividir, según el sistema que utilice, en Time Domain: dominio temporal (TD-OCT), y Spectral Domain: dominio espectral (SD-OCT).16
Dominio temporal (TD-OCT)
La OCT tipo Time-domain es el método original de la OCT. Frecuentemente es comparado con el ecógrafo ultrasónico porque sus principios básicos son análogos, con TD-OCT, que usa como medio la luz, mientras que la ecografía utiliza el sonido. Ambos métodos crean una imagen seccional mediante la medición del tiempo de retardo del eco y la intensidad reflejada y dispersada de la luz o del sonido.16
Dominio frecuencial (SD-OCT)
La OCT tipo Spectral-Domain, en cambio, adquiere toda la información sin exploración axial a través del tejido; la obtiene mediante la evaluación del espectro de la interferencia entre la luz reflejada y un espejo estacionario. La diferencia clave es que en un sistema SD-OCT la longitud del brazo de referencia es fija. Las interferencias se obtienen para diferentes frecuencias (λ) simultáneamente, y la luz de salida del interferómetro se analiza con un espectrómetro (de ahí el término dominio espectral).16
En años recientes, el OCT de dominio espectral para segmento anterior ha ganado protagonismo, ya que dentro de sus tantas funciones ofrece valores biométricos del cristalino, como es el plano ecuatorial.17,18
Martínez-Enríquez y otros presentaron y validaron un modelo de OCT cuantitativo desarrollado para una estimación precisa de la geometría completa de la lente, incluyendo parámetros como el volumen de la lente, el diámetro ecuatorial y la posición del plano ecuatorial (EPP: equatorial plane position, por sus siglas en inglés), distancia desde el ápice anterior al ecuador de la lente.19
Diversas publicaciones recientes consideran el plano ecuatorial del cristalino como un parámetro muy prometedor en el desarrollo de una nueva generación de fórmulas.20,21,22
En la presente revisión, los autores consideran las aplicaciones del MS-39 (CSO, Florencia, Italia) reconocido como uno de los más avanzados OCT de segmento anterior.
MS-39
El MS-39 utiliza OCT de dominio espectral y topografía con disco de Plácido para obtener mediciones del segmento anterior del ojo. Después de autocalibrarse, el proceso de escaneo obtiene una imagen de Plácido y una serie de 25 imágenes radiales de OCT de 7,5 x 16 mm que incluyen 1024 A-scan. Usa una luz con 840 nm de longitud de onda, una resolución axial de 3,5 um y una resolución transversal de 35 um17) (Fig. 1)
 Fuente: Manual MS-39. Disponible en: https://www.csoitalia.it/en/prodotto/info/63-ms-39
Fuente: Manual MS-39. Disponible en: https://www.csoitalia.it/en/prodotto/info/63-ms-39
Fig. 1 Topógrafo MS-39.
El equipo proporciona información de paquimetría, elevación, curvatura y poder dióptrico de ambas superficies corneales. Además, brinda mapas epiteliales y estromales muy útiles en patologías de superficie corneal.18
Se ha demostrado por histopatología y por técnicas de imagen un adelgazamiento epitelial central con un engrosamiento epitelial periférico en pacientes con queratocono.23,24) Reinstein y otros describieron un patrón epitelial en forma de “dona”, usando ultrasonido de alta frecuencia, y demostró que los mapas epiteliales y estromales son muy útiles en el diagnóstico precoz de queratocono subclínico.25,26 Estos mapas del MS-39 han sido introducidos con parámetros que permiten también clasificar la gravedad del queratocono.25,26,27,28,29
Una de las aplicaciones más importantes del equipo es la biometría del cristalino, que posibilita conocer su grosor y la distancia hasta su plano ecuatorial, lo que ayuda al cálculo del lente intraocular.18) (Fig. 2).
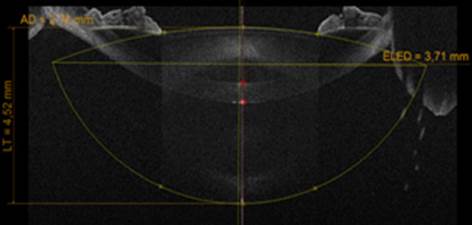 Fuente: Manual MS-39. Disponible en: https://www.csoitalia.it/en/prodotto/info/63-ms-39
Fuente: Manual MS-39. Disponible en: https://www.csoitalia.it/en/prodotto/info/63-ms-39
Fig. 2 Imagen del plano ecuatorial del cristalino.
Diversas publicaciones recientes consideran el plano ecuatorial del cristalino como un parámetro muy prometedor en el desarrollo de una nueva generación de fórmulas que tomen en cuenta la anatomía del cristalino para la predicción de la posición efectiva del lente intraocular.20,21,22 En el año 2017 Tsunehiro y otros estudiaron 178 ojos de 99 pacientes sometidos a cirugía de catarata. Propuso una fórmula basada en parámetros preoperatorios del cristalino obtenidos gracias a imágenes de OCT para el cálculo de la posición efectiva del lente, con la que se logró mejores resultados de predicción en comparación con las fórmulas Hoffer Q y SRK/T.30
Otras de las aplicaciones del MS-39 son la aberrometría corneal y la pupilografía. De igual manera, realiza un screening de glaucoma usando medidas como AOD (angle opening distance: por sus siglas en inglés) y TISA (trabecular iris space área: por sus siglas en inglés), y un screening de queratocono basado en el índice BVC (Baiocchi, Calossi, Versaci) con cálculos de Ambrosio.18) El índice BVC se basa en una combinación de las aberraciones de alto orden que se encuentran elevadas en pacientes con queratocono y ha demostrado tener una alta sensibilidad y especificidad para el diagnóstico de queratocono subclínico.31,32
Existe también un módulo de cálculo de lente intraocular basado en técnicas de Ray-Tracing (Trazado de Rayos) para todo tipo de ojo, una pantalla de planeamiento para anillos intraestromales y un sistema de análisis de la película lagrimal que estudia valores como el NIBUT (Non invasive breakup time).18 Se ha demostrado que este equipo ofrece mediciones con una alta repetibilidad.
En el año 2018, Savini y otros estudiaron la repetibilidad de las mediciones realizadas con un MS-39 y su concordancia con mediciones obtenidas con Pentacam (Sistema Scheimplug) y concluyó que el MS-39 provee una alta repetibilidad para todos los parámetros medidos en todo tipo de ojos. La concordancia de las mediciones del MS-39 con las del Pentacam fueron altas para algunos parámetros, como la profundidad de la cámara anterior y el grosor corneal central, y moderados para otros.17 En estudios posteriores se ha demostrado también que el MS-39 tiene alta repetibilidad en ojos con queratocono.33,34
El MS-39 constituye una valiosa herramienta para los oftalmólogos y, sobre todo, para los dedicados al segmento anterior, pues con la información que a través de este puede obtenerse del globo ocular se podrá llegar a un mejor diagnóstico y seguimiento de diversas enfermedades del segmento anterior, y en el futuro perfeccionar y crear fórmulas que le proporcionen al paciente mejores resultados que redunden en una mejor calidad de vida.














