Introducción
La tomografía de coherencia óptica (OCT) (del inglés, Optical Coherence Tomography) ocupa un lugar privilegiado dentro de la comunidad oftalmológica. El desarrollo tecnológico, desde dominio en el tiempo a dominio espectral y fuente de barrido (swept source), ha logrado el incremento de la velocidad de la captura, de la profundidad y de la resolución de las imágenes; lo que ha permitido la segmentación de las células ganglionares, el reconocimiento de la apertura de la membrana de Bruch (BMO) (del inglés, Bruch´s membrane opening) como punto de referencia para el análisis de los parámetros del disco óptico y, más recientemente, la angiografía sin contraste (OCTA) (angiography).1
En la actualidad, la OCT resulta imprescindible para la toma de decisiones clínicas y como criterio de inclusión en las investigaciones y los ensayos clínicos relacionados con el glaucoma. Además, la comunidad científica trabaja sobre la base de unificar los criterios para el reporte de los estudios de OCT; por lo cual se propuso para 2021 el protocolo APOSTEL (Advised Protocol for OCT Study Terminology and Elements)2) en el que se recogen las recomendaciones para la nomenclatura de las estructuras de la retina, así como detalles relacionados con la adquisición y análisis de los resultados en los reportes científicos (fig. 1).
Los artefactos constituyen una limitación de la tomografía de coherencia óptica. Son relativamente frecuentes y, por lo general, se deben a variaciones anatómicas, movimiento durante la captura de la imagen, entre otras causas. De manera general, se recomienda chequear la calidad del examen y la presencia de artefactos antes de analizar los resultados; así como complementar estos con el interrogatorio y los hallazgos al examen físico, de manera ideal mediante biomicroscopia de polo posterior, para minimizar la posibilidad de errores diagnósticos. Es útil tener en cuenta lo anterior, a pesar de que las consultas dedicadas al cuidado de los pacientes glaucomatosos se encuentran frecuentemente sobrecargadas de pacientes.
La utilidad de la OCT en el diagnóstico de daño glaucomatoso incluye el análisis estructural en tres localizaciones fundamentales: células ganglionares a nivel macular, capa de fibras neuroretiniana peripapilar (RNFL, retinal nerve fiber layer), anillo neuroretiniano y copa en el disco óptico; y el análisis vascular en dos localizaciones: parafoveal y peripapilar. El acelerado desarrollo de esta tecnología en el mejoramiento de su capacidad diagnóstica hace imprescindible comprender sus ventajas y limitaciones en el análisis personalizado de los resultados de cada paciente; con el propósito de lograr la detección precoz del daño glaucomatoso y con ello la prevención de ceguera por esta causa.
El objetivo del estudio fue exponer los últimos avances en la aplicación de la tomografía de coherencia óptica en la detección del glaucoma.
Métodos
Se realizó una búsqueda de la literatura científica y académica en Google Académico, para lo cual se emplearon las siguientes palabras clave: glaucoma; OCT; OCTA; angiografía por OCT; células ganglionares- plexiforme interna; capa de fibras neuroretiniana. Se recuperaron solo documentos publicados en los últimos cinco años que trataran el tema de estudio.
Parámetros estructurales y vasculares en el análisis del daño glaucomatoso
Una parte significativa de la población de las células ganglionares (alrededor del 50 % del total de células ganglionares de la retina) reside en la mácula; por lo que el daño glaucomatoso puede monitorearse en esta zona. La muerte progresiva de las células ganglionares resulta en la pérdida de las conexiones dendríticas (capa plexiforme interna), el cuerpo de la célula (capa de células ganglionares) y de sus axones (RNFL).
La OCT permite la identificación y delineación (“segmentación”) de las capas individuales de la retina. A nivel macular se analiza el grosor de la capa células ganglionares y la plexiforme interna (GCIP, ganglion cell- inner plexiform layer) y del complejo de células ganglionares (GCC, ganglion cell complex) el cual incluye las dos capas anteriores y la capa de fibras neuroretiniana. Mahmoudi y otros3) demostraron que la medición de la capa de los cuerpos de las células ganglionares maculares aislada es equivalente a GCIP para la detección del glaucoma. Los protocolos actuales utilizan GCIP o GCC, en dependencia de la tecnología que se disponga.
Según hallazgos de Hood y otros,4 la zona macular más vulnerable al daño glaucomatoso es la inferior, fuera de los 8 grados centrales. Los axones de células ganglionares de la zona temporal forman un arco superior e inferior alrededor de la fóvea en su viaje hacia el disco óptico, sin cruzar el meridiano horizontal macular. El disco óptico se ubica por encima de dicho meridiano y, por ello, la mayor parte de los haces de fibras de la mácula inferior ingresan al disco óptico por el cuadrante inferior. En cambio, una pequeña región (cecocentral) de la mácula inferior y las fibras de la mácula superior entran por el lado temporal del disco, región menos susceptible al daño. El daño macular precoz suele ser arciforme y escalonado, lo que se ha mostrado mediante OCT, en la región temporal del mapa de GCIP macular (fig. 2).
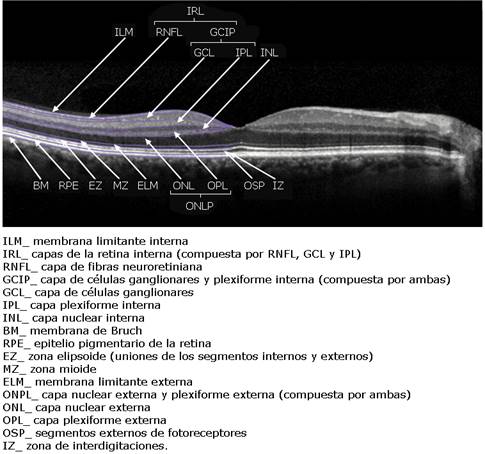
 Fuente: Base de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.
Fuente: Base de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.Fig. 2 - CIRRUS™ 5000 HD-OCT (versión 11.0, Carl Zeiss Meditec, Inc., Dubin, CA) (macular cube 200 × 200 protocol). Análisis del grosor de la capa de células ganglionares-plexiforme interna (GCL - IPL Thickness) global, mínimo y en seis sectores (súperotemporal, superior, súperonasal, ínferonasal, inferior e ínferotemporal) que forman anillo elíptico de diámetro vertical interno de 1 mm y externo de 4 mm; y diámetro horizontal de 1,2 y 4,8 mm, respectivamente (diseñado para excluir zonas donde la capa de células ganglionares se hace delgada y difícil de detectar). El mapa de desviación del ojo derecho muestra hallazgos compatibles con glaucoma: sectores inferior e ínferotemporal en color rojo (menos del 1 % de probabilidad de normalidad vs. base de datos normativa); sectores superior y súperotemporal en amarillo (limítrofes) y sectores nasales en verde (95 % de probabilidad de normalidad). Este hallazgo arciforme y escalonado en la zona temporal del mapa corresponde a daño glaucomatoso típico. El ojo izquierdo muestra hallazgos no glaucomatosos, mapa de desviación con todos los sectores en rojo excepto ínferonasal y escaneo B confirma pérdida del patrón normal de la retina en la zona foveal.
Al parecer, se requiere una pérdida del 30-50 % de las células ganglionares antes que sea posible detectar la disminución de la sensibilidad en el campo visual. Además, aunque el daño glaucomatoso macular sea frecuente y pueda ocurrir en estadios tempranos de la enfermedad, este suele pasar desapercibido en la perimetría estándar automatizada 24-2 y 30-2, patrones de uso frecuente en las consultas de glaucoma.
El estudio de GCIP abre oportunidades para la detección de los cambios estructurales antes que los cambios perimétricos. La variabilidad interindividual macular es menor que aquella registrada para la apariencia del disco óptico y el grosor de RNFL, por lo que la clasificación respecto a la base de datos normativa para GCIP pudiera tener mayor valor predictivo que las bases normativas para el resto de los parámetros. El grosor macular total también ha mostrado diferencias significativas entre grupos de sujetos sanos, hipertensos oculares, glaucomas incipientes, moderados y avanzados.5) No obstante, se prefieren utilizar parámetros más específicos como GCIP y GCC; los cuales muestran mayor área bajo la curva.1
De acuerdo al metanálisis realizado por Kansal y otros,1) la capacidad diagnóstica del grosor de GCIP es similar al grosor de RNFL. Los de mayor capacidad diagnóstica son el valor global y los sectores superior, inferior, súperotemporal e ínferotemporal. De modo similar, Abd y otros6) encontraron que el grosor de GCC y de RNFL tienen un valor diagnóstico comparable como biomarcadores de glaucoma temprano, moderado y avanzado; aunque los valores para GCC fueron superiores en la detección del glaucoma incipiente. Los autores plantean la posibilidad hipotética de lograr un diagnóstico precoz al detectar la pérdida del cuerpo celular antes que la axonal, mediante estudio de las células ganglionares maculares; y correlacionar estos hallazgos con los defectos iniciales que se ubican en la región paracentral (10-20º) del campo visual.
La investigación realizada por McCann y otros7) mostró que el grosor de las células ganglionares maculares en el sector ínferotemporal proporciona la mayor especificidad en la detección del daño glaucomatoso. De modo similar, este sector se reporta como el de mejor desempeño para la detección de glaucoma preperimétrico en los sujetos con miopía axial. Por el contrario, los hallazgos de GCIP fuera de límites normales en sujetos sanos se han correlacionado directa y proporcionalmente con el error refractivo miópico.8,9 Estas circunstancias deben tenerse en cuenta al interpretar los resultados.
En el caso del glaucoma avanzado, la perimetría estándar automatizada es el medio diagnóstico actual de mayor relevancia clínica, debido a las limitaciones de la OCT por el llamado efecto “piso o suelo”. Este efecto nombra la delgadez de los parámetros estructurales, lo que constituye un impedimento en la OCT para calificar la magnitud del daño avanzado y detectar su progresión. Al parecer, permanece mayor cantidad de tejido en GCIP, por encima de las medidas consideradas como “piso”, al comparar con RNFL y anillo neuroretiniano; por lo que se ha propuesto que GCIP podría ser el mejor candidato estructural para evaluar el glaucoma avanzado.10
La distribución de los axones de las células ganglionares y de los cuerpos celulares es muy simétrica entre el hemicampo superior e inferior de la mácula y entre ambos ojos en individuos sanos. La asimetría intraocular entre los hemisferios superior e inferior, utilizando el protocolo de análisis de asimetría del polo posterior, ha mostrado un potencial significativo para el diagnóstico precoz del glaucoma de tensión normal y primario de ángulo abierto. Su desempeño para el diagnóstico del glaucoma preperimétrico se reporta comparable al análisis de RNFL, GCIP y de los parámetros del disco óptico.11 Estos autores reportan el índice de asimetría ínferotemporal/superonasal como el más meritorio. Las asimetrías interoculares de GCC también han mostrado excelente precisión diagnóstica para la detección del glaucoma en estadios incipientes y moderados.12
El análisis de GCIP falla en detectar el glaucoma temprano cuando existe mayor distancia entre la fóvea y el defecto de la RNFL, cuando el defecto de RNFL es más estrecho o cuando existe un escalón nasal periférico aislado. Otros parámetros como la refracción, la longitud axial, el área del disco, la calidad de la imagen y la etnia pueden influir en los resultados debido a que la base de datos normativa no se encuentra ajustada para ellos. En la enfermedad de Parkinson, en presencia de riesgo genético de enfermedad cardiovascular, enfermedades desmielinizantes del nervio óptico, entre otras; también se ha observado disminución del grosor de GCIP.13 La oftalmoscopia de polo posterior y otros exámenes diagnósticos pueden considerarse para evaluar los posibles diagnósticos diferenciales.
El análisis del grosor de RNFL es el pilar diagnóstico más utilizado para la detección del glaucoma y el parámetro considerado estándar de oro en la OCT de polo posterior (fig. 3).1,5) La colección de haces de RNFL es más gruesa en los cuadrantes superior e inferior del disco, por lo que estas regiones son particularmente vulnerables al daño glaucomatoso.4 El grosor disminuye de manera significativa con la edad y por ello los resultados se comparan con base de datos normativa según la edad para clasificar la probabilidad de encontrarse dentro o fuera de la normalidad; tanto en el valor global como en el análisis por cuadrantes y por sectores horarios.
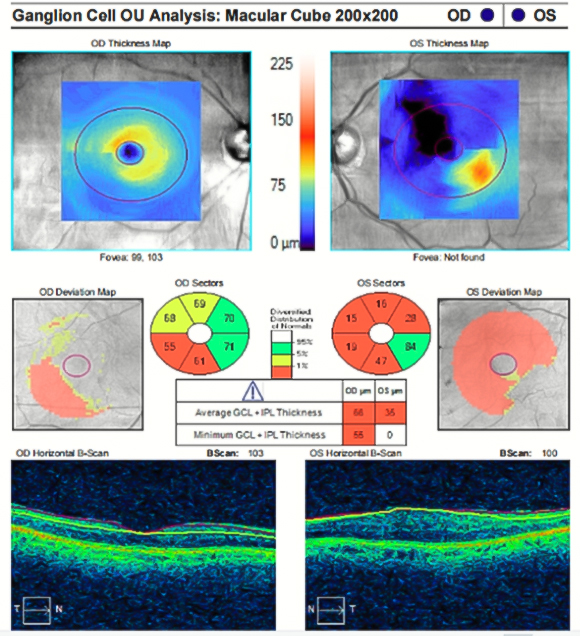
 Fuente: Bases de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.
Fuente: Bases de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.Fig. 3 - CIRRUS™ 5000 HD-OCT (versión 11.0, Carl Zeiss Meditec, Inc., Dubin, CA) (Optic Disc Cube Protocol 200 x 200). Análisis del grosor de la capa de fibras neuroretiniana (RNFL) a partir de algoritmo que centra automáticamente el disco óptico (punto azul en el mapa de desviación) y localiza el escaneo circumpapilar a 3,46 mm de diámetro. En el ojo derecho, la tabla muestra hallazgos compatibles con glaucoma: grosor promedio de RNFL y simetría interocular, ambas en rojo (menos del 1 % de probabilidad de normalidad vs. base de datos normativa). Mientras, el análisis por cuadrantes y sectores horarios confirma la alta probabilidad de valores fuera de la normalidad en el sector inferior, seguido del superior. Referente a los parámetros del disco, la tabla muestra hallazgos compatibles con glaucoma: relación de área copa/disco vertical en rojo y valores de área de anillo y de relación de área copa/disco global en amarillo (menos del 1 % y el 5 % de probabilidad de normalidad, respectivamente). En el ojo izquierdo, las mediciones de la RNFL y del disco óptico tienen 95 % de probabilidades de encontrarse dentro de límites normales (color verde).
Según los resultados del metanálisis realizado por Kansal y otros,1) se reportan como los de mayor capacidad diagnóstica el valor global y los cuadrantes superior e inferior. No obstante, algunos estudios revelan que el cuadrante inferior muestra los mejores valores de área bajo la curva, siendo superiores a los que obtiene el grosor global de RNFL.5
En investigación realizada con pacientes en estadios incipientes de glaucoma primario de ángulo abierto y en hipertensos oculares, los autores encontraron que aunque la evaluación del disco óptico y el análisis del grosor macular son importantes en el diagnóstico, el grosor de RNFL continúa siendo el más valioso.5 Otros reportes muestran que este parámetro proporciona la mayor sensibilidad en la detección del daño glaucomatoso.7
El grosor global de RNFL difiere como promedio 6 μm entre caucásicos, afroamericanos y asiáticos.14 Referente a la asimetría interocular, se reporta que diferencias superiores a 9-12 μm son estadísticamente fuera de los límites normales y pueden representar una neuropatía óptica glaucomatosa temprana.15,16,17 Este parámetro ha mostrado excelente precisión diagnóstica para la detección del glaucoma en estadios incipientes y moderados.12 Es importante tener en cuenta que la asimetría en el tamaño del disco puede justificar de manera fisiológica la asimetría en el grosor de RNFL interocular.
Algunos autores demuestran que la certeza de estimación de la enfermedad mediante la RNFL permanece moderada. El principal motivo consiste en la variabilidad interindividual de las mediciones y la utilidad parcial de la base de datos normativa con ajuste solo para la edad y no para la etnia, longitud axial, refracción, área de disco o calidad de la imagen.14 La compensación de factores relacionados con el disco óptico (relación, orientación y área), la fóvea (distancia y ángulo), la densidad de vasos retinianos, el error de refracción y la edad reducen la variabilidad de las mediciones y pueden mejorar la detección del glaucoma.
En realidad, las causas que afectan el eje fóvea-disco y el efecto de su ajuste sobre la variabilidad de RNFL y la discriminación de glaucoma no se conocen bien. Se ha propuesto que los ojos cuyo centro foveal se encuentra más abajo con respecto al disco, pueden tener mayor probabilidad de mostrar cambios en el sector inferior en el curso temprano de la enfermedad. Por lo tanto, es más probable que en estos ojos se diagnostique el glaucoma precozmente; hecho que necesita ser investigado con mayor profundidad.18
La presencia de catarata cortical o de un flóculo vítreo en el cuadrante ínferotemporal puede determinar el análisis sectorial de RNFL como fuera de los límites normales e interpretarse erróneamente como glaucoma. Varias entidades que cursan con anomalías focales de la retina en las regiones supero e ínferotemporal como la obstrucción venosa de rama, área de retinocoroiditis, entre otras; pueden simular defecto glaucomatoso y favorecer errores diagnósticos si se prescinde del examen físico del polo posterior.
En la neuropatía óptica anterior isquémica no arterítica, en su forma crónica, se ha encontrado reducción del grosor de RNFL similar al glaucoma primario de ángulo abierto, siendo las diferencias en los parámetros del disco óptico las que permiten el diagnóstico diferencial entre ambas entidades.19) Varios factores como la diabetes, la hipertensión, el mayor defecto miópico, las enfermedades cardiovasculares, entre otros se han asociado con grosores más delgados de la RNFL y se reconoce que existen diferencias significativas entre las etnias.14
En cuanto a las características del disco óptico, la OCT ofrece posibilidades para la medición certera del borde del disco óptico, del anillo neuroretiniano y de la copa; a partir de la identificación automática de la BMO y su uso como punto de referencia para delimitar el borde del disco óptico. La distancia entre BMO y la membrana limitante interna define el grosor del anillo neuroretiniano, tomándose su menor distancia como el parámetro BMO-MRW (Bruch’s membrane opening-based minimal rim width). Este se mide en 360 grados y se compara con la base de datos normativa (fig. 4).
 Fuente: Base de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.
Fuente: Base de datos del Instituto Cubano de Oftalmología Ramón Pando Ferrer.Fig. 4 - Spectralis SD-OCT (Heidelberg Engineering) (Glaucoma Module Premium Edition). BMO-MRW (Bruch’s membrane opening-based minimal rim width). A) Muestra tomogramas concéntricos para análisis de la capa de fibras neuroretiniana y radiales para análisis de los parámetros de disco óptico, ambos centrados en el disco óptico. B) Línea roja corresponde a la membrana de Bruch (BM) en el que su final coincide con el punto de referencia para identificar el borde del disco óptico. Línea roja corresponde a la membrana limitante interna (ILM). La distancia entre ambos corresponde al grosor del anillo neuroretiniano, su menor distancia identifica el parámetro BMO-MRW. C) Despliegue del grosor BMO-MRW en 360º. D) Comparación de BMO-MRW según sectores de Garway-Heath vs. base de datos normativa donde se observan sectores inferiores fuera de los límites normales y sector temporal superior limítrofe; hallazgos compatibles con daño glaucomatoso.
Se reporta que el desempeño de BMO-MRW es similar al grosor de RNFL peripapilar y superior a GCIP para discriminar entre sujetos sanos y con glaucoma incipiente.20) Algunos autores informan que su valor en el sector ínferotemporal es el de mayor capacidad diagnóstica de la OCT.21
El parámetro BMO-MRW parece tener un desempeño mejor que RNFL para diferenciar individuos miopes sanos y glaucomatosos, con menor porcentaje de falsos positivos, fundamentalmente en las miopías mayores de -6 dioptrías.22) Enders y otros23) reportaron, además, que en discos ópticos grandes BMO-MRW es superior a RNFL, tanto para detectar glaucoma como para reflejar la relación estructura-función. Por otro lado, Li y otros20) encuentran que las áreas bajo la curva de ambos BMO-MRW y RNFL son comparables, tanto en sujetos con macrodiscos como en miopes; y que los valores BMO-MRW global y sectoriales son más delgados en los macrodiscos que en los discos sanos de tamaño normal.
Los discos grandes, los cuales son frecuentes en los pacientes miopes, representan un desafío para el diagnóstico clínico del glaucoma debido a la delgadez del anillo neuroretiniano a la biomicroscopia de polo posterior. La OCT es particularmente útil en la evaluación de estos casos. En situaciones donde el acceso a la tecnología es difícil, se suele hiperestimar el diagnóstico de glaucoma e indicar el tratamiento hipotensor ocular en pacientes donde los hallazgos pudieran ser fisiológicos.
El parámetro BMO-MRW tiene utilidad para evaluar la regla ISNT, la cual plantea que el grosor del anillo neuroretiniano es mayor en el sector inferior que en el superior, este mayor que el nasal y este mayor que el temporal, en sujetos normales. El desempeño de esta regla utilizando BMO-MRW resultó ser superior que su aplicación en la fotografía para distinguir entre discos ópticos normales y glaucomatosos; con la ventaja adicional de poder aplicarla cuando el anillo es imposible de distinguir mediante oftalmoscopia, como ocurre en los discos inclinados.24
Referente a la asimetría interocular, una diferencia superior a 49 μm en el valor BMO-MRW global puede considerarse estadísticamente anormal; lo cual puede sugerir daño glaucomatoso.17) Es importante tener en cuenta que la asimetría en el tamaño del disco puede justificar de manera fisiológica las asimetrías en las características de anillo neuroretiniano y de copa entre ambos ojos.
La figura 3 muestra parámetros del disco óptico, diferentes de BMO-MRW, que son útiles en el diagnóstico de glaucoma. Investigaciones realizadas con inteligencia artificial han comprobado que las características del anillo neuroretiniano, así como la profundidad de la copa óptica y de la lámina cribosa se asocian significativamente a la gravedad del daño glaucomatoso.25
Coincide que Abd y otros6) estudiaron sujetos sanos y glaucomatosos en diferentes estadios de la enfermedad y encontraron cambios significativas en la razón de área copa disco (C/D, cup/disc) global (p < 0,001), C/D vertical (p < 0,001) y área de anillo (p = 0,006). De modo similar, Dagdelen y otros5) encontraron diferencias en todos los parámetros: área de anillo, C/D global, C/D vertical y volumen de la copa; donde el área de anillo mostró las mayores diferencias entre los grupos. Todos estos parámetros mostraron también correlación con el defecto medio y la desviación a patrón del campo visual; donde el área de anillo mostró la mejor correlación y el volumen de la copa la menor correlación. Los hallazgos en C/D vertical también se han destacado por su capacidad diagnóstica. Según Zhang y otros8) su valor se compara con los parámetros de las células ganglionares maculares y logra mejores resultados que RNFL peripapilar en la detección del glaucoma en pacientes con miopía axial.
La asimetría en la razón C/D es un signo clínico importante para el diagnóstico precoz del glaucoma, en ausencia de causas que justifiquen su presencia como son la anisometropia, la miopía u otras anomalías del disco óptico. Budenz16) demostró que no existen diferencias significativas en cuanto a error de refracción, tamaño de disco óptico y tamaño de copa óptica entre los ojos del mismo individuo, por lo que se espera que estas variables no afecten los resultados.
Varios estudios poblacionales han demostrado que la asimetría C/D mayor de 0,1 está presente en menos del 8 % de la población y la asimetría mayor de 0,2 en menos del 5 % y hasta menos del 1 % de los sujetos normales, según la población estudiada. La asimetría C/D mayor de 0,2 se utiliza como criterio de exclusión de la muestra de sujetos sanos en los estudios epidemiológicos y ensayos clínicos relacionados con el glaucoma, debido a la importancia de este parámetro en el diagnóstico de glaucoma.
Un estudio reciente confirmó que la relación C/D mayor se relaciona con un daño glaucomatoso más avanzado en el campo visual; y que la fortaleza de esta asociación varía según la raza, siendo superior en los pacientes de raza negra. Acorde a este hallazgo, sería importante incorporar una base de datos normativa según la raza en la interpretación de la significación de los resultados.26
El rechazo nasal de los vasos centrales de la retina a nivel del disco óptico es un hallazgo frecuente en la neuropatía óptica glaucomatosa. Sawada y otros27) utilizaron la ventaja de obtener imágenes de profundidad mejorada (EDI, enhanced-depth imaging) mediante OCT y confirmaron que el desplazamiento nasal de los vasos es mayor en pacientes con glaucoma que en sujetos normales. Además, encontraron que aquellos pacientes con mayor desplazamiento nasal presentan una angulación mayor de los vasos al pasar por la lámina cribosa, y que esto se asocia a campos visuales significativamente más afectados.
Actualmente existe una tendencia mundial al incremento de la miopía, condición ocular que constituye un factor de riesgo para el glaucoma; aunque los mecanismos fisiopatogénicos involucrados no son bien conocidos. La miopía se asocia a formas atípicas de discos ópticos y cambios en el polo posterior; así como a diferentes anomalías del campo visual. En este sentido, se ha propuesto que es valiosa la exploración de las células ganglionares8,9 y de BMO-MRW;22,23 considerándose estos resultados superiores al análisis de RNFL. Otros autores encuentran que en la miopía axial existe adelgazamiento de RNFL promedio, GCIP promedio y mínimo, así como de los parámetros no temporales de RNFL y de GCIP; por lo que se justifica considerar el estado refractivo en los pacientes sospechosos de glaucoma.28) En los pacientes miopes, en los que las características estructurales y el campo visual muestran formas atípicas, el diagnóstico precoz de daño glaucomatoso solo puede realizarse mediante la evaluación de cambios significativos en el tiempo.
La OCTA proporciona una imagen tridimesional de la microvascularización de la retina, lo que permite analizar, tanto la densidad como la perfusión vascular de manera cualitativa y cuantitativa (fig. 5). Para el estudio del glaucoma se evalúan estos parámetros en las zonas peripapilar y parafoveal, se delimita el área y el perímetro de la zona avascular foveal y se estima la vascularización coroidea peripapilar. Esta práctica no requiere la inyección de un medio de contraste, eliminando así los efectos adversos tanto sistémicos como locales de la medicación.
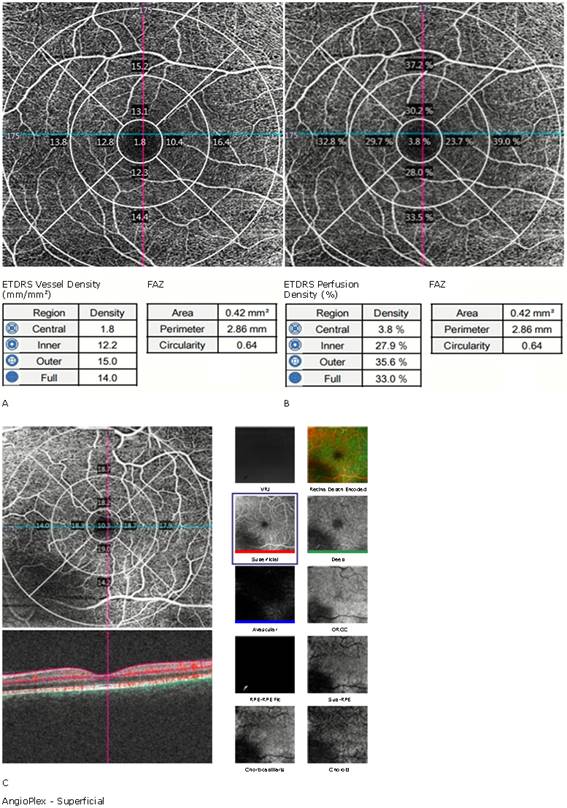
Fig. 5 - CIRRUS™ 5000 HD-OCT (versión 11.0, Carl Zeiss Meditec, Inc., Dubin, CA) Angioplex. OCT Angiography (Angiography 6 x 6 mm protocol; base de datos normativa no disponible). El análisis macular subdivide la región según mapa del Early Treatment of Diabetic Retinopathy Study (ETDRS): círculo de 1 mm de diámetro centrado en fóvea (central), anillo interno (inner) desde 1-3 mm y anillo externo (outer) desde 3-6 mm. Los anillos interno y externo se subdividen en cuadrantes superior, temporal, inferior y nasal. La tabla muestra valores promedios de densidad vascular A) de perfusión vascular, B) área, perímetro y circularidad de la zona avascular foveal (FAZ, foveal avascular zone). La imagen tomográfica muestra los valores promedios por cuadrantes. Debido a artefacto C) las imágenes de segmentación de retina y coroides muestran sombra en el sector ínferonasal en todos los niveles. En consecuencia, los cuadrantes nasal e inferior del anillo externo del plexo superficial parafovea muestran falsa disminución de los valores de densidad vascular.
Conceptualmente la OCTA mide la densidad vascular como la longitud de los vasos con circulación en un área definida y la densidad de perfusión como el área porcentual donde hay circulación. Para evaluar la perfusión, se complementa la tecnología de la OCT con la capacidad de detección del movimiento de los glóbulos rojos, como agente de contraste para obtener imágenes del flujo sanguíneo. El flujo se detecta en una variación sobre el tiempo en un patrón de puntos, formado por interferencia de luz difusa desde las células sanguíneas y el tejido estructural adyacente.
Enders y otros29 encontraron correlación significativa entre la densidad vascular peripapilar y los parámetros estructurales de la OCT que basan sus medidas en la BMO. Yarmohammadi y otros30 reportan que la densidad vascular tiene capacidad diagnóstica similar al grosor de RNFL y GCC para discriminar sujetos sanos de glaucomatosos y detectar el daño glaucomatoso antes que el campo visual computarizado. Según algunos autores, los hallazgos vasculares peripapilares han mostrado mejor correlación con los resultados del campo visual que el grosor de RNFL; lo cual requiere estudios de mayor tamaño muestral para confirmarse.31
Varios autores reportan asociación entre la disminución de la densidad vascular parafoveal y los defectos centrales en el campo visual 10-2; así como correlación topográfica de este parámetro con el grosor de GCIP y de RNFL en pacientes con sospecha de glaucoma y glaucoma incipiente.32,33) Estos hallazgos revelan su utilidad potencial como herramienta de detección temprana y en el seguimiento de los pacientes sospechosos y glaucomatosos. Choi y otros34 encontraron que la disminución de la densidad vascular parafoveal, el incremento del perímetro de la zona avascular foveal y la disminución del índice de circularidad de esta zona son hallazgos frecuentes en pacientes glaucomatosos.
La disminución de la densidad vascular se asocia significativa y proporcionalmente a la gravedad del daño glaucomatoso campimétrico, según resultado de diferentes investigadores. Estos hallazgos de la OCTA superan los estructurales para la detección de la progresión cuando el daño es avanzado; lo cual abre nuevas posibilidades en la evaluación de estos pacientes.35)
La asimetría entre ojos, relativo a la densidad vascular, es superior en los pacientes con sospecha de glaucoma que en sujetos normales.15 Sin embargo, el desempeño de este parámetro resulta inferior al de las asimetrías focales de RNFL y de GCC para detectar pacientes con glaucoma primario de ángulo abierto en estadio incipiente a moderado, según resultado de Xu y otros.12
El reporte de la Academia Americana de Oftalmología en el 202133 revela los niveles de evidencia para los hallazgos de la OCTA; en el cual se reconoce la disminución de la densidad vascular peripapilar (nivel II) y parafoveal (niveles I y II) en pacientes con sospecha de glaucoma, glaucoma preperimétrico y glaucoma perimétrico. Además, se reconoce que el grado de disminución de la densidad vascular se correlaciona significativamente con la gravedad del glaucoma, tanto global como topográficamente (nivel II), así como longitudinalmente (nivel I).
El papel de la OCTA en el diagnóstico clínico de la enfermedad queda aún por demostrarse. Parámetros como la edad, el género, la presión intraocular, el equivalente esférico, la actividad física, las enfermedades sistémicas y los medicamentos han mostrado tener un impacto significativo en las medidas cuantitativas de la OCTA. Entre sus limitaciones se encuentran el tiempo de captura de la imagen mayor que para los parámetros estructurales, lo cual genera artefactos (fig. 5) en las imágenes por movimientos oculares, parpadeo o movimientos del paciente; la sombra de los vasos superficiales más gruesos genera “imagen fantasma” al evaluar capas más profundas; no detecta áreas donde el flujo sanguíneo es muy lento como pólipos o algunos microaneurismas; y ofrece un mapa estático de la red vascular, por lo tanto, no proporciona información veraz sobre el flujo de sangre o las fugas vasculares.31
La detección de glaucoma mediante el análisis en conjunto de los protocolos de mácula, RNFL, nervio óptico y de análisis vascular parece incrementar las probabilidades de detección de glaucoma en estadios tempranos. En determinado individuo, cualquiera de los protocolos podría afectarse antes que los otros, por lo que se justifica realizar el análisis de todas las mediciones y no confiarse en un solo parámetro. El uso de múltiples parámetros puede incrementar potencialmente las posibilidades de falsos positivos, lo que resulta un desafío para la interpretación correcta de los resultados.
Consideraciones finales
La tecnología disponible para el estudio estructural y funcional del glaucoma tiene limitaciones debido a la variabilidad interindividual de los resultados y a la falta de congruencia entre los hallazgos de la OCT y campimétricos. En la actualidad se trabaja sobre modelos de inteligencia artificial para el diagnóstico del glaucoma. Estos modelos consisten en la combinación de algoritmos de aprendizaje automático para identificar patrones en conjuntos de datos observados y predecir resultados, sin modelos preprogramados. Los algoritmos utilizan una serie de redes neuronales artificiales de varias capas para la extracción y transformación de características. Las predicciones mediante estos modelos pueden reducir el tamaño muestral y la duración de los ensayos clínicos, con gran impacto en el desarrollo de terapias neuroprotectoras y otras investigaciones relacionadas con el glaucoma.