Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Salud Pública
versión impresa ISSN 0864-3466
Rev Cubana Salud Pública vol.40 no.4 Ciudad de La Habana oct.-dic. 2014
INVESTIGACIÓN
Medicamentos notificados como productores de reacciones adversas graves en Cuba en un período de diez años
Notified drugs causing severe adverse reactions in Cuba in a ten-year period
MSc. Giset Jiménez López,I DrC. Anaí García Fariñas,II DrC. Ana María Gálvez González,II MSc. Ismary Alfonso Orta,I MSc. María Cristina Lara Bastanzuri,I MSc. Dulce María Calvo BarbadoI
I Ministerio de Salud Pública. La Habana, Cuba.
II Escuela Nacional de Salud. La Habana, Cuba.
RESUMEN
Introducción: los medicamentos inducen cambios en la morbilidad y mortalidad de la población, pero pueden ocasionar efectos adversos graves. En el país existe un sistema de farmacovigilancia que recoge y analiza las reacciones adversas medicamentosas, pero no se han descrito los efectos adversos graves producidos en un periodo de diez años.
Objetivo: describir los efectos adversos graves por medicamentos en Cuba entre 2003-2012.
Métodos: estudio descriptivo que empleó el método de farmacovigilancia de serie de casos de reacciones adversas de medicamentos, en diez años en Cuba.
Resultados: en la base de datos nacional se cuantificaron 116 814 notificaciones de reacciones adversas a medicamentos, de ellas 1 583 fueron graves (1,4 %), predominó el sexo femenino (55,6 %) y los adultos entre 18 y 59 años (56,9 %). Las penicilinas y las reacciones de hipersensibilidad fueron las más registradas y predominaron las reacciones adversas que pusieron en peligro la vida con 1 309 reportes (82,7 %), aquellas clasificadas como probables con 949 reportes (59,9 %) y las de baja frecuencia de aparición
con 1 014 reportes (64,1 %).
Conclusiones: el presente trabajo contribuye a ampliar el conocimiento que se tiene en el país sobre la frecuencia de aparición de reacciones adversas graves por medicamentos, las características de la población afectada y la valoración de su impacto indica que las reacciones adversas por medicamentos representan un problema de salud relevante.
Palabras clave: farmacovigilancia, reacciones adversas medicamentosas, efectos adversos.
ABSTRACT
Introduction: drugs induce changes in morbidity and mortality of the population, but they can also cause severe adverse reactions. Cuba has a pharmacovigilance system that collects and analyses the drug adverse reactions, but the severe adverse effects recorded in a ten-year period have not been described yet.
Objective: to describe the severe drug adverse effects recorded in Cuba from 2003 to 2012.
Methods: a descriptive study that used the method of farmacovigilance of case series of drug adverse reactions occurred in Cuba in ten years.
Results: the national database stored 116 814 reports of drug adverse reactions, 1 583 of them were severe (1.4 %), females (55.6 %) and adults aged 18 to 59 years (56.9 %) prevailed. Penicillins and hypersensitivity reactions were the most recorded, and life-threatening adverse reactions with 1 309 reports (82.7 %), those classified as probable ones with reports (59.9 %) and those of low frequency occurrence with 1 014 reports (64.1 %) predominated.
Conclusions: this paper contributes to widen the knowledge on the frequency of occurrence of severe drug adverse reactions and the characteristics of the affected population throughout the country. The assessment of their impact reveals that drug adverse reactions represent a relevant health problem.
Keywords: pharmacovigilance, drug adverse reactions, adverse effects.
INTRODUCCIÓN
Los medicamentos han sido factor clave en la prolongación de la esperanza de vida, la erradicación o el control de ciertas enfermedades y el bienestar general de la población.1 Paralelo al desarrollo de nuevos fármacos hay un incremento en el potencial de efectos adversos; aunque los efectos terapéuticos de las nuevas moléculas pueden ser mayores y más selectivos, su seguridad debe ser evaluada continuamente.2
La magnitud del efecto provocado por una reacción adversa en un individuo se relaciona con su intensidad.3,4 En los glosarios de farmacovigilancia se habla de intensidad o gravedad de una reacción adversa y se define como la magnitud del efecto provocado por una reacción adversa en un individuo. Puede calificarse como leve, moderada o grave, según afecte o no, y en qué medida, el desarrollo de la actividad cotidiana del paciente. Se distingue del concepto de gravedad, que valora el riesgo que la reacción ha supuesto para la vida del paciente.5
Otra manera de definir las reacciones adversas graves es reconocer que son aquellas que producen la muerte, amenazan la vida del paciente, producen incapacidad permanente o sustancial, requieren hospitalización o prolongan el tiempo de hospitalización, producen anomalías congénitas o procesos malignos. Para evaluar la gravedad de una reacción adversa a los medicamentos, siempre se debe tener en cuenta su intensidad, duración y el contexto general en el que se produce.5
Los hallazgos de diferentes investigaciones,6,7 confirman que los efectos adversos a medicamentos provocan un impacto negativo en la evolución clínica de los pacientes, aumentan de manera considerable los costos de la atención hospitalaria y constituyen un problema de salud a nivel mundial.
Estudios realizados en Estados Unidos de América (EE. UU.) registran más de 100 000 fallecimientos anuales atribuibles a efectos adversos por fármacos. Además el costo debido a la mala utilización de medicamentos puede alcanzar los 76 000 dólares de los que el 62 % son gastos derivados de los ingresos hospitalarios.8
En Cuba, la Unidad Coordinadora de Farmacovigilancia, que pertenece al Departamento de Farmacoepidemiología de la Dirección de Medicamentos y Tecnologías Médicas del Ministerio de Salud Pública, se mantiene como el órgano asesor científico técnico de la actividad.9
Los resultados de este sistema de farmacovigilancia muestran que el 20 % de los reportes provienen de la atención secundaria de salud. Es objetivo del sistema detectar las reacciones adversas a medicamentos (RAM) que producen ingreso en servicios de urgencia, prolongan la estadía hospitalaria y con ello el consumo de recursos, además de que son los niños y ancianos (poblaciones especiales) los que están más expuestos a utilizar medicamentos por razones fisiológicas y por las enfermedades que predominan relacionadas con la edad.
Algunos autores han publicado estudios en el ámbito hospitalario en los que predominan las reacciones adversas moderadas, graves y mortales, las cuales además de producir daños en los pacientes afectados, provocan gastos adicionales al sistema de salud.10,11
La magnitud o intensidad del efecto adverso es la primera clasificación a realizar por el profesional o experto que se dedica a la farmacovigilancia, ya que depende de esta la inmediatez de acción. A medida que aumenta la gravedad, se hace necesario un sistema alerta-acción robusto que minimice las secuelas del efecto adverso grave.
A pesar de la existencia del sistema de farmacovigilancia y del trabajo constante por los profesionales de salud, no se han descrito las reacciones adversas graves ocurridas en la población cubana en un periodo de diez años. Resulta de vital importancia caracterizar la serie de casos graves que incluyen reacciones adversas mortales en el país en un período amplio de tiempo, con el fin de profundizar en el conocimiento de las mismas y trazar estrategias que contribuyan al uso racional de los medicamentos y la prevención de los efectos adversos.
Esta investigación tiene como objetivo describir los efectos adversos graves producidos por medicamentos en Cuba en un periodo de diez años.
MÉTODOS
Se realizó un estudio descriptivo, transversal, que empleó el método de farmacovigilancia serie de casos a partir de la notificación espontánea de reacciones adversas, en los años comprendidos entre el 2003 y el 2012, en Cuba.
Se trabajó con el universo, compuesto por todas las notificaciones de pacientes con reacciones adversas que pusieron en peligro la vida del paciente u ocasionado su muerte, por ende, aquellas clasificadas como graves y mortales, según severidad, registradas en la base de datos del Sistema Cubano de Farmacovigilancia en los años de la investigación.
La información necesaria se obtuvo de la base de datos nacional de farmacovigilancia, de la que se filtraron los años de interés para la investigación. Esta base de datos como fuente de información está validada por el sistema de farmacovigilancia y por la Autoridad Reguladora Nacional. A partir de este conjunto de datos se obtuvo una base secundaria de reportes graves que fue revisada por un especialista con más de diez años de experiencia en la actividad.
Se estudiaron variables como el sexo (masculino y femenino), el grupo de edad (pediatría: menor de 18 años, adultos: 18 a 59 años y geriatría: 60 años y más), el fármaco sospechoso (amoxicilina, dipirona, carbamazepina y otros) y su grupo farmacológico (antibacterianos, anticonvulsivantes, analgésicos no opioides, entre otros), el tipo de efecto adverso (shock anafiláctico, muerte, disnea, necrolisis tóxica, entre otros), la intensidad (grave o mortal), imputabilidad (definitiva, probable, posible, condicional y no relacionada) y la frecuencia de aparición (frecuente, ocasional, rara y no descrita). Esta operacionalización se realizó de acuerdo a las Normas y Procedimientos del Sistema Cubano de Farmacovigilancia.4
Se realizó una revisión bibliográfica y documental. Para resumir la información se emplearon las medidas de frecuencia relativa y proporciones.
Desde el punto de vista ético, la información referida a los pacientes se omitió respetando la confidencialidad de los datos.
RESULTADOS
El Sistema Cubano de Farmacovigilancia se sustenta en la Red Nacional de Farmacoepidemiología y sobrepasa los diez años de trabajo. Los profesionales sanitarios han evolucionado desde la creación de una cultura de reporte a la notificación real de efectos adversos importantes y graves.
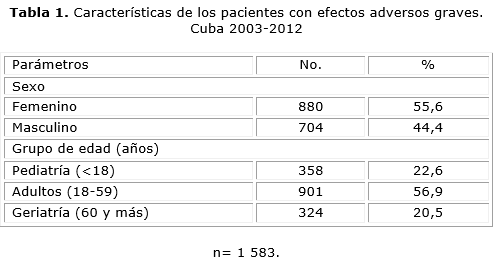
Entre 2003-2012 se registraron en la base de datos nacional 116 814 notificaciones de pacientes con efectos adversos, de ellas 1 583 RAM se clasificaron como graves, las que ocuparon el 1,4 % de los reportes del sistema.
Las RAM resultaron ser más frecuente en el sexo femenino (55,6 %) y en los adultos entre 18 y 59 años (56,9 %) (tabla 1).
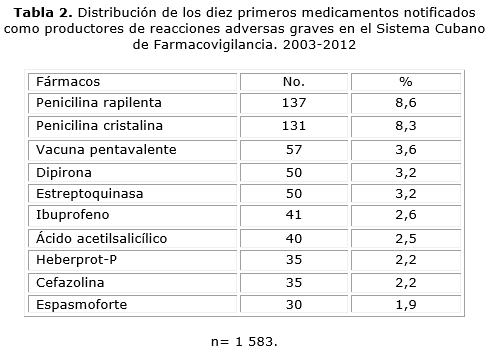
Las penicilinas rapilenta y cristalina fueron los fármacos de mayor notificación de RAM graves con 137 reportes (8,6 %) la primera y la cristalina con 131 (8,3 %). El tercer lugar lo ocupó, la vacuna pentavalente con 57 reportes (3,6 %) (tabla 2).
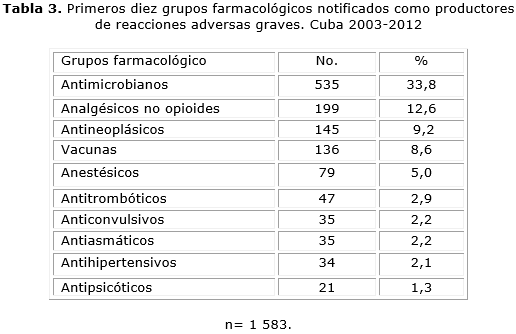
Los antimicrobianos fueron el grupo farmacológico más notificado con 535 reportes (33,8 %), los fármacos asociados fueron las penicilinas rapilenta, cristalina, benzatínica y la ceftriaxona. El segundo grupo farmacológico más representado fueron los analgésicos no opioides con 199 reportes (12,6 %), los medicamentos más notificados dentro de este grupo fueron la dipirona, ibuprofeno, ácido acetilsalicilico y el espasmoforte. El tercer grupo estuvo constituido por los antineoplásicos con 145 notificaciones (9,2 %), dentro del cual el cisdiclorodiamino platino, el carboplatino y el fluoracilo fueron los más registrados (tabla 3).
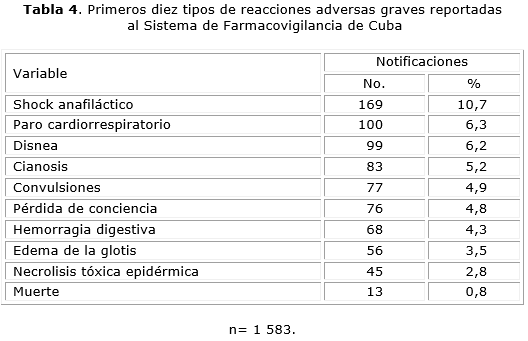
Los primeros diez tipos de efectos adversos relacionados con dichas reacciones adversas graves aparecen en la tabla 4. El tipo de efecto adverso grave más reportado fue el shock anafiláctico con 169 reportes (10,7 %), seguido de paro cardiorrespiratorio con 100 (6,3 %) y la disnea con 99 (6,2 %). Otros tipos de RAM graves reportadas con menor frecuencia fueron: cianosis 83 reportes (5,2 %), convulsiones 77 (4,9 %), pérdida de conciencia 76 (4,8 %), hemorragia digestiva 68 (4,3 %), edema de la glotis 56 (3,5 %), necrolisis tóxica epidérmica 45 (2,8 %) y muerte 13 reportes (0,8 %).
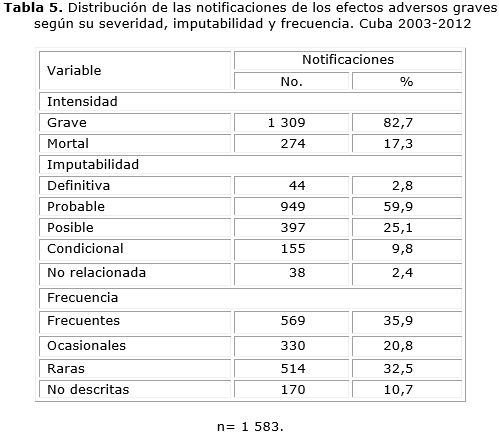
En cuanto a la intensidad, imputabilidad y frecuencia de las RAM, predominaron aquellas que pusieron en peligro la vida con 1 309 reportes (82,7 %), aquellas clasificadas como probables con 949 (59,9 %) y las de baja frecuencia de aparición, que es la sumatoria de ocasionales, raras y no descritas con 1 014 reportes (64,1 %) (tabla 5).
DISCUSIÓN
En diez años de trabajo, el sistema ha detectado el 1,4 % de reacciones adversas graves por medicamentos, a partir de la notificación espontánea o pasiva. Al comparar estos resultados con los de otros países se aprecia que la estimación conjunta de RAM en pacientes españoles es del 13 %, graves el 12 %, mortales el 0,1 % y se hospitalizaron procedentes de urgencias por RAM el 5,1 % (valor medio IC< 95 %.11
Los problemas de reacciones adversas a medicamentos están descritos en la literatura internacional y las reacciones adversas tienen un peso considerable en los sistemas de salud y en la sociedad,12 pero la evidencia demostrada en los estudios publicados generalmente se aplican al ámbito de un hospital específico o región de un país determinado, además de que difieren los resultados por razones como el tipo de sistema sanitario y las fuentes de información que se utilizan, es por ello que los resultados obtenidos en el presente estudio no coinciden con parte de la literatura revisada.
En cuanto al predominio del sexo femenino encontrado, el estudio se comportó igual a lo que publica la literatura revisada. Se plantea que las mujeres son más propensas a padecer efectos adversos y algunas de las razones que sostienen esta afirmación es que consumen más medicamentos, tienen menor masa corporal y están expuestas a procesos hormonales diferentes a los hombres, lo que aumenta el riesgo de RAM, así como de su gravedad y desenlace.13
Resulta de interés la distribución según grupos de edades, ya que en el presente estudio predominaron las reacciones adversas en los adultos, es decir las personas entre 18 y 59 años de edad. Quedó alrededor de 43,1 % para los grupos de edades extremas de la vida. Se considera que hasta el momento este hecho es una particularidad del Sistema Cubano de Farmacovigilancia ya que su nivel de reporte espontáneo proviene sobre todo de la atención primaria de salud (nivel en el que se desarrolló la farmacovigilancia desde sus inicios y la influencia de la Red de Farmacoepidemiología). Las reacciones adversas graves que ocurren en poblaciones de riesgo como los niños y los adultos mayores son detectadas en el medio hospitalario y su nivel de reporte es más bajo.13
El predominio de RAM mortales en los adultos, encontrado en este estudio, no se correspondió con lo descrito tradicionalmente en la literatura, pues se consideran a los ancianos como la población de mayor riesgo, ya que en ellos concurren la asociación de varias enfermedades, sean crónicas o no, la polifarmacia, la posibilidad de interacciones medicamentosas, los cambios en la farmacocinética y la farmacodinamia, lo que hace que sean pacientes muy vulnerables a sobredosis relativas y otras toxicidades de los medicamentos, lo que puede aumentar el riesgo de muerte en esta edad extrema de la vida.14,15
En publicaciones cubanas sobre farmacovigilancia las penicilinas constituyen los fármacos más utilizados en el país dentro del grupo de los antibacterianos, siendo por lo tanto, los que mayor número de reacciones adversas ocasionan, y constituyen en su mayoría reacciones moderadas, graves y mortales.13
Jiménez López y otros, en una investigación durante el período del 2000 al 2008 en Cuba,16 plantean que las penicilinas fueron los fármacos más asociados con RAM mortales. Dicho comportamiento se extiende al resto de los años del periodo estudiado.
La vacuna pentavalente (Heberpenta®) fue introducida en septiembre del 2006, fue la que con mayor frecuencia estuvo asociada con reportes de RAM, pero es una vacuna compleja que provee inmunización contra cinco enfermedades diferentes. Al ser un medicamento nuevo, esta vacuna ha tenido una vigilancia de forma activa en todo el país, por lo que se orientó reportar todos sus efectos adversos durante su comercialización. Además el sistema establece que se deben reportar todas las reacciones que ocurren en menores de un año y todas las de medicamentos con menos de cinco años en el mercado.4
Un resultado importante de estudio es que entre los primeros diez medicamentos relacionados con reacciones adversas severas se encuentra el factor de crecimiento epidérmico (Heberprot-P), fármaco de origen biológico, de producción nacional e innovador en el tratamiento de las úlceras de pie diabético. Este producto tuvo en el país un ensayo clínico fase IV de dos años de duración y al cierre del mismo en el 2010, todos los eventos adversos graves pasaron a la base de datos nacional.
Los antimicrobianos constituyen el primer grupo farmacológico relacionado con un mayor número de reacciones adversas. Se plantea que el 41,0 % de los pacientes tratados con estos medicamentos presentan alguna RAM, y en Cuba específicamente los antimicrobianos han ocupado entre el 31-32 % del total de notificaciones que se reciben.11-13,16
En este trabajo el shock anafiláctico, la disnea y el edema de la glotis, la anafilaxia en general, así como el paro cardiorrespiratorio se correspondieron con las penicilinas (rapilenta, cristalina y benzatínica) y con otros betalactámicos como la cefalosporinas (cefazolina). Otros medicamentos como la dipirona, el ibuprofeno y el espasmoforte también se relacionaron con este peligroso efecto.
El shock anafiláctico es un tipo de reacción inmunoalérgica de hipersensibilidad, entre sus características es posible destacar que no es dosis dependiente, es inesperada, de elevada mortalidad, afecta el 1-3 % de la población, es un efecto descrito para muchos medicamentos, difícil de estudiar experimentalmente y con frecuencia el mecanismo no se conoce o no está bien esclarecido, por eso es comprensible que la notificación espontánea, el mayor sistema utilizado por los centros nacionales de farmacovigilancia sea especialmente efectiva para detectar efectos adversos de este tipo.17,18
Las penicilinas y sus productos de degradación actúan como haptenos después de su reacción covalente con proteínas, por lo menos el 25 % de las reacciones son efecto de los determinantes antigénicos menores, responsables del mayor número de reacciones graves e inmediatas. En algunos estudios se ha observado que las reacciones de hipersensibilidad son los efectos adversos más frecuentes que surgen con las penicilinas y que complican entre el 0,7 al 4 % de los períodos de tratamiento. Las reacciones de hipersensibilidad más graves producidas por estos fármacos son el angioedema y la anafilaxia, de esta se plantea una incidencia de 0,004 a 0,04 % y en promedio, el 0,001 % de pacientes tratados con penicilinas fallecen por anafilaxia. Las cefalosporinas también producen con frecuencia hipersensibilidad, las reacciones parecen ser idénticas a las generadas por las penicilinas, ello depende de la estructura betalactámica compartida por ambos tipos de antimicrobianos.16
El paro cardiorrespiratorio también puede ser una manifestación de una reacción de hipersensibilidad, de conjunto con la disnea, el edema de la glotis, la cianosis, la pérdida de conciencia y las convulsiones. En el presente estudio estuvo más bien relacionado con anestésicos como mepivacaína, lidocaína, tiopental, ketamina, bupivacaína y propofol, no representados entre los medicamentos más relacionados con RAM graves y mortales.
La hemorragia digestiva estuvo vinculada sobre todo con el ácido acetilsalicílico, el ibuprofeno, el piroxicam, el naproxeno, la dipirona y la indometacina, es decir, con los medicamentos del grupo de los antinflamatorios no esteroideos (AINEs). Otro fármaco importante involucrado fue la warfarina.
En Inglaterra un estudio observacional prospectivo para evaluar la carga hospitalaria que presentan las RAM, obtiene como resultado que la reacción adversa más frecuente fue la hemorragia gastrointestinal y los fármacos más implicados incluyeron: bajas dosis de aspirina, AINEs diferentes de la aspirina y warfarina.19
Los AINEs (acido acetilsalicílico, ibuprofeno, piroxicam, naproxeno, indometacina y otros), son responsables de 12 000 ingresos hospitalarios/año debido a hemorragia gastrointestinal, el equivalente a un hospital de 400 camas trabajando a plena capacidad. Estos fármacos causan aproximadamente 2 000 muertes al año teniendo como causa esta RAM, comparado con las 3 500 muertes que se producen por accidentes de tráfico. Este efecto adverso mortal se describe sobre todo asociado a consumo prolongado de los mismos, dos meses o más y el daño gastrointestinal cuesta al sistema de salud de Inglaterra, alrededor de 250 millones de libras esterlinas por año.20
Las manifestaciones digestivas de los antinflamatorios no esteroideos son esperadas, por responder en gran medida a su mecanismo de acción mediado las síntesis de prostaglandinas y su principal enzima la ciclooxigenasa, conocida como enzima COX con sus dos isoformas, COX 1 relacionada con efectos adversos gastrointestinales y COX 2, relacionada con efectos adversos cardiovasculares, por ser estos medicamentos inhibidores no selectivos de dicha enzima. Además, poseen acción irritante local ocasionada porque permiten la difusión retrograda de ácido al interior de la mucosa gástrica.
Es importante hacer un uso adecuado de estos resultados ya que en el caso específico de los AINEs se trata de reacciones conocidas y esperadas, lo que permite hacer un uso más racional de los mismos con el fin de evitar reacciones menos comunes y graves como puede ser la hemorragia digestiva.
Vale destacar los casos de necrolisis tóxica epidérmica, este es un efecto adverso cuya causa es únicamente el medicamento, es decir, es una enfermedad inducida por fármacos de base inmunoalérgica, en la que se produce una lisis de las células de piel y mucosas por una reacción de hipersensibilidad a un medicamento. La persona simula un gran quemado y en múltiples ocasiones fallece por un shock séptico. Los fármacos más relacionados con este tipo de RAM fueron cotrimoxazol, dipirona, carbamacepina, ciprofloxacina, ceftriaxona, fenitoina y paracetamol.
La Food and Drug Administration (FDA), refiere que en 1987 en EE. UU., 12 000 y 15 000 ingresos hospitalarios se debieron a los efectos adversos y se estima que únicamente se han declarado el 10 % del valor real. Estudios posteriores estiman en más de 100 000 los fallecimientos anuales atribuibles a RAM.21
En Cuba se realizó una caracterización de las reacciones adversas mortales en el período del 2000 al 2008, los resultados de esta investigación informan que los eventos generales (37,5 %) predominaron con 82 reportes de shock anafiláctico, el 50,4 % de las reacciones fueron clasificadas probables y de baja frecuencia de aparición.16
Desde el punto de vista práctico, se consideran reacciones adversas comprobadas aquellas asociaciones fármaco-efecto adverso que posea una imputabilidad posible, probable o definitiva. Cuando la imputabilidad es condicional, es considerado como RAM inesperada y generalmente se necesita más información, la que contribuye al análisis de posibles señales.22
Este es el punto de partida para generar hipótesis de relaciones causales entre la administración de un fármaco y la aparición de un determinado efecto adverso, ya que la notificación de casos clínicos de sospechas de reacciones adversas a medicamentos, así como la cuantificación de series de asociaciones fármaco/RAM no descritas, son los medios más rápidos para generar hipótesis partiendo del criterio clínico de ser suficientemente graves o interesantes como para merecer un estudio más profundo que conlleve a que sean clarificadas o refutadas.
En la revisión de la base de datos del Sistema Cubano de Farmacovigilancia, un hallazgo importante es que más del 10 % de las reacciones graves y mortales fueron no descritas, lo cual engrosa la serie de reacciones adversas a analizar, para el proceso de generación de señales que debe aplicar el sistema, como parte de su perfeccionamiento.
En Cuba, entre las reacciones adversas severas clasificadas de baja frecuencia y graves se pueden mencionar edema de la glotis por verapamilo, shock anafiláctico por vancomicina, coma por tioridazina, convulsiones y abombamiento de fontanela por ácido nalidíxico, trombocitopenia por amoxicilina, entre otras. En esta misma categoría, ejemplos de reacciones adversas con desenlace fatal fueron paro cardíaco por vincristina, necrolisis tóxica epidérmica por actinomicina, shock anafiláctico por hidrocortisona, hipertensión intracraneal por paclitaxel, entre otros.
Por otra parte, en los diez años de estudio de la base de datos nacional, entre las reacciones adversas clasificadas como no descritas se pueden mencionar, mialgias por cimetidina, insuficiencia hepática por carbamazepina, necrolisis tóxica epidérmica y hemorragia digestiva por ciprofloxacina, pérdida de conciencia por factor de crecimiento epidérmico (Heberprot-P) y alucinaciones por dipirona.
Puche Cañas y otros,15 plantean que las reacciones adversas no deben ser reportadas porque se estima que ya es un problema establecido con certeza, y que el reporte de nuevos casos no será importante; idea con la que no concuerda la autora, ya que la prevalencia de determinado efecto adverso puede ser muy distinta en ciertas regiones geográficas en comparación con la registrada en los ensayos clínicos debido a múltiples razones, entre ellas, las diferencias genéticas.
En el estudio de Jiménez López sobre reacciones adversas mortales, según frecuencia de aparición, aunque hubo reacciones conocidas, descritas en la literatura, su mayoría son de baja frecuencia de aparición y no es despreciable el número de reportes de RAM no descritas (16 %), este comportamiento se considera interno del país, porque no aparece en la bibliografía revisada un estudio que exponga la frecuencia de aparición de RAM mortales en otros países.16
Para el Sistema Cubano de Farmacovigilancia, es importante la detección de efectos adversos ocasionales, raros o muy raros e incluso no descritos, este es el punto de partida para generar hipótesis de relaciones causales entre la administración de un fármaco y la aparición de un determinado efecto adverso, ya que la notificación de casos clínicos de sospechas de reacciones adversas a medicamentos, así como la cuantificación de series de asociaciones fármaco/RAM no descritas, son los medios más rápidos para generar hipótesis partiendo del criterio clínico de ser suficientemente graves o interesantes como para merecer un estudio más profundo que conlleve a que sean clarificadas o refutadas.
El presente trabajo contribuye a ampliar el conocimiento que se tiene en el país sobre la frecuencia de aparición de reacciones adversas graves por medicamentos, las características de la población afectada y al valorar su impacto, se observa que las reacciones adversas por medicamentos representan un problema de salud relevante.
El sistema de farmacovigilancia puede contribuir a trazar estrategias de prevención de reacciones adversas y educación de los profesionales sanitarios para el uso racional de medicamentos
REFERENCIAS BIBLIOGRÁFICAS
1. Segura O, Maldonado C. Las reacciones adversas a medicamentos: una aproximación desde el punto de vista económico. Biomédica. 2003;23:401-7.
2. Bates DW, LeapeL. Adverse drug reactions. En: Carruters GS, editor. Melmon and Morrelli's clinical pharmacology. New York: McGraw-Hill; 2000. p. 1 225-7.
3. Chao Cardeso A, Ávila Pérez J, Debesa García F. Farmacovigilancia. En: Furones Mourelle JA, Jiménez López G, Lara Bastanzuri C, Pérez Peña J, Calvo Barbado DM y Cruz Barrios MA, editores. Farmacoepidemiología. Uso racional de medicamentos. La Habana: Editorial Academia; 2010. p. 81-96.
4. Jiménez López G, Alfonso Orta I. Normas y Procedimientos del sistema cubano de Farmacovigilancia. 2011 [citado 4 Abr 2011]. Disponible en: http://www.cdfc.sld.cu/farmacovigilancia.htm
5. Grupo de Farmacovigilancia de la Red Panamericana para la Armonización Farmacéutica (PARF) de la Organización Panamericana de la Salud (OPS). Buenas Prácticas de Farmacovigilancia para las Américas. Documento técnico versión 5. Washington, D. C.: OPS; 2011.
6. Alonso Hernández P, Otero López MJ, Maderuelo Fernández JA. Ingresos hospitalarios causados por medicamentos: incidencia, características y coste. Farmacia Hosp. 2002;26:77-89.
7. Tribiño G, Maldonado C, Segura O, Díaz J. Costos directos y aspectos clínicos de las reacciones adversas a medicamentos en pacientes hospitalizados en el servicio de medicina interna de una institución de tercer nivel de Bogotá. Biomédica. 2006;26:31-41.
8. Muehlberger N, Schneeweiss S, Hasford J. Adverse drug reaction monitoring cost and benefit considerations, part I. Frequency of adverse drug reactions causing hospital admissions. Pharmacoepidemiol Drug Safety. 1997;6(suppl 3):S71-S77.
9. Debesa GF, Jiménez LG, Pérez PJ, Ávila J. La estrategia de la farmacoepidemiología en Cuba. Características y papel de la Unidad coordinadora nacional de farmacovigilancia en Cuba. Boletín Fármacos. 2001;4(2):1-5.
10. Alonso I, García O, Triolet A, Gomez C, Ruiz K. Reacciones adversas en una unidad de terapia intensiva. Electrón J Biomet. 2008 [citado 15 Nov 2011];2:10-8. Disponible en: http://www.biomet.unitet.edu/2008/n2/Alonso.pdf
11. Rego J, Leyva C, Pérez M. Pesquisaje activo de sospechas de reacciones adversas a medicamentos en el Hospital "Dr. Salvador Allende". Primer semestre 2006. Rev Cubana Farm. 2007 [citado 15 Nov 2011];41(3). Disponible en: http://www.sld.cu/sitios/revfarmacia
12. Singer K. Adverse drug reactions: current issues and strategies for prevention and management. Expert Opinion Pharmacother. 2002;3(9):1289-300.
13. Jiménez LG, Debesa GF, Gonzalez DB, Ávila PJ, Pérez PJ. El sistema cubano de farmacovigilancia, seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm. [citado 15 Nov 2011];40(1). Disponible en: http://www.sld.cu/sitios/revfarmacia
14. Rodríguez DR, Jiménez LG, Fernández ME, González DB. Caracterización de las reacciones adversas medicamentosas en ancianos. Cuba. 2003-2005. Rev Cubana Farm. 2007 [citado 15 Nov 2011];47(3). Disponible en: http://www.sld.cu/sitios/revfarmacia
15. Puche Cañas E, Luna del Castillo JD. Reacciones adversas a medicamentos en pacientes que acudieron a un hospital general: un meta-análisis de resultados. An Med Internat (Madrid). 2007;24(12):574-8.
16. Jiménez López G, Tasé Martínez MJ, Peña Machado MA, Hernández Núñez A. Caracterización de las reacciones adversas medicamentosas mortales. Cuba 2000-2008. Rev Electron Biomed/Electron J Biomed. 2012 [citado 15 Mar 2012];2. Disponible en: http://www.biomed.uninet.edu/2012/n2/jimenez.html
17. Lasheras AB. Reacciones adversas a medicamentos. Plan Nacional de Formación Continuada. Avances en Farmacología y Farmacoterapia. Módulo I. Consejo General de Colegios Oficiales de Farmacéuticos. Pamplona: Universidad de Navarra; 2005 [citado 15 Mar 2012]. Disponible en: http://www.unav.es/practicafarma/publicaciones.html
18. Downey W. Heath Database. In: Brian L. Strom, editor. Pharmacoepidemiology. London, UK: John Wiley and Sons, Ltd; 2000. p. 325-45.
19. Pirmohamed M. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ. 2004;329:15-9.
20. Adverse drug reactions in hospital patients. A systematic review of the prospective and retrospective studies. Evidence-based Health Care. 2002 [cited 2006 Oct 2006]. Available from: http://www.ebandolier.com
21. Fontana MA. Seguimiento del proceso intrahospitalario de uso de medicamentos: estrategia de minimización. Rev Medicina Sociedad. 2006 [citado 20 May 2006]. Disponible en: http://www.medicinaysociedad.org.ar/publicaciones
22. Meyboom RHB, Egberts ACG, Edwards IR, Hekster YA, De Koning FHP, Gribnau FWJ. Principles of signal detection in pharmacovigilance. Drug Saf. 1997;16:355-65.
Recibido: 13 de enero de 2014.
Aprobado: 9 de abril de 2014.
Giset Jiménez López. Departamento de Farmacoepidemiología. Dirección de Medicamentos y Tecnologías Médicas. MINSAP. 23 y N Vedado, 7mo. piso. Plaza de la Revolución 11 400. La Habana, Cuba.
Dirección electrónica: giset.jimenez@infomed.sld.cu