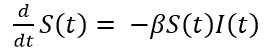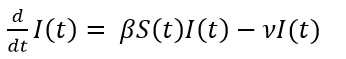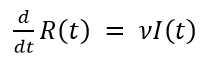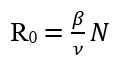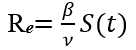Introducción
Las epidemias surgieron, prácticamente, desde que el hombre empezó a vivir en comunidades numerosas. Tucídides, historiador de la antigüedad, reporta en su libro Historia de la guerra del Peloponeso la epidemia que azotó la ciudad de Atenas entre 430-426 a.n.e., en el que menciona síntomas, progresión y número de muertes. De hecho, la palabra epidemia proviene del griego, epi, por sobre, demos, pueblo, y logos, que significa estudio. Es la descripción acerca de la salud comunitaria, que ocurre cuando una enfermedad afecta a una cantidad de individuos, superior al esperado. El ilustre sabio y médico griego Hipócrates, contemporáneo de Tucídides, se considera el padre de la epidemiología, al establecer el nexo entre enfermedad y medio ambiente y delinear los factores que afectan la diseminación de una enfermedad en el tiempo.1,2
Numerosas epidemias han afectado a la humanidad, y muchas han sido bien documentadas. Se puede decir, incluso, que sus influencias en diversos acontecimientos históricos no son para nada desdeñable. La peste antonina o plaga de Galeno (probablemente viruela o sarampión) en el siglo II d. n. e. que causó un drástico decrecimiento de la población del Imperio romano. Según el historiador romano Dion Casio causó en Roma cerca de 2000 muertes por día. Esta plaga se extendió a la Galia y a las legiones romanas del Rhin, llegando hasta Egipto. Algunos historiadores aseguran que contribuyó a la aceleración de la caída del imperio.3,4
Sin duda, la muerte negra o peste negra o peste bubónica, que azotó a Europa en la mitad del siglo xiv, fue una de las plagas más temidas y que más defunciones causó. Tal vez más de la mitad de la población europea pereció. Se originó en Mongolia en 1328 y se extendió rápidamente a China, India, Medio Oriente, norte de África y Europa. Lo más aceptado en la actualidad es que fuera causada por la bacteria Yersinia pestis. Esta pandemia es una de las más documentadas en un periodo anterior a la epidemiología como ciencia. No afectó ni al África subsahariana, ni a América, poniendo de relieve su transmisibilidad de persona a persona. Reapareció en Europa en múltiples ocasiones, incluso entrado el siglo xix.5,6,7,8
Otra plaga devastadora fue la de viruela, la que provocó la muerte de la mitad de la población azteca en 1520, durante la conquista española. Este hecho, sin duda, fue una ventaja inmunológica de más relevancia que las ventajas tecnológicas y políticas que también disfrutaron los conquistadores. La última gran pandemia de influenza devastadora, fue la gripe española, que en Europa dejó 20 millones de muertos en 1919, más que los que produjo la primera guerra mundial que acababa de concluir en 1918. No son pocos los investigadores que añaden la cifra de muertos por la influenza a los producidos por la conflagración, pues no sin falta de razón, el estado en que había quedado Europa imposibilitó tomar medidas eficaces para enfrentar la catástrofe.9,10
Una observación importante, es que las diversas epidemias aparecían repentinamente creciendo en intensidad, para luego desaparecer dejando parte de la población sin infectar. Este comportamiento se observa en enfermedades que son fatales o en aquellas cuyas víctimas adquieren inmunidad contra la reinfección. Por lo tanto, la pregunta natural es ¿por qué algunas enfermedades se desarrollan intempestivamente y después desaparecen de la misma forma sin afectar a toda la comunidad?
Muchas de las enfermedades infecciosas que han asolado a la humanidad, como la viruela, la varicela, la poliomielitis o la tuberculosis, han desaparecido gradualmente del mundo moderno gracias a los programas de vacunación y a la medicina preventiva. Sin embargo, otras enfermedades persisten en gran escala, como las de naturaleza parasitaria en países del tercer mundo. Algunas se han convertido en endémicas, como la malaria o el dengue en regiones tropicales. Enfermedades que se creían controladas han resurgido poniendo en entredicho los sistemas y programas de salud, ejemplo de estas son el sarampión y la tuberculosis. A este panorama hay que añadir el surgimiento de nuevas enfermedades de naturaleza epidémica como el VIH/sida (1983), la gripe aviar (H5N1) (1997), el SARS (2002), la influenza A H1N1 (2009), y actualmente la COVID-19 (2019).4,6
Todas estas enfermedades de naturaleza epidémica han impuesto retos a las políticas de salud pública. La COVID-19 ha puesto de relieve la interconexión global y la fragilidad de los sistemas nacionales de salud, incluso en países con el más alto nivel de desarrollo económico y mayor potencial científico, pero en los que la salud pública ha dejado de ser una prioridad de los estados. En muchos de estos países los modelos epidémicos matemáticos no fueron tenidos en cuenta, pues implicaba tomar medidas anti-epidémicas de salud pública que afectaban intereses económicos.
Epidemiología matemática
La epidemiología matemática modela la propagación de enfermedades infecciosas en una comunidad. Su objetivo es entender los mecanismos que hacen posible que se lleve a cabo dicha propagación. Es decir, la epidemiología matemática estudia la propagación de enfermedades al nivel poblacional. Mientras que los mecanismos de transmisión de persona a persona de una enfermedad en la actualidad son bastante conocidos, particularmente después de los trabajos de Pasteur y Koch en el siglo xix. El proceso de transmisión dentro de una comunidad es complejo ya que dependen de factores diversos; como los geográficos, sociales, culturales, económicos o políticos.
La importancia de tener datos es crucial para la modelación de los procesos epidémicos. El primer estudio estadístico de enfermedades infecciosas se le atribuye a John Graunt en 1663, quien en su libro Natural and Political Observations Madeuponthe Billsof Mortality estableció estadísticas de salud pública. En el que se puede, por ejemplo, comparar los riesgos de morir por peste bubónica en relación a otras causas de muertes no consideradas epidémicas. Durante el siglo xviii los trabajos del médico y matemático Daniel Bernoulli, acerca de la vacunación contra la viruela, demostraron la reducción de la mortalidad utilizando este proceder. En el siglo xix, los trabajos de Pasteur y Koch que les permitieron descubrir los mecanismos de transmisión de persona a persona, pavimentaron el camino de la modelación matemática de procesos infecciosos comunitarios, que, a inicio del siglo xx, darían un salto cualitativo con los estudios de Hamer, Ross y, finalmente, Kermack y McKendrick.11
En 1906 William Hamer mientras estudiaba la recurrencia de la aparición del sarampión, establece el importante principio para la modelación, conocido como la ley de acción de masas, el que plantea que “la tasa a la cual una enfermedad se propaga es proporcional al número de individuos susceptibles por el número de individuos infecciosos”. Pero, quien se considera el padre de la epidemiología matemática moderna es el británico Sir Ronald Ross, que tuvo un papel relevante en las investigaciones sobre la malaria a fines del siglo xix. Su nombre está vinculado al agente transmisor del patógeno, el mosquito anófeles. Obtuvo el premio Nobel en 1902 por su trabajo, aunque otros investigadores que tuvieron un papel distinguido en las investigaciones sobre la malaria fueron obviados del reconocimiento. Vale la pena señalar que Carlos J. Finlay desde 1881 había sugerido que un mosquito, el Culex, actualmente conocido como Aedes aegypti, era el agente transmisor de la fiebre amarilla.11,12
Ross, además de médico era matemático y estaba concentrado en la erradicación de la malaria. En 1912 propuso el primer modelo de compartimentos basado en ecuaciones diferenciales, con la intención de comprender la dinámica de la malaria e informar a los oficiales de salud pública de Su Majestad acerca de las medidas para su eliminación. Su modelo lo convenció de que para erradicar la malaria se debía disminuir drásticamente la población de mosquitos. Sin embargo, sus contribuciones no convencieron a sus contemporáneos. Esta fue la primera vez que se relacionó el fin de una epidemia con el concepto que más tarde sería conocido como el número reproductivo básico. Los trabajos sobre influenza de Kermack y McKendrick, entre 1927 y 1935, continuaron profundizando en este concepto. Ellos establecieron el teorema del umbral: “la introducción de un individuo infeccioso a una comunidad no dará lugar a un brote epidémico, a menos que la densidad de susceptibles sobrepase un cierto umbral”. Finalmente, el término número reproductivo básico R0 fue acuñado por MacDonald en los años 50.6,11
Los modelos dinámicos de compartimentos epidémicos se desarrollaron a lo largo del siglo xx, pero tuvieron un gran auge a partir de la pandemia del sida en los años 80. Su uso está destinado para entender los mecanismos que influyen en la propagación de una enfermedad, predecir el curso de una epidemia, detectar umbrales poblacionales más allá de los cuales existe el riesgo epidémico, sugerir estrategias de control, establecer políticas óptimas de vacunación o determinar cuáles políticas son más efectivas. La pandemia de la influenza A H1N1 de 2009, revivió el modelo básico SIR de Kermack y McKendrick, que se creía superado por modelos más sofisticados.13
Por lo que el objetivo del presente estudio es aplicar el modelo SIR, sin profundizar en el aparato matemático que lo acompaña, para conocer el impacto de la COVID-19 en Cuba, con énfasis en La Habana, como centro de la epidemia en el país
Este trabajo es parte de los esfuerzos que, en todos los órdenes, ha desarrollado el Ministerio de Salud Pública de Cuba para enfrentar la pandemia de la COVID-19.
Modelo básico SIR de Kermack y McKendrick
El modelo básico SIR (Susceptibles-Infectados-Recuperados) de Kermack y McKendrick es un modelo de compartimentos donde la población bajo estudio se divide en clases epidemiológicas y se describe un flujo entre ellas, como se muestra en la figura 1.
En este modelo el compartimento del centro mide la prevalencia, es decir, el número de casos de una enfermedad en la población en un tiempo dado, o sea, I(t). Para este estudio, por ejemplo, I(t) indica cuántos casos positivos a la COVID-19 existen en un día epidémico dado, que es en la manera en que se va a medir el tiempo. A esa cantidad también se le reconoce como casos activos.
El modelo básico SIR de Kermack y McKendrick asume que la población total N se mantiene constante en el tiempo, o sea, es la suma de los susceptibles más los infectados más los recuperados (Ecuación 1):
La transmisión es por contacto directo. Para transmitir la infección, un infeccioso hace contacto con βN individuos por unidad de tiempo. La probabilidad de contacto entre un infeccioso y un susceptible es S/N, luego el número de nuevas infecciones por unidad de tiempo es (βN)(S/N)I= βS I. Es decir, un infeccioso transmite la enfermedad con una tasa de contagio β, según la ley de acción de masas. Esto significa que los cambios en la población susceptible también se comportan según la ley de acción de masas. Por otra parte, una fracción ν de infectados por unidad de tiempo deja esa clase para convertirse en recuperados con inmunidad permanente. Esto conduce al sistema de ecuaciones diferenciales del modelo SIR (Ecuaciones 2,3,4).
Una vez que una cantidad inicial diferente de cero de individuos infecciosos entran a la comunidad en el tiempo inicial, comienza a desatarse la dinámica del modelo que puede conducir o no a un brote epidémico. El símbolo d dt significa la derivada, la cual podemos interpretar como los cambios por unidad de tiempo de susceptibles o infectados o recuperados, según la ecuación específica. Sin embargo, particularmente 𝑑 𝑑𝑡 𝐼(𝑡) tiene un significado importante en epidemiología pues representa la incidencia, la cual podemos definir como el número de casos nuevos de la enfermedad por unidad de tiempo.
Es interesante señalar que, en la ecuación 2, en la medida que pasa el tiempo su miembro izquierdo 𝑑 𝑑𝑡 𝑆(𝑡) toma siempre valores negativos ya que S(t) e I(t) son cantidades positivas, al igual que la tasa β. Esto significa que la cantidad de susceptibles S(t) del primer compartimento, decrece. El mismo razonamiento puede hacerse para la ecuación 4, para la cual los recuperados R(t) del último compartimento son siempre crecientes. Esto es lo natural, ya que en el modelo epidémico los susceptibles comienzan con una cantidad N que va decreciendo en la medida que se van infectando, cambiando así a infectados. Por el contrario, al inicio de la epidemia no hay recuperados, pero una vez pasado el periodo infeccioso empiezan a aparecer y se hacen cada vez más numerosos. Aunque no es propósito de este trabajo, se puede demostrar que el periodo infeccioso está relacionado con el parámetro ν del modelo y concretamente es el inverso de ν, o sea, 1 𝜈 que para la COVID-19 es de 14 días.
Este análisis sobre el crecimiento o decrecimiento que se explica de manera sencilla para los compartimentos de recuperados y susceptibles, no es tan fácil para el compartimento de infectados. Para establecer cómo es el crecimiento o decrecimiento de la prevalencia, es decir, de los infectados del compartimento central, o lo que es lo mismo, saber si la incidencia es positiva o negativa, hay que utilizar herramientas del cálculo diferencial e integral que no se incluyen en el presente estudio. Lo que conduce al número reproductivo básico (R0).
Para saber si los infecciosos crecerán, desatando la epidemia o por el contrario decrecerán extinguiéndose, hay que analizar el número reproductivo básico, denotado por R0. Este número en el modelo SIR básico se define en la siguiente ecuación 5.
R0 representa el número promedio de infecciones secundarias producidas por un individuo, durante su periodo infeccioso, en una población donde todos son susceptibles. Si este número es menor que uno, no habrá brote epidémico, ya que la incidencia es negativa, o lo que es lo mismo, la prevalencia es decreciente. Por el contrario, si R0 > 1, entonces se desatará un brote epidémico que en su inicio tendrá un crecimiento exponencial, lo que significa que lo hace de manera muy rápida en el tiempo. Para ilustrar este proceso imaginemos que un individuo contagia a 2, esos 2 a otros 2 cada uno en un segundo nivel de contagio, por lo tanto, ya habrían 4 contagiados. Si continua esta progresión en el tercer nivel habrían 8 y para el décimo nivel de contagio habrían 1024 contagiados.
Como es natural razonar, la epidemia culmina cuando, en el tiempo, alguna de las cantidades S(t) o I(t) son cero, es decir, todos los susceptibles dejan de serlo para convertirse en infectados o los infectados se extinguen. Utilizando herramientas matemáticas se puede demostrar que la primera opción no es posible. La dinámica de lo que ocurre, cuando hay brote epidémico, es que los susceptibles decrecen hasta una cantidad límite usualmente denotada por 𝑆 ∞ . Paralelamente los infecciosos van creciendo hasta un valor máximo, para luego decrecer hasta extinguirse por completo. Este comportamiento cualitativo es consistente con las observaciones ampliamente documentadas a lo largo de las epidemias que han azotado a la humanidad y cuyos recuperados alcanzan una inmunidad permanente o suficientemente larga en el tiempo.
Lo expuesto puede observarse en la figura 2, cuyas curvas son la solución del sistema de ecuaciones.
 Fuente: Departamento de Vigilancia en Salud. Minsap.
Fuente: Departamento de Vigilancia en Salud. Minsap.Fig. 2 Solución del sistema de ecuaciones diferenciales SIR.
Pueden apreciarse, las curvas de susceptibles a la izquierda (Fig. 2A), los infectados al centro (Fig. 2B) y los recuperados a la derecha (Fig. 2C), para un periodo de 120 días epidémicos en eje x. El eje y indica las cantidades de cada una de las clases. Como se observa, los susceptibles parten de un valor N (un poco más de 10 millones de personas) y decrece en el tiempo hasta una cantidad límite 𝑆 ∞ , aproximadamente de medio millón de personas. Los infectados (Fig. 2B) comienzan con muy pocos individuos, que apenas se distinguen, pueden ser uno o dos incluso, de pronto crecen repentinamente hasta un pico máximo de 3,4 millones de personas, que se alcanza a los 66 días. A los 120 días ya prácticamente han desaparecido. Los recuperados comienzan en cero hasta que la totalidad de infectados han sanado.
En este modelo simple se desprecia el número de muertes por la enfermedad, así como por otras causas. De igual manera los nacimientos en el periodo también son ignorados. Existen modelos más sofisticados que toman en cuenta la demografía, otros consideran un mayor número de clases, por ejemplo, se incluyen clases de infectados latentes o infectados asintomáticos. Otros modelos incorporan parámetros vinculados a las políticas anti-epidémicas. Incluso otros modelos SIR no son deterministas como el que se presenta en el presente estudio, sino que incorporan términos probabilísticos o procesos estocásticosa en su diseño. Todos estos modelos son matemáticamente más complejos. El modelo básico demostró durante la pandemia del H1N1 en 2009, ser lo suficientemente robusto para diseñar y verificar las políticas de salud pública, además con su divulgación, concientizar a la población de la importancia del cumplimiento de las medidas dictadas. No obstante, los modelos más sofisticados forman parte del arsenal que permite comprender una epidemia y son utilizados junto a este para dar respuestas a distintas preguntas y corroborar resultados.
Parámetros del modelo y políticas antiepidémicas frente a la COVID-19 en Cuba
La estimación de R0 debe realizarse a partir de las primeras observaciones una vez detectado el brote epidémico. Como se observa de su definición, R0 depende de β, ν y N. Para la COVID-19 los valores de ν y N son conocidos, uno está relacionado con el periodo infeccioso y el otro es el número de pobladores. Sin embargo, la tasa de contagio β debe ser estimada, lo cual se realiza estimando la incidencia per cápita que se conoce como fuerza de la infección. Un análisis de regresión a partir de los datos de prevalencia en los primeros momentos de la epidemia permite hacer las estimaciones de R0. Una vez corroborado que este valor es mayor que uno, se desatan las alarmas y comienzan a proponerse las medidas anti-epidémicas. En muchos casos los gobiernos no tienen que esperar al cálculo del R0 y toman medidas al observar un crecimiento abrupto de nuevos casos o brotes epidémicos en países vecinos. En particular en el caso de Cuba comenzó a prepararse, incluso, antes de que se reportara el primer caso, cuando ya todo apuntaba a que la COVID-19 se convertiría en pandemia.
Las medidas anti-epidémicas influyen en las tasas de contagio, por lo tanto, el β se va modificando en el tiempo de acuerdo al impacto de las disposiciones tomadas. En Cuba podemos citar como los principales eventos de 2020 los siguientes:
11 de marzo: día 1 epidémico. Primeros tres casos confirmados en la provincia de Sancti Spíritus. Turistas italianos.
24 de marzo: día 14 epidémico. 57 casos confirmados en el país.
Suspensión de las clases en todos los niveles de enseñanza, incluida la universitaria y la técnico-profesional.
Cierre de fronteras y cuarentena obligatoria a todos los viajeros provenientes del exterior en instituciones bajo el control del Ministerio de Salud Pública.
Suspensión del transporte interprovincial.
12 de abril: día 32 epidémico: 669 casos confirmados en el país.
A todo esto, hay que añadir una fuerte campaña de divulgación sobre medidas higiénicas, como el lavado de manos y desinfección de superficies; uso obligatorio del nasobuco y mantener una distancia física de más de 1,5 metros entre personas. Además, se realizó una estructuración de la venta de los comercios y otras disposiciones que prohibían aglomeraciones. Estas medidas buscan influir en la curva de infectados para que, en su pico, es decir la máxima prevalencia, no sobrepase las capacidades hospitalarias, principalmente las unidades de cuidados intensivos (UCI), ya que el uso de respiradores mecánicos en pacientes críticos es prácticamente indispensable. En hospitales de varios países desarrollados, acostumbrados a tener 5 casos diarios en las UCI, llegaron a tener 50 en los momentos de mayor prevalencia de la COVID-19.
Por esta razón, la tasa de contagio β y el R0 se deben calcular periódicamente para dar los estimados a las autoridades sanitarias y gubernamentales, para que les permitan prever las necesidades de camas y equipamiento, así como las cantidades de medicamentos específicos a necesitar.
Algunos ajustes del modelo SIR en diferentes tiempos epidémicos en Cuba
En los siguientes ejemplos de ajustes del modelo SIR en diferentes tiempos epidémicos se calcularon los parámetros semanalmente.
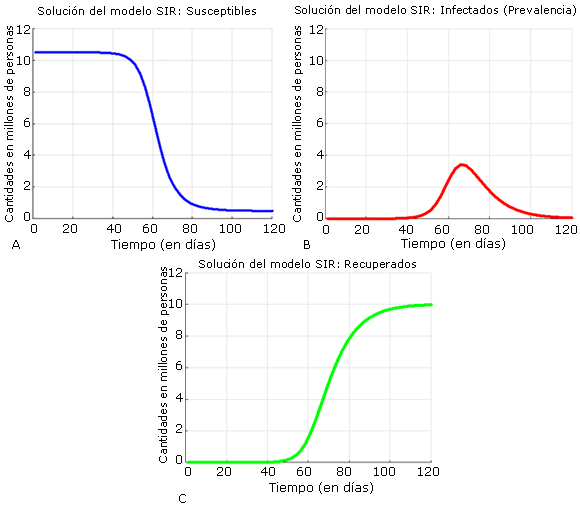
Para la primera semana el valor estimado de R0 fue de 4,3. La figura 3 muestra la modelación en las 2 primeras semanas (14 días). El ajuste del parámetro β se realizó utilizando los datos solo de la primera semana, señalizados en círculos de color rojo. Como se puede observar la curva modela bien los datos de la segunda semana (cruces en color azul) que no se utilizaron para la estimación.
 Fuente: Departamento de Vigilancia en Salud. Minsap.
Fuente: Departamento de Vigilancia en Salud. Minsap.Fig. 3 Ajuste del modelo las dos primeras semanas utilizando datos de la primera semana.
La figura 4 muestra la corrida del mismo modelo hasta 120 días. Se observa que sin medidas antiepidémicas la máxima prevalencia en el día 70, podría haber llegado a 4,5 millones de infectados, cerca del día 70 de la epidemia y pasados 120 días todavía existiría un elevado número de casos activos.
En la medida que el tiempo epidémico va transcurriendo se puede calcular el número reproductivo efectivo (Ecuación 6), que no es más que el número promedio de infecciones secundarias producidas por un individuo, durante su periodo infeccioso, en la población de susceptibles en el tiempo t. Cuando este número es menor que uno, la epidemia empieza a decrecer y matemáticamente se expresa como:
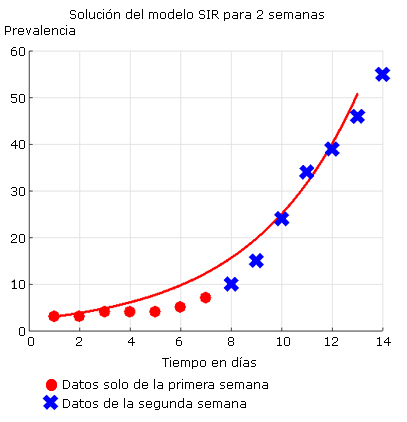
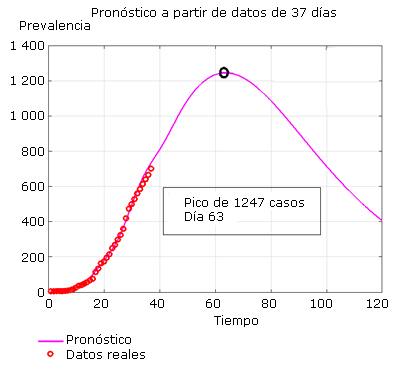
La figura 5 muestra los datos hasta el día 37 epidémico (17 de abril) cuando ya se habían tomado las medidas más importantes. Se puede observar la predicción de 1247 casos de máxima prevalencia en el día 63 epidémico.
 Fuente: Departamento de Vigilancia en Salud. Minsap.
Fuente: Departamento de Vigilancia en Salud. Minsap.Fig. 5 Ajuste del modelo y predicción hasta 120 días utilizando datos de los 37 primeros días epidémicos.
La estimación semanal del R e en las primeras seis semanas se muestra en la tabla 1, donde se observa que después de la segunda semana el R e comienza a descender.
Tabla 1 Estimación del número reproductivo efectivo para 6 semanas
| Semana | 1 | 2 | 3 | 4 | 5 | 6 |
| R
|
4,3 | 11 | 6,16 | 4 | 3,76 | 2,13 |
Con una rápida y efectiva ubicación de los contactos de los casos confirmados, del aumento de pruebas PCR (polymerase chain reaction) para la detección de carga viral a los grupos de riesgo y un pesquisaje diario y masivo a toda la población con síntomas gripales, prácticamente todos los pacientes con la COVID-19 que expresaban la enfermedad y una parte de los asintomáticos fue detectada con mucha confiablidad. Esto permitió que ingresaran a los centros de salud y comenzaran su tratamiento antes, incluso, de enfermarse. Además, aumentó la confianza en los datos utilizados para los pronósticos y las autoridades sanitarias pudieron programar los recursos humanos y de instalaciones sobre bases más sólidas.
Para el día 69 epidémico ya se había sobrepasado el pico (Fig. 6). Los datos mostraron que se había adelantado para el día 45, con una máxima prevalencia real de 849 casos, afortunadamente un 32 % menor que lo pronosticado el día 37. En la figura se observa además que para el día 100 prácticamente no se pronosticaban casos.
 Fuente: Departamento de Vigilancia en Salud. Minsap.
Fuente: Departamento de Vigilancia en Salud. Minsap.Fig. 6 Ajuste del modelo y predicción hasta 120 días utilizando datos de 69 días.
La secuencia de los números reproductivos efectivos decreció para esa fecha por debajo de uno como muestra la tabla 2.
Tabla 2 Estimación del número reproductivo efectivo para 11 semanas
| Semana | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| R
|
4,3 | 11 | 6,16 | 4 | 3,76 | 2,13 | 1,9 | 0,8 | 0,69 | 0.24 | 0,4 |
Los rebrotes no están exceptos de aparecer. Una gran masa de población susceptible constituye la base para su aparición. La disminución de la precepción de riesgo que induce al resquebrajamiento de la disciplina antiepidémica, el uso incorrecto o desuso del nasobuco o cubrebocas, e incluso hechos fortuitos son algunas de las causas más frecuentes. También una causa muy importante es la eliminación de las medidas de restricción física en pos de una reactivación económica, pero sin un control de la epidemia por parte de las autoridades sanitarias. Una característica de la COVID-19 es el elevado porciento de población seropositiva en SARS-CoV-2 que se mantiene asintomática, pero que propaga la enfermedad dificultando la detección del caso que da origen a un foco. Entre los lugares más peligrosos de provocar un elevado número de contagios están los locales cerrados de centros laborales con gran número de trabajadores interactuando.
Cuando los datos de prevalencia se van alejando de lo predicho por el modelo SIR, mostrando el aumento de la incidencia, se desatan de nuevo las alarmas (Fig. 7). Se hace necesario un pesquisaje masivo e intensivo para buscar los casos primarios y sus contactos y así cortar el foco de transmisión. Se realiza un gran número de pruebas PCR intencionadas en los lugares afectados, incluso extendiéndose a las comunidades donde están enclavados. Cuando el rebrote vincula a una comunidad y no puntualmente a centros laborales o de similar característica, las autoridades valoran la implementación de medidas de restricción comunitaria, a partir de las predicciones que aporta el modelo SIR.
 Fuente: Departamento de Vigilancia en Salud. Minsap.
Fuente: Departamento de Vigilancia en Salud. Minsap.Fig. 7 Modelo SIR estimado con datos de 73 días.
La estimación periódica de los parámetros del modelo SIR permite recalcular el número reproductivo efectivo R e . La magnitud del rebrote se puede inferir a partir del historial de los R e anteriores, asumiendo que la tendencia de estos es decrecer a cero en concordancia con una política sanitaria coherente. La figura 8 muestra diversos eventos en La Habana que produjeron un alejamiento de los datos al modelo y cómo el modelo SIR con estimación periódica de parámetros logra responder a ellos, pudiéndose predecir cada uno de los subpicos y ayudando a las autoridades de salud a disponer de los recursos hospitalarios, y sanitarios en general, de manera eficiente. También permite el diseño de campañas contra la disminución de la percepción de riesgo y la erradicación de indisciplinas epidémicas. Además, y no menos importante, da la posibilidad de sopesar la implementación de las medidas de desescalamiento de las restricciones, para la reanudación del quehacer económico sin perder el control epidemiológico en ningún momento.
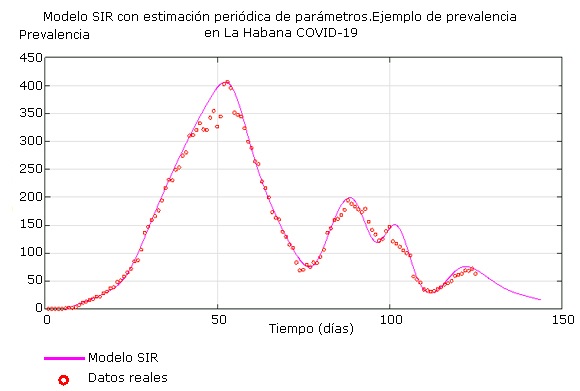
Fig. 8 Reproducción y predicción de rebrotes en la prevalencia de la COVID-19, con el modelo SIR mediante estimación periódica de parámetros. Ejemplo de La Habana.
Se debe señalar que las estimaciones obtenidas del modelo están sesgadas a favor de los datos. Este es un fenómeno que ocurre siempre, independiente del modelo, aunque por supuesto dentro del comportamiento cualitativo que este proporciona. Por lo tanto, si las condiciones en que los datos son obtenidos se modifican es muy probable que las estimaciones futuras sean bastante discordantes con la realidad. En este sentido, los modelos funcionan de una manera análoga a las predicciones que realizan los organismos internacionales acerca del crecimiento económico que tendrán las regiones o países. Estas estimaciones se pueden ver afectadas por factores diversos no contemplados al momento de su realización. Ejemplo de ello pueden ser conflictos bélicos, desastres naturales o pandemias como la actual COVID-19. En la modelación de la epidemia los rebrotes son estos hechos no contemplados originalmente. Sin embargo, existen rebrotes predecibles que son los que están vinculados al levantamiento de las medidas de cuarentena, de distanciamiento físico o de las barreras anticontagio, como el nasobuco, debido a una pretendida reactivación económica. Todo ello sin un control efectivo de la epidemia y echando por tierra políticas sanitarias coherentes llevadas a efecto hasta ese momento por los gobiernos.
Para conocer sobre cómo los diversos países se vieron afectados por este fenómeno en la COVID-19 y su comparación con Cuba se puede consultar el sitio COVID19 Cuba Data Dashboard and Data by Postdata.club, Juventud Técnica Magazine, SchoolofMath and Computer Science of Havana University and collaborators, 2020 (https://covid19cubadata.github.io). Este es el sitio de referencia en Cuba para los datos públicos de COVID-19, en el que se pueden encontrar la estadística de la pandemia, e indicadores como la incidencia, letalidad, el índice reproductivo, índice de Oxford, comparaciones entre países y otros aspectos que permiten el seguimiento de esta pandemia en el país.
Consideraciones finales
El modelo SIR básico, es un sistema dinámico determinista formado por tres ecuaciones diferenciales, donde cada una de ellas representa a una clase epidemiológica en la que se puede dividir la población en estudio, susceptibles, infectados y recuperados. La población se considera constante y el tránsito ocurre de una clase a la otra hasta la clase de recuperados, donde se permanece con inmunidad permanente. Los parámetros de las ecuaciones tienen significación epidemiológica y se van modificando a lo largo de la epidemia. Los números reproductivos básicos y efectivo (R0) y (Re) son indicadores epidémicos que permiten, de acuerdo a su valor, conocer el comportamiento de la epidemia (R0 < 1 y Re < 1 indican decrecimiento de la epidemia).
Los modelos dinámicos en conjunción con sistemas de salud pública robustos y políticas sanitarias coherentes permiten predecir el comportamiento epidémico y evaluar la eficacia de las políticas implementadas. La divulgación de la utilidad de los modelos matemáticos al personal de la salud, e incluso a un público más general, es de importancia para el apoderamiento de estas herramientas en épocas de pandemias. El modelo SIR básico de Kermack y McKendrick es útil para la predicción y apoyo a la toma de decisiones de salud pública, durante una epidemia de influenza, en particular con la COVID-19, que ha puesto a las fuerzas sanitarias en tensión para combatirla a nivel mundial. Asimismo, este modelo permite analizar rebrotes o eventos locales de transmisión y es aplicable a poblaciones específicas para la modelación de eventos, principalmente cuando hay implementadas medidas de aislamiento y baja interacción entre territorios. Esto permitió su aplicación en La Habana, donde sus estimados apoyaron a los epidemiólogos a cuantificar la magnitud de cada evento y prever su alcance.
Aunque no se ejemplificó en este trabajo, es bueno señalar que en comunidades pequeñas donde se hayan reportado casos de la enfermedad, si están cerradas, el modelo permite tener estimaciones locales fiables que permitan calcular mejor los recursos que se deben destinar para ellas.
Existen otros modelos más sofisticados que el simple de Kermack y McKendrick aplicado en el presente estudio. Especialmente los modelos SIR que incorporan la demografía, que pueden conducir a estados libres de la enfermedad o a estados endémicos, es decir, donde una cierta cantidad de infectados conviven en la comunidad. Esta condición es muy interesante estudiarla, ya que muchos de los virus que fueron pandemia en su momento como el H1N1, son endémicos en la actualidad. Mantener la endemia bajo control es muy importante y en este contexto el número R0 de estos modelos está vinculado a su control.14
Conclusiones
Un sistema de salud robusto y organizado es una ventaja muy importante para aprovechar las potencialidades de los modelos epidemiológicos. La calidad en la estimación de parámetros depende en gran medida de la calidad de los datos que el sistema de salud pueda proporcionar. En Cuba, el sistema de salud y el Gobierno aúnan esfuerzos para combatir la COVID-19, para lo que se apoyan en los modelos epidemiológicos, a la vez que proporcionan datos fiables para su elaboración. De esta manera, la información aportada por los modelos ayuda a la implementación de campañas contra la disminución de la percepción de riesgo y la erradicación de indisciplinas epidémicas y sopesar la implementación de las medidas de desescalamiento de las restricciones para la reanudación del quehacer económico sin perder el control epidemiológico en ningún momento.