Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. v.22 n.1 La Habana ene.-abr. 2007
Trabajo original
AISLAMIENTO E IDENTIFICACIÓN MORFOLÓGICA, BIOQUÍMICA Y MOLECULAR DE Leifsonia xyli subsp. xyli EN CUBA
ISOLATION AND MORPHOLOGICAL, BIOCHEMICAL AND MOLECULAR IDENTIFICATION OF Leifsonia xyli subsp. xyli
Aleika Iglesia*, Raiza González**, Dayamí Martín*, Maricela Díaz* y Elba Álvarez*
*Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba. Correo electrónico: aiglesia@censa.edu.cu. **Centro Nacional de Bioplantas. Ciego de Ávila. Cuba
RESUMEN
En este trabajo se obtiene el cultivo puro de Leifsonia xyli subsp. xyli a partir de variedades cubanas de caña de azúcar y se logra disminuir las dificultades presentadas hasta el momento con el aislamiento de esta fitobacteria de naturaleza fastidiosa. Se evidencia el pleomorfismo típico de esta especie bacteriana y la total coincidencia de las características bioquímicas y moleculares que la identifican. Se cuenta por primera vez en Cuba con aislados caracterizados que pueden ser empleados en futuras investigaciones y servicios, así como en la obtención de antisueros para el diagnóstico serológico de esta importante enfermedad.
Palabras clave: Leifsonia xyli subp. xyli; morfología; bioquímica; PCR; identificación.
ABSTRACT
In this work, Leifsonia xyli subsp. xyli pure culture is obtained from Cuban varieties of sugarcane, and the difficulties present till now regarding the isolate of this phytobacterium of fastidious nature are decreased. The typical pleomorphism of this bacterial species and the total coincidence of the biochemical and molecular characteristics that identify it, are evindenced. It is counted for the first time in Cuba with characterized isolates which can be used in future researches and services, as well as in the antisera obtaining for the serological diagnostic of this important disease.
Key words: Leifsonia xyli subp. xyli; morphology; biochemistry; PCR; identification.
INTRODUCCIÓN
La enfermedad del raquitismo de los retoños de la caña de azúcar provocada por Leifsonia xyli subsp. xyli fue observada por primera vez durante el verano de 1944-1945, cuando investigadores australianos detectaron en zonas cañeras ubicadas dentro del distrito de Mac Key (Queensland), considerables afectaciones en el vigor de las plantas de la variedad Q-28, que había sido introducida en la producción, principalmente por su buen comportamiento frente a diferentes enfermedades (6).
Está considerada como una de las patologías bacterianas más importantes para el cultivo de la caña de azúcar por las pérdidas que ha provocado y los altos niveles de propagación e intensidad que presentan en el campo. En Cuba está presente desde 1953 y posteriormente informada por varios investigadores quienes advirtieron su amplia distribución en las áreas cañeras del país (4, 5, 19).
El diagnóstico de la enfermedad se ha afectado debido a la ausencia de síntomas que puedan ser atribuidos específicamente a la enfermedad, así como las propias características de la bacteria que la produce. Por su parte, el control se ha basado en el uso de material de siembra saneado, empleo de variedades resistentes y la utilización de medidas que limiten su diseminación en el campo (18, 21).
Durante muchos años se han presentado algunas dificultades con el aislamiento de la fitobacteria que la produce, dadas por su naturaleza fastidiosa, su pobre desarrollo en medios de cultivos y lenta multiplicación en el hospedante (7, 17). Y aunque existen grupos de trabajo de Australia, Sudáfrica, USA, Brasil y Francia que han trabajado en el aislamiento y diagnóstico de esta fitobacteria en Cuba, no se ha logrado obtener resultados consistentes. Esto ha conllevado a que existan limitaciones en el diagnóstico y caracterización de esta enfermedad, ya que no se cuentan con cepas que puedan ser empleadas para la obtención de anticuerpos policlonales y como controles positivos para la validación de los métodos serológicos y moleculares.
Es por ello que nuestro trabajo está dirigido a la obtención de una cepa caracterizada desde el punto de vista morfológico, bioquímico y molecular que pueda emplearse para la obtención de antisueros policlonales y como control positivo de ensayos de diagnóstico imprescindibles en los programas de selección de semillas y de mejoramiento genético de la caña de azúcar en Cuba.
MATERIALES Y MÉTODOS
Obtención del cultivo puro de Leifsonia xyli subsp. xyli a partir de jugos de la variedad CP31-294 de caña de azúcar
Con el objetivo de obtener el cultivo puro de Leifsonia xyli subsp. xyli se utilizaron cinco muestras del tercio inferior de tallos de caña de azúcar pertenecientes a la variedad CP31-294 severamente afectada por el RSD y procedentes de las áreas de campo de la Estación Experimental "Antonio Mesa" en Jovellanos, provincia de Matanzas.
Preparación de las muestras: se extrajeron secciones de tallos de la zona del entrenudo de estas muestras, las que se lavaron con agua destilada estéril (0.2 conductividad) y se desinfectaron con etanol absoluto (70%), durante 1 minuto. Los jugos se obtuvieron bajo condiciones asépticas en gabinete de bioseguridad, mediante el corte de pequeñas secciones de tallos con un horadador de 5mm de diámetro, que se colocaron en un sistema doble de tubos (uno de 0.5mL perforado por el fondo dentro de otro de 1.5mL) para recoger los fluidos por centrifugación a 10 000 rpm, durante cinco minutos. Una porción de 200mL, fue conservada a -20ºC para utilizarla como control positivo en los ensayos posteriores (inmunoquímicos y moleculares) y a la otra se le realizó diluciones seriadas desde 10-1 hasta 10-6 con solución salina estéril al 0.85% (0.85g de NaCl en 100mL de agua destilada) para la siembra en medio de cultivo.
Para el cultivo in vitro de Leifsonia xyli subsp. xyli se utilizó el medio SC (8) [17g de agar extracto de maíz, 4g de agar bacteriológico, 8g de peptona, 30mL de cloruro de hemina bovina (0.1% de hemina en NaOH al 0.05N), 0.2g de MgSO4, 13mL de K2HPO4 (0.1M), 87 mL de KH2PO4 (0.1 M) y 800 mL de agua destilada, pH 7.5], el cual se esterilizó durante 15 minutos. Luego de enfriado hasta 50ºC se le adicionó una solución acuosa filtrada con filtro millipore (0.2mm) de 5g de glucosa, 0.5g de cisterna, 2g de albúmina bovina fracción V y ácido nalidíxico (10) en 100 mL de agua destilada.
Las placas se inocularon con 0.1mL de las diluciones de jugos 10-3 y 10-5, las que se extendieron con espátula de Drigalski y se incubaron a 28ºC durante dos semanas, aproximadamente, hasta lograr el crecimiento de colonias típicas, que después se pasaron hacia nuevas placas. Las características morfológicas y culturales de las mismas se describieron y compararon de acuerdo a lo descrito para esta especie (8).
Después de realizar dos pases sucesivos de una colonia, fueron conservadas a -70ºC, en tubos de crioconservación con medio líquido S8 (componentes del medio SC, sin agar bacteriológico) y glicerol al 20% (11).
Identificación morfológica, bioquímica y mediante PCR del aislamiento en estudio
Las características morfológicas de las células bacterianas asociadas a la enfermedad, se determinaron mediante el uso de la técnica de tinción de Gram (9) y por microscopia electrónica (20). Se determinaron las propiedades bioquímicas más importantes: oxidasa; utilización de citrato, gluconato, almidón, esculina, gelatina; producción de sulfuro de hidrógeno; Voges-Proskauer y producción de ácidos a partir de D-arabinosa, D-galactosa, D-sacarosa y salicina (8, 12).
Para complementar los estudios morfológicos y bioquímicos se utilizó la técnica de PCR con el empleo de los iniciadores y programas sugeridos para el diagnóstico específico de Leifsonia xyli subsp. xyli (1, 16). Todas las muestras amplificadas pertenecen a suspensiones bacterianas preparadas a una concentración de 108 UFC/mL las que fueron incubadas durante 10 minutos a 100ºC. Se utilizaron controles negativos de bacterias (Xanthomonas axonopodis pv. vasculorum, Xanthomonas albilineans y Herbaspirillum rubrisubalbicans), para verificar las especificidad del método.
RESULTADOS Y DISCUSIÓN
En el aislamiento de la bacteria se obtuvieron colonias típicas de Leifsonia xyli subsp. xyli a los 14 días, las que se caracterizaron por ser no pigmentadas, circulares, pequeñas, transparentes y con un diámetro que varió entre 0.1 y 0.3 mm en medio SC. Tales características se correspondieron con las descritas para esta especie y con el tiempo establecido para su crecimiento (8). Resultados similares se obtuvieron por otros autores, quienes realizaron una comparación entre diferentes aislamientos de la bacteria, los que no mostraron diferencias entre sí al ser comparados morfológicamente.
El procedimiento y el medio de cultivo resultaron efectivos para el aislamiento y aunque no todos los intentos realizados permitieron la obtención de colonias típicas de esta especie, la utilización de tallos de la variedad CP31-294, severamente afectada por RSD, así como la obtención de jugos por centrifugación, contribuyeron a disminuir los problemas presentados hasta el momento para cultivar esta bacteria de naturaleza fastidiosa (7).
Estas dificultades han sido descritas por varios autores (6, 8, 9), quienes informaron acerca de los bajos títulos en que puede encontrarse esta especie bacteriana, así como las contaminaciones que se producen por el desarrollo de microorganismos saprófitos que enmascaran el aislamiento, debido al tiempo en que tarda la bacteria en crecer (9).
La influencia negativa que ejercen los contaminantes en la obtención de buenos resultados en el aislamiento se evitó con el uso de diluciones seriadas del jugo obtenido, unido a la introducción de ácido nalidíxico como componente del medio de cultivo, antibiótico al cual, las bacterias del género Clavibacter y Leifsonia han mostrado resistencia (10).
Las experiencias obtenidas por varios investigadores al realizar el aislamiento de otras bacterias fitopatógenas sugieren que las mejores diluciones para la siembra primaria en el caso de las bacterias fitopatógenas son las de 10-3 y 10-5, resultados que se tuvieron en cuenta al realizar el aislamiento de esta bacteria (6).
En la identificación morfológica la respuesta a la tinción de Gram fue positiva, aspecto coincidente con lo señalado por otros autores, al referirse a la composición de la pared celular de las especies pertenecientes al género Leifsonia que le permiten fijar el colorante violeta cristal (8).
En las observaciones realizadas al microscopio electrónico se apreciaron bacilos rectos y curvos con dimensiones muy pequeñas que oscilaron entre 1-3mm de largo y 0.1-0.3mm de ancho (Figura 1), lo cual evidenció el pleomorfismo típico de Leifsonia xyli subsp. xyli informado con anterioridad (9, 19) para esta especie, al examinar no solo cultivos bacterianos cubanos sino extractos de jugos procedentes de variedades afectadas por la enfermedad.
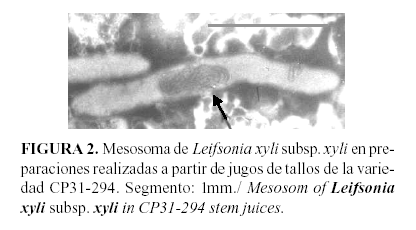
Esta característica, unida a las pequeñas dimensiones de las células, la ausencia de flagelo, así como la presencia de mesosoma (Figura 2), hacen que la misma sea fácilmente diferenciada, de las otras especies bacterianas que afectan el cultivo de la caña de azúcar desde el punto de vista morfológico (6).
En los resultados de la identificación bioquímica se apreció la total coincidencia de todas las pruebas realizadas con lo señalado por otros autores los que propusieron la reclasificación de esta especie basados Fundamentalmente en sus características bioquímicas y culturales (12).
La amplificación obtenida mediante PCR al utilizar las parejas de iniciadores RST59/RST60 y Cxx1/Cxx2 se ejemplifica en la Figura 3. Se muestran los fragmentos de 438pb y 229pb que identifican específicamente a Leifsonia xyli subsp. xyli.
El uso de iniciadores derivados de la región intergénica 16S-23S del ARNr (ITS) ha permitido el desarrollo de métodos de amplificación enzimática in vitro de gran utilidad para el diagnóstico específico, la identificación y la clasificación taxonómica de procariontes, teniendo en cuenta que se encuentra entre dos regiones generalmente conservadas (15, 22). En este sentido algunos autores (2, 3, 14), demostraron las potencialidades de este sitio para el diagnóstico específico de Leifsonia xyli subsp. xyli, al evidenciar la no existencia de secuencias homólogas en otras especies bacterianas que afectan el cultivo de la caña de azúcar (13, 16).
Las observaciones al microscopio electrónico, los resultados de las pruebas bioquímicas, así como la amplificación in vitro de secuencias específicas de esta bacteria por PCR, permitieron identificar la cepa obtenida como Leifsonia xyli subsp. xyli (Lxx-1) y contar por primera vez en Cuba con cepas de esta especie para investigaciones que se realizan en estos momentos y para mejorar los sistema de diagnóstico de esta importante enfermedad que afecta todas las áreas cañeras del país y ocasiona grandes pérdidas a la economía.
REFERENCIAS
1. Astua-Monge G. Detection of Clavibacter xyli subsp. xyli, the causal agent of ratoon stunting disease of sugarcane, based on amplification of DNA in the ribosomal DNA spacer. Thesis presented to the graduate school of the university of Florida in partial fulfillment of the requirements for the degree of Master of Science, University of Florida.1995;58pp.
2. Brumbley JM, Petrasovits LA, Birch RG, Taylor PW. Transformation and transposon mutagenesis of Leifsonia xyli subsp. xyli, causal organism of ratoon stunting disease of sugarcane. Mol Plant Microbe Interact. 2002;15(3):262-268.
3. Brumbley JM, Petrasovits LA, Murphy RM, Nagel RJ. Establishment of a functional genomic plataform for Leifsonia xyli subsp. xyli.2005;17(2):175-183.
4. Chinea A. Panorama fitopatológico de la caña de azúcar en Cuba. En: Seminario Taller 35 Aniversario del Instituto Nacional de Investigaciones de la Caña de Azúcar. Jovellanos, Matanzas. 2002;Pp.67-70.
5. Chinea A, Pérez Milían JR, Peralta EL, Matos M. Raquitismo de los retoños de la caña de azúcar: Medio siglo de investigaciones en Cuba. En: Seminario Científico Internacional de Sanidad Vegetal. La Habana, Cuba, mayo 24. 2005;Pp.62.
6. Davis MJ, Bailey RA. Ratoon stunting. Pp. 49-54. En: A guide to sugarcane diseases. Rott P, Bailey RA, Comstock JC, Croft BJ, Saumtally AS. (editors) Charter: Diseases caused by bacteria;2001.
7. Davis MJ. Advances in Diagnosis and Management of Leaf Scald and Ratoon Stunting Diseases of Sugarcane. En: Seminario Científico Internacional de Sanidad Vegetal. La Habana, Cuba, mayo 24-28.2005;Memorias AS 3.1.
8. Davis MJ, Dean JL. Comparison of diagnostic techniques for determining incidence of ratoon stunting disease of sugarcane in Florida. Plant. Disease Report.1984;(68):896-899.
9. Davis MJ, Gillaspie AG, Harris RW, Lawson RH. Ratoon stunting disease of sugarcane: Isolation of the cause bacterium. Science. 1980;(10):1365-1367.
10.Davis MJ, Vidaver AK. Coryneform plant pathogens En: Plant pathogenic b Schaad NW, Jones JB, Chun W. (Eds). Charter: Diseases caused by bacteria.2001;Pp. 218-235.
11.Díaz Maricela. Escaldadura Foliar de la Caña de azúcar en Cuba: caracterización, diversidad y diagnóstico molecular de su agente causal Xanthomonas albilineans Ashby (Dowson). Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. CENSA. La Habana.2000;78 Pp.
12.Evtushenko LI, Dorofeeva LV, Subbotin SA, Cole JR, Tiedje JM. Leifsonia poae gen. nov., sp. nov., isolated from nematodo gall on Poa annua, and reclassification of "Corinebacterium aquaticum" Leifson 1962 as Leifsonia aquatica nov. and Clavibacter xyli Davis et al. 1984 with two subspecies as Leifsonia xyli (Davis et al. 1984) gen. nov.,comb. nov. Intern J Syst Evol Microbiol. 2000;50:371-380.
13.Fegan M, Smith Robert GR, Van de Velde R, Teakle DS, Hayward AA. Sensitive and specific detection of Clavibacter xyli subsp. xyli, causal agent of ratoon stunting disease of sugar cane, with a polymerase chain reaction-based assay. Plant Dis. 1998;82(3):285-290.
14.Gagliardi RP. Análisis estructural y comparativo del genoma de Leifsonia xyli subsp. xyli. Tesis presentada para la obtención del Título de Maestro en Agronomía en la Escuela Superior de Agricultura "Luis Queiroz". Universidad de Sao Pablo. Piracicaba, Brasil.2003;61p.
15.McGregor DP, Forster S, Steven J, Adair J, Leary SE, Leslie DL, Harris WJ, Titball RW. Simultaneous detection of microorganisms in soil suspension based on PCR amplification of bacterial 16S rRNA fragments. Bio Techniques. 1996;21:463-471.
16.Pan YB, Grisham MP, Burner DM, Damann KE Jr, Wei Q. A Polymerase chain reaction protocol for the detection of Clavibacter xyli subsp. xyli, the causal bacterium of sugarcane ratoon stunting disease. Plant Dis. 1998;(82):285-290.
17.Peralta EL, Arocha Y, Iglesia A, Diaz M, Álvarez E, López M, Pino O, Miranda I, Milián J, Carvajal O, Matos M, Curbelo I. Completamiento de la caracterización de los patógenos causantes de las enfermedades más importantes de la caña de azúcar en Cuba y desarrollo de métodos de mayor eficacia para su control. Informe Final de Proyecto. Academia Nacional de Ciencias de Cuba,2003;70 p.
18.Peralta Esther L. El diagnóstico de fitopatógenos en la región. Phytopathology,2001;22(9):21-23.
19.Pérez JR. El raquitismo de los retoños (RSD) de la caña de azúcar en Cuba. Tesis de opción al grado de Candidato a Doctor en Ciencias. Referata. Jovellanos, Matanzas;1985.
20.Sigee DC. Microscopical techniques for bacteria. . En: Laboratory guide for identification of plant pathogenic bacteria. Shaad NW, Jones JB, Chun W. Editors. St. Paul: Phytopathological Society Press.1990; Pp. 1-5
21.Taylor PWJ. Detection and control of transmission of ratoon stunting disease. Pp 209-217. En: Sugarcane Pathology. Volume III. Bacterial and Nematode Diseases. Rao GP, Editor. Oxford & IBH;2004.
22.Taylor PWJ, Petrasovits LA, Van der Velde R, Birch R, Croft GBJ, Fegan M, Smith GR, Brumbley SM. Development of PCR-based markers for detection of Leifsonia xyli subsp. xyli in fibrovascular fluid of infected sugarcane plants. Australasian Plant Pathology.2003;32(3):367-375.
(Recibido 13-4-2006; Aceptado 1-11-2006)