Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.2 La Habana mayo-ago. 2012
ARTÍCULO ORIGINAL
Ciclo y tablas de vida horizontal de Diaphorina citri Kuwayama (Hemiptera: Psillidae) sobre Muralla paniculata L.
Life cycle and horizontal tables Diaphorina citri Kuwayana (Hemiptera: Psillidae) on Muralla paniculata L.
Heyker Lellani Baños, J. Alemán, María de los Ángeles Martínez, Ileana Miranda, H. Rodríguez, Moraima Suris, Jennifer Ravelo
Dirección de Protección de Plantas. Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: hlellani@censa.edu.cu.
RESUMEN
El objetivo del presente estudio fue determinar la duración del ciclo de vida, proporción sexual, longevidad, fecundidad y tabla de vida horizontal por edades de Diaphorina citri Kuwayama, vector de ²Candidatus Liberibacter sp.² agente causal del Huanlongbing, criado sobre plantas de Muralla paniculata L. Para ello se estableció una cría del psíllido en laboratorio bajo las siguientes condiciones: 21 ±1°C y 68,5±10% respectivamente, con fotoperíodo de 14L/10D. El estudio se realizó a partir de una cohorte de 20 hembras y otra para los diferentes estadios a partir de 125 huevos. Se encontró que el tiempo de desarrollo de los estados inmaduros: 7-18 días; la longevidad de los adultos de aproximadamente 10 y 11 días; proporción sexual (C/X): 2:1. La tasa de mortalidad específica (qx) fue baja para los estados de huevo a ninfa IV, mostrándose elevada en las ninfas de quinto instar. La fecundidad (mx) y la tasa neta de reproducción (R0) alcanzaron valores superiores a la unidad mostrando que la población está en crecimiento. Estos parámetros resultan de interés no solo para conocer la dinámica poblacional en laboratorio sino para diseñar estrategias para la cría masiva del parasitoide Tamarixia radiata Waterson.
Palabras clave: tabla de vida, fecundidad, ciclo de vida, Diaphorina citri.
ABSTRACT
The purpose of this work was to determine the length of life cycle, sex ratio, longevity, fecundity and horizontal table of life by age of Diaphorina citri var. Kuwayama, vector of ²Candidatus Liberibacter sp.² causal agent of Huanlongbing, reared on Muralla paniculata L. plants. The psillid was reared in the laboratory at 21±1°C and a relative humidity 68,5± 10% under a 14h light; 10h dark photoperiod. Its life cycle and life table were determined from a cohort of 20 females and 125 eggs. The developmental period of eggs and nymphs were 7-18 days; adult longevity was 10 y 11 days with a sexual proportion (C/X): 2:1. Specific mortality rate for each stage (qx) was lower for eggs- nymph IV and increased in nymph V. Fecundity (mx) and net reproductive rate (R0) reached values higher than the unit showing growing populations. These parameters are interest not only to know the population dynamics in the laboratory, but also to design strategies of mass rearing of Tamarixia radiata Waterson.
Key words: table of life, fecundity, life cycle, Diaphorina citri.
INTRODUCCIÓN
Los cítricos están considerados entre las líneas de desarrollo para ingreso de divisas en Cuba, de ellos se obtienen, con destino a la exportación, fruta fresca, jugo y aceites escenciales, productos que se comercializan fundamentalmente en Europa, aunque algunas cantidades se han enviado a zonas del Caribe, América Latina y países asiáticos como Japón. El panorama del fruto en el país ha ido cambiando a tono con los nuevos tiempos. La Isla de la Juventud, por ejemplo, que llegó a producir 161 000 toneladas, fundamentalmente de toronja, hoy solo obtiene unas 10 000 toneladas (1).Mucho han tenido que ver en ello los cambios climáticos y el consecuente surgimiento y desarrollo de plagas y enfermedades devastadoras (2).
En los últimos años se ha producido un incremento acelerado de la aparición y diseminación de enfermedades en los cítricos, amenazado particularmente al Caribe por la rápida expansión de razas o formas severas del virus de la Tristeza de los cítricos (CTV) y la introducción de enfermedades existentes en otros países del continente como el cáncer de los cítricos, la clorosis variegada , la mancha negra de la fruta y el Huanglongbing; este último en incremento luego de la aparición de Diaphorina citri Kuwayama (3).
En la actualidad se cuenta con diversos planes de manejo para este insecto, los cuales van desde el uso de insecticidas como el Imidacloprid hasta la utilización de extractos naturales a base de Nim, aunque el mayor énfasis se hace en la utilización de enemigos naturales. Los más importantes por su efectividad como controladores de esta plaga lo constituyen las especies asiáticas de parasitoides Diaphorencyrtus aligarhensis (Shaffe, Alan y Agarwol) y Tamarixia radiata Waterston, este ultimo presente en nuestro país (4). Estas especies han sido importadas para emplearlas en programas de control biológico en el mundo (5, 6 y 7). Por otra parte se ha informado la presencia de este parasitoide establecido y colonizando el territorio nacional, por lo que se pretende potenciar el parasitismo natural con incrementos locales para elevar la efectividad del control natural.
Numerosos trabajos han sido publicados acerca del ciclo de vida del psillído, destacándose la importancia de los principales aspectos sobre la biología y el comportamiento reproductivo de este insecto para el establecimiento de crías masivas de T. radiata; así pues se ha determinado que las hembras podrían llegar a poner más de 800 huevos durante sus vidas. El ciclo de vida requiere de 15 a 47 días, dependiendo de la estación del año (8,9, 10, 11, 12, 13, 14,15).
La plantas de la especie Muralla spp. constituyen un reservorio natural de D. citri durante el período de no brotación de los cítricos, por esto y por no ser consideradas como un hospendante de la bacteria ²Candidatus Liberibacter sp.² (Jagoueix, Bové and Garnier), son recomendadas como hospedante de D.citri en las crías de T. radiata a nivel de laboratorios (16,17,18).
Basándonos en estos estudios en otras regiones del mundo y con vistas a conocer el comportamiento de este insecto y sus poblaciones con el objetivo de encaminar estudios que sentarán bases para el desarrollo de pies de crías de T. radiata se propuso determinar las características del ciclo de vida así como el estudio de poblaciones de D. citri obtenidas en el laboratorio.
MATERIALES Y MÉTODOS
Biología de D. citri sobre M. paniculata en condiciones de local de cría climatizado.
Cultivo del Hospedante
Las plantas de M. paniculata se obtuvieron a partir de semillas de plantas procedentes del sector privado del municipio San José de las Lajas, en la provincia de Mayabeque. Las semillas se trataron con ácido indolbutírico a una concentración de 1 mL.L con el objetivo de mejorar su germinación y fueron sembradas en cepellones contentivos de una mezcla de suelo ferralítico rojo típico y abono orgánico (proporción 2:1). La opción de utilizar plantas de esta especie fue recomendada por Etienne, 2007(1) quien señala que ellas constituyen un hospedante de más fácil manejo, en comparación con plantas de lima, limón o naranja.
El trasplante se realizó a los 35 días de la germinación de las semillas, a macetas de 5 L, donde permanecieron hasta que las plantas alcanzaron una altura de 40 cm (aproximadamente a los seis meses). En ese momento se procedió a la poda y aplicación de ácido indolbutírico o Fitomás-E® a una concentración de 0.5 mL.L-1 para estimular la brotación, quedando listas para introducirlas en las jaulas de cría.
Cría y Biología de D. citri
Se utilizaron tres jaulas de 95x81x100 cm con 7 plantas de M. paniculata en cada jaula, las que poseían brotes óptimos para la oviposición ; en cada una se liberaron 50 adultos de D. citri con una relación sexual hembra-macho de 2:1. Los adultos se mantuvieron en las jaulas por 24 horas y a partir de este momento se retiraron. Se estableció un fotoperíodo de 14 horas luz con una temperatura y humedad relativa promedio de 21 ±1°C y 68.5 ±10% respectivamente; registrados diariamente mediante un termohigrómetro de precisión digital modelo Testo 608-H2.
En cada planta se seleccionó al azar un brote, el cual se identificó, para distinguirlo del resto y se realizaron observaciones diarias hasta la aparición de los huevos, los cuales se contabilizaron con una lupa de 10x. A los 125 huevos obtenidos en la primera generación de laboratorio, se les siguió su desarrollo, llevándose un registro del tiempo de duración de los distintos estados y estadios ninfales.
Una vez alcanzado el 5to instar, los brotes se cubrieron con bolsas de nylon previamente agujereadas para evitar así la formación de gotas de agua debido a la transpiración de la planta; de esta forma se contabilizaron los adultos emergidos. Estos se recolectaron diariamente y se colocaron en jaulas de 60x50x50 cm con plantas de M. paniculata donde se mantuvieron hasta su muerte.
Tabla de vida por edades.
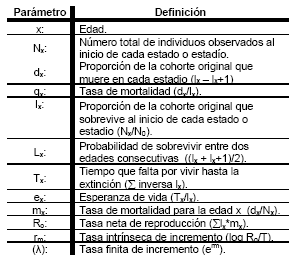
En esta tabla de vida se estudia un grupo de individuos (cohorte), desde su nacimiento hasta la muerte del último individuo. A partir de los datos obtenidos de los estudios biológicos, se construyeron las tablas de vida, partiendo de una cohorte de 125 huevos y de otra cohorte de 20 hembras. Se tuvieron en cuenta para cada intervalo de edad los siguientes parámetros:
RESULTADOS Y DISCUSIÓN
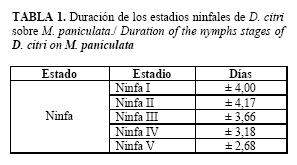
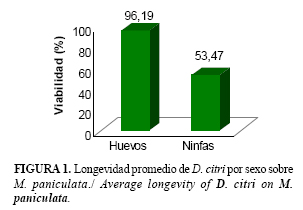
Mediante el método de cría antes expuesto se obtuvo en la primera generación una población estimada de 2900 adultos, obtenida a partir de los individuos emergidos en cada una de las jaulas. En estas poblaciones, la duración de los distintos estados y estadios del psíllido se comportó según se muestran a continuación (Tabla 1 y Figura 1).
El período de incubación de los huevos fue de 3,21 días, con una viabilidad del 96,19%, la duración de los estadios ninfales estuvo entre 17-18 días con una sobrevivencia de 53,47, aunque los de mayor interés (3ro-5to) se alcanzaron aproximadamente a partir de los 11 días. El porcentaje de sobrevivencia fue en un 50 %, la longevidad de los adultos es de 10 días para las hembras y 11,4 para los machos, el período de pre-ovoposición es de 9,81 días. En resumen, el ciclo de vida de este insecto se estableció en 30,38 días como promedio.
Se plantea que a 25°C la eclosión puede ocurrir a los 4 días (19), llegando a disminuir hasta 2 días. La cantidad de huevos puestos por las hembras de D. citri, así como la eclosión de los mismos depende en gran medida del hospedante y de las condiciones climáticas imperantes en la región (20).
El análisis de los registros obtenidos sobre el tiempo de desarrollo de huevo-adulto, en condiciones de laboratorio, sobre M. paniculata indican que se trata de un ciclo corto (30 días) pudiéndose presentar varias generaciones en el campo.
En los estudios de la duración del ciclo de desarrollo de D. citri nuestros resultados coinciden con los obtenidos por diferentes grupos de investigadores a nivel Mundial. Por ejemplo, en Francia (21) se obtuvo una duración total del ciclo entre 16-17 días a 25°C y en la Florida se informa una duración de 16,9 días a esta misma temperatura (19). Así mismo, Grafton-Cardwell (22) y Chiou-nan (23) obtuvieron un ciclo de desarrollo del psíllido de 16-17 días en las mismas condiciones climáticas.
Los valores de longevidad media del adulto obtenidos en este estudio se encuentran por debajo de los valores obtenidos por Etienne (21) para esta especie, los cuales se encuentran entre los 39,6 y 47,5 días. Analizando estos resultados, resalta la baja longevidad que se alcanzó en este estudio, en lo que pudo haber influenciado la excesiva manipulación a que fueron sometidos, pues en general, las condiciones del hospedante y climáticas se encuentran en el intervalo óptimo informado para esta especie.
En Brasil, investigadores de Piracicaba, Sao Paulo (19) observaron que el período de pre-ovoposición fue de 10,93 días a una temperatura de 24 °C, el período de incubación de estos huevos fue de 3,63 días mientras que el desarrollo de los estadios ninfales se completó a los 14,11 días, siendo la viabilidad de 93,8% y 74,0% para huevos y ninfas respectivamente. A su vez, estos autores informan a 25°C, variaciones del ciclo de desarrollo que van desde 12,1- 43,5 días, siendo como promedio de 17,1 días.
En China (23) fueron necesarios 15 días para el completamiento de los estadios ninfales a 25°C, con un período de preovoposición desde 17-60 días, así mismo EPPO (24) en su base de datos de plagas cuarentenadas informa un período de preovoposicion de 12 días aproximadamente, además indica una duración de los estados ninfales de 11 a 30 días y un ciclo completo toma desde 14 días hasta 40 días; cifras comparables con las obtenidas por Chavan y Summanwar (20) quienes confirman un desarrollo ninfal completo entre los 11-15 días, obteniéndose de esta forma un ciclo de desarrollo completo de 15-47 días dependiendo de las condiciones climáticas.
Teniendo en cuenta estos valores y debido a su corto ciclo de desarrollo, numerosos autores plantean la presencia de varias generaciones en el campo en un mismo año, pudiendo estar entre 10 (23) y 30 generaciones al año (22).
Los datos biológicos obtenidos de esta especie permitieron establecer y fijar los parámetros biológicos bajo las condiciones climatológicas de Cuba, así como también los valores alcanzados en los ensayos nos demuestran que nuestros resultados están dentro de los que se informan para la especie según las condiciones de temperatura y humedad relativa establecidas en los laboratorios.
De cualquier forma durante el estudio se evidenció que las plantas hospedantes y el efecto de las condiciones climáticas a las que son sometidas las crías del insecto resultan importantes en la sobrevivencia e intervalo de desarrollo del psíllido en condiciones de cría artificial en Cuba.
TABLA DE VIDA HORIZONTAL POR EDADES
Es conveniente recordar que el valor de rm en condiciones controlada está regido por la natalidad y la mortalidad de los individuos de la población, mientras que en condiciones naturales existen otros factores que afectan el equilibrio como la inmigración y emigración de los individuos, además de los cambios ambientales y la presencia de enemigos naturales, lo cual puede afectar la dinámica poblacional del psíllido (25). En términos demográficos el valor l está determinado por el ambiente y el ciclo de vida de la especie. Este parámetro caracteriza la dinámica potencial de la población y sirve para discutir efectos en escenarios más complejos. Ambos parámetros son considerados propios de la especie y están regidos por factores genéticos y sirven como punto de partida para el manejo de poblaciones, ya sea para reducir la diseminación de la plaga o para incrementar la dispersión de una especie introducida (26).
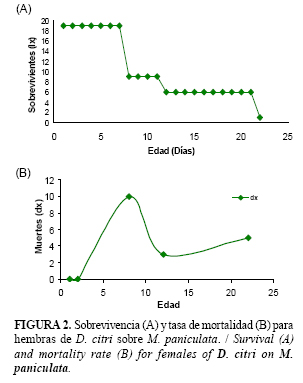
La curva de supervivencia (lx), muestra que entre el primer y el octavo día de emergidos los psíllidos la probabilidad de sobrevivir es constante. Al octavo día ocurre la muerte de prácticamente el 50% de la población, tal y como muestran las curvas de Tipo I (Figura 2 A). Este proceso se repite en el tiempo, ocurriendo la depresión de la población a los 8, 12 y 22 días. A su vez la curva de mortalidad (dx), alcanza el valor máximo a los 8 días de emergidos los insectos, conociéndose este valor como edad modal para las muertes. A medida que las causas de la mortalidad aumentan la edad modal disminuye, siendo este el propósito principal de las medidas de control (Figura 2 B).
Los parámetros biológicos de la población registrados (Tabla 2) muestran que la tasa de mortalidad específica (qx) mantiene valores bajos en todos los estadios, lo que estaría indicando que las condiciones de temperatura, humedad y fotoperíodo utilizadas serían las adecuadas para el desarrollo de estos estados. Los valores de qx se incrementaron en las ninfas de quinto instar, un aspecto de vital importancia si tenemos en consideración que por esta vía se pierde parte importante de los hospedantes requeridos para la cría de T. radiata, por lo que se recomienda realizar el parasitismo una vez que las ninfas alcancen el tercero y cuarto instar. Como consecuencia, la sobrevivencia (lx) obtenida en los primeros estadios es elevada.
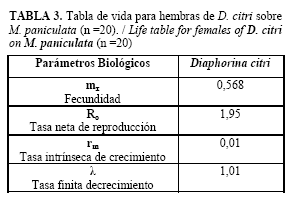
La fecundidad (mx) y la tasa neta de reproducción (R0) alcanzaron valores superiores a la unidad mostrando que la población está en crecimiento, lo que favorece el establecimiento de poblaciones para mantener estándares discretos de la cría de T. radiata (Tabla 3).
El valor negativo de la tasa intrínseca de crecimiento (rm) indica que el número de individuos que pasa de un estadio a otro es cada vez menor, donde de un total de 125 huevos solo 45 alcanzaron la fase de adulto, lo que representa el 36 % de la población inicial. A la fase de ninfa III llegaron 66,4% de los individuos, siendo esta la fase más importante para el desarrollo del parasitoide.
Se conoce que una hembra de T. radiata es capaz de parasitar 30 ninfas de D. citri en 24 horas (14), por lo que si se parte de un lote de parasitismo compuesto por 30 hembras, se requieren 900 ninfas entre tercero y quinto instar. Según lo obtenido en este estudio, si se quiere garantizar 900 ninfas de tercer instar, se debe partir de 1355 huevos del psíllido.
Cabe destacar que, aunque los datos obtenidos en las tablas de vida en el laboratorio sólo tienen valor relativo y no pueden ser aplicados directamente a las poblaciones en condiciones de campo; ellos indican claramente el límite potencial superior del organismo bajo situaciones ideales (en ausencia de enemigos naturales, poca o ninguna competencia, y abundancia de alimentos) (27).
En futuros estudios sería recomendable confeccionar la tabla de vida en condiciones naturales para establecer una comparación y tener una mejor visión del comportamiento de las poblaciones de este insecto.
REFERENCIAS
1. El cítrico cubano aspira crecer a partir del 2013. Juventud Rebelde. 22 de junio del 2008. (en línea). (Consultado: 8-10-2010). Disponible en: http://www.juventudrebelde.cu/cuba/2008-06-22/el-citrico-cubano-aspira-crecer-a-partir-del-2013/.
2. Cuestas AL. Estrategia para recuperar los cítricos. El Habanero.10 de abril del 2009.(En línea). Disponible en: http://www.elhabanero.cubaweb.cu. (Consultado: 8-10-2010).
3. FAO. Principales productores de alimentos y productos agrícolas. (En línea). (Consulta: 3-9-2007). Disponible en: http://www.fao.org/es/ess/top/commodity.html;jsessionid=94FD1EA6512C46E206369CA85A0F571E?item=512&lang=es &year =2005.
4. Peralta EL. Principales enfermedades emergentes que amenazan la citricultura de los países del Caribe. Taller Sobre Plagas Emergentes de los Cítricos. Rev Protección Veg. 2002;17(3):193-202.
5. Vaccaro N, Bouvet J. Registro de un enemigo natural de la chicharrita de los cítricos en Entre Ríos. Argentina. Boletín de la IOBCSRNT. 2006;15:13.
6. McFarland C, Hoy M. Survival of Diaphorina citri (Homoptera: Psyllidae), and its two parasitoids, Tamarixia radiata (Hymenoptera: Eulophidae) and Diaphorencyrtus aligarhensis (Hymenoptera: Encyrtidae), under different relative humidities and temperature regimes. Fla Entomol. 2001;84(2):227-233.
7. Grafton-Cardwell E, Godfrey K, Rogers M, Childers C, Stansly P. Asian Citrus Psyllid. ANR Publications. 2006. ISBN-13:978-1-60107-395-9.
8. Fernández M, Miranda I. Comportamiento de Diaphorina citri Kuwayama (Hemiptera: Psyllidae). Parte I: Características morfológicas, incidencia y enemigos naturales asociados. Rev Protección Veg. 2005;20(1):27-31.
9. Husain MA, Nath D. The citrus psylla (Diaphorina citri, Kuw.) (Psyllidae: Homoptera). Memoirs of the Department of Agriculture India. 1927;10:1-27.
10.Mangat BS. Citrus psylla (Diaphorina citri Kuway) and how to control it. Citrus Industry. 1961;42:20.
11.Catling HD. Distribution of the psyllid vectors of citrus greening disease, with notes on the biology and bionomics of Diaphorina citri. FAO Plant Protection Bulletin. 1970;18:8-15.
12.Atwal AS, Chaudhary JP, Ramzan M. Studies on the development and field population of citrus psylla, Diaphorina citri Kuwayama (Psyllidae: Homoptera). Journal of Research Punjab Agricultural University. 1970;7:333-338.
13.Pande YD. Biology of citrus psylla, Diaphorina citri Kuw. (Hemiptera: Psyllidae). Israel Journal of Entomology. 1971;6:307-310.
14.Capoor SP, Rao DG, Viswanath SM. Greening disease of citrus in the Deccan Trap Country and its relationship with the vector, Diaphorina citri Kuwayama. p. 43-49. In Weathers LG, Cohen M (editor). Proceedings of the 6th Conference of the International Citrus Virology, University of California, Division of Agricultural Sciences. 1974.
15.Wooler A, Padgham D, Arafat A. Outbreaks and new records. Saudi Arabia. Diaphorina citri on citrus. FAO Plant Protection Bulletin. 1974;22:93-94.
16.Mathur RN. Psyllidae of the Indian Subcontinent. Indian Council of Agricultural Research, New Delhi. 1975. 429 pp.
17.Tsai JH, Wang JJ, Liu YH. Seasonal abundance of the Asian citrus Psyllid, Diaphorina citri Kuwayama. (Homoptera: Psyllidae) in Southern Florida. Florida Entomologist. 2002;85(3):446-451.
18.Skelley LH, Hoy MA. A synchronous rearing method for the Asian citrus psyllid and its parasitoids in quarantine. Journal Biological Control. 2004;29(1):14.
19.Nava DE, Torres MLG, Rodríguez MDL, Bento JMS, Parra JRP. Biology of Diaphorina citri (Hem: Psyllidae) on different hosts and at different temperatures. Universidade de Sa~ o Paulo, Piracicaba, SP, Brazil. J Appl Entomol. 2007;131(9-10):709-715.
20.Chavan VM, Summanwar AS. Population dynamics and aspects of the biology of citrus psylla, Diaphorina citri Kuw, in Maharashtra. 1993. 286-290.
21.Liu YH, Tsai JH. Effects of temperature on biology and life table parameters of the Asian citrus psyllid, Diaphorina citri Kuwayama (Homoptera: Psyllidae). Ann Appl Biol. 2000;137:201-206.
22.Etienne J, Quilicis S, Marival D, Franck A. Biological control of Diaphorina citri (Homoptera: Psyllidae) in Guadeloupe by imported Tamarixia radiata (Hymenoptera: Eulophidae). Fruits. 2001;56:307-315.
23.Chiou-nan Ch. Ecology of the insects vectors of citrus systemic disease and their control in Taiwan. Taipei, Taiwan, 1998. (En línea). (Consulta: 19-05-2009). Disponible en: http:www.agnet.org/library/eb/459a/.
24.EPPO Quarantine Pest. Diaphorina citri. 1990.
25.Programa Regional de Desarrollo Científico y Tecnológico Departamento de Asuntos Cientificos y Secretaría General de la OEA, Washinton, D.C., 1979. 109 p.
26.Neubert M, Castell H. Demography and dispersal: Calculation and sensivity analysis of invasion speed for estructured populations. Ecology. 2000;8(16):1613-1628.
27.Aguilar HG. Biología y ecología de Typhlodromus pilosus Chant (Acari: Phytoseiidae) en el Valle Central de Costa Rica e importancia de los ácaros fitoseidos como agentes reguladores de las poblaciones de ácaros fitoparásitos. Tesis para optar al título de Ingeniero Agrónomo en el grado de Licenciado en Fitotecnia. Universidad de Costa Rica, San José, Costa Rica. 1986. 81 p.
Recibido: 25-8-2011.
Aceptado: 18-12-2011.
(1) Dr. C. Inra-URPV, Domaine Duclos, 97170 Petit-Bourg, Guadeloupe, France. Comunicación personal.