Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.3 La Habana sep.-dic. 2012
COMUNICACIÓN CORTA
Elementos del ciclo de vida de población cubana de Meloidogyne incognita (Kofoid y White) Chitwood en Solanum lycopersicum L.1
Life cycle elements of a Cuban population Meloidogyne incognita (Kofoid and White) in Solanum lycopersicum L.
Dainé Hernández-Ochandía, Yailén Arias, Lucila Gómez, Belkis Peteira, Ileana Miranda, Mayra G. Rodríguez
Dirección de Protección de Plantas. Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: daineh@censa.edu.cu.
RESUMEN
El experimento se desarrolló en condiciones semicontroladas, en aisladores biológicos (18-21oC), con el objetivo de determinar la duración del ciclo de vida de Meloidogyne incognita (Kofoid y White) Chitwood y la producción de huevos por hembras adultas en las primeras 96h en tomate (Solanum lycopersicum L.). Plantas de unos 15cm de altura se trasplantaron a macetas y una semana después se inocularon 2500±5 J2 de M. incognita raza 2. A las 72 horas se retiraron y plantaron en macetas con suelo estéril. El sistema radical fue extraído seis días post-inoculación para observar los diferentes estadios. La temperatura media en el período del estudio fue de 18-21oC. Tres plantas fueron extraídas diariamente y se detuvo la extracción 96h después de haberse observado las primeras hembras adultas con huevos en la matriz gelatinosa. Entre 7 y 10 días posteriores a la inoculación, las raíces del tomate mostraron zonas hinchadas, indicativo de la entrada de los juveniles y de su alimentación. El ciclo de vida, desde J2 a hembra con matriz gelatinosa y huevos fue de 24 días. Las hembras en las primeras 24 horas depositaron más de 50 huevos en las matrices y a las 96h, tenían como promedio más de 100 huevos cada una.
Palabras clave: manejo de nematodos agalleros.
ABSTRACT
The experiment was carried out under semi controlled conditions in biological insulators (18-21oC), with the objective of determining the duration of the life cycle of Meloidogyne incognita (Kofoid & White) Chitwood and the egg production of the adult females on tomato (Solanum lycopersicum L.) in the first 96h. Plants with about 15cm of height were transplanted to pots and, a week later, inoculated with 2500 ±5 J2 of M. incognita race 2. At 72 hours, they were removed and planted in pots with sterile soil. The root system was drawn out six days after inoculation to observe the different stages. The average temperature during the study was 18 to 21oC. Three plants were removed and the daily extraction was stopped 96 h after the first adult females with eggs in the gelatinous matrix were observed. Between 7 and 10 days after inoculation, the roots of tomato showed swollen areas, indicative of the entrance of the juveniles and their feeding. The life cycle from J2 to female eggs with gelatinous matrix was 24 days. In the first 24 hours, the females deposited over 50 eggs in the wombs, and at 96h, each of them had an average of eggs higher than 100.
Key words: manage of root know nematode.
Los nematodos formadores de agallas pertenecientes al género Meloidogyne Goeldi, representan un grupo polífago, económicamente importante y con especial adaptación como parásitos obligados de más de 2000 especies vegetales, entre las que se encuentran hortalizas, frutales, ornamentales y otras (1).
Estos nematodos se reproducen y alimentan en células modificadas en las raíces de las plantas que parasitan, donde inducen agallas de diversos tamaños y provocan variados síntomas. Estos últimos dependen de factores como planta la hospedante, especie de nematodo y sus niveles poblacionales. El rápido desarrollo y reproducción de estos nematodos en buenos hospedantes, deviene en un alto número de generaciones en cada temporada de cultivo (1), conocimientos a tener en cuenta en el manejo de las plantaciones.
El ciclo de vida de Meloidogyne spp. comprende: huevo, cuatro estadios juveniles y el adulto .La duración de cada uno de estos estadios difiere en cada especie y depende de otros factores como la temperatura, la humedad y la planta hospedante (1).
El estudio del ciclo de vida de estos nematodos y de su potencial reproductivo en buenos hospedantes bajo determinados parámetros ambientales, ofrece elementos para su manejo en campo. De ahí la necesidad de afrontar estas investigaciones en el contexto actual, donde factores como la temperatura comienzan a experimentar variaciones en las condiciones de Cuba.
El objetivo del presente trabajo fue estudiar el ciclo biológico de una población cubana de Meloidogyne incognita (Kofoid y White) Chitwood, estableciendo además el número medio de huevos por hembra en las primeras 96 horas de su existencia.
El experimento, que constó de tres repeticiones en el tiempo, se desarrolló en condiciones de laboratorio en Centro Nacional de Sanidad Agropecuaria (CENSA) (Mayabeque, Cuba), entre los meses de febrero y mayo 2011. Las temperaturas en el período, se midieron con hidro-termómetro digital Loger TESTO® y oscilaron entre 18-21ÚC, correspondientes a la época de las temperaturas más frescas en Cuba (invierno y primavera).
Se utilizaron plantas de tomate (Solanum lycopersicum L.)var. Campbell-28 producidas en el laboratorio. Las semillas, suministradas por el Instituto Nacional de Ciencias Agrícolas (Mayabeque, Cuba), se colocaron a germinar en una bandeja de 50x 20cm, que contenía una mezcla de suelo Ferralsol Éutrico con abono orgánico (estiércol vacuno) (3:1), previamente estilizada al vapor (121°C, 1h).
Las bandejas se mantuvieron en los aisladores a temperatura ambiente con riego en días alternos hasta que las plántulas alcanzaron unos 13cm de altura y dos pares de hojas verdaderas. Posteriormente, se trasplantaron a macetas de 1L de capacidad con la mezcla estéril de suelo y abono orgánico descrita anteriormente.
La población de nematodo empleada en el estudio pertenecía a la especie M. incognita raza 2 (aislada originariamente de tomate), que procedía del banco de poblaciones del CENSA, previamente identificada morfológica, fisiológica y molecularmente por Gómez (2).
El inóculo se preparó con el empleo del método de Baermann modificado (3), que permite recuperar solo juveniles activos. Se colectaron los juveniles de las primeras 72 horas y en cada maceta se inocularon 2 500±5 juveniles infestivos o de segundo estadio (J2), en tres orificios de unos 2cm de profundidad, alrededor del tallo de las plantas. Tres días después de la inoculación se extrajeron las plantas, se lavaron las raíces y se plantaron en macetas con sustrato estéril, de manera de limitar la penetración de los J2 a las primeras 72 horas.
Seis días después del trasplante, se inició la toma de muestras (tres plantas con su sistema radical) cada 24 horas, operación que se repitió diariamente hasta 96 horas, después que aparecieron hembras adultas con ootecas.
Los datos se expresaron en cantidad de días de duración de cada estadio. El estudio se repitió tres veces en el tiempo y se analizaron los datos independientemente. Los datos que se presentan corresponden a una de las repeticiones pues mostraron la misma tendencia.
El sistema radical de cada planta extraída se lavó cuidadosamente con agua corriente y las raíces se tiñeron con Fuchina ácida (0,05%) al calor (4) y se preservaron en placas Petri con lactofenol sin colorante, hasta que fueron analizadas. En ese momento, se lavaron con agua corriente para eliminar el exceso de colorante, se observaron externamente, tomaron fotografías y abrieron cuidadosamente con escarpelo y pinzas bajo un microscopio estereoscopio (ZEISS®).
El estado de desarrollo de cada espécimen extraído se evaluó desde J2 a hembra adulta con ootecas, y se registró como sigue: J2 (agrupamos los J2 vermiformes pre-parasíticos, J2 parasíticos «hinchados» sexualmente no diferenciados, J2 tardío - juvenil hembra); juvenil de tercero y cuarto estadio (J3 y J4) y hembras (globosas con y sin ootecas), utilizando los criterios para determinar ciclo de vida en Meloidogyne spp. de Triantaphyllou y Hirschmann (5). No se contabilizaron los machos migratorios que emergieron.
Los datos acerca del número de nematodos encontrados por estadio de desarrollo se extrajeron diariamente y se cuantificó el total observado. Especímenes/estadios se observaron al microscopio (ZEISS®) con aumento de 20x y fotografiaron con una cámara (CANNON® 4.6mpx) acoplada a microscopio estereoscópico STEMI DV4®.
Luego que aparecieron las primeras hembras adultas, se contabilizó el número de huevos.hembra-1 hasta las 96 horas.Para ello se tomaron al azar 10 hembras con sus ootecas por día, provenientes de las tres plantas evaluadas diariamente, desde el primero al cuarto día (96 horas).
Las bolsas de huevos se extrajeron con pinzas y se montaron de forma individual en portaobjetos con una gota de lactofenol + Fuchina ácida (0,05%), y se taparon con cubre-objeto. Los portaobjetos se colocaron en placas Petri a manera de cámaras húmedas para conservar el material hasta el momento de ejecutar los conteos en microscopio estereoscopio (STEMI DV4®).
Los datos de número de huevos por hembra.día-1 se sometieron a Análisis de Varianza Simple y las medias se compararon a través de Dócima de Rango Múltiple de Duncan, empleado el Paquete Estadístico SAS, Versión 9.0.
La dinámica del desarrollo de síntomas típicos asociados a la presencia de Meloidogyne spp. en raíces corroboró que, entre cuatro y siete días posteriores a la inoculación, las plántulas de tomate exhibían zonas hinchadas y engrosamiento en los extremos de la raíz principal y las laterales, las que fueron casi imperceptibles a simple vista. Sin embargo, hacia el decimoquinto día, pequeñas agallas fueron evidentes en el sistema radical de las plantas, las que aparecieron de mayor tamaño entre 20 y 27 días después (Fig. 1).
Según Yu (6), las zonas hinchadas que se observan en las raíces a partir de los 4 días después de la inoculación, representan la evidencia del establecimiento exitoso de los sitios de alimentación en las regiones de diferenciación celular por parte de los J2, los que comienzan a alimentarse.
En ese período temprano de desarrollo (entre 7 y 10 días posteriores a la entrada de las mismas a las raíces), la presencia de M. incognita puede pasar inadvertida para los productores en sus semilleros y viveros.
Hacia los 27 días, el sistema radical de las plantas exhibió agallas grandes y redondeadas, en ocasiones formando como cuentas de un collar, síntomas típicos de la presencia de Meloidogyne spp. en las raíces de hospedantes favorables, como es el caso de la variedad de tomate empleada.
Acompañando a los síntomas en las raíces, desde la etapa temprana del parasitismo (unos 10 días después de la inoculación), las plantas examinadas mostraron incipiente clorosis, lo que pudo estar relacionado con el inicio del proceso de alimentación de los juveniles.
Con relación a ello se sabe que los nematodos formadores de agallas inducen la re-diferenciación de las células del parénquima en las raíces, en células de alimentación multinucleadas e hipertrofiadas. Ellas constituyen una fuente exclusiva de nutrientes para el desarrollo del nematodo y conducen a la formación de las típicas agallas, síntoma primario de la infestación por Meloidogyne (7). Estas zonas de células hipertrofiadas interfieren en los flujos de nutrientes y agua, provocando en la planta síntomas de marchitamiento y clorosis entre otros.
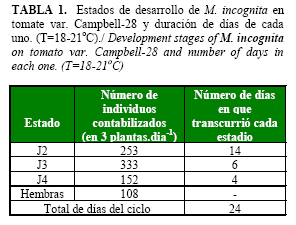
M. incognita completó el ciclo de vida (de J2 a hembra adulta con huevos) en unos 24días (Tabla 1). Los segundo, tercer y cuarto estadios se observaron entre 6-14, 15-20 y 21-23 días posteriores a la inoculación, respectivamente. Las primeras hembras adultas, que presentaron matriz gelatinosa incipiente con huevecillos, fueron observadas a partir del día 24 posterior a la inoculación. El día 28, momento en que dimos por concluido el experimento, todas las hembras contabilizadas poseían ootecas.
Los J2 fueron visibles dentro de las raíces a los 6 días posteriores a que las plantas fueron inoculadas. Los J2 (vermiformes pre-parasíticos, J2 parasíticos «hinchados» sexualmente no diferenciados y J2 tardío - juvenil hembra) aparecieron hasta el día 14. Sharma y Trivedi (8) en su estudio del ciclo de M. incognita en Trigonella foenum- graecum L. (22±3°C), observaron que los J2 fueron visibles en las raíces entre los 3 y 6 días posteriores a la inoculación.
El resultado de este estudio, referido al número de días o periodo que media entre cada uno de los estadios coincide con lo planteado por Abad et al. (7), quienes refieren que el tiempo de transición de J3 a J4 ocurre en un lapso de 4 a 7 días, mientras que el que utiliza el nematodo para pasar de J2 a J3 es de casi 15 días.
Cuando analizamos las raíces, constatamos que los J2 se distribuyeron de forma no uniforme, concentrados fundamentalmente en la zona de ápice de las mismas.
Al respecto, Abad et al. (7) señalaron que los J2 pre-parasíticos penetran las raíces de los hospedantes, usualmente cerca de la punta, mediante el uso del estilete protráctil y por la liberación de secreciones que contienen enzimas que degradan las paredes celulares. Luego comienzan a moverse intercelularmente, causando solamente el mínimo daño a la célula, hasta encontrar un sito de alimentación adecuado para permanecer durante todo su ciclo de vida (1,7).
Después de haber encontrado el sitio ideal para la alimentación, el J2, se vuelve sedentario e inmóvil y comienza a ensanchar, por lo que cambia totalmente su forma de gusano aguzado en ambos extremos, por la de salchicha (Fig. 2).
La presencia de agallas bien desarrolladas y de hembras adultas con bolsas de huevos confirmó la exitosa culminación del ciclo de vida (Fig. 1 y Fig. 2).
La duración del ciclo de vida depende de factores como la temperatura, donde a mayores temperaturas el ciclo se acorta y viceversa. De igual modo, la susceptibilidad del hospedante y la especie de nematodo involucrada en la interacción son factores importantes.
Así tenemos que Khan (9) en su estudio de M. incognita (28-35°C) en papaya (Carica papaya L.), encontró que la mayoría de las larvas comenzaron a penetrar las raíces pocas horas después de la inoculación (~12 horas) y a los 22 días, más del 32% de los especímenes eran hembras bien formadas.
Por otra parte, en un estudio desarrollado a 21 - 35°C, las hembras adultas de Meloidogyne arenaria (Neal) Chitwood, aparecieron unos 20 días después de ser inoculadas en una variedad susceptible de soya. El ciclo de Meloidogyne javanica (Trueb) Chitwood en un buen hospedante como Impatiens balsamina L. se completó en solo 23 días a temperaturas entre 25 y 30°C (10).
También Meloidogyne graminícola (Golden & Birchfield) tiene un ciclo muy corto (menos de 3 semanas) en arroz (Oryza sativa L.) en Bangladesh (22-29oC)(11), mientras Meloidogyne minor (Karssen et al.) parece tener un ciclo mayor que otras especies, pues cuando se estudió en papa (Solanum tuberosum Sw.), unas tres semanas después de la inoculación, aun se encontraron juveniles (12).
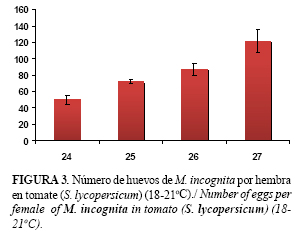
La cantidad de huevos.hembra-1 mostró diferencias significativas (Fig. 3). Es necesario resaltar que a los 24 días, las hembras bien desarrolladas fueron capaces de producir como promedio, medio centenar de huevos.hembra-1, valor que aumentó por día, sobrepasando el centenar a los 27 días. Las masas de huevos en estas primeras horas eran suaves, pegajosas e hialinas y los huevos se observaron claramente dentro de ellas con diversos grados de desarrollo del Juvenil 1 (J1).
Cada hembra puede colocar de 30 a 80 huevos.día-1, en dependencia de las condiciones ambientales y el hospedante (13), y los valores obtenidos en este estudio están en correspondencia con lo informado por estos autores para el género.
Se sabe que el desarrollo embriogénico de Meloidgyne spp., que precede a la formación del J1 está determinado primariamente por la temperatura y humedad superficial (1). La embriogénesis dentro del huevo comienza en el tracto reproductivo de la hembra, pero no concluye hasta que los huevos son depositados en la matriz gelatinosa (14).
En este estudio no evaluamos el periodo que tomó el desarrollo embriogénico, pero se sabe que a temperaturas óptimas (25-30°C), la embriogénesis en M. javanica por ejemplo, tomó entre 9 y 13 días (15). A las temperaturas que desarrollamos el ensayo deberá tomar unos días más, aspecto que se debe estudiar en el futuro.
Este elemento constituye un llamado de atención para los productores, especialmente en aquellas estrategias de manejo donde se emplee prácticas tan valiosas como el uso plantas trampa (13). Si las plantas no se extraen en el momento en que se indicó y permanecen más tiempo en los canteros, pueden ser un elemento que contribuya a elevar el número de J2 en el suelo para infestar el cultivo siguiente. Por lo corto del ciclo a temperaturas más cálidas, esto es vital en casas de cultivo, donde los valores de este parámetro deben ser mayores a las experimentadas en el estudio, aspecto que debe ser objeto de investigaciones futuras.
Durante el ciclo de vida, los nematodos formadores de agallas experimentan cambios notables en su morfología, transformándose del juvenil aguzado en ambos extremos (J2), a través de varias mudas, en hembras o machos adultos. La extensión del ciclo depende de dos factores fundamentales, la temperatura y la susceptibilidad del hospedante, constatándose que a temperaturas de 18 a 21ºC la duración del ciclo fue de unas cuatro semanas y que las hembras, a partir de los 24 días generaron decenas de huevos que representarán el inoculo para la siguiente generación.
REFERENCIAS
1. Moens M, Perry RN, Starr JL. Meloidogyne Species - a diverse group of novel and important Plant Parasites. En Root-knot Nematodes. CAB International. 2009; Pp. 1-17.
2. Gómez L. Diagnóstico de nematodos agalleros y prácticas agronómicas para el manejo de Meloidogyne incognita en la Producción Protegida de Hortalizas. Tesis en opción al grado Científico de Doctor en Ciencias Agrícolas. 2007. Universidad Agraria de la Habana, Cuba. 100pp.
3. Pitcher RS, Flegg JJM. An improved final separation sieve for the extraction of plant-parasitic nematodes from soil debris. Nematologica. 1968;14:123-127.
4. Byrd DW, Kirkpatrick T, Barker KR. An improved technique for clearing and staining plant tissues for detection of nematodes. Jour Nematol. 1983;15:142-143.
5. Triantaphyllou AC, Hirschmann H. Post-infection development of Meloidogyne incognita Chitwood, 1949 (Nematoda: Heteroderidae). Ann Inst Phytopath of Benaki. 1960;3:1-11.
6. Yu MH. Root-Knot Nematode Development and Root Gall Formation in Sugarbeet. J Sugar Beet Research. 1995;32(1):47-58.
7. Abad P, Castagnone-Sereno P, Rosso MN, Engler JA, Favery B. Invasion, Feeding and Development. En Moens M, RN Perry, JL Starr (Eds). Root-knot Nematodes. CAB International. 2009. Pp. 163-181.
8. Sharma A, Trivedi PC. Studies on the life cycle on Meloidogyne incognita in two cultivars of Trigonella foenum-graecum. Nematol Medit. 1992;20:215-216.
9. Khan TA. Studies on the life cycle of Meloidogyne incognita on papaya in presence of Fusarium solani. Indian J Nematol. 2002;32(1):30-32.
10.Khan Tabreiz, Mohd A, Ashraf Shaikhul, Hasan Sabiha. Pathogenicity and life cycle of Meloidogyne javanica on balsam (Impatiens balsamina). Archives of Phytopathology and Plant Protection. 2006;39(1):45-48.
11.Bridge J, Page SJ. The rice root-knot nematode, Meloidogyne graminicola, on deep water rice (Oryza sativa subsp. indica). Rev Nematol. 1982;5:225-232.
12.Wesemael WML, Tanning LM, Viaene N, Moens M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum cv. Bintje. In XLIII Annual Meeting of Tropical American Nematologists Organization (ONTA). Coimbra, Portugal, 4-8 September 2011. Pp. 57.
13.Karssen G, Moens M. Root-knot Nematodes. En Roland N. Perry & Maurice Moens (Eds). Plant Nematology. CABI. 2006. Pp. 60-91.
14.Evans AF, Perry RN. Survival Mechanisms. En Moens M, Perry RN, Starr JL (Eds). Root-knot Nematodes. CAB International. 2009. Pp. 2201-2202.
15.Bird A. Influence of Temperature on Embryogenesis in Meloidogyne javanica. J Nematol. 1972;4(3):206-213.
16.Cuadra R, Cruz X, Fajardo JO. Cultivos de ciclo corto como plantas trampas para el control del nematodo agallador. Nematropica. 2000;30:241-246.
Recibido: 31-10-2011.
Aceptado: 28-7-2012.
1 Investigación ejecutada en el marco del proyecto «Interacción Tomate- Fusarium oxysporumf.sp. lycopersici-Meloidogyne incognita: alternativas para el manejo en sistemas de cultivos protegidos».