Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.27 no.3 La Habana sep.-dic. 2012
COMUNICACIÓN CORTA
Efecto alelopático del almendro de la India (Terminalia catappa L.) sobre Sclerotium rolfsii Sacc
Allelopathic effect of Indian almond (Terminalia catappa L.) on Sclerotium rolfsii Sacc
Ray EspinosaI, Luis R. BravoI, Lidcay HerreraI, Yordanys RamosI, Manuel EspinosaII
IUniversidad Central Marta Abreude Las Villas. Carretera a Camajuaní km 5½. Santa Clara, Villa Clara, Cuba. Correo electrónico: rayer@uclv.edu.cu.
IICentro Provincial de Higiene y Epidemiología. Ave. Liberación Nº 102 entre D y E, Santa Clara, Villa Clara, Cuba.
RESUMEN
El estudio se realizó con el objetivo de determinar el efecto alelopático de extractos obtenidos de las hojas de Terminalia catappa L. sobre el crecimiento micelial de Sclerotium rolfsii Sacc. Para ello se obtuvieron los extractos con disolventes de diferentes polaridades (éter dietílico, etanol y agua destilada) y se probaron a varias concentraciones (0,50g.mL-1, 0,65g.mL-1 y 0,80g.mL-1). A través de la determinación del Índice de Respuesta Alelopática (IRA) se comprobó que los extractos etéreo y alcohólico a concentraciones de 0,50g.mL-1 y 0,65g.mL-1 provocaron inhibiciones menores que la observada en la concentración de 0,80g.mL-1. El extracto acuoso indujo inhibiciones mayores en las tres concentraciones probadas. El tamizaje fitoquímico reveló la presencia de ácidos grasos, cumarinas, flavonoides y taninos.
Palabras claves: alelopatía, Terminalia catappa, Sclerotium rolfsii.
ABSTRACT
The objective of this study was to determine the allelopathic effect of Terminalia catappa L. leaf extracts on Sclerotium rolfsii Sacc mycelia growth. With this purpose, different concentrations (0.50gmL-1, 0.65g.mL-1 and 0.80g.mL-1) of extracts obtained with solvents of different polarities (ether, ethanol and distilled water) were tested. By determining the Allellopathic Response Index (ARI), the ethereal and ethanolic extracts (0.50gmL-1 and 0.65g.mL-1) were shown to induce less inhibition than that observed with 0.80g.mL-1. The aqueous extracts induced higher inhibition with the three concentrations tested. The phytochemical screening revealed the presence of fatty acids, coumarins, flavonoids and tannins.
Key words: allelopathy, Terminalia catappa, Sclerotium rolfsii.
El empleo de fungicidas químicos para el control de hongos fitopatógenos del suelo ha permitido el incremento de la producción, debido a la reducción de las enfermedades provocadas por estos microorganismos. Sin embargo, sus efectos adversos sobre la biota del suelo, el hombre y el medio ambiente, plantean la necesidad de buscar alternativas sostenibles, dirigidas a la implementación de una agricultura orgánica.
Entre los hongos fitopatógenos del suelo se destaca Sclerotuim rolfsii Sacc como uno de los agentes causales de pudrición en collar (damping off) de mayor importancia, afecta a más de 200 géneros de plantas, principalmente de las familias Solanaceae y Fabaceae.
Los principios alelopáticos pueden ser una alternativa importante en el manejo integrado de diferentes cultivos para minimizar los daños provocados por hongos del suelo. El género Terminalia, de forma general, posee una serie de compuestos químicos que han mostrado efectos inhibitorios del crecimiento de bacterias y hongos (12,3). Específicamente, Terminalia catappa L. ha demostrado efectos inhibitorios sobre Bacillus subtilis (4) y algunos hongos del suelo como Rhizonctonia solani Kuhn (5), Phytophthora nicotianae var parasitica y Fusarium oxisporum (6).
El objetivo del trabajo fue determinar el efecto alelopático de extractos obtenidos de las hojas de T. catappa sobre el crecimiento micelial de S. rolfsii.
Las hojas verdes de plantas adultas de T. catappa se recolectaron en la Facultad de Ciencias Agropecuarias ubicada en la Universidad Central «Marta Abreu» de Las Villas, entre los meses de noviembre y diciembre de 2011. Se secaron en estufa a 35°C (Memmert, Alemania) con recirculación de aire durante 5 días, luego se molinaron a un tamaño de partícula máximo de 0,5mm (7).
Se trabajó con tres tipos de extractos obtenidos en los disolventes: éter dietílico (MerK, Alemania), etanol (MerK, Alemania) y agua destilada, para ello se tomaron muestras de 140g del material vegetal y se le añadieron 500mL de disolvente en sendos balones de 1L. La extracción fue asistida por ultrasonido en un baño ultrasónico (Branson1500, México) durante 30 min. a una frecuencia de 72Hz, posteriormente fueron filtrados por papel de filtro (Watman 3) (8).
Los extractos etéreo y etanólico se llevaron a sequedad en rotoevaporador (Heidolph, Alemania) para eliminar el disolvente y evitar interferencias debido a su actividad biocida, luego se resuspendieron en 140mL de agua destilada con 3g de Polisorbato 80 (MerK, Alemania) (9). El extracto acuoso fue concentrado en rotoevaporador hasta llegar a 140mL. Todos los extractos quedaron con una concentración de 1g.mL-1 como solución inicial para obtener las concentraciones de trabajo (0,50 g.mL-1; 0,65 g.mL-1 y 0,80 g.mL-1).
Para evaluar la actividad alelopática de la planta sobre los hongos se utilizó el método de envenenamiento del medio de cultivo (10). El experimento se realizó a través de un diseño completamente aleatorizado con tres placas Petri como réplicas para cada una de las concentraciones por extracto.
Se prepararon para cada extracto tres erlenmeyer y se colocaron en cada uno 15; 10,5 y 6 mL de agua destilada y 4,5 g de Agar Dextrosa Sabouraud (BioCen, Cuba). Se esterilizaron en autoclave (RayPa, España). Una vez concluido este proceso se dejó enfriar hasta 60°C para adicionarle a cada uno, en función de la concentración, 15mL, 19,5mL y 24mL de extracto previamente esterilizado por una membrana miliporo (0,2mm) de acetato de celulosa (Sartorius, Alemania). Se uniformó manualmente el medio de cultivo y se repartieron 10 mL en placas Petri estériles de 100mm de diámetro y 20mm de altura. Se sembró en el centro de cada placa un disco de 10mm de diámetro, obtenido de las márgenes de un cultivo puro de S. rolfsii (micoteca de la Facultad de Ciencias Agropecuarias) en Agar Dextrosa Sabouraud de cuatro días de edad, se incubó a 28 ± 1°C en condiciones de oscuridad. Se midió el diámetro de la colonia cada 24h con una regla milimetrada, en forma de cruz y se promediaron los valores. El experimento terminó cuando en el tratamiento testigo la colonia cubrió totalmente la placa (96h).
Se calculó el Índice de Respuesta Alelopática (IRA) (11).
Si T > M, IRA = (M/T) 1
Si T = M, IRA = 0
Si T < M, IRA = 1 (T/M)
Donde:
T Diámetro de crecimiento del micelio del patógeno en el testigo
M - Diámetro de crecimiento del micelio del patógeno en el medio de cultivo envenenado con el extracto.
Si: IRA > 0 º Estimulación.
IRA < 0 º Inhibición
Para comparar los tratamientos se empleó la prueba no paramétrica de KruskalWallis y se utilizó el paquete estadístico SPSS, versión 11.5.
Se realizó un tamizaje fitoquímico según la Norma Ramal de Salud Pública Nº 311/98 (12) para determinar los grupos químicos de las sustancias que componían cada extracto. Para comprobar la presencia o no de estos compuestos se desarrollaron en el extracto etéreo reacciones para: alcaloides, cumarinas y ácidos grasos. En el etanólico: resinas triterpenos o esteroides, saponinas, aminoácidos libres, cumarinas, carbohidratos reductores, quinonas, flavonoides, alcaloides, glucósidos cardiotónicos y fenoles o taninos. En el acuoso: saponinas, carbohidratos reductores, flavonoides y fenoles o taninos.
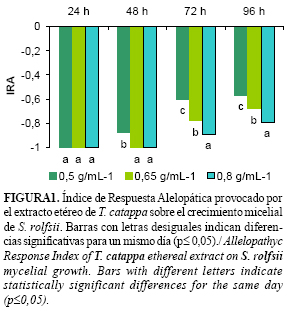
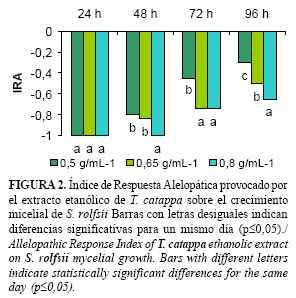
Durante los días de evaluación se observaron diferentes niveles de inhibición en función de las concentraciones de cada extracto. En las placas envenenadas con el extracto etéreo (Fig. 1), a las 24h el crecimiento fue nulo, a partir de las 48h comenzó a observarse el micelio en la placa que contenía el extracto a la concentración de 0,5g/mL-1. Al finalizar el experimento (96h) en esta misma concentración el IRA fue de -0,6. En las concentraciones de 0,8 g/mL-1 y 0,65 g/mL-1 el efecto inhibitorio fue mayor (-0,8 y -0,7 respectivamente). En el caso del extracto etanólico (Fig. 2) se aprecian resultados similares en cuanto a los niveles de inhibición micelial en los diferentes momentos de evaluación. Para ambos extractos a medida que se aumentó la concentración se evidenciaron mayores inhibiciones.
El factor concentración es de vital importancia para este tipo de estudios. Se ha determinado que en muchos casos existe una dependencia entre la concentración de los extractos y su actividad biológica, a medida que aumenta la concentración pueden obtenerse inhibiciones más elevadas (13). Varios estudios demostraron que al aumentar o disminuir en pocas unidades las concentraciones, varió el grado de afectación que producen los compuestos alelopáticos sobre el desarrollo fungoso (6, 14).
El extracto acuoso, a todas las concentraciones, indujo inhibición total en cada momento de evaluación. No se observó crecimiento micelial en las placas. Algunos autores sugieren, en tal caso, que se relaciona con la acción de una o varias sustancias alelopáticas dentro del extracto, las que actúan como inhibidor no competitivo de alguna enzima (15). Es posible que por tal razón en las tres concentraciones probadas del extracto acuoso se aprecie el mismo resultado. Según las reacciones de identificación para los diferentes metabolitos, en el extracto etéreo se encontraron cumarinas y ácidos grasos, mientras en los extractos etanólico y acuoso se hallaron solamente taninos hidrolizables y flavonoides. La actividad biológica producida por los extractos de la planta sin dudas estará relacionada con la presencia de algunas o todas estas sustancias. Así por ejemplo, compuestos del tipo cumarina, tales como: metil-esculina, escopolina, escopoletina y furanocumarinas tienen capacidad inhibitoria en diferentes sistemas fungosos (16).
Entre los ácidos grasos de mayor importancia desde el punto de vista alelopático se encuentran: ácidos linoleico, mirístico, palmítico, láurico e hidroxiesteárico (14). Los taninos hidrolizables son conocidos por su alta toxicidad debido a su propiedad de precipitar proteínas (astringencia) y formar quelatos con metales (17, 18). En estudios con taninos sobre sistemas fungosos se determinó que estos son los responsables de la inactivación de varias enzimas y que se encuentran involucrados en la formación de complejos con iones metálicos, como el hierro (19). En hojas y frutos de T. catappa se identificaron la punicalina y punicalagina como compuestos mayoritarios, estos poseen efectos inhibitorios sobre el complejo de la succinato deshidrogenasa y ATPasa, además afectan la integridad de las membranas debido a su astringencia (20).
Los flavonoides poseen propiedades antioxidantes importantes; sin embargo en altas concentraciones actúan como prooxidantes (21), dentro de este grupo se identificaron algunos compuestos capaces de afectar procesos bioquímicos a nivel mitocondrial, entre ellos se puede mencionar al kaempferol, mircetina, quercetina, naringenina y umbeliferona que inhiben la producción de ATP en la mitocondria (22).
Los extractos etéreo, etanólico y acuoso de T. catappa poseen efecto alelopático sobre S. rolfsii. Se destacó el acuoso por inducir mayor inhibición en el crecimiento micelial del hongo. Este efecto puede estar asociado, de forma general, a la presencia de metabolitos secundarios como ácidos grasos, cumarinas, taninos y flavonoides.
REFERENCIAS
1. Paarakh PM. Terminalia arjuna (Roxb.) Wt. and Arn: A Review. Internacional Journal of Pharmacology. 2010;6(5):515-534.
2. Kuete V, Tabopda TK, Ngameni B, Nana F, Tshikalange TE, Ngadjui BT. Antimiycobacterial, antibacterial and antifungal activities of Terminalia superba (Combretaceae). Journal of Ethnopharmacology. 2010;120:494-501.
3. Tabopda K, Ngoupayo J, Tanoli KSA, Mitaine AC, Ngadjui TB, Ali SM, et al. Antimicrobial pentacyclic triterpenoids from Terminalia superba. Planta Med. 2009;75(5):522-527.
4. Babayi H, Kolo J, Okogun I, Ijah J. The antimicrobial activities of metanolic extracts of Eucaliptus camaldulensis and Terminalia catappa against some pathogenic microorganisms. BIOKEMESTRY. 2004;16(2):106 -111.
5. Espejo F, Espinosa R, Puente M, Cupull R, Rodríguez M. Efecto alelopático de Tagetes erecta L. y Terminalia catappa L. sobre Rhizoctonia solani (Kühn). Centro Agrícola. 2010;37(2):89-92.
6. Puente M. Efecto de diversos extractos de plantas sobre los hongos fitopatógenos del suelo Rhizoctonia solani Kühn y Sclerotium rolfsii Sacc. Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. Santa Clara: Universidad Central Marta Abreu de Las Villas Cuba; 2007.
7. Narwal SS. Suggested methodology for allelopathy laboratory bioassay. In: Narwal S, Qasem J, editors. Allelopathy: Field Observation and Methology. Joudpur. India: Scientific Publisher; 1996. p. 255-265.
8. Palma M, Piñeiro Z, Rostagno M, Barroso C. Ultrasound-Assisted Extraction of Compounds From Foods. Ultrasonics Sonochemestry. 2006;4:135-138.
9. Osorio GP. Evaluación de hongos endofíticos y extractos botánicos para el control de la sigatoka negra (Mycosphaerella fijiensis Morlet.) en banano. Magister Scientiae en Agricultura Ecológica. Turrialba, Costa Rica, 2006.
10.Marcano A, Vargas N, Pire A. Efecto de extractos vegetales y fungicidas sintéticos sobre el crecimiento micelial in vitro de Sclerotium rolfsii y Thielaviopsis basicola. Lara2005 updated 12 diciembre de 2006; Available from: http://www.revfacagronluz.org.ve/pdf/octubre-diciembre2005/.
11.Wang Z, Christie P, Chen Q, Liu X, Xie L, Bai C, et al. Allelopathyc Potencial and Chemical Constituents of Volatil Oil From Praxelis clematidea. Allelopathy Journal. 2006;18(2):225-236.
12.MINSAP. Norma Ramal de Salud Pública 311/98. Medicamentos de origen vegetal: Extracto fluidos y tinturas. Procesos tecnológicos. La Habana. Cuba. 1998.
13.Tharayil N. To survive or to slay. Plant Signaling and Behavior. 2009;4(7):580-583.
14.Lorenzo P, González L. Alelopatía: una característica ecofisiológica que favorece la capacidad invasora de las especies vegetales. Ecosistemas. 2010;19(1):79-91.
15.Del Pino VH, Lajolo FM. Efecto inhibitorio de los taninos del frijol carioca (Phaseolus vulgaris L.) sobre la digestibilidad de la faseolina por dos sistemas multienzimáticos. Ciência e Tecnologia de Alimentos. 2003;23(1):23-29.
16.Macías AF, Molinillo GJM, Varela RM, Torres A, Galindo CG. Bioactive compounds from the genus Hellianthus. In: Macías AF, Molinillo GJM, Cutler HG, editors. Recent advances in allelopathy. Cádiz: Servicios de publicaciones de la Universidad de Cádiz; 1999. p. 100-120.
17.Salazar JA. Actividad biológica y análisis químico de extractos orgánicos de Chrysophyllum caimito L. Tesis en opción al título de Licenciado en Química. Cumaná. Sucre. Venezuela: Universidad de Oriente; 2011.
18.Makkar PSH, Siddhuraju P, Becker K. Plant Secondary Metabolites. Totowa, New Jersey: Humana Press Inc.; 2007.
19.Yamaguchi H, Okuda K. Chemically Modified Tannin and Tannin-Copper Complexes as Wood Preservatives. 2006, updated 3 de febrero de 2008; Available from: http://www.bfafh.de/SEARCH/ELF/FORMBIB/DDW?M%3D952124%26K%3D%0DT3+07+184%0D%26R%3DY%26U%3D1.
20.Hernandez M, García L, Rojo D. Alemendro de la India: potencial biológico valioso. Rev Cubana Invest Biomed. 2003;22(1):15-19.
21.Pérez G. Los flavonoides: antioxidantes o prooxidantes. Revista Cubana de Investigaciones Biomédicas. 2003;22(1).
22.Valdameri G. Efeitos da flavonas sobre o metabolismo celular. Mestre em Ciências-Bioquímicas. Curitiba. Paraná. Brasil: Universidade Federeal do Paraná; 2008.
Recibido: 2-5-2012.
Aceptado: 24-5-2012.