Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.29 no.1 La Habana ene.-abr. 2014
ARTÍCULO RESEÑA
Antagonistas microbianos para el manejo de la pudrición negra del fruto en Theobroma cacao L. Estado actual y perspectivas de uso en Cuba
Microbial antagonists to manage black pod rot in Theobroma cacao L. Their present status and perspective use in Cuba
Annia Hernández-RodríguezI*, Yeter Ruíz-BeltránI, Yanelis Acebo-GuerreroI, Yulien Miguélez-SierraII, Mayra Heydrich-PérezI
IDepartamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Calle 25 # 455 e/ J e I, Vedado, La Habana, Cuba.
IILaboratorio de Biotecnología Vegetal. Facultad Agroforestal de Montaña de la Universidad de Guantánamo, Guantánamo, Cuba.
RESUMEN
Este trabajo tuvo como objetivo valorar las perspectivas de empleo de antagonistas microbianos en el manejo integrado de la pudrición negra del fruto del cacao (Theobroma cacao L.), provocada por especies del género Phytophthora. Se resumen los principales componentes de manejo de la pudrición negra del fruto, tales como control químico, métodos culturales, resistencia genética y control biológico, profundizando en el uso y perspectivas de hongos y bacterias antagonistas. Los antagonistas microbianos constituyen una alternativa a utilizar dentro del manejo integrado del cultivo, ya que pueden mitigar los efectos deletéreos ocasionados por Phytophthora spp. Dentro de los principales mecanismos que utilizan estos antagonistas para su acción se encuentran: parasitismo, competencia y producción de metabolitos antifúngicos. Las cepas autóctonas cubanas de bacterias promotoras del crecimiento vegetal presentan actividad antagonista in vitro e in vivo ante Phytophthora palmivora (Butl) Butl, lo que sugiere sus potencialidades para el manejo de la pudrición negra del fruto de cacao.
Palabras clave: antagonistas microbianos, pudrición negra del fruto, control biológico, Phytophthora spp.
ABSTRACT
This work was aimed to demonstrate the perspective use of microbial antagonists in the integrated management of Black pod rot in T. cacao. Some of the main management strategies of Black pod rot are summarized, making emphasis on the use and perspectives of microbial antagonists for the control of Phytophthora spp. Microbial antagonists are suggested as an alternative in cacao pest management since they could mitigate the deleterious effects caused by Phytophthora spp. Microbial antagonists exert their action mainly through parasitism, competence, and production of antifungal metabolites. Native Cuban strains have antagonistic activity in vitro and in vivo against P. palmivora, which suggests their potentialities for the production of efficient bioproducts as one of the alternatives for the integrated management of cacao.
Keys words: microbial antagonist, black pod rot, biological control, Phytophthora spp.
INTRODUCCIÓN
Theobroma cacao L. es la especie de mayor importancia económica del género Theobroma. Es un cultivo perenne tropical endémico de la región del Amazonas (1), que pertenece a la familia Malvaceae (2). Existen tres cultivares de cacao: Criollo, Trinitario y Forastero, representando este último un gran porcentaje de la superficie cultivada a nivel mundial (3). Sus semillas se comercializan y son destinadas para la producción de chocolate (4). Sus derivados y bioproductos también son transformados en cosméticos, bebidas finas, gelatinas, helados y jugos (5).
Las plantas de T. cacao se desarrollan en ambientes húmedos y sombreados, condiciones extremadamente favorables para el desarrollo de plagas (6). Entre las enfermedades más frecuentes que afectan a este cultivo se destacan la escoba de bruja (causada por el hongo Moniliophthora perniciosa Stahel.); la moniliasis (causada por el hongo Moniliophthora roreri Cif & Par) y la pudrición negra del fruto producida por el oomycete Phytophthora spp. (7).
La pudrición negra del fruto es un problema económico serio en todas las regiones del mundo donde se cultiva T. cacao, causando pérdidas significativas de las cosechas que pueden alcanzar del 60 al 100% de la producción, dependiendo de las condiciones ambientales (8), con un valor monetario de aproximadamente 423 millones de dólares anuales (9). Esta enfermedad es una de las más temidas por los agricultores y aunque su distribución es mundial, afecta mayormente la producción de cacao en África del Oeste y África Central (10).
En Cuba, la pudrición negra del fruto es la enfermedad más importante que afecta el rendimiento de Theobroma cacao L (11). Las mayores afectaciones ocurren cuando la enfermedad afecta la bellota provocando del 9 al 17% de las pérdidas de las cosechas (12). Se realizaron varias prospecciones en zonas productoras de cacao, destacándose Phytophthora palmivora (Butl.) como el patógeno más importante que afecta las plantaciones de T. cacao (11, 12, 13).
Para controlar la infección por Phytophthora, se aplican métodos encaminados a reducir la población del patógeno y evitar la diseminación de la enfermedad (14). Los microorganismos antagonistas ofrecen una alternativa ecológica para el manejo de plagas que afectan cultivos de importancia económica. Su aplicación en ecosistemas agrícolas sostenibles contribuye de manera substancial al mejoramiento de los suelos, la disminución del uso de productos químicos en la agricultura y la protección del ambiente. Varios estudios evidenciaron la eficiencia de los grupos microbianos Trichoderma, Pseudomonas y Bacillus como antagonistas ante Phytophthora palmivora (Butl) Butl (15, 16). Este trabajo tuvo como objetivos: I) Realizar un análisis de la literatura relacionada con las tácticas de manejo de la pudrición negra del fruto en T. cacao y II) Establecer las perspectivas del empleo de antagonistas microbianos en el manejo integrado del cultivo para Cuba.
PARTE ESPECIAL
Notas sobre la Pudrición negra del fruto en T. cacao
La pudrición negra del fruto es una enfermedad del cacao (T. cacao) provocada por especies del género Phytophthora: P. palmivora, Phytophthora heveae Thompson, Phytophthora megakarya Braz et Griff, Phytophthora capsici Leonian y Phytophthora citrophthora Smith & Smith, todas relacionadas con esta enfermedad (17, 18).
En África, P. megakarya es la especie más agresiva de las encontradas en los campos del cultivo del cacao; sin embargo, no está informada su presencia en América (17), siendo P. citrophora la más difundida en América Central. En Cuba, no se encuentran estas especies y P. palmivora y Phytophthora tropicalis Aragaki & Uchida son los agentes causales de la enfermedad en la zona de Baracoa, Guantánamo (11,12,13).
Los principales síntomas que manifiesta el cultivo del cacao, una vez infectado por alguno de estos patógenos son: quemaduras en diferentes órganos de la planta, úlceras malignas del tallo y la pudrición negra del fruto (19). Las mayores pérdidas ocurren cuando la enfermedad afecta al fruto, provocando pudriciones del 30% de las bellotas y la muerte de hasta el 10% de las plantas anualmente (18).
La pudrición negra del fruto es comúnmente correlacionada con la presencia de alta humedad relativa y temperaturas templadas (20). Se plantea que la enfermedad se ve favorecida cuando la humedad relativa es superior al 95% y las temperaturas se encuentran entre 18 y 24ºC, parámetros que se corresponden con las condiciones tropicales (12, 20) y las óptimas para el crecimiento de este oomycete (14).
Manejo de la pudrición negra del fruto en T. cacao
El manejo de Phytophthora en T. cacao incluye métodos culturales, físicos, químicos, biológicos y genéticos (14, 21). Los métodos culturales involucran la manipulación del ambiente para hacerlo poco favorable al establecimiento del patógeno y desempeñan una función fundamental en el manejo de la enfermedad (22, 23). El saneamiento del campo y la eliminación de los frutos infectados y esporulados, retrasan la dispersión de las esporas, y con ello disminuye el inóculo del patógeno (14, 23). Sin embargo, los frutos enfermos no constituyen la única vía de transmisión de la enfermedad, pues Phytophthora tiene la capacidad de esporular en múltiples tejidos de un árbol infectado, incluyendo las raíces (20).
En los suelos se encuentran también sitios infectados por el patógeno (23), por esta razón se podan los árboles para permitir la entrada del sol y con ello evitar excesos de humedad y elevar las temperaturas por encima de 24°C, para crear condiciones desfavorables para el patógeno (14). Aunque esta alternativa es prometedora, muchas veces resulta laboriosa y difícil para los agricultores (16).
El uso de cultivares resistentes resulta eficiente para el control de plagas. Sin embargo, el proceso para obtenerlos resulta dilatado y pueden aparecer subespecies más agresivas del patógeno (22). En T. cacao, a pesar de todos los avances en esta línea de investigación, no están disponibles actualmente genotipos resistente a Phytophthora spp. (24), lo que podría estar relacionado con el hecho de que la resistencia a la pudrición negra del fruto en T. cacao es poligénica (21).
En la actualidad, la aplicación de fungicidas sintéticos constituye el método de control más empleado en el cultivo y su eficiencia depende del método de aplicación y modo de acción, dosis y época del año (22). Para reducir la incidencia de Phytophthora en las bellotas se aplicaron compuestos de cobre, metalaxil y fosfonatos (23, 25). Por ejemplo, el fungicida sistémico metalaxyl demostró ser eficiente para el control de la pudrición negra del fruto cuando se aplicó solo o combinado con compuestos de cobre en intervalos de tres y cuatro semanas, por otra parte, también se demostró que los compuestos de cobre pueden reducir la incidencia de esta plaga (25). Sin embargo, hay que tener en cuenta que, de modo general, estos fungicidas comerciales son agresivos al medio ambiente y tienen altos costos, con una relación costo beneficio que no siempre resulta favorable, lo que provoca que su uso sea limitado.
Es importante destacar que ninguno de los métodos anteriormente expuestos ofrecen efectos satisfactorios cuando son utilizados de forma aislada. El manejo de la pudrición negra del fruto solo podría lograrse si se integran métodos químicos y biológicos, control genético y métodos culturales adecuados dentro de un programa integral (14, 21).
Teniendo en cuenta estos aspectos, se iniciaron investigaciones relacionadas con la búsqueda de otras alternativas sostenibles para el ambiente y menos costosas para el productor, y que pudieran ser incluidas en el manejo integrado del cultivo, dirigiéndose esfuerzos de investigación al aislamiento, desarrollo y uso de antagonistas microbianos (26, 27, 28).
Sin embargo, el aislamiento de hongos y bacterias por si solo no es una garantía de que estos aislados sean buenos antagonistas, por lo que es necesario llevar a cabo estudios in vitro e in vivo para determinar su capacidad antagónica frente al fitopatógeno de interés. En la interacción planta- Phytophthora palmivora- antagonistas microbianos, se debe establecer como primer criterio de selección, la actividad antagonista de los aislados ante cepas autóctonas del patógeno. Posteriormente se deben hacer ensayos de resistencia foliar para determinar la actividad antagónica in vivo en T. cacao.
En estudios realizados por Nyassé et al. (29), se demostró que existe una correlación positiva entre los síntomas obtenidos cuando se inoculan las hojas de dos meses de edad con cepas virulentas del P. palmivora y los frutos de T. cacao infectados con este patógeno en condiciones de campo. Este efecto está relacionado con la similitud en la composición de las ceras epicuticulares presentes en el envés de las hojas y en la superficie de los frutos (30), lo que influye en la penetración del patógeno y colonización del tejido vegetal.
Hongos antagonistas y su empleo en el manejo de Phytophthora spp.
Los hongos antagonistas del género Trichoderma tienen la capacidad de actuar contra una amplia variedad de fitopatógenos. Estos emplean diferentes mecanismos para manejar las plagas, destacándose entre ellos la competencia por el espacio y los nutrientes, el micoparasitismo, la producción de compuestos inhibidores, la inactivación de enzimas del agente patógeno y la inducción de resistencia (31).
Se demostró que especies de Trichoderma inhiben el crecimiento de Phytophthora spp., tanto en condiciones in vitro como in vivo. En este sentido, se aislaron cepas de Trichoderma asperellum Samuels (9), Trichoderma martiale Samuels (32) y Trichoderma viride Pers. (15) de la rizosfera de T. cacao con potencial para el control de diferentes especies de Phytophthora. Hanada et al. (32) informaron que T. martiale causó reducción de la enfermedad ocasionada por P. megakarya en frutos de cacao en condiciones in situ, con resultados similares a los obtenidos con la aplicación de fungicidas.
T. martiale colonizó y permaneció en la superficie del fruto de cacao por más de 80 días y estableció una asociación endofítica con el cultivo que pudo ser evidenciada en las plantas tres meses posteriores a la inoculación (32). Estos resultados demostraron las potencialidades de T. martiali y sus perspectivas de uso en las estrategias de manejo del cultivo.
Uno de los principales mecanismos de acción que despliega Trichoderma sobre Phytophyhora es el parasitismo. Estos hongos pueden parasitar la hifa del patógeno mediante enrollamientos, ganchos y cuerpos de tipo apresorios, que penetran la pared celular por la acción hidrolítica de las enzimas quitinasas, glucanasas y celulasas (33, 34). También se demostró que Trichoderma produce metabolitos secundarios, que inhiben otros microorganismos con los que no se establece contacto físico. Algunas cepas producen trichodermina, dermadina, suzukacilina, viridina, alameticina, richotoxina, metabolitos que son responsables del mecanismo antagónico ante Phytophthora spp. (35, 36).
Estudios recientes demostraron que cepas de Trichoderma pueden activar Resistencia Sistémica Inducida (SIR- Systemic Induced Resistance, por sus sus siglas en inglés) en plantas contra diferentes plagas. Por ejemplo, Shoresh et al. (37), informaron que T. asperellum indujo resistencia en pepino contra Pseudomonas syringae pv. lachrymans (E. F. Smith & Bryan) Young, Dye & Wilkie. Este mecanismo de acción también podría ser eficiente para el control de Phytophthora en T. cacao; sin embargo, la demostración de esta hipótesis requerirá de investigaciones futuras.
También se demostró que hongos endófitos son potencialmente eficientes como agentes de control biológico de plagas que afectan a T. cacao. Hanada et al. (8), seleccionaron ocho aislamientos endófitos de los géneros Trichoderma, Pestalotiopsis, Curvularia, Tolypocladium y Fusarium con actividad antagonista in vitro e in vivo contra P. palmivora en plantas desarrolladas en condiciones axénicas. Mejia et al. (38), informaron que hongos endófitos aislados de tejidos sanos de T. cacao, tuvieron actividad antagonista in vitro contra P. palmivora. En ambas investigaciones se demostró que estos antagonistas tienen la capacidad de colonizar de forma eficiente los tejidos del cultivo y que la competencia por el sustrato y la antibiosis son los principales mecanismos mediante los cuales ejercen su acción.
La competencia es un mecanismo de acción que se pone de manifiesto cuando existe limitación de un requerimiento nutricional o espacio (39). Si el crecimiento del antagonista es más rápido que el del patógeno, éste no tiene la capacidad de explorar el sustrato debido a la ausencia de germinación y formación de estructuras (34). En T. cacao, se concibe que un agente de control biológico eficaz es aquel con alta velocidad de crecimiento y capacidad de colonización y sobrevivencia en los tejidos de la planta y el fruto, lo que le permita excluir al patógeno, mediante competencia por nutrientes importantes para la germinación de las esporas y el desarrollo de estructuras infectivas.
En Cuba, en la Estación de Investigaciones de Cacao en Baracoa, Guantánamo, se emplearon cepas de Trichoderma sp. para el control biológico de P. palmivora en plantaciones de T. cacao. Se destaca, la aplicación de Trichoderma cepa G-6, cuya aplicación disminuyó la incidencia de la enfermedad en condiciones de campo y las pérdidas económicas en el cultivo del 12% a 2% (40). Estos resultados confirman que la aplicación de productos con cepas de Trichoderma permiten mitigar los efectos deletéreos ocasionados por P. palmivora en T. cacao y sus potencialidades de uso en el cultivo.
Estado actual y perspectivas del empleo de bacterias antagonistas para el manejo de Phytophthora spp.
El uso de bacterias antagonistas en el manejo de patógenos en cultivos anuales y perennes sobresale como una alternativa a los problemas ambientales causados por la agricultura intensiva tradicional (41). Estas bacterias se pueden aislar de la rizosfera del cultivo o de la superficie de las hojas o frutos (42).
Las características más importantes de un antagonista están relacionadas con su estabilidad genética, efectividad a bajas concentraciones, capacidad de utilizar diferentes fuentes nutricionales, sobrevivir a las condiciones adversas del ambiente, efectividad contra una amplia gama de patógenos, factibilidad ecológica, resistencia a fungicidas y su compatibilidad con otros procedimientos comerciales (26).
Los principales mecanismos involucrados en el control biológico de fitopatógenos con el uso de bacterias antagonistas son: la competencia por los nutrientes, minerales y espacio; la síntesis de metabolitos, tales como sideróroros, antibióticos, toxinas y biosurfactantes, y la inducción de resistencia sistémica en la planta (21, 26, 41). Estos mecanismos son potenciados por alta motilidad del microorganismo y su capacidad de formar biopelículas (26).
En la práctica se debe tener en cuenta que el efecto inhibitorio de las bacterias antagonistas no ocurre por la acción independiente de algunos de estos mecanismos, sino que la supresión de las enfermedades de las plantas se logra por su labor conjunta, tanto en las interacciones microbianas como en las interacciones microorganismos-planta.
Las Bacterias Promotoras del Crecimiento Vegetal (PGPB- por sus siglas en inglés) tienen potencial como agentes de control biológico relativamente económicos. Sin embargo, su aplicación a gran escala se vio obstaculizada por resultados contradictorios obtenidos en pruebas de campo, debido, generalmente, a su baja competitividad en la rizosfera, lo que comprende una colonización efectiva de la raíz, la habilidad de sobrevivir y proliferar a lo largo del ciclo de vida del cultivo y no provocar desequilibrios en la microbiota nativa (27).
Algunas cepas de PGPB de los géneros Bacillus (4, 27), Pseudomonas (26) y Azospirillum (43) se utilizaron como antagonistas de Phytophthora spp. Koranteng y Awuah (16), aislaron y caracterizaron ocho rizobacterias antagonistas de P. palmivora y demostraron que productos a base de las bacterias y sus caldos libres de células, podrían ser utilizados como biofungicidas para controlar la Pudrición negra del fruto en T.cacao.
Por su parte, Melnick et al. (27), demostraron que la cepa de Bacillus cereus BT8 tuvo la capacidad de reducir la severidad de la pudrición negra del fruto del cacao producida por P. capsici. Los autores señalaron que una mejor comprensión de los aspectos moleculares involucrados en la supresión de la enfermedad podría facilitar su control. Asimismo, Bhavani y Abraham (28) informaron que cepas de Pseudomonas aeruginosa y Pseudomonas fluorescens tienen efecto antagónico in vitro contra este patógeno.
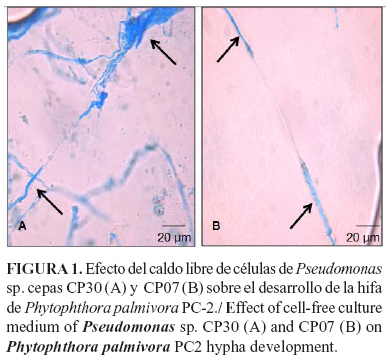
En el Laboratorio de Ecología Microbiana perteneciente a la Facultad de Biología de la Universidad de La Habana (Cuba), se seleccionaron cepas de Pseudomonas sp. en base a su efecto antagonista ante P. palmivora en experimentos in vitro e in vivo. Los resultados evidenciaron que Pseudomonas sp. cepas CP30 y CP07 produjeron diferentes tipos de metabolitos que afectaron el desarrollo de P. palmivora (Datos de los autores no publicados).
En la Figura 1 se evidencia la degradación de la hifa de P. palmivora cepa PC2, por la presencia de color azul en las células, indicativo de la entrada de azul de tripano. Este colorante permite diferenciar células vivas y muertas, pues las células o tejidos vivos no son coloreados, debido a la alta selectividad de la membrana celular. En este caso, la degradación de la hifa pudo estar provocada por la liberación de enzimas de origen bacteriano en el caldo de cultivo, como celulasas y b-glucanasas, que actúan sobre la pared celular de P. palmivora, que está compuesta fundamentalmente por celulosa y b-1,7 glucanos (44).
El efecto antagónico de estas cepas fue confirmado posteriormente en experimentos in vivo utilizando bellotas de cacao, donde se evidenció disminución del crecimiento del hongo en los tratamientos donde se inocularon el antagonista y el patógeno (Figura 2), resultando menor el número de bellotas infectadas y el porcentaje de infección (Datos de los autores no publicados).
Los resultados demostraron que las cepas Pseudomonas sp. CP07 y CP30 tienen actividad antagonista in vitro y podrían ser potencialmente eficientes en el control de Phytophthora en el cultivo del cacao y en la producción de biofertilizantes que puedan ser incluidos en el manejo integrado del cultivo; sin embargo, otros estudios in vivo e in situ deben ser realizados.
El control biológico de microorganismos fitopatógenos con Pseudomonas fluorescentes puede ocurrir por varios mecanismos de acción, como la producción de sideróforos, que hacen al hierro inaccesible para los patógenos; antibióticos, como 2,4-diacetilfloroglucinol (DAPG), pioluteorina, pirrolnitrina; derivados de fenacina, de lipopéptidos cíclicos (45, 46), la competencia por los nutrientes y la colonización de la raíz (47); además de la inducción de resistencia sistémica en la planta (48).
La efectividad de cepas de Pseudomonas fluorescentes con actividad antagonista ante fitopatógenos que afectan a cultivos de importancia económica fue informada con anterioridad por otros autores (48, 49, 50); sin embargo, son limitados los estudios en cultivos perennes y en condiciones tropicales. Este grupo microbiano constituye un excelente ejemplo de la combinación de múltiples mecanismos para ejercer un efectivo control biológico, incluyendo el antagonismo directo y la inducción de resistencia en la planta (51).
En T. cacao la mayor parte de los estudios estuvieron dirigidos al uso de microorganismos para disminuir de forma directa el inóculo de los patógenos que lo afectan, aprovechando sus potencialidades en la producción de antibióticos, sideróforos y enzimas líticas. Sin embargo, estudios recientes demostraron que cepas del género Bacillus protegen a la planta contra el ataque de Phytophthora spp. (27) y resultados preliminares evidenciaron que cepas autóctonas cubanas de Pseudomonas sp. indujeron resistencia en plantas de T. cacao contra P. palmivora (Datos de los autores no publicados ), lo que permite el condicionamiento de las respuestas de defensa de la planta ante este patógeno (52) y abre nuevas perspectivas en la búsqueda de agentes de control biológico efectivos.
La inducción de resistencia en la planta por PGPB permite el condicionamiento de su capacidad defensiva contra un amplio espectro de patógenos. Esta interacción es altamente específica y depende de la planta hospedante, el patógeno y la cepa bacteriana (26). La determinación de los genes que codifican para proteínas relacionadas con las respuestas de defensa en T. cacao permitirá establecer marcadores moleculares de resistencia en el cultivo y la obtención de cultivares resistentes a estas plagas. Nyadanu et al. (30), demostraron que existen flavonoides, taninos, lignina y azúcares insolubles relacionados con la resistencia a la pudrición negra de la mazorca en T. cacao. Estos marcadores bioquímicos podrían conducir a la obtención de nuevos genotipos de cacao resistentes a esta enfermedad.
En este contexto, el establecimiento de una nueva metodología basada en técnicas biotecnológicas que incluya la aplicación de PGPB, permitiría la producción sostenible de plantas de T. cacao. Las técnicas de micropropagación in vitro podrían ser una alternativa viable para estos fines (53).
Dado el potencial benéfico que presentan las bacterias rizosféricas, expresado a través de la producción de diferentes metabolitos de interés, estas representan una fuente interesante a estudiar con el objetivo de elaborar biopreparados para uso en cultivos de importancia económica y específicamente en T. cacao. Sin embargo, para lograr un producto eficiente, se deben realizar estudios de selección de cepas, hacer evaluaciones a gran escala en condiciones de campo, trabajar con cepas autóctonas de cada localidad edafoclimática y esclarecer los verdaderos mecanismos a través de los cuales ejercen su acción.
CONCLUSIONES
Los trabajos actuales sobre microorganismos antagonistas evidencian su potencial de empleo en el control de patógenos que afectan a cultivos de importancia económica. En la búsqueda de antagonistas microbianos se evaluaron hongos (Trichoderma spp.) y bacterias (Pseudomonas spp., Bacillus spp.) para el manejo de Phytophthora spp. en Theobroma cacao L., sugiriendo que pueden representar una alternativa a utilizar en el cultivo.
La aplicación de estas bacterias y sus productos activos potenciarían las técnicas biotecnológicas, permitiendo obtener plántulas con respuestas de defensa condicionadas ante Phytophthora spp. y mayor sobrevivencia durante la fase de aclimatación, aspectos que constituyen objeto de investigaciones en el Laboratorio de Ecología Microbiana de la Universidad de La Habana en colaboración con Laboratorio de Biotecnología Vegetal de la Universidad de Guantánamo en Cuba.
No obstante, a pesar de las potencialidades de estos antagonistas, no han sido desarrollados hasta el momento productos comerciales que puedan ser adoptados por los productores contra la Pudrición negra del fruto en este cultivo, por lo que se debe profundizar en el estudio de los diferentes microorganismos propuestos y en sus mecanismos de acción para mejorar su efectividad cuando sean aplicados como inoculantes microbianos.
AGRADECIMIENTOS
Este estudio fue financiado por el Proyecto de Investigación Bilateral «Aplicación de Bacterias Promotoras del Crecimiento Vegetal en la producción sustentable de cacao (Theobroma cacao L.) en Cuba».
REFERENCIAS
1. Motamayor JC, Lachenaud P, da Silva e Mota JW, Loor R, Kuhn DN, et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 2008;3.
2. Guiltinan MJ, Pua EC, Davey MR. Cacao. Biotechnology in Agriculture and Forestry. Berlin, Springer-Verlag Berlin Heidelberg. 2007;60:497-518.
3. Cheesman E. Notes on the nomenclature, classification and possible relationships of cocoa populations. Tropical Agriculture. 1944;21:144-159.
4. Melnick RL, Suárez C, Bailey BA, Backman PA. Isolation of endophytic endospore-forming bacteria from Theobroma cacao as potential biological control agents of cacao diseases. Biological Control. 2011;57:236-245.
5. De Almeida FAA, Valle RR. Ecophysiology of the cacao tree. Plant Physiol. 2007;19(4):425-448.
6. Fulton RH. The Cacao Disease Trilogy: Black Pod, Monilia Pod Rot, and Witches'-Broom. Plant Disease. 1989;73(7):601-603.
7. Ploetz RC. Cacao diseases: Important threats to chocolate production worldwide. Phytopathology. 2007;97:1634-1639.
8. Hanada RE, Pomella AWV, Salazar H, Pereira JO. Seleção de fungos endofíticos visando o controle biológico de Phytophthora sp., agente causal da podridão-parda dos frutos de cacau. Fitopatologia Brasileira. 2004;29:134.
9. Tchameni SN, Ngonkeu MEL, Begoude BAD, Wakam NL, Fokoma R, Owona AD, et al. Effect of Trichoderma asperellum and arbuscular mycorrhizal fungi on cacao growth and resistance against black pod disease. Crop Protection. 2011;30:1321-1327.
10.Adebola MO, Amadi JE. Antagonistic activities of Paecilomyces and Rhizopus species against the cocoa black pod pathogen (Phytophthora palmivora). African Scientist. 2010;11(4):235-239.
11.Hubeaux D. Caracterisation du Phytophthora, agent de la pourriture brune de la cabosse, à Cuba. B. Sc. Louvain: Université Catholique de Louvain, 2010. 90 pp.
12.Matos G, Blaha G, Rodriguez F, Cabrera M, Marquez J, Martinez F, et al. Losses due to Phytophthora palmivora (Butl.) and other agents on cocoa plantations in Baracoa. Café y Cacao. 1998,1:7-11.
13.Matos Y, Peteira B, Matos G, Decock C, Hubeaux D, Lambertt W, et al. Prueba de apareamiento en 90 aislamientos de Phytophthora, provenientes de frutos enfermos de cacao (Theobroma cacao Lin.) en el municipio de Baracoa, provincia Guantánamo, Cuba. Rev Protección Veg. 2011;26:198-199.
14.Agrios GN. Burlington MA. Plant Pathology. Control of plant diseases. USA, Elsevier Academic Press. 5th Ed. 2005; 295-350.
15.Mpika J, Kébé IB, Issali AE, N'Guessan FK, Druzhinina S, Komon-Zélazowska M, et al. Antagonist potential of Trichoderma indigenous isolates for biological control of Phytophthora palmivora the causative agent of black pod disease on cocoa (Theobroma cacao L.) in Côte d'Ivoire. African Journal of Biotechnology. 2009;8:5280-5293.
16.Koranteng SL, Awuah RT. Biological suppression of black pod lesion development on detached cocoa pods. African Journal of Agricultural Research. 2011;6(1):67-72.
17.Kroon LPNM, Brouwer H, de Cock AWAM, Govers F. The genus Phytophthora. Phytopathology. 2012;102:348-364.
18.Hebbar PK. Cacao diseases: a global perspective from an industry point of view. Phytopathology. 2007;97:1658-1663.
19.Guest D. Black pod: Diverse pathogens with a global impact on cocoa yield. Phytopathology. 2007;97:1650-1653.
20.Deberdt P, Mfegue CV, Tondje PR, Bon MC, Ducamp M, Hurard C, et al. Impact of environmental factors, chemical fungicide and biological control on cacao pod production dynamics and black pod disease (Phytophthora megakarya) in Cameroon. Biological Control. 2008;44:149-159.
21.Acebo-Guerrero Y, Hernández-Rodriguez A, Heydrich-Pérez M, El jaziri M, Hernández-Lauzardo AN. Management of black pod rot in cacao (Theobroma cacao L.). Fruits. 2012;67:41-48.
22.Adejumo TO. Crop protection strategies for major diseases of cocoa, coffee and cashew in Nigeria. African Journal of Biotechnology. 2005;4(2):143-150.
23.Ndoumbè-Nkeng M, Cilas C, Nyemb E, Nyasse S, Bieysse D, et al. Impact of removing disease pods on cocoa black pod caused by Phytophthora megakarya and on cocoa production in Cameroon. Crop Protection. 2004;23(5):415-424.
24.Opoku IY, Assuah MK, Aneani F. Management of black pod disease of cocoa with reduced number of fungicide application and crop sanitation. Afr J Agric Res. 2007;2:601-604.
26.Haas D, Defago G. Biological control of soil-borne pathogens by Fluorescent pseudomonads. Nat Rev Microbiol. 2005;10:1-13.
27.Melnick RL, Zidack NK, Bailey BA, Maximova SN, Guiltinan M, Backman PA. Bacterial endophytes: Bacillus spp. from annual crops as potential biological control agents of black pod rot of cacao. Biological Control. 2008;46:46-56.
28.Bhavani R, Abraham K. Efficacy of selected epiphytic microflora from pod surface against Phytophthora pod rot of cocoa, Recent trends in horticultural biotechnology: ICAR national symposium on biotechnological interventions for improvement of horticultural crops, issues and strategies, Kerala. 2005;871-875.
29.Nyassé S, Cilas C, Herail C, Blaha G. Leaf inoculation as an early screening test for cocoa (Theobroma cacao L.) resistance to Phytophthora black pod disease. Crop Protection. 1995;94(14):657-663.
30.Nyadanu D, Akromah R, Adomako B, Kwoseh C, Dzahini-Obiatey H, et al. Host plant resistance to Phytophthora pod rot in cacao (Theobroma cacao L.): the role of epicuticular wax on pod and leaf surfaces. International Journal of Botany. 2012;8:13-21.
31.Harman GE, Howell CR, Viterbo A, Chet I, Lorito M. Trichoderma species-opportunistic, avirulent plant symbionts. Nature Reviews Microbiology. 2004;2:43-56.
32.Hanada RE, de Souza JT, Pomella AWV, Hebbar KP, Pereira JO, et al. Trichoderma martiale sp. nov., a new endophyte from sapwood of Theobroma cacao with a potential for biological control. Mycological Research. 2008;112:1335-1343.
33.Bernal A, Andreu C, Moya M, González M, Fernández O. Utilización de Trichoderma spp. como alternativa ecológica para control de Fusarium oxysporum Schlecht f. sp cubense (E.F. Smith) Snyd & Hans. Fitosanidad. 2007;83:26-29.
34.Martinez B, Infante D, Reyes Y. Trichoderma spp. y su función en el control de plagas en los cultivos. Rev Protección Veg. 2013;28(1):1-11.
35.Villamil JEC, Blanco JOV, Viteri SER. In vitro evaluation of Native Microorganisms for their Antagonism against Moniliophthora roreri Cif & Parin Cocoa (Theobroma cacao L.). Rev Fac Nal Agr Medellín. 2012;65(1):6305-6315.
36.Vinale F, Marra R, Scala F, Ghisalberti L, Lorito M, Sivasithamparam K. Major secondary metabolites produced by two commercial Trichoderma strains active againt different phytopatogens. Letters in Applied Microbiolog. 2006;43:143-148.
37.Shoresh M, Harman G, Mastouri F. Induced Systemic Resistance and Plant Responses to Fungal Biocontrol Agents. Annu Rev Phytopathol. 2010;48:21-43.
38.Mejia LC, Rojas EI, Maynard Z, Arnold EC, Hebbar P, Samuels GJ, et al. Endophytic fungi as biocontrol agents of Theobroma cacao pathogens. Biol Control. 2008;46:4-14.
39.Gary E, Kubicek C. Trichoderma and Gliocladium, enzymes, biological control and commercial applications, http://www.amazon.com/Trichoderma-Gliocladium-Biological-commercial-applications/dp/0748408053#reader_0748408053.2. 2011; 396. 10 de abril de 2012.
40.Matos GA, Matos Y, Clapé P. Control Biológico de Phytophthora palmivora en plantaciones de cacao para lograr producciones orgánicas y sostenibles empleando cepas de Trichoderma sp. http://www.ediciones.inca.edu.cu/files/congresos/2010/AES-0.26.
41.Singh JS, Pandey VC, Singh DP. Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development. Agriculture, Ecosystems and Environment. 2011;140:339-353.
42.Hernández AN, Velásquez M, Hernández AR. Use of antagonistic microorganisms for the control of postharvest diseases in fruits. Revista Mexicana de Fitopatología. 2006;24:111-121.
43.Aguirre JFM, Mendoza AL, Cadena JI, Avendaño CHA. Efecto de la biofertilización en vivero del cacao (Theobroma cacao L.) con Azospirillum brasilense Tarrand, Krieg et Döbereiner y Glomus intraradices Schenk et Smith. Interciencia. 2007;32:541-546.
44.Diby P, Saju KA, Jisha PJ, Sarma YR, Kumar A, Anandaraj M. Mycolytic enzymes produced by Pseudomonas fluorescens and Trichoderma spp. against Phytophthora capsici, the foot rot pathogen of black pepper (Piper nigrum L.). Annals of Microbiology. 2005;55(2):129-133.
45.Weller DM, Landa BB, Mavrodi OV, Schroeder KL, De La Fuente L, Blouin BS, et al. Role of 2,4-diacetylphloroglucinol-producing fluorescent Pseudomonas spp. in the defense of plant roots. Plant Biol. 2007;9:4-20.
46.Raaijmakers JM, de Bruijn I, de Kock MJD. Cyclic lipopeptide production by plant-associated Pseudomonas spp.: diversity, activity, biosynthesis, and regulation. Mol Plant Microbe Interact. 2006;19:699-710.
47.Ghirardi S, Dessaint F, Mazurier S, Corberand T, Raaijmakers JM, et al. Identification of Traits Shared by Rhizosphere-Competent Strains of Fluorescent Pseudomonads. Microb Ecol. 2012;64:725-737.
48.Hofte M, Altier N. Fluorescent pseudomonads as biocontrol agents for sustainable agricultural systems. Research in Microbiology. 2010;161:464-471.
49.De La Cruz-Quiroz R, Chávez C, Hernández M, Rodríguez R, Hernández D, Aguilar CN. Antagonist capacity of newly isolated strains of Pseudomonas fluorescens against three important phytopathogenic bacteria. American Journal of Agricultural and Biological Science. 2011;6:267.
50.Yanes ML, De La Fuente L, Altier N, Arias A. Characterization of native fluorescent Pseudomonas isolates associated with alfalfa roots in Uruguayan agroecosystems. Biological Control. 2012;63:287-295.
51.Lee KJ, Oh BT, Seralathan KK. ed. Maheshwari, D.K. Advances in Plant Growth Promoting Rhizobacteria for biological control of plant diseases. In Bacteria in Agrobiology: Disease Management: Springer Berlin Heidelberg. 2013;1-13.
52.Moeinzadeh A, Sharif FZ, Ahmadzadeh M, Tajabadi FH. Biopriming of sunflower (Helianthus annuus L.) seed with Pseudomonas fluorescens for improvement of seed invigoration and seedling growth Australian. Journal of Crop Science. 2010;4(7):564-570.
53.Mneney E, Mantell SH. In vitro micrografting of cashew. Plant Cell, Tissue and Organ. Culture. 2001;66:49-58.
Recibido: 8-5-2013.
Aceptado: 19-9-2013.
*Autor para la correspondencia: Departamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Calle 25 # 455 e/ J e I, Vedado, La Habana, Cuba. Correo electrónico: annia@fbio.uh.cu.